即时、定量黄曲霉毒素M1荧光淬灭免疫层析检测法建立和评价
孔凡虹,刘 丽,董成亚,何 露,王 丹,刘 颖,王雅杰,3
(1.首都医科大学附属北京天坛医院,北京100050;2.首都医科大学附属北京天坛医院临床医学研究实验室,北京100050;3.首都医科大学附属北京天坛医院检验科,北京100050)
·方法研究·
即时、定量黄曲霉毒素M1荧光淬灭免疫层析检测法建立和评价
孔凡虹1,刘 丽2,董成亚2,何 露1,王 丹1,刘 颖1,王雅杰2,3
(1.首都医科大学附属北京天坛医院,北京100050;2.首都医科大学附属北京天坛医院临床医学研究实验室,北京100050;3.首都医科大学附属北京天坛医院检验科,北京100050)
目的利用原创性荧光淬灭免疫层析技术进行黄曲霉毒素M1(AFM1)快速、定量检测方法的探索。方法对原创性AFM1检测试纸条从灵敏度、重复性与准确性方面进行性能验证,同酶联免疫吸附法原理的AFM1检测试剂进行比对研究。结果荧光淬灭免疫层析AFM1检测试纸条最低检测下限为0.075ng/mL,批内变异系数≤7.3%,回收率为65.8%~94.1%。AFM1荧光淬灭免疫层析检测试纸条与酶联免疫法检测试剂具有良好的相关性(R2=0.9659)。结论荧光淬灭免疫层析AFM1检测试纸条可灵敏、准确、定量检测牛乳中的AFM1。
荧光淬灭; 免疫层析; 黄曲霉毒素M1; 即时检测
世界粮农组织报告,每年大约有25%的农作物受到真菌和真菌毒素的污染,其中最常见的真菌毒素为黄曲霉毒素[1]。黄曲霉毒素属于I类致癌物。其中,黄曲霉毒素B1毒性比氰化钾大10倍,比砒霜大68倍,是毒性极强的剧毒物质[2]。黄曲霉毒素是一类化学结构类似的化合物,均为二氢呋喃香豆素的衍生物,主要是由黄曲霉和寄生曲霉产生的次级代谢产物。它们存在于土壤、动植物、各种坚果中,特别容易污染花生、玉米、稻米、大豆、小麦等粮油产品。目前已分离鉴定出的黄曲霉毒素有20种,主要是黄曲霉毒素B1、B2、G1、G2以及M1、M2[3-4]。其中AFM1为动物摄入AFB1后在体内经过羟基化形成的产物,可随动物尿液、乳汁排出。乳品中黄曲霉毒素主要存在形式为AFM1,AFM1在乳制品的加工处理过程中可长期稳定存在,并且有强烈的损害肝和致癌作用[5]。对食品中的黄曲霉毒素进行检测对于食品安全具有十分重要的意义,本文利用原创性荧光淬灭免疫层析技术(background fluorescence quenching immunochromatographic assay,bFQICA)[6]进行牛奶中AFM1快速、定量检测方法的探索。
材料和方法
1 实验材料
试剂:荧光淬灭免疫层析AFM1检测试纸条购自上海容晖生物科技有限公司(试剂批号14121501);AFM1酶联免疫法快速检测试剂盒购自奥地利(试剂批号20140819,AgraQuantⓇ);生鲜牛乳购自北京三元食品有限公司。仪器:Simp1型荧光淬灭免疫层析分析仪(上海鑫谱生物科技有限公司);电热恒温培养箱(IC412C,日本 yamato);微型离心机(sorvall legend micro17,Thermo Fisher)。
2 实验步骤
检测牛奶中AFM1的实验步骤(见图1):①取生鲜牛乳样本离心,取下层液体200μL置于淬灭抗体试剂杯中,恒温箱中30℃孵育5min,使样本中的AFM1与淬灭抗体充分结合。取60μL样本滴加于荧光淬灭免疫层析AFM1检测试纸条加样孔中,并于恒温箱中30℃孵育12min。②整张测试膜预先包被荧光物质,牛乳样本加入样品孔后,在毛细作用下沿硝酸纤维素膜(nitrocellulose membrane,NC膜)向吸水垫方向移动。当样本流动至检测线(test line,T线)时,游离的淬灭抗体与固定在T线处的AFM1-BSA结合,形成淬灭抗体-AFM1-BSA复合物,并使T线处背景荧光发生淬灭。③过量的游离淬灭抗体继续迁移,与固定在质控线(control line,C线)的对照剂(抗淬灭抗体的抗体)反应,并使C线处背景荧光发生淬灭,提示检测体系有效。④定量结果通过记录检测试纸条窗口荧光信号变化来进行定量计算。采用Simp1型荧光淬灭免疫层析分析仪测量NC膜上T线处的背景荧光(F2)和NC膜其他位置背景荧光(F1),取F2/F1作为AFM1浓度的效应值,AFM1标准品浓度与其对应的效应值可拟合成标准曲线(见图2),读取检测试纸条上二维码中包含的该标准曲线信息,即可获得AFM1浓度。
3 检测试纸条性能的评价
3.1 最低检测限 对原料乳样本(AFM1零值样本)进行10次平行检测,将F2/F1平均值加两倍标准差的值代入标准曲线方程计算得到最低检测限。
3.2 分析内精密度 取AFM1标准品溶液加入原料乳中,配制成3个浓度点,分别为0.30、0.45、0.60ng/mL,每组样本平行测定10次,根据结果计算变异系数(coefficient of variation,CV),测试检测试纸条精密度。
3.3 回收率 取AFM1标准品溶液加入原料乳中,配置成0.35ng/mL的样本,平行检测10次,取均值得到本底数据。向上述加标回收本底样本中继续添加AFM1标准品溶液,得到两个理论添加浓度分别为0.094、0.472ng/mL的样本,每个样本平行测定3次,取均值扣除本底数据后计算加标回收率。
3.4 对比实验 因阳性样本很难获取,故用AFM1标准品配制浓度分别为0.00、0.05、0.10、0.15、0.20、0.30ng/mL的样本,用荧光淬灭免疫层析AFM1检测检测试纸条与酶联免疫法的黄曲霉毒素检测试剂盒,分别进行检测,每种浓度的样本平行测定3次,取3次测定的平均值计算相关系数,评估两种方法的相关性。
结 果
1 荧光淬灭免疫层析检测试纸条的灵敏度、精密度与准确性
对AFM1荧光淬灭免疫层析检测试纸条的灵敏度、重复性与准确性进行验证,结果提示,AFM1荧光淬灭免疫层析检测试纸条的最低检测限、分析内精密度和回收率均符合国标要求。

表1 荧光淬灭免疫层析检测试纸条的灵敏度、精密度与准确性
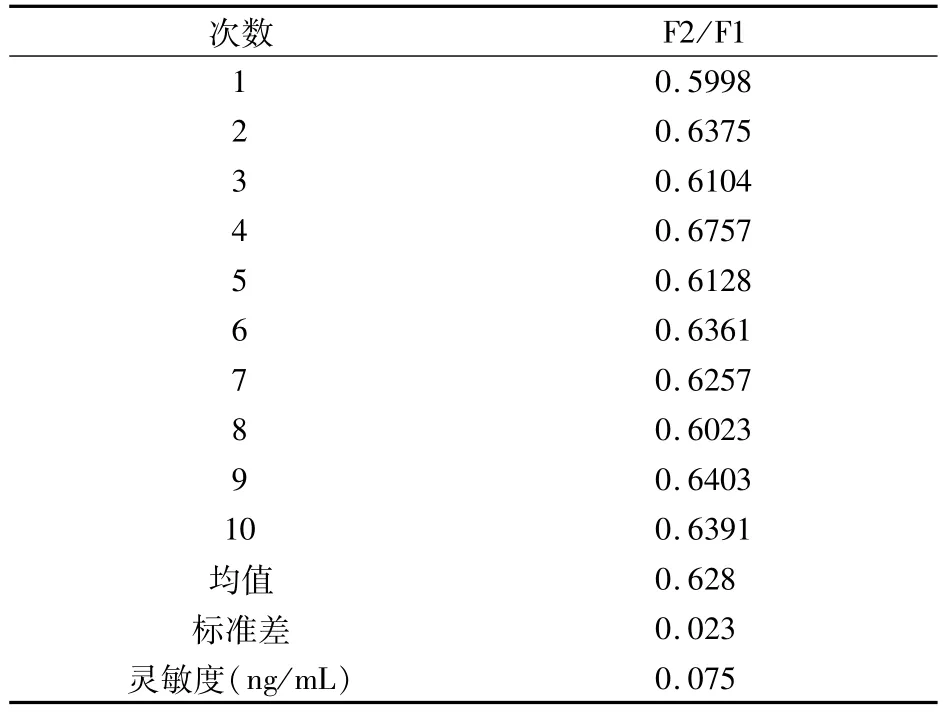
表2 最低检测限实验结果
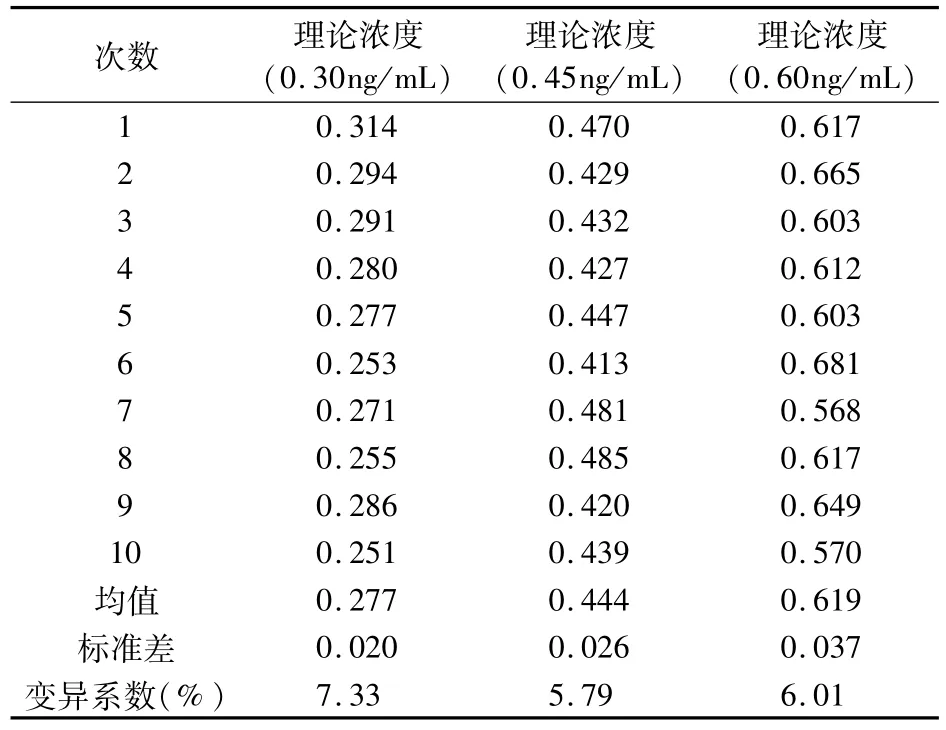
表3 精密度实验结果
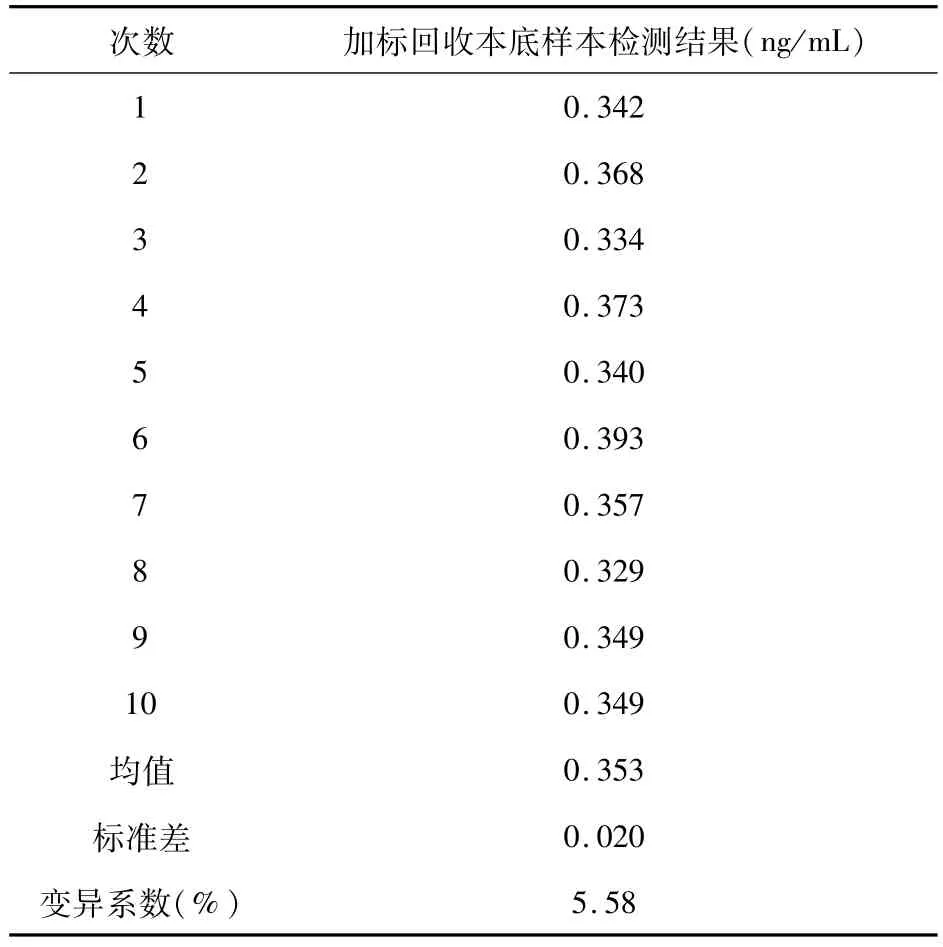
表4 加标回收本底样本检测结果
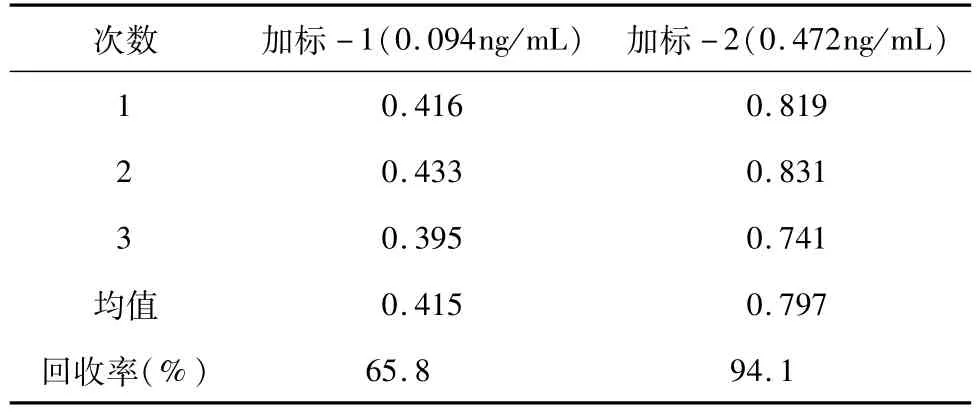
表5 回收率实验结果
2 AFM1荧光淬灭免疫层析检测试纸条与酶联免疫吸附法检测试剂对比结果
结果提示,荧光淬灭免疫层析AFM1检测试纸条与酶联免疫吸附法原理的黄曲霉毒素检测试剂具有良好的相关性(R2=0.9659)。见图3。
讨 论
用于黄曲霉毒素检测的技术有很多,这些技术按定量与否可分为定性分析和定量分析;按照检测原理不同可分为分离类技术和免疫化学类技术。常用的分离类技术包括薄层色谱法(thin-layer chromatography,TLC)、液相色谱 法(liquid chromatography,LC)、微柱筛选法等,可定性或定量检测黄曲霉毒素。TLC自1990年被美国官方农业化学家协会 (Association of Official Agricultural Chemists,AOAC)列为标准方法[7],该方法同时具有定性和定量分析黄曲霉毒素的功能。
免疫层析技术是一种新型的快速免疫分析技术,是以微孔膜作为固相载体,利用液体可以流过微孔膜也可以通过毛细作用在膜上向前移行的特性,以酶或者各种有色微粒子标记抗体或抗原作为标记物,通过抗原抗体反应进行抗原抗体检测的快速检验方法[8]。其中胶体金因其带有肉眼可见的颜色变化、价廉、与生物分子易于结合、稳定等特点,仍然是应用最广的标记物。但在大多数的实验中胶体金免疫层析法为通过肉眼观察T线颜色改变的定性或半定量实验[8-9]。随着现代科学技术的不断发展,特别是免疫学、生物化学和分子生物学的不断发展,人们已创建了不少快速、简便、特异、敏感、低耗且适用的黄曲霉毒素检测方法,尤其是以金标试纸为代表的各种方法已经被先进国家所广泛使用,可在5~10分钟完成对样品中黄曲霉毒素的定性测定。
本实验在原创性荧光淬灭免疫层析法[6]基础上进行黄曲霉毒素检测尝试。荧光淬灭免疫分析技术中胶体金标记的待测物抗体提供受体荧光分子,NC膜上的荧光素提供供体荧光分子,两种分子在10nm范围之内可产生荧光共振能量转移(fluorescence resonance energy transfer,FRET)现象,当胶体金标记的淬灭抗体结合在T线处时,使T线处NC膜的背景荧光发生淬灭。本技术的特点在于,将整张硝酸纤维素膜均匀地标记荧光物质,加入待测物发生层析反应后,以样本中已知和未知的内在荧光物质产生的背景荧光作为荧光基线,利用变化的比值进行计算,可较好去除背景干扰,且可不受仪器随着时间延长读取荧光信号衰减或不同仪器之间读数差异的影响。同一样本在不同仪器上尽管原始荧光信号读数不同,但F2与F1的比值差异无统计学意义。在前期实验中,我们用AFP作为待测物进行了反应体系的测试,结果与临床已使用的化学发光免疫分析法差异无统计学意义,并且检测结果不受黄疸的干扰[6]。
利用原创性荧光淬灭免疫层析法检测AFM1的最低检测下限为0.075ng/mL,分析内变异系数≤7.3%,符合国标GB451337-2010要求(分别为<0.1ng/mL、<10%);回收率为65.8%~94.1%,符合国标GB/T23212-2008(58.8%~97.5%)要求。荧光淬灭免疫层析AFM1检测试纸条与酶联免疫法检测AFM1具有良好的相关性(R2=0.9659)。该技术继承了胶体金免疫层析法的特异、快速、便捷、廉价、稳定的优点,可同时实现定性与定量检测,不仅具有较高灵敏性,还具有较强的抗背景干扰能力,对于牛奶质量检测具有一定的意义。
[1]Bhat R,Rai R V,Karim A A.Mycotoxins in food and feed:present status and future concerns.Com.Rev.Food Sci.Food Saf,2010,9(1):57-81.
[2]Li P,Zhang Q,Zhang D,Guan D,et al.Aflatoxin measurement and analysis.Shanghai:InTech,2011:183-208.
[3]Turner P C.The molecular epidemiology of chronic aflatoxin driven impaired child growth.Scientifica(Cairo),2013:152879.
[4]Wu F,Stacy S L,Kensler T W.Global risk assessment of aflatoxins in maize and peanuts:are regulatory standards adequately protective?Toxicol Sci,2013,135(1):251-259.
[5]Khademi F,Mohammadi M,Kiani A,et al.Efficient conjugation of aflatoxin M1 with bovine serum albumin through aflatoxin M1-(O-carboxymethyl) oximeandproductionofanti-aflatoxinM1 antibodies.Jundishapur J Microbiol.2015,8(4):e16850.
[6]Chen X,Xu Y,Yu J,et al.Antigen detection based on background fluorescence quenching immunochromatographic assay.Anal Chim Acta,2014,841:44-50.
[7]Wacoo A P,Wendiro D,Vuzi P C,et al.Methods for detection of aflatoxins in agricultural food crops.J Appl Chem,2014:1-15.
[8]Cheng X,Pu X,Jun P,et al.Rapid and quantitative detection of C-reactive protein using quantum dots and immunochromatographic test strips.Int J Nanomedicine,2014,9:5619-5626.
[9]Singh J,Sharma S,Nara S.Evaluation of gold nanoparticle based lateral flow assays for diagnosis of enterobacteriaceae members in food and water.Food Chem,2015,170:470-483.
(檀叶青编辑)
Establishment and Evaluation of Real-time and Quantitative Detection of Aflatoxin M1 Using Background Fluorescence Quenching Immunochromatographic Assay
KONG Fan-hong,LIU Li,DONG Cheng-ya,HE Lu,WANG Dan,LIU Ying,WANG Ya-jie
(Beijing Tiantan Hospital,Capital Medical University,Beijing 100050,China)
ObjectiveTo established a rapid,quantitative method by using background fluorescence quenching immunochromatographic assay(bFQICA)to detect aflatoxin M1.MethodsThe sensitivity,repeatability and accuracy of bFQICA strips in detection of aflatoxin M1 were assessed.Meanwhile,the milk samples with aflatoxin M1 were also detected with enzyme-linked immunosorbent detection reagents,and the results were analyzed.ResultsThe LOD of the bFQICA assay was 0.04 ng/mL,and the coefficient of variation of the assay was equal or less than 7.3%.The recovery ratio of the assay was 65.8%to 94.1%.There was good correlation between background fluorescence quenching immunochromatographic assay and enzyme-linked immunosorbent aflatoxin M1 detection reagents(R2=0.9659).ConclusionThe background fluorescence quenching immunochromatographic assay could be used to detect aflatoxin M1 in milk with high sensitivity and good accuracy.
Background fluorescence quenching; Immunochromatography; Aflatoxin M1; Point of care test
10.11748/bjmy.issn.1006-1703.2016.03.026
2015-10-20;
2015-11-12
北京市科技新星计划交叉学科合作课题(xxhz201409);首都医科大学校长基金(2015JYY80);首都医科大学“本科生科研创新”项目(xsky2014104);北京市留学人员科技活动择优资助项目(2013)
王雅杰,医学博士,主任医师,副教授,硕士研究生导师。主要研究领域:疾病相关蛋白质组学及实用性实验室技术和指标研发

