猪圆环病毒2型LAMP检测方法的建立
宋玉财 王官晓 王 彬 于晓云 刘洪明 于小川 王俊卿 徐晓静(山东省烟台市动物卫生监督所 264003)
猪圆环病毒2型LAMP检测方法的建立
宋玉财 王官晓 王 彬 于晓云 刘洪明 于小川 王俊卿 徐晓静(山东省烟台市动物卫生监督所 264003)
本试验首先以PCV2的ORF2基因作为靶基因设计4条特异性引物,再优化LAMP反应体系各成分以找到最佳配比,经过特异性与灵敏度试验的验证,最终建立快速检测PCV2的LAMP方法。结果显示,该方法最短可在1h内完成整个检测过程,最小检测量接近1拷贝质粒DNA,灵敏度远高于本实验室常用的PCR方法,且相同条件下PCV1、PPV、PRV均不发生扩增,特异性良好。除通过琼脂糖凝胶电泳得到阶梯状条带外,还可加入SYBR Green I染料肉眼判定结果。
猪圆环病毒2型 环介导等温扩增
LAMP建立之初是作为一种创新的、用于体外扩增核酸的分子生物学技术,后续的研究发现,其许多特点使其在病原检测中也有着不可比拟的优势。本研究利用环介导等温扩增技术(LAMP)建立了一种新的检测猪圆环病毒2型(PCV2)核酸的方法,扩充了实验室检测抗原的方式,由于LAMP检测方法摆脱了昂贵仪器的束缚,适合于条件受到限制的基层临床诊断。此次尝试为本实验室在检测PCV2方向提供了新的途径,进一步改善之后也能为基层临床诊断提供试剂盒选择。
1 材料与方法
1.1 质粒与病毒来源 分别连接PCV2、PCV1整个病毒基因组的重组质粒pSK-PCV2-SD1、pMD18-T-PCV1为山东省畜禽疫病防治及繁育重点实验室保存提供。猪细小病毒病灭活疫苗WH-1株由中牧实业股份有限公司提供、伪狂犬病活疫苗由吉林正业生物制品股份有限公司提供。
1.2 主要试剂 Bst DNA聚合酶(大片段)(美国New England Biolabs公司)、Betaine(美国Sigma-Aldrich公司)、MgSO4(美国Amresco公司)、Taq DNA聚合酶(Fermentas中国公司)、普通质粒小提试剂盒(天根生化科技北京有限公司);SYBR Green I核酸染料、Tris平衡酚购自北京索莱宝科技有限公司;dNTP、DNA Marker DL-2000、蛋白酶K均购自宝生物工程(大连)有限公司;其他试剂均为进口或国产分析纯。
1.3 DNA模板的制备 (1)质粒的抽提:无菌条件下,取两瓶的LB液体培养基,首先按1:1000的比例加入氨苄青霉素(Amp,100mg/ml),摇匀后再分别以1:100接种含有重组质粒pSK-PCV2 SD1、pMD18-T-PCV1的DH5α菌种,置于振荡器中37℃ 200r/min摇菌12h。将菌液转至离心管,质粒提取过程参照天根生化科技(北京)有限公司普通质粒小提试剂盒(离心柱型)说明书。(2)DNA的提取:加入1ml灭菌水溶解粉末状伪狂犬病活疫苗,取伪狂犬活疫苗溶解液和猪细小病毒病灭活疫苗各500μl于1.5ml离心管。向离心管中加入10% SDS溶液50μl,而后加入蛋白酶K(20mg/ml)10ul,混匀后置55℃水浴1.5~2h;加入200μL Tris平衡酚,充分混匀溶液,置高速离心机中4℃12000rpm离心15min;取上清液于一新1.5ml离心管中,加入Tris平衡酚和氯仿各200μl,充分混匀,4℃ 12000rpm离心15min;取上清液于一新离心管中,加入氯仿200μl,充分混匀,4℃ 12000rpm离心15min;取上清液于一新离心管中,加入2倍上清液体积的已预冷的无水乙醇,于冰箱-20℃静置20min后,4℃ 12000rpm离心15min,弃掉上清液,此时会发现管底附着有透明粘性沉淀。向离心管中加入1mL 70%乙醇冲洗沉淀表面和管壁,4℃ 7500rpm离心5min,弃掉乙醇,用吸水纸吸走余下液体;加入20μL灭菌水将沉淀溶解,置于-20℃保存备用。
1.4 引物设计与合成 根据GenBank上公布的多个PCV2毒株基因序列,以BioEdit软件进行序列比对,筛选出序列JS2003(登录号:AY578327)的ORF2片段作为靶基因,应用日本荣研株式会社的在线引物设计程序Primer Explorer V4(http://primerexplorer.jp/e/),设计得到4条LAMP引物,包括1对外引物(F3/B3)和1对内引物(FIP/BIP)。P3、P4为实验室常用PCR反应中扩增整个ORF2基因的上下游引物。所有引物由生工生物工程(上海)有限公司合成。引物序列见表1。

表1 LAMP和PCR引物序列
1.5 LAMP检测方法的建立与优化 通常LAMP方法使用25μL反应体系,成分包括:内外引物、dNTPs、MgSO4、Betaine、Bst DNA聚合酶、10×ThermoPol Buffer、模板DNA。以LAMP原文中提到的反应体系为基础,对各组分进行适当优化。内外引物浓度比按照10:1~1:1不断调试,其中内引物终浓度范围0.8~2.4μM,外引物终浓度范围0.2~0.8μM;dNTPs终浓度范围0.2~1.4mM;MgSO4终浓度范围0~6mM;Betaine终浓度范围0~1.4M;Bst DNA聚合酶8U、10×ThermoPol Buffer 2.5μl、模板DNA 1μl。反应温度控制在60~65℃,扩增60min,80℃ 5min终止反应。取8μL扩增产物上样于1.5%琼脂糖凝胶中电泳,置凝胶成像系统下观察结果。此外,还可向反应管中加入1μl SY BR Green I核酸染料,肉眼观察溶液颜色变化,进一步确定结果,可将反应管置于紫外分析仪下观察有无荧光。
1.6 PCR体系构成和扩增反应程序 以实验室常用检测PCV2的PCR方法来实现与LAMP检测方法的对比,PCR方法也使用25μL反应体系,已经过前任研究者的优化。各成分终浓度分别是:上下游引物(P3、P4)0.4μM,dNTPs 0.2mM,1.5mM MgCl2,2.5U Taq DNA聚合酶,1×Taq Buffer with KCl。加入模板DNA 1μl,灭菌水补齐25μl。PCR扩增反应程序设定为:95℃ 3min,94℃1min,55℃ 1min,72℃ 1min,共30个循环;最后72℃延伸10min。扩增产物经1.5%琼脂糖凝胶电泳,在凝胶成像系统下分析结果。
1.7 LAMP检测方法的灵敏性试验 (1)梯度标准质粒模板的建立:① 分子量(M)=碱基数×碱基平均分子量=(扩增片段碱基数+载体碱基数)×2×330;②拷贝数=质量/分子量*NA= m/M*NA。制备质粒模板,用微量紫外分光光度计测定其浓度,计算出此浓度下溶液包含的质粒拷贝数,使用灭菌水倍比稀释该溶液,得到每μl溶液所含质粒拷贝数的数量级按109~100依次分布的梯度标准质粒模板。(2)LAMP和PCR方法的灵敏度测定:以1μl拷贝数为109~100梯度标准质粒溶液为模板DNA,按照优化后的体系进行LAMP反应。同时,使用相同的模板DNA进行常规PCR检测。两者的扩增产物经1.5%琼脂糖凝胶电泳分析,LAMP的扩增产物加入SYBR Green I核酸染料,置紫外分析仪下观察结果。另外,提取临床已知的58份病料的DNA,同时进行了LAMP和PCR方法的检测,予以比较。
1.8 LAMP检测方法的特异性试验 提取到重组质粒pSK-PCV2-SD1、pMD18-T-PCV1,提取到两种疫苗中的PRV和PPV基因组DNA。通过实验室其他研究人员建立的,用于同时检测PCV、PRV、PPV的多重PCR诊断方法来确定PRV和PPV作为对照可用。分别以质粒pSK-PCV2-SD1、pMD18-T-PCV1和验证过含PRV、PPV的DNA为模板,灭菌水为阴性对照,采用优化后的体系来检验LAMP方法的特异性。扩增完成后,1.5%琼脂糖凝胶中电泳确定结果。
2 结果
2.1 优化后的LAMP反应体系 LAMP优化完成的25μL反应体系中各成分最终浓度确定为:内引物(FIP/BIP) 2.4μM,外引物(F3/B3)0.24μM,dNTPs 0.6mM,Betaine 0.4M,Bst DNA聚合酶8U,1×ThermoPol Buffer(20mM Tris-HCl、10mM KCl、10mM (NH4)2SO4、2mM MgSO4、0.1% Triton X-100),模板DNA 1μl,添加灭菌水至25μl。可以看到1×ThermoPol Buffer包含2mM的MgSO4,试验证明在该体系下另外添加Mg2+后可导致扩增失败。最佳反应条件是将反应管置63℃水浴60min,再放入80℃ 5min中止扩增。电泳分析可得知,当反应温度在60~64℃范围,均能呈现出明显的LAMP特有的阶梯状条带,表明扩增完成良好,其中尤以63℃条带最亮;加入SYBR Green I核酸染料后,肉眼观察可见阳性反应管内液体呈黄色,而阴性对照则为橙红色;紫外灯下可见阳性反应管发出明亮的黄色荧光。
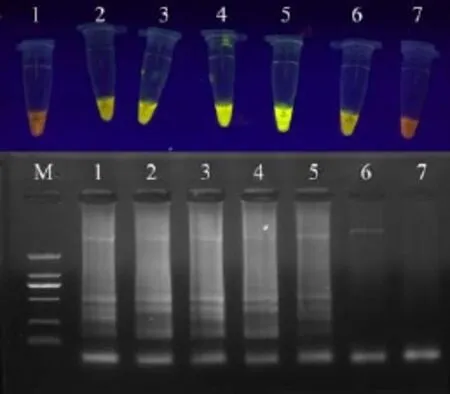
图1 LAMP温度梯度的电泳及可视化分析
2.2 LAMP检测方法的灵敏度 (1)使用引物P3、P4的PCR方法扩增的靶序列包含PCV2基因组中整个ORF2,扩增片段大小717bp。灵敏度测试以含有109~100拷贝数的标准质粒溶液为模板DNA。电泳结果可见,PCR的条带从第7泳道开始消失,而LAMP的阶梯状条带直到第10泳道,也就是质粒模板仅为个位拷贝数时仍完成扩增。相比较而言,LAMP检测方法的最低检测量为100拷贝,质粒浓度约为0.01fg/μL;常规PCR检测方法的最低检测量为104拷贝,质粒浓度约为100fg/μL。同时检测PCV2,LAMP方法的灵敏度相当于常规PCR法的10000倍。(2)对于临床已知的58份病料的检测情况为:PCR方法共检测出12例阳性结果,而LAMP方法则检测出了18例阳性结果,相比PCR方法能多检测出6例阳性病料。在临床检测结果的确认方面还有不完善的地方,但应该能部分反映出LAMP方法的灵敏性确实比PCR要好一些。

图2 LAMP检测方法和PCR的灵敏度对比A: LAMP灵敏度的电泳及可视化分析;B: PCR灵敏度的电泳分析。M:DNA Marker DL-2000;1-10:每反应管内模板质粒拷贝数10倍倍比缩小,依次从109-100;11:阴性对照。Lanes: M, DNA Marker DL-2000; 1, 1 × 109copies/tube; 2, 1 × 108copies/tube; 3, 1 × 107copies/tube; 4, 1 × 106copies/tube; 5, 1 × 105copies/tube; 6, 1 × 104copies/tube; 7, 1 × 103copies/tube; 8, 1 × 102copies/tube; 9, 1 × 101copies/tube; 10, 1 × 100copy/tube; 11, negative control.
2.3 LAMP检测方法的特异性 PCV2、PRV、PPV是引起几类主要猪病的重点DNA病毒,PCV1不具致病性,但由于与PCV2基因组之间存在较高的同源性,在检测PCV2感染时必须能够加以区分。电泳结果显示,同等条件下,只有以重组质粒pSK-PCV2 SD1为模板的LAMP扩增产物呈现特有的阶梯状条带。其余分别使用重组质粒pMD18-T-PCV1、PRV DNA、PPV DNA作为模板的反应结果均为阴性。说明该LAMP检测方法对PCV2有良好的特异性。

图3 LAMP检测方法特异性试验的电泳分析
3 讨论
(1)猪圆环病毒包括PCV1和PCV2两种基因型,PCV1并无致病性,而PCV2感染对养猪业来说却是一个比较棘手的问题。Meehan等报道中提到PCV2各毒株间的核苷酸同源率达到96%以上,PCV1和PCV2之间的核苷酸同源率则小于80%[1-3]。以基因组中两个较大的开放阅读框ORF1和ORF2来看,两者在ORF1的核苷酸同源率约为83%,相对地,两者在ORF2的核苷酸同源率更小,约为67%[2-4]。试验的目的是扩增只针对PCV2进行,选择ORF2为靶基因设计的4条引物,从而取得了比较理想的结果。(2)试验中发现,LAMP体系的优化与引物不同有关,同样的体系在引物改变后有可能不会完成核酸扩增。因此,每当更换一组引物,体系配比最好重新摸索。如本试验最终选定的这组引物所构成的体系,在MgSO4终浓度超过2mM时,便无法继续完成核酸扩增。此外,扩增失败的原因还与内外引物浓度比密切相关,就这组引物而言,当内引物浓度不大于2µM,外引物浓度不大于0.2µM时,只有当模板浓度较大时扩增才能发生。所以,前期不断调试直到找到最佳反应体系,对于后续LAMP灵敏度和特异性方面的研究是至关重要的。(3)LAMP原理表明,当形成使核酸循环扩增的初始茎环结构后,多条内引物会同时与模板作用[5],最终形成茎环数量不同的混合产物。因此经过凝胶电泳能呈现出LAMP特有的阶梯状条带。在其他文献中提到LAMP扩增过程中产生焦磷酸镁,将反应管离心后能观察到白色沉淀[6]。但本试验发现,由于沉淀很难经由肉眼观察,在没有浊度仪的情况下,这种判别方式并不理想,当然也可能与该体系的Mg2+浓度偏低有关。除了通过凝胶电泳的方式判定结果外,还可向扩增产物中添加SYBR Green I核酸染料,本试验中经常会出现阳性反应管内液体呈橘黄色而阴性管呈橘红色的情况,所以相对于单纯用肉眼观察,将反应管置于紫外灯下观察有无荧光会使精确度提高很多。
[1] Hamel AL, Lin LL, Nayar GP. Nucleotide sequence of porcine circovirus associated with postweaning multisystemic wasting syndrome in pigs[J]. J Virol, 1998, 72(6):5262-5267.
[2] Meehan BM, McNeilly F, Todd D, et al. Characterization of novel circovirus DNAs associated with wasting syndromes in pigs[J]. J Gen Virol, 1998, 79(Pt 9):2171-2179.
[3] Morozov I, Sirinarumiter T, Sorden SD, et al. Detection of a novel strain of porcine circovirus in pigs with postweaning multisystemic wasting syndrome[J]. J Clin Microbiol, 1998, 36(9):2-2541.
[4] Gibbs MJ, Weiller GF. Evidence that a plant virus switched hosts to infect a vertebrate and then recombined with a vertebrate-infecting virus[J]. Proc Natl Acad Sci USA , 1999, 96(14):8022-8027.
[5] Mori Y, Hirano T, Notomi T. Sequence specific visual detection of LAMP reactions by addition of cationic polymers [J]. BMC Biotechnol, 2006, 6:3.
[6] Enosawa M, Kageyama S, Sawai K, et al. Use of loop-mediated isothermal amplification of the IS900 sequence for rapid detection of cultured Mycobacterium avium subsp. Paratuberculosis [J]. J Clin Microbiol, 2003, 41(9):4359-4365.
S852.65+9.2
A
1007-1733(2016)05-0009-03
2016–02–26)

