去盲肠公鸡对豆粕氨基酸标准消化率的比较研究
胡如久 汪 菲 李 晶 杨小军 姚军虎
(西北农林科技大学动物科技学院,杨凌 712100)
去盲肠公鸡对豆粕氨基酸标准消化率的比较研究
胡如久 汪 菲 李 晶 杨小军 姚军虎
(西北农林科技大学动物科技学院,杨凌 712100)
在比较分析无氮日粮法(NFD)和回归法(REG)测定去盲肠公鸡的内源氨基酸基础损失量(EAALb)的基础上,采用排空-强饲代谢试验测定豆粕的氨基酸(AA)标准消化率,为家禽饲料原料AA营养价值的评定提供理论依据。结果显示:(1)总AA的排泄量(mg/kg DMI)与摄入量(mg/kg DMI)间线性回归方程为Y=12 625.2+0.096X(R2=0.759);(2)NFD法和REG法测定的EAALb分别为11 489.7、12 625.2 mg/kg DMI,两者间差异不显著(P>0.05);(3)豆粕总AA的表观消化率随日粮粗蛋白质(CP)水平的增加呈二次曲线变化规律,在CP>12.0%时,达到相对恒定;经NFD和REG校正后得到的豆粕总AA标准消化率差异不显著(P>0.05),且均不依赖于日粮CP水平,分别介于85.58%~89.61%和86.75%~90.05%。以上结果表明,NFD和REG均可用于测定EAALb,豆粕总AA和大部分AA的标准消化率不受日粮CP水平的影响,表明以豆粕AA标准消化率配制日粮具有较好的可加性。
无氮日粮法 回归法 内源氨基酸损失量 氨基酸消化率 去盲肠公鸡
豆粕作为家禽饲料中最主要的蛋白质原料,氨基酸(AA)消化率是评价其营养价值的重要指标之一。准确测定饲料原料的AA消化率是实现日粮精准供给AA的基础。生产实践中,常采用表观可消化AA或AA表观消化率(Apparent digestibility, AD)指标来配合家禽日粮。然而,越来越多的研究表明[1-2],以AD值为基础设计的日粮配方不能准确反映家禽对饲料AA的利用情况,因此,很难精准地满足家禽的AA需要。标准可消化AA或AA标准消化率(Standardized digestibility, SD)指标是用内源氨基酸基础损失量(Basal endogenous amino acid losses, EAALb)对AD进行校正后得到的,较AD指标评定家禽AA需要及饲料AA营养价值具有更高的准确性[3]。研究表明,采用SD值配合日粮比AD值具有更好的可加性和可重复性[4]。因此,准确测定EAALb成为采用SD指标配合日粮的关键。目前,有许多方法测定EAAL[5-8],其中无氮日粮法(Nitrogen-free diet method, NFD)和回归法(Regression method, REG)是常见的测定EAAL的方法,测值可代表EAALb。对于一个可靠SD值,EAALb的测定结果必须具有一致性和可重复性。然而,NFD和REG测定鸡EAALb的结论不尽相同,二者测定值在不同研究间变异较大[9-11]。此外,由于排除后肠道微生物干扰和精准饲喂,去盲肠公鸡排空-强饲代谢试验用于测定鸡EAAL和AA消化率已被广泛接受[12-14]。因此,本试验以去盲肠公鸡为实验动物,分别采用NFD和REG测定EAALb,在此基础上测定豆粕AA的SD值,并对这2种方法获得的结果进行了比较,为家禽饲料原料的AA营养价值评定提供参考。
1 材料与方法
1.1 试验设计与日粮
42只去盲肠公鸡随机等分为7个处理组,每处理6重复。处理1饲喂NFD,直接测定EAALb;其余6组饲喂以豆粕为唯一粗蛋白质(CP)来源(各组CP水平分别为3.0%、6.0%、9.0%、12.0%、15.0%、18.0%)的半纯合日粮,用于回归法测定EAALb。
试验日粮是以玉米淀粉和蔗糖为主要原料配制成的半纯合日粮,采用纸纤维调平各组粗纤维水平,参考Adedokun等[15]推荐的方法调平日粮电解质,除了CP和AA外,其他营养成分均满足或超过NRC(1994)[16]公鸡营养需要。试验日粮组成与主要营养指标见表1。
1.2 实验动物及饲养管理
选择25周龄、体重一致[(2.24±0.15) kg]、健康的罗曼褐蛋公鸡42只,试验前对所有试鸡进行盲肠切除手术,手术操作和术后护理参考Payne等[17]。术后恢复6周,待试鸡体况、采食、排泄恢复正常后,开始正式试验。试验期间单笼饲养,保证饮水,舍温控制在16~20 ℃,相对湿度55%~65%。
1.3 代谢试验
代谢试验操作参考“Sibbald”排空-强饲法操作程序[18],采用48 h空腹+48 h全收粪法。强饲前在试鸡肛门缝制空心塑料瓶盖,以便内旋上已绑定螺口的集粪袋收集试鸡的排泄物,适应5 d后开始试验。禁食24 h后每只试鸡预强饲25 g/kg bw相应试验日粮,并准确计时,48 h后进行正式强饲(25 g/kg bw),之后立即套上集粪袋,每隔2 h收集1次,连续收集48 h。每次收集排泄物后按10 mL/200 g鲜样加10%的硫酸和3滴甲苯防腐,然后立即置于-20 ℃冰箱冷冻保存。
1.4 化学分析
分析前排泄物在4 ℃下溶化,将每只鸡48 h采集的排泄物混合均匀,经真空冷冻干燥后回潮24 h,称重并粉碎,过0.5 mm筛后用四分法取样待测。豆粕、试验日粮和排泄物中的干物质、粗蛋白质、粗纤维、中性洗涤纤维按照杨胜[19]的方法进行测定。饲料和排泄物中AA是在110 ℃下6 mol/L盐酸水解24 h后使用Biochrom 30型氨基酸自动分析仪(Pharmacia Biotech, UK)进行测定。由于谷氨酰胺和天冬酰胺在水解过程中分别被转化成谷氨酸和天冬氨酸,所以测定得到的谷氨酸和天冬氨酸值分别代表的是样品中谷氨酸+谷氨酰胺和天冬氨酸+天冬酰胺的含量。酪氨酸和色氨酸在水解中被破坏,没有被测定。
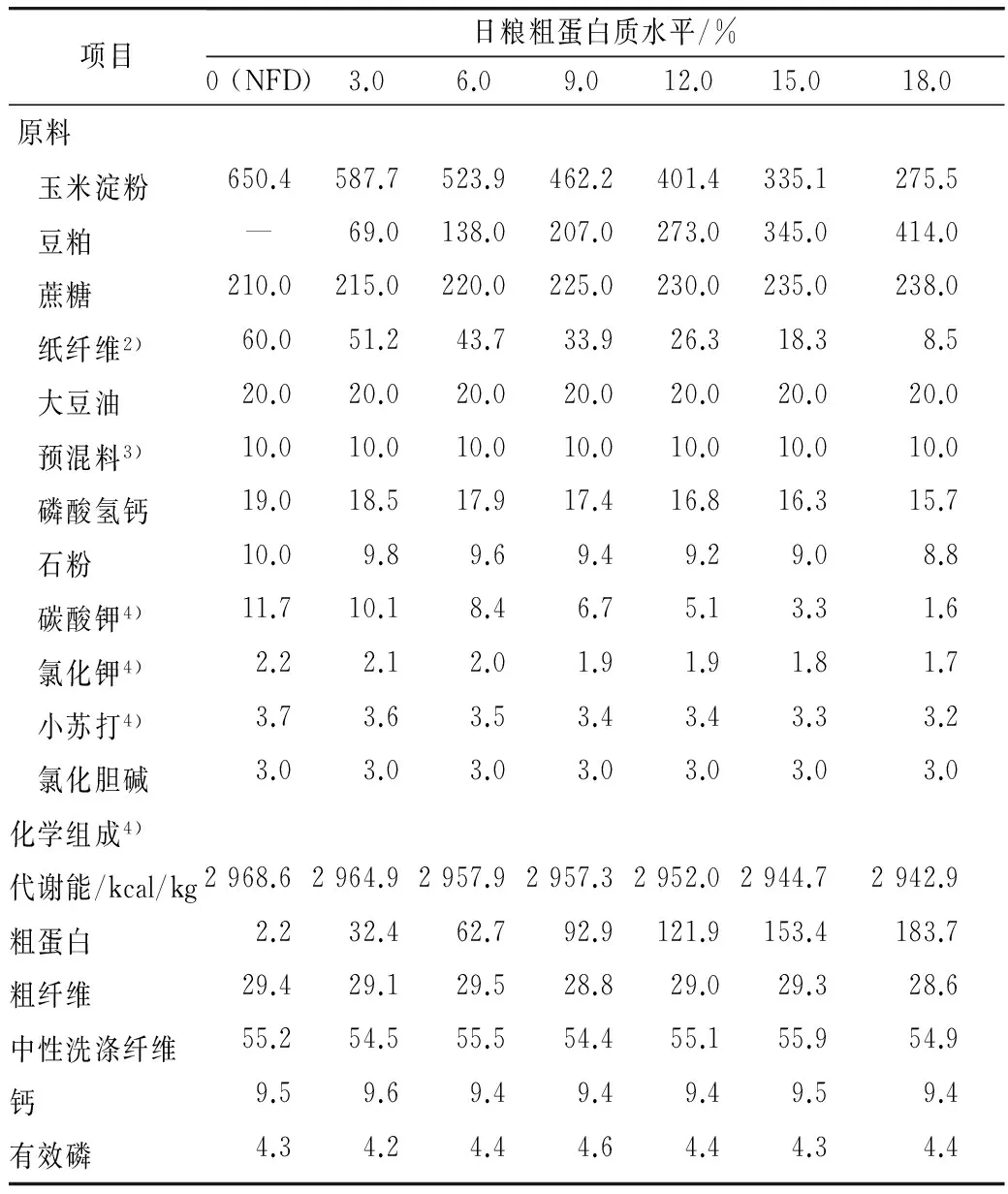
表1 试验日粮组成及营养水平(饲喂基础)/g/kg
注:1) 日粮组成及营养水平以饲喂状态为基础。2) 中国药业集团公司上海化学试剂公司,其中CF 490 g/kg,NDF 910 g/kg。3) 向每kg日粮提供:VA 5 000 IU,VD31 500 IU,VE 30 IU,VK33.0 mg,VB14.0 mg,VB26. 0 mg,VB64.0 mg,VB1230.0 μg,烟酸 35.0 mg,泛酸钙 15.0 mg,叶酸5.0 mg,生物素0.3 mg,Fe 60 mg,Cu 10 mg,Mn 80 mg,Zn 80 mg,I 0.4 mg,Se 0.3 mg。 4) 参考Adedokun等[11]添加方法保证日粮电解质平衡,每千克日粮中Na++K+Cl-毫当量(mEq)值为203.0。
1.5 计算与统计分析
AD计算公式如(1)所示:

(1)
式中:IAA为日粮AA总摄入量(mg/kg DMI),FAA为排泄物中AA总排泄量(mg/kg DMI)。
NFD由于使用不含氮日粮饲喂试鸡,收集的排泄物中AA含量即为EAALb,记为EAALbnfd(mg/kg DMI)。
REG原理:根据REG计算原理[20],其计算公式如(2)所示。IAA (X)对FAA(Y)作线性回归,如果这种线性关系存在,则当回归方程外推到IAA为0时,回归截距值(a值)即为EAALb,记为EAALbreg(mg/kg DMI)。
Y=a+bX
(2)
SD的计算:经EAALb校正AD可得到SD,其计算公式如下:
(3)
所有试验数据采用IBM SPSS 21.0软件进行one-way ANOVA分析,差异显著时进行Duncan氏多重比较检验,以P<0.05作为显著性判断标准。
2 结果分析
2.1 内源氨基酸基础损失量
NFD和REG测定的EAALb值见表2。REG中除了Arg、Cys、Val和Pro外,大多数AA的总排泄量(mg/kg DMI)与总摄入量(mg/kg DMI)间线性回归方程的R2>0.700,总AA的回归方程为Y=12 625.2+0.096X(R2=0.759)。Cys的R2过低(R2=0.052),回归方程无统计学意义,故REG不能测定Cys内源基础损失量。除Lys和Val外,REG测定的其他AA的内源基础损失量值与NFD法测定值差异不显著(P>0.05)。图1直观比较了两种方法测定总AA的内源基础损失量,REG测定总AA的内源基础损失量(12 625.2 mg/kg DMI)与NFD法测定值(11 489.7 mg/kg DMI)差异不显著(P>0.05)。两种测定方法中,各AA的内源基础损失量的相对大小基本一致,Glu均为内源损失较大的AA,其次是Pro、Asp、Thr、Val、Ser。总体上,大部分非必需AA的内源基础损失量高于必需AA。

表2 无氮日粮法与回归法测定去盲肠公鸡内源氨基酸基础损失量的比较
注:同种氨基酸的同一行平均值肩标字母不同者,表示差异显著(P<0.05),下同。

图1 无氮日粮法、回归法测定去盲肠公鸡内源氨基酸基础损失量
2.2 氨基酸表观消化率
表3为测定的各个AA和总AA的表观消化率。由表3可知,在日粮CP低于12.0%时,各组的绝大多数AA和总AA的表观消化率随日粮CP水平的增加而显著增加(P<0.05);在日粮CP高于12.0%时,各组的绝大多数AA和总AA的表观消化率差异不显著(P>0.05)。从整体来看,大多数必需AA的表观消化率值高于非必需AA,其中,Arg、Ile、His、Leu、Met、Lys、Phe、Asp和Glu的表观消化率较高,而Cys和Pro的表观消化率较低,在日粮CP为3.0%时为负值。总AA的表观消化率在日粮CP高于12.0%时基本稳定在80.0%以上。
2.3 氨基酸标准消化率
NFD测定的SD值见表4。由表4可知,除在日粮CP水平为3.0%时16种AA中有8种AA的SD值显著低于其他各组之外(P<0.05),其他各组的各个AA和总AA的SD值无显著差异(P>0.05)。在日粮CP水平为6.0%~18.0%的范围内,NFD测定豆粕的SD值变化范围为87.36%~89.61%。
REG测定的SD值见表5。由表5可知,除Leu、Ser在日粮CP水平为3%的SD值显著低于其他各组外(P<0.05),其他各组的各个AA和总AA的SD值无显著差异(P>0.05)。由于REG测定的Cys内源损失量值不可用,故其SD未列出。在日粮CP水平为3.0%~18.0%的范围内,REG测定豆粕的SD值变化范围为86.75%~90.05%。
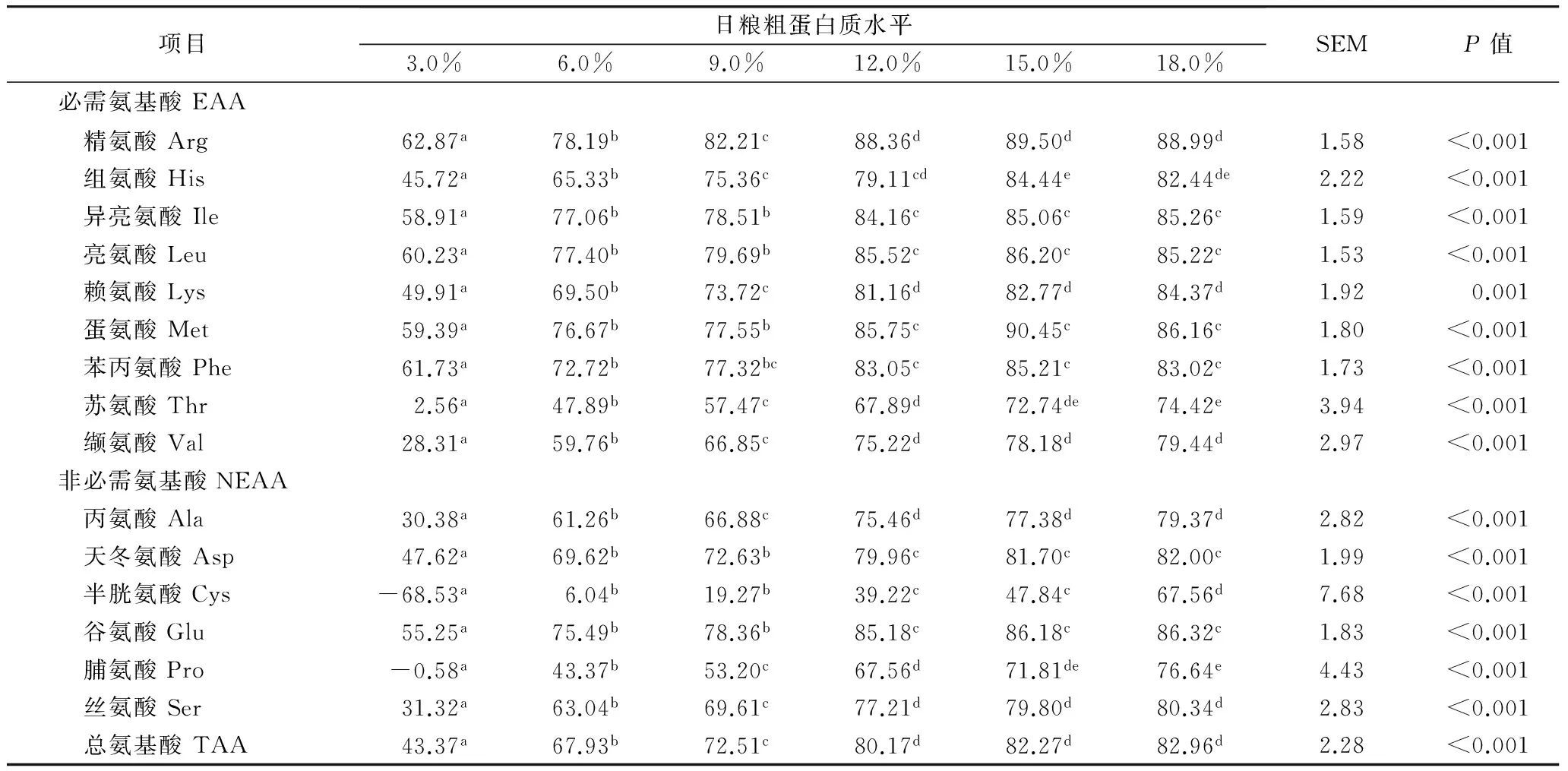
表3 去盲肠公鸡对以豆粕为基础的日粮氨基酸表观消化率/%

表4 无氮日粮法测定以豆粕为基础的日粮氨基酸标准消化率/%
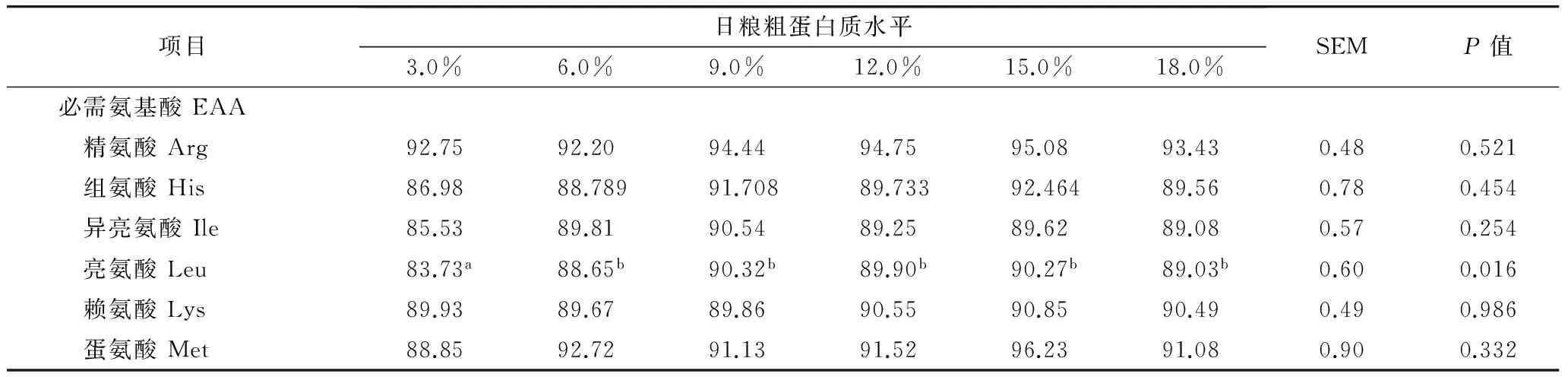
表5 回归法测定的以豆粕为基础的日粮氨基酸标准消化率/%

表5(续)
注:1) REG测定的Cys内源损失量值不可用,故REG校正的Cys标准消化率未列。

图2 日粮CP水平对氨基酸表观消化率和标准消化率的影响
总AA的表观消化率及2种方法校正的总AA标准消化率随日粮CP水平变化的规律见图2。由图2可知,总AA的表观消化率随日粮CP水平的增加呈二次曲线变化规律,在日粮CP高于12.0%时,达到稳定。NFD和REG校正的总AA标准消化率的曲线基本重合,表明这2种方法均可测定AA的标准消化率。
3 讨论
3.1 不同方法测定内源氨基酸基础损失量的比较
NFD较其他测定家禽EAALb的方法具有简单易行、成本低廉等优点,目前仍是测定家禽EAALb的经典和常用方法。统计分析资料表明,NFD是测定EAALb最具一致性和可靠性的方法,其测值居各种方法的均值附近。REG也是测定家禽EAALb的常见方法之一。REG假定排泄物中AA总流量与其食入量间呈线性关系,当外推AA食入量为零时的AA排泄量(即回归截距)就是EAALb。本试验结果表明,REG测定的排泄量(mg/kg DMI)与日粮总AA摄入量(mg/kg DMI)的回归方程为Y=12 625.2+0.096X(R2=0.759),线性关系相对较好,大多数AA的摄入量与排泄量间回归方程的R2>0.700。然而,Souffrant[21]指出AA排泄量与摄入量可能不存在线性关系。由于AA排泄量受众多因素影响[15],如随日粮蛋白质水平的增加,其他日粮成分也会相应改变,从而影响对结果的估测,所以AA排泄量与摄入量间是否存在稳定的线性关系还有待考证。
本试验结果表明,REG测定的总AA的内源基础损失量稍高于NFD,但二者无显著差异,这与Furuya等[22]的试验结果基本一致。此外,其他研究者[23-24]在猪和小鼠上也得到类似结果。然而,Fígares等[25]报道,采用REG测定鸡的EAALb显著高于NFD;张鹤亮等[26]研究结果则显示NFD测值高于REG。这说明NFD与REG比较,不同研究者得到的结论并不一致,二者测值在不同研究间变异较大,这可能是由于试验日粮组成、试验动物、排泄物收集的时间、环境等因素的不同造成的。
对于NFD与REG所测定的EAALb的AA组成而言,本试验测定的必需AA内源基础损失量相对较低,这与Boisen等[27]在猪上测定的结果一致。此外,本试验表明,Glu、Pro和Asp均为内源基础损失量最大的3种AA,Thr、Val、Ser、Lys相对较高,这与前人结果[7,28]较一致。家禽胃肠道EAAL是内源氨基酸分泌和重吸收共同作用的结果,主要来源于消化液(唾液、胆汁、胃液、胰液和肠液)、黏蛋白、肠脱落细胞和血清白蛋白等[3]。黏蛋白是其中最主要的组成部分,富含Glu、Pro、Thr、Ser(糖基化区域)和Cys(未糖基化区域)等AA[29],从而造成EAAL中这些AA的含量较高。另外,Taverner等[30]指出,肠道中来源于内源部分的Glu、Asp、Thr、Ser等重吸收量低,较多进入排泄物。
3.2 不同方法测定豆粕氨基酸标准消化率的比较
本试验结果表明,豆粕AA的表观消化率受日粮CP水平影响较大,总AA的表观消化率随CP的增加呈曲线变化,在CP>12.0%后基本保持恒定,这与姚军虎等[5]和Fan等[31]等结果一致。各种AA的AD在3.0%时普遍较低,这是因为此阶段EAAL占总排泄物的比例较高,小肠吸收的AA含量也少,对AD的结果影响较大[31]。经NFD和REG校正后的豆粕SD值在不同CP水平下的差异较AD低,虽然REG测定标准消化率比NFD测定值略高且更恒定,但二者测值差异不显著,且均不依赖于日粮CP水平,分别介于85.58%~89.61%和86.75%~90.05%,这与Zhai等[32]报道结果相似。
Stein等[2, 4]综述指出,蛋白质饲料原料AA的AD值等于该AA摄入量减去该AA的总排泄量后与AA摄入量的比值,此计算方法没有排除了EAAL的干扰,受日粮影响变化很大,在配合饲料中可加性较低;SD是用EAALb校正表观消化率得到的,即从表观AA消化率所去除的AA总排泄量中减去了EAALb后得到的AA消化率,由于EAALb受日粮影响变化不大,SD基本保持相对恒定。本试验中NFD和REG测定的豆粕AA标准消化率随日粮CP的变化规律与上述Stein[2]等提出的经典理论相符,表明这2种方法均可作为测定基础EAAL较为理想的方法,在此基础上通过校正此2种方法测定的EAALb获得的豆粕AA的SD具有比较高的准确性。
4 结论
NFD和REG均可作为测定EAALb较为理想的方法。豆粕AA的表观消化率显著受日粮蛋白质水平的影响,而经NFD和REG校正后的AA标准消化率均不受日粮蛋白质水平的影响,表明以AA标准消化率配合日粮具有较好的可加性。
[1]Adedokun S A, Adeola O, Parsons C M, et al. Methodology for endogenous flow estimates for standardization of digestible amino acids[J]. Poultry Science, 2007, 86:395-395
[2]Stein H H, Seve B, Fuller M F, et al. Invited review: Amino acid bioavailability and digestibility in pig feed ingredients: Terminology and application[J]. Journal of Animal Science, 2007, 85(1):172-180
[3]Nyachoti C M, deLange C F M, McBride B W, et al. Significance of endogenous gut nitrogen losses in the nutrition of growing pigs: A review[J]. Canadian Journal of Animal Science, 1997, 77(1):149-163
[4]Stein H H, Fuller M F, Moughan P J, et al. Definition of apparent, true, and standardized ileal digestibility of amino acids in pigs[J]. Livestock Science, 2007, 109(1):282-285
[5]姚军虎, 王康宁, 杨凤, 等. 肉仔鸡内源氨基酸基本损失量测定方法的比较研究[J]. 动物营养学报, 2000(4):23-27
Yao J H, Wan K N, Yang F,et al. Comparative research on the methods for measure basal endogenous amino acid losses of broiler chickens [J]. Chinese Journal of Animal Nutrition, 2000(4):23-27
[6]Ravindran V, Hew L I, Ravindran G, et al. Endogenous amino acid flow in the avian ileum: quantification using three techniques[J]. British Journal Nutrition, 2004, 92(2):217-223
[7]Golian A, Guenter W, Hoehler D, et al. Comparison of various methods for endogenous ileal amino acid flow determination in broiler chickens[J]. Poultry Science, 2008, 87(4):706-712
[8]Adedokun S A, Adeola O, Parsons C M, et al. Standardized ileal amino acid digestibility of plant feedstuffs in broiler chickens and turkey poults using a nitrogen-free or casein diet[J]. Poultry Science, 2008, 87(12):2535-2548
[9]Donkoh A, Moughan P J, Morel P C. Comparison of methods to determine the endogenous amino acid flow at the terminal ileum of the growing rat[J]. Journal of the Science of Food and Agriculture, 1995, 67(3):359-366
[10]Siriwan P, Bryden W, Mollah Y, et al. Measurement of endogenous amino acid losses in poultry[J]. British Poultry Science, 1993, 34(5):939-949
[11]Bielorai R, Iosif B. Amino acid absorption and endogenous amino acids in the lower ileum and excreta of chicks[J]. Journal of Nutrition, 1987, 117(8):1359-1362
[12]Rezvani M, Kluth H, Bulang M, et al. Variation in amino acid digestibility of rapeseed meal studied in caecectomised laying hens and relationship with chemical constituents[J]. British Poultry Science, 2012, 53(5):665-674
[13]Kim E J, Utterback P L, Parsons C M. Comparison of amino acid digestibility coefficients for corn, corn gluten meal, and corn distillers dried grains with solubles among 3 different bioassays[J]. Poultry Science, 2012, 91(12):3141-3147
[14]Adedokun S A, Utterback P, Parsons C M, et al. Comparison of amino acid digestibility of feed ingredients in broilers, laying hens and caecectomised roosters[J]. British Poultry Science, 2009, 50(3):350-358
[15]Adedokun S A, Adeola O, Parsons C M, et al. Factors affecting endogenous amino acid flow in chickens and the need for consistency in methodology[J]. Poultry Science, 2011, 90(8):1737-1748
[16]NRC. Nutrient Requirements of Poultry[M]. Washington, DC: National Academy Press, 1994:19-26
[17]Payne W, Kifer R, Snyder D, et al. Studies of protein digestion in the chicken 1. investigation of apparent amino acid digestibility of fish meal protein using cecectomized, adult male chickens[J]. Poultry Science, 1971, 50(1):143-150
[18]Sibbald I. A bioassay for true metabolizable energy in feedingstuffs[J]. Poultry Science, 1976, 55(1):303-308
[19]杨胜. 饲料分析及饲料质量检测技术[M]. 北京: 北京农业大学出版社, 1993
Yang S.Feed and feed quality detection technology[M]. Beijing: Beijing Agricultural University Press, 1993
[20]Eklund M, Mosenthin R, Piepho H P, et al. Estimates of basal ileal endogenous losses of amino acids by regression analysis and determination of standardised ileal amino acid digestibilities from casein in newly weaned pigs[J]. Journal of the Science of Food and Agriculture, 2008, 88(4):641-651
[21]Souffrant W. Endogenous nitrogen losses during digestion in pigs[J]. EAAP Publication (Netherlands) 1991, 54-54
[22]Furuya S, Kaji Y. Estimation of the true ileal digestibility of amino acids and nitrogen from their apparent values for growing pigs[J].Animal Feed Science and Technology, 1989, 26(3):271-285
[23]Jansman A J M, Smink W, van Leeuwen P, et al. Evaluation through literature data of the amount and amino acid composition of basal endogenous crude protein at the terminal ileum of pigs[J]. Animal Feed Science and Technology, 2002, 98(1-2):49-60
[24]Hodgkinson S M, Moughan P J. An effect of dietary protein content on endogenous ileal lysine flow in the growing rat[J]. Journal of the Science of Food and Agriculture, 2007, 87(2):233-238
[25]Fernández-Fígares I, Nieto R, Prieto C, et al. Estimation of endogenous amino acid losses in growing chickens given soya-bean meal supplemented or not with dl-methionine[J]. Animal Science, 2002, 75:415-426
[26]张鹤亮, 李德发, 谯仕彦, 等. 3种内源氨基酸测定方法的准确性比较分析[J]. 畜牧兽医学报, 2010, 41(010):1346-1353
Zhang H L, Li D F, Qiao S Y,et al. The comparative analysis of accuracy of three determining endogenous amino acids methods[J]. Acta Veterinaria et Zootechnica Sinica, 2010, 41(10):1346-1353
[27]Boisen S, Moughan P J. Dietary influences on endogenous ileal protein and amino acid loss in the pig: A review[J]. Acta Agriculturae Scandinavica Section A-Animal Science, 1996, 46(3):154-164
[28]Lemme A, Ravindran V, Bryden W. Ileal digestibility of amino acids in feed ingredients for broilers[J]. World's Poultry Science Journal, 2004, 60(04):423-438
[29]Lang T, Hansson G C, Samuelsson T. Gel-forming mucins appeared early in metazoan evolution[J]. Proceedings of the National Academy of Sciences, 2007, 104(41):16209-16214
[30]Taverner M, Hume I, Farrell D. A vailability to pigs of amino acids in cereal grains[J]. British Jounal Nutrition, 1981, 46(01):149-158
[31]Fan M Z, Sauer W C, Hardin R T, et al. Determination of apparent ileal amino acid digestibility in pigs: effect of dietary amino acid level[J]. Journal of Animal Science, 1994, 72(11):2851-2859
[32]Zhai H, Adeola O. Apparent and standardized ileal digestibilities of amino acids for pigs fed corn-and soybean meal-based diets at varying crude protein levels[J]. Journal of Animal Science, 2011, 89(11):3626-3633.
Comparative Study of Standardized Amino Acid Digestibility in Soybean Meal Fed to Cecectomized Roosters
Hu Rujiu Wang Fei Li Jing Yang Xiaojun Yao Junhu
(College of Animal Science and Technology, Northwest A&F University,Yangling 712100)
Based on the comparative analysis of nitrogen-free diet method (NFD) and regression method (REG) for the determination of basal endogenous amino acid losses (EAALb), the standardized amino acid digestibility in soybean meal was determined with the precision-fed cecectomized rooster assay. It would provide theory basis for an evaluation of nutritional value of amino acids (AA) in poultry feed. Results showed as follows: (1) there was a good linear relationship between outflow (mg/kg DMI) and intake (mg/kg DMI) of total amino acid, and the regression equation wasY=12 625.2+0.096X(R2=0.759); (2) there was no significant difference between the endogenous losses of total amino acid determined by NFD method and REG method (11 489.7 vs. 12 625.2 mg/kg DMI) (P>0.05); (3) values for apparent amino acid digestibility of soybean meal showed a quadratic curve increase with an increase in dietary crude protein (CP) and was relatively constant when dietary CP levels was higher than 12.0%; values for standardized amino acid digestibility (85.58%~89.61% vs. 86.75%~90.05%) corrected by the NFD method and REG method keep relatively consistent and were not influenced by dietary CP levels. In conclusion, NFD method and REG method could be well applied to determine basal endogenous amino acid losses, and values for standardized amino acid digestibility of soybean meal corrected by the NFD method and REG method were independent of dietary CP levels, indicating that the diet prepared by the standardized AA digestibility of soya bean meal represents good additivity.
nitrogen-free diet method, regression method, endogenous amino acid losses, amino acid digestibility, cecectomized roosters
S831.5
A
1003-0174(2016)10-0085-08
国家自然科学基金(31172223)
2015-01-24
胡如久,男,1989年出生,博士,动物营养原理与方法
姚军虎,男,1962年出生,教授,动物营养原理与方法

