胞红蛋白对巨噬细胞氧化损伤的保护作用
,,, ,,,,
(1.南华大学医学院病生教研室,心血管病研究所,动脉硬化学湖南省重点实验室,湖南 衡阳 421001;2.南华大学附属第一医院;3.南华大学附属第二医院急诊科)
·基础医学·
胞红蛋白对巨噬细胞氧化损伤的保护作用
屈顺林1,朱宇凝1,潘文军1,李维1,王宇菲1,谢黎明2,姜志胜1,范文静3
(1.南华大学医学院病生教研室,心血管病研究所,动脉硬化学湖南省重点实验室,湖南 衡阳 421001;2.南华大学附属第一医院;3.南华大学附属第二医院急诊科)
目的探讨CYGB在巨噬细胞氧化损伤过程中的表达及作用。方法构建CYGB高表达/低表达巨噬细胞模型,Western blot检测不同浓度H2O2刺激RAW264.7 12 h后CYGB的蛋白表达水平;用分光光度计观察RAW264.7在氧化损伤过程中乳酸脱氢酶(LDH)活性和丙二醛(MDA)含量的变化情况。结果0.5 mmol/L H2O2处理巨噬细胞12 h后CYGB表达水平明显高于空白对照组(P<0.05);与0.5 mmol/L H2O2处理组相比,0.5 mmol/L H2O2对CYGB高表达组的CYGB表达升高(P<0.05),而0.5 mmol/L H2O2对CYGB低表达组的CYGB表达降低,差异有统计学意义(P<0.05);0.5 mmol/L H2O2+CYGB高表达组中LDH活性和MDA含量下降;0.5 mmol/L H2O2+CYGB低表达组中LDH活性和MDA含量升高,差异有统计学意义(P<0.05)。结论巨噬细胞氧化损伤时CYGB表达水平增加;CYGB在巨噬细胞氧化损伤过程中具有拮抗作用。
巨噬细胞; 氧化应激; 胞红蛋白; 过氧化氢
氧化应激是指体内产生过多的活性氧 (reactive oxygen species,ROS)分子,细胞内氧化/抗氧化防御机制的平衡被打破,ROS及其相关代谢产物过量聚集,导致细胞损伤[1]。而巨噬细胞可以吞噬、杀伤和清除细菌、病毒及损伤、衰老的组织细胞有助于病变部位的康复[2]。 珠蛋白广泛存在于动植物中,具有独特的蛋白结构—血红素辅基,其可以通过铁卟啉环和组氨酸多肽链与氧分子可逆性结合[3],在呼吸系统中尤为重要。在脊椎动物中,已知的珠蛋白主要有肌红蛋白(MGB)、血红蛋白(HGB)、脑红蛋白(NGB)和胞红蛋白(CYGB)[4]。而CYGB具有携氧与贮氧、氧感受器等生理功能[5],同时它还具有清除自由基的作用[6-7]。然而CYGB在巨噬细胞氧化应激时的作用尚不清楚。
1 材料与方法
1.1材料与试剂小鼠巨噬细胞RAW264.7购于中南大学湘雅医学院中心实验室;硝酸纤维素膜(PVDF)为Millipore公司产品。 BCA Protein Assay Kit为Pierce公司产品,;ECL发光检测试剂盒购于康为公司。CYGB抗鼠一抗购于 Proteintech 公司;β-actin一抗购于长沙艾佳生物技术有限公司。乳酸脱氢酶(LDH)检测试剂盒和丙二醛(MDA)检测试剂盒均购于南京建成公司; DMEM培养基购于Hyclone公司。
1.2细胞培养及分组
1.2.1 RAW264.7细胞用含10%的小牛血清并含10 mmol/l的HEPES的DMEM培养基,置于5%CO2,37 ℃的恒温培养箱中培养。当细胞贴壁达70%~90%时进行传代。传代时弃去培养液,胰蛋白酶消化后,加入5 mL含血清培养液终止消化,每24~72 h传代一次。
1.2.2 实验分组 探讨CYGB表达水平改变对RAW264.7 氧化损伤的作用,将RAW264.7细胞分为四组:①对照组;② 0.5 mmol/L H2O2处理RAW264.7 12 h组;③ 0.5 mmol/L H2O2+CYGB高表达组:先转染CYGB表达质粒,24 h后用0.5 mmol/L H2O2处理RAW264.7 12 h;④ 0.5 mmol/L H2O2+CYGB低表达组:先转染CYGB干扰质粒,24 h后用0.5 mmol/L H2O2处理RAW264.7 12 h。
1.3蛋白印迹(Western blot) 用裂解液裂解各组细胞,提取总蛋白。利用蛋白定量试剂盒定量后,100 ℃煮3~5 min使蛋白变性,分装并于-80 ℃保存。配制并灌注10%SDS-PAGE分离胶和5%的浓缩胶,加入蛋白样品,恒压80 V电泳30 min,待溴酚蓝染料带进入分离胶后将电流调至120 V电泳1 h,转膜到PVBDF膜上,恒流200 mA转膜2 h;5%无抗脱脂奶粉封闭4 h,加一抗于4 ℃孵育过夜,TBST洗膜3次,每次10 min,然后将辣根过氧化物酶标记的相应二抗与膜共同孵育1 h,TBST洗膜3次,室温摇荡洗膜,每次10 min,显影,定影。
1.4 CYGB表达和低表达巨噬细胞模型的构建
1.4.1 参考分子克隆CaCl2法制备DH5α感受态细胞,加入本课题组已有的质粒进行转化对菌液进行质粒的提取,然后用于转染[8]。
1.4.2 转染细胞 转染前一天进行细胞铺板,使用无抗生素的培养基培养细胞24 h,使转染时细胞密度达到30%~50%。
1.5 LDH活性及MDA含量检测将准备好的细胞样本采用南京建成生物工程研究所相应试剂盒,操作步骤严格参照试剂盒说明书执行,分光光度计检测MDA及LDH含量。
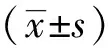
2 结 果
2.1 H2O2处理对RAW264.7细胞CYGB表达的影响
荧光定量PCR和Western blot检测结果发现用0.5 mmol/L H2O2处理巨噬细胞12 h后CYGB表达明显升高,差异有统计学意义(P<0.05);与H2O2处理组相比,0.5 mmol/L H2O2+CYGB高表达组的CYGB表达显著增加,0.5 mmol/L H2O2+CYGB低表达组的CYGB表达明显下降,差异有统计学意义(P<0.05)。
2.2 CYGB对RAW264.7细胞LDH活性影响H2O2刺激能明显上调LDH的活性,转染CYGB表达质粒能下调LDH活性,而转染CYGB干扰质粒却上调LDH活性。


组别H2O2(μmol/L)LDH(U/mg·prot)control组022.52±1.158H2O2处理组50052.70±1.716aH2O2+CYGB高表达组50044.91±0.925bH2O2+CYGB低表达组50060.25±0.543b
与对照组比较,a:P<0.05;与H2O2处理组比较,b:P<0.05
2.3 CYGB对RAW264.7细胞MDA含量影响H2O2刺激能明显上调MDA的含量,转染CYGB表达质粒能下调MDA含量,而转染CYGB干扰质粒却进一步上调MDA含量。

图1 H2O2处理巨噬细胞对CYGB表达的影响 A:荧光定量PCR结果;B:Western blot检测结果 与空白对照组比较,*:P<0.05;与H2O2处理组比较,#:P<0.05

图2 CYGB对H2O2刺激巨噬细胞时LDH的影响 A:control组; B:H2O2组; C:H2O2+CYGB高表达组; D:H2O2+CYGB低表达组.与对照组比较,*P<0.05;与H2O2处理组比较,#P<0.05
表2CYGB对H2O2刺激巨噬细胞时MDA含量的影响(x±s,n=3)

组别H2O2(μmol/L)MDA(U/mg·prot)control组01.591±0.084H2O2处理组5002.142±0.062aH2O2+CYGB高表达组5001.944±0.041bH2O2+CYGB低表达组5002.358±0.069b
与对照组比较,a:P<0.05;与H2O2处理组比较,b:P<0.05
3 讨 论
巨噬细胞作为免疫细胞在体内扮演着清道夫角色,可聚集到病变部位。激活后的巨噬细胞能产生和释放大量ROS,ROS过多介导的氧化应激反应可导致细胞功能下降,甚至细胞器损伤、溶解[9]。组织缺氧(如心肌梗死)也可造成细胞内氧化应激,产生大量的活性氧,释放到细胞外,导致组织细胞的进一步损伤[10]。氧化应激可引起多种促炎细胞因子的表达释放促进细胞的活化,巨噬细胞活化后又可出现呼吸“爆发现象”[11],产生大量的ROS,在氧自由基杀伤异物的同时大量的ROS也会造成细胞内功能的下降,细胞器的溶解,细胞坏死等[12]。另外H2O2可使生物膜中的多不饱和脂肪酸氧化损伤,改变膜流动性、通透性和破坏膜的完整性,进而造成氧化应激损伤,在感染、缺血/再灌注损伤、休克等多种炎性疾病引起的病理性改变过程中氧化应激扮演着重要角色[13]。

图3 CYGB对H2O2刺激巨噬细胞时MDA含量的影响 A:control组; B:H2O2组; C:H2O2+CYGB高表达组; D:H2O2+CYGB低表达组.*:P<0.05,与对照组比较;#:P<0.05,与H2O2处理组比较
当细胞受到各种刺激的时候,NF-κB二聚体释放出来,然后经过翻译后的修饰作用后进一步被激活,并转移到细胞核中,在细胞核中与目的基因结合并促进其转录[14]。CYGB在细胞核与细胞质中均有表达,在氧化损伤过程中,NF-κB与CYGB都被激活且表达增高[15]。CYGB启动子区的CpG小岛区域具有NF-κB结合位点,这意味着CYGB表达可能受到NF-κB的调控[16]。通过荧光定量检测发现,CYGB与NF-κB具有内在的相关性,在巨噬细胞氧化应激过程中CYGB上调,NF-κB下降;而低表达CYGB后可使NF-κB上调。考虑可能是CYGB具有抗氧化、清除ROS的功能,在氧化应激反应中减少了ROS对细胞的损伤,降低了ROS对细胞的刺激,从而反射性的降低了NF-κB的表达[17]。本课题研究应用H2O2构建氧化损伤模型,以探讨CYGB在H2O2诱导的RAW264.7细胞氧化应激损伤中的作用[18]。 CYGB具有储存、运输O2,结合和清除NO等功能。在细胞氧化应激过程中能够表达上调,清除过多的ROS[19]。CYGB作为新发现的携氧珠蛋白,在细胞氧化应激过程中表达上调,具有清除ROS的作用[9]。本实验研究发现CYGB在氧化应激过程中表达升高且对巨噬细胞的氧化损伤具有明显的保护作用[20]。
CYGB作为珠蛋白家族成员,从发现至今已经有十余年。CYGB含有血红素蛋白能够结合O2,NO和CO[21]。CYGB参与了细胞多种生理过程的调控,包括细胞增殖与分化和氧化还原平衡等[22]。CYGB的功能研究有望对慢性炎症性疾病的防治提供一个新的方向。
[1] Sugimoto H,Makino M,Sawai H,et al.Structural basis of human cytoglobin for ligand binding[J].J Mol Biol,2004,339(4):873-885.
[2] Kumar,S.,R.Meena and R.Paulraj,Role of Macrophage (M1 and M2) in Titanium-Dioxide Nanoparticle-Induced Oxidative Stress and Inflammatory Response in Rat[J].Appl Biochem Biotechnol,2016.
[3] Burmester T,Ebner B,Weich B,et al.Cytoglobin:a novel globin type ubiquitously expressed in vertebrate tissues[J].Mol Biol Evol,2002,19(4):416-421.
[4] 曾海燕,方勇,曾高峰.丹红注射液对脂多糖诱导THP-1巨噬细胞促炎因子分泌的影响及机制[J].中南医学科学杂志,2014,42(5):443-446.
[5] Yoshizato K,Thuy le TT,Shiota G,et al.Discovery of cytoglobin and its roles in physiology and pathology of hepatic stellate cells [J].Proc Jpn Acad Ser B Phys Biol Sci,2016,92(3):77-97.
[6] Hodges NJ,Innocent N,Dhanda S,et al.Cellular protection from oxidative DNA damage by over-expression of the novel globin cytoglobin in vitro[J].Mutagenesis,2008,23(4):293-298.
[7] Schmidt M,Gerlach F,Avivi A,et al.Cytoglobin is a respiratory protein in connective tissue and neurons,which is up-regulated by hypoxia[J].J Biol Chem,2004,279(9):8063-8069.
[8] Liu Q,Dai Z,Liu Z,et al.Oxidized low-density lipoprotein activates adipophilin through ERK1/2 signal pathway in RAW264.7 cells[J].Acta Biochim Biophys Sin,2010,42(9):635-645.
[9] De Beuf A,Hou XH,D’Haese PC,et al.Epoetin delta reduces oxidative stress in primary human renal tubular cells[J].J Biomed Biotechnol,2010,2010:395785.
[10] Li D,Chen XQ,Li WJ,et al.Cytoglobin up-regulated by hydrogen peroxide plays a protective role in oxidative stress[J].Neurochem Res,2007,32(8):1375-1380.
[11] Chua PJ,Yip GW,Bay BH.Cell cycle arrest induced by hydrogen peroxide is associated with modulation of oxidative stress related genes in breast cancer cells[J].Exp Biol Med (Maywood),2009,234(9):1086-1094.
[12] Chuang YC.Mitochondrial dysfunction and oxidative stress in seizure-induced neuronal cell death[J].Acta Neurol Taiwan,2010,19(1):3-15.
[13] Guo X,Philipsen S,Tan-Un KC.Characterization of human cytoglobin gene promoter region[J].Biochim Biophys Acta,2006,1759(5):208-215.
[14] Nishi H,Inagi R,Kawada N,et al.Cytoglobin,a Novel Member of the Globin Family,Protects Kidney Fibroblasts against Oxidative Stress under Ischemic Conditions [J].Am J Pathol,2011,178(1):128-139.
[15] Wystub S,Ebner B,Fuchs C,et al.Interspecies comparison of neuroglobin,cytoglobin and myoglobin:sequence evolution and candidate regulatory elements[J].Cytogenet Genome Res,2004,105(1):65-78.
[16] Harris AL.Hypoxia--a key regulatory factor in tumour growth[J].Nat Rev Cancer,2002,2(1):38-47.
[17] Denko NC.Hypoxia,HIF1 and glucose metabolism in the solid tumour[J].Nat Rev Cancer,2008,8(9):705-713.
[18] Guo X,Philipsen S,Tan-Un KC.Characterization of human cytoglobin gene promoter region[J].Biochim Biophys Acta,2006,1759(5):208-215.
[19] Fordel E,Thijs L,Moens L,et al.Neuroglobin and cytoglobin expression in mice.Evidence for a correlation with reactive oxygen species scavenging[J].FEBS J,2007,274(5):1312-1317.
[20] 潘文军.胞红蛋白对巨噬细胞氧化损伤的保护作用[D].南华大学医学院心血管疾病研究所,2015:1-89.
[21] Chua PJ,Yip GW,Bay BH.Cell cycle arrest induced by hydrogen peroxide is associated with modulation of oxidative stress related genes in breast cancer cells[J].Exp Biol Med (Maywood),2009,234(9):1086-1094.
[22] Mimura I,Nangaku M,Nishi H,et al.Cytoglobin,a novel globin,plays an antifibrotic role in the kidney[J].Am J Physiol Renal Physiol,2010,299(5):F1120-1133.
ProtectiveeffectofCYGBonMacrophageduringOxidativeDamage
QU Shunlin,ZHU Yuning,PAN Wenjun,et al
(DepartmentofPathophysiology,CollegeofMedicine,UniversityofSouthChinaHengyang,Hunan421001,China)
ObjectiveTo observe change of cytoglobin(CYGB) expression and explore the protective role of CYGB during oxidative stress in macrophages.MethodsWestern blot was used to detect CYGB expression after 0.5 mmol/L H2O2treatment for 12 h.Cell model of CYGB overexpression and downexpression was constructed,then to observe the role of CYGB during oxidative stress.After treatment with H2O2for 12 h,CYGB protein levels,lactate dehydrogenase(LDH) and malondialdehyde(MDA) were detected in each group.ResultThe expression of CYGB in H2O2-treated group was increased compared with control group,the difference was significant (P<0.05).The expression of CYGB was higher in 0.5 mmol/L H2O2treatment+CYGB expression group and lower in 0.5 mmol/L H2O2treatment+CYGB interference group compared with the 0.5 mmol/L H2O2treated group (P<0.05).Results showed that LDH,MDA level was decreased in H2O2treatment+CYGB expression group and increased in H2O2treatment+CYGB interference group.ConclusionExpression of CYGB in macrophage was increased during oxidative stress.The CYGB protected against oxidative injury in macrophage.
macrophages; oxidative stress; cytoglobin; H2O2
10.15972/j.cnki.43-1509/r.2016.05.002
2015-12-25;
2016-07-26
国家自然基金项目(编号:81670424)、国家安全生产重大事故防治关键技术科技项目(hunan-0013-2016AQ)、湖南省科技厅项目(编号:2015SK20203,2011TT2051)、湖南自然科学基金项目(编号:2015JJ2118)、湖南省教育厅重点课题(编号:2015JJ2118)、湖南省卫计委科研项目(编号:B2016087)、湖南省研究生科研创新项目(CX2016B480)和中国博士点基金项目(编号:20114324120004)。.
*通讯作者,qushunlin78@126.com.
R36
A
秦旭平)

