一株油菜根际促生菌的产芽孢发酵条件优化
杨 蓉,古孜亚,詹发强,侯 敏,龙宣杞
(1.新疆农科院微生物应用研究所,乌鲁木齐 830091;2.新疆大学生命科学与技术学院,乌鲁木齐 830052)
一株油菜根际促生菌的产芽孢发酵条件优化
杨 蓉1,古孜亚2,詹发强1,侯 敏1,龙宣杞1
(1.新疆农科院微生物应用研究所,乌鲁木齐 830091;2.新疆大学生命科学与技术学院,乌鲁木齐 830052)
【目的】提高从油菜根际分离筛选得到的促生菌蜡状芽孢杆菌(Bacillus cereus)QZB24-6的芽孢数量和芽孢产率,为进一步该苗株在复合生物肥中的应用打下基础。【方法】采用单因素和正交试验,研究不同的氮源、碳源、pH、温度、培养时间对蜡状芽孢杆菌形成芽孢的影响。【结果】确定蜡状芽孢杆菌产芽孢培养基的最佳组分为(g/L):乳糖2%、酵母膏1.5%、硫酸锰0.07%、磷酸氢二钠0.4%、磷酸二氢钠0.2%。对发酵条件进行了研究,温度35℃、pH值7.0、接种量4%、装液量100mL、转速为180 r/min下发酵72 h。【结论】通过优化培养基组分和培养基条件,最终发酵液中活菌数、芽孢数、芽孢产率分别为2.27×108cfu/mL、2.05× 108cfu/mL、90.31%。
油菜;蜡状芽孢杆菌;发酵;优化;芽孢产率
0 引 言
【研究意义】芽孢(endospore)是产芽孢菌在生长发育后期在细胞内形成的圆形或椭圆形、厚壁、含水量低、抗逆性强的休眠构造。芽孢没有新陈代谢,能经受多种环境伤害,包括热、紫外线、多种溶剂、酸、碱等,这一特征使芽孢杆菌具有非常良好的应用前景,对于提高菌剂的仓储期、维持菌剂生物活性非常重要[1],是制备微生物制剂的理想存在形式。【前人研究进展】陈波等[2]和马海林等[3]分别从樱桃和冬枣根际土壤中筛选出具有较大应用潜力的PGPR,并通过盆栽试验证实,筛选的PGPR具有较好的促生作用。作为微生态制剂中的拮抗菌剂,在生产处理过程中或外界环境影响下,要保持较高的活性和稳定性。因此,形成芽孢是评价拮抗细菌极为重要的指标[4-5]。甄静等[6]采用单因素和正交试验的方法,研究不同的氮源、碳源、无机盐、pH、温度、培养时间、接种量对枯草芽孢杆菌 XK-1形成芽孢的影响,经优化后,该菌株的产芽孢率达96%。郭夏丽等[7]采用分批培养法研究了营养条件、初始pH值、溶氧量对其生孢的影响,确定最佳培养基,产芽孢率可达82.9%。【本研究切入点】目前,对芽孢杆菌抑制真菌病害的报道越来越多,微生物菌剂肥料成为生物防治的研究热点之一。高效稳定的微生物菌剂成为研制复合菌剂的新趋势。菌体产生的芽孢通过现代发酵工程技术可以制作成生物肥料、接种剂、接种液等形式在农业生产中应用。芽孢杆菌对植物起有效作用又影响菌剂应用效果的就是其产生的芽孢及芽孢含量。研究芽孢杆菌的发酵培养基及条件。【拟解决的关键问题】以自行分离筛选的QZB24-6菌株为研究对象,QZB24-6菌株初步鉴定为蜡状芽孢杆菌(Bacillus cereus),是一种好氧和兼性厌氧、能产生抗逆抗旱耐热的芽孢,对其摇瓶发酵培养基及发酵条件进行优化,使芽孢产率最大化,为其规模化发酵生产提供芽孢杆菌在其生长期能产生一种休眠状态、具有抗逆抗旱能力的内生孢子。
1 材料与方法
1.1 材 料
1.1.1 菌种
从油菜主栽品种青杂2号根际土壤中分离的根际促生菌QZB24-6,经过初筛复筛鉴定得出QZB24-6为蜡状芽孢杆菌(Bacillus cereus)。
1.1.2 试剂
蔗糖、玉米粉、麦芽浸粉、乳糖、可溶性淀粉、葡萄糖、蛋白胨、牛肉膏、酵母膏、豆饼粉、硫酸铵、尿素、氯化钙、硫酸锰、磷酸氢二钾、碳酸钙、硫酸锌、磷酸氢二钠、磷酸二氢钠、琼脂、NaCl、MgSO4·7H20等购自天津市天新精细化工开发中心。
1.1.3 仪器
高压蒸汽灭菌锅MLS-3020(新的医疗器械有限公司),紫外分光光度计UV-2550(日本岛津自动化设备有限公司),摇床ZHWY-100D(上海智城仪器制造有限公司),MLS-3020高压蒸汽灭菌锅(新德医疗器械有限公司),DK-8D电热恒温水槽(上海精宏实验设备有限公司):PHs-3C酸度计(上海雷磁仪器厂),AEL_160岛津电子天平(日本岛津自动化设备有限公司),摇床ZHWY-100D(上海智城仪器制造有限公司),电热恒温培养箱DHP-9162(上海-恒科学仪器有限公司)
1.1.4 培养基
蛋白胨牛肉膏(LB)培养基:蛋白胨 1.0%,牛肉膏0.3%,氯化钠0.5%,琼脂2%,pH 7.2~7.4。
种子培养基:蛋白胨1.0%,牛肉膏0.3%,氯化钠0.5%,pH 7.2~7.4。
基础发酵培养基:葡萄糖2%,蛋白胨1%,磷酸氢二钠 0.4%,磷酸二氢钠0.2%,硫酸镁0.05%,氯化钙0.02%,pH 7.0。
1.2 方 法
1.2.1 菌种活化
将保存好的菌株QZB24-6进行活化,然后接种于LB斜面培养基上,放入 30℃恒温培养箱里培养24 h,备用。
1.2.2 种子液的制备
取一环活化菌种,接入装有200mL种子培养基的500mL三角瓶中,120 r/min、30℃恒温培养。
1.2.3 生长曲线的测定
将QZB24-6菌株在平板上活化以后,挑单菌落接入200mL装有种子培养基的三角瓶(500mL)中,160 r/min、30℃恒温振荡培养。培养24 h,每隔 2 h从发酵液中取样在600 nm下测OD值,绘制生长曲线。
1.2.4 发酵培养基成分单因素试验
1.2.4.1 最佳碳源筛选
选取蔗糖、玉米粉、麦芽浸粉、乳糖、可溶性淀粉为碳源替代基础发酵培养基中的碳源;将培养12 h的种子液以2%的接种量接于发酵培养基中,规格为500mL的三角瓶里装液量为 200mL,120 r/min、30℃振荡培养 48 h。以发酵活菌数、芽孢数及芽孢产率为检测指标,确定最佳碳源。
1.2.4.2 最佳氮源筛选
选取豆饼粉、硫酸铵、酵母膏、牛肉膏、尿素为氮源替代基础发酵培养基中的氮源;将培养 12 h的种子液以 2%的接种量接于发酵培养基中,采用摇瓶发酵培养条件,摇床30℃,48 h,120 r/min震荡培养。测定发酵活菌数和芽孢数,计算芽孢产率,以确定最佳氮源。
1.2.4.3 无机盐筛选
选取硫酸锰、磷酸氢二钾、碳酸钙、硫酸锌为无机盐替代基础发酵培养基中的无机盐;将培养12 h的种子液以2%的接种量接于发酵培养基中,采用摇瓶发酵培养条件,摇床 30℃,48 h,120 r/min震荡培养。测定发酵活菌数和芽孢数,计算芽孢产率,以确定最适无机盐。将综合单因素试验结果用于条件优化试验。
1.2.5 正交试验设计
在蜡状芽孢杆菌QZB24-6基础发酵培养基的基础上,采用单因子试验选取最适的碳源、氮源、无机盐,综合单因素试验结果,然后按不同配方进行正交试验,从而研究碳源、氮源和无机盐浓度对该芽孢杆菌的芽孢形成量的影响。用正交助手软件 L9(33)的3因素3水平的正交表进行正交试验,并对结果进行发差分析。
1.2.6 摇瓶发酵条件优化
1.2.6.1 温度
发酵温度分别在30、32、35、37、40℃的不同温度下的摇床(转速160 r/min,接种量2%,500mL三角瓶里装200mL,pH 7)中振荡培养,从发酵液中取样,测定活菌数、芽孢数及芽孢产率,分析得出最适宜的培养温度,并用于下面的单因素试验。
1.2.6.2pH
采用2 mol/L盐酸或3 mol/L NaOH调节培养基pH值,使得初始pH值为6.0、6.5、7.0、7.5、8.0,摇床振荡培养(转速160 r/min,接种量2%,500mL三角瓶里装200mL),从发酵液中取样,测定活菌数、芽孢数及芽孢产率,分析得出最适宜的初始pH值,并用于下面的单因素试验。
1.2.6.3 时间
在最优培养基pH值和发酵温度下,在摇床(转速160 r/min,接种量2%,500mL三角瓶里装200mL)中分别振荡培养24、36、48、60、72 h,从发酵液中取样,测定活菌数、芽孢数及芽孢产率,分析得出最适宜的培养时间,并用于下面的单因素试验。
在最佳发酵时间和温度条件下,分别按 2%、4%、6%、8%、10%的接种量,在摇床(转速160 r/min)中振荡培养,从发酵液中取样,测定活菌数、芽孢数及芽孢产率,分析得出最适宜的接种量,并用于下面的单因素试验。
1.2.6.5 通气量
在500mL三角瓶里分别装 50、100、150、200、250mL发酵液,在最佳发酵温度、时间、接种量的条件下培养,测定活菌数、芽孢数及芽孢产率,从而得出最佳的通气量。
1.2.6.6 转速
将摇床振荡速度分别设定在 120、140、160、180、200 r/min,在最佳发酵温度、时间、接种量、通气量条件下振荡培养,从发酵液中取样,测定活菌数、芽孢数及芽孢产率,分析得出最佳的发酵转速。
1.2.7 芽孢产率测定
1.2.7.1 活菌总数
比如宝宝在孕16周时,体重约120克,而很多孕妇这时可能由于妊娠反应重,体重不增反降,其实这没关系,妈妈的体内营养储备足以应付这样的反应,因为宝宝这时对营养要求不高,所以孕妈妈这时体重不长,甚至下降都没问题。反之,如果这时孕妈妈体重增加了3~5千克,而宝宝才120克,这些体重都长在什么地方了呢?其实是孕妈妈自己变胖了,是多余的营养素转变成脂肪储存在体内了。当然这可能会为将来母乳喂养储存营养,但问题是16周后随着妊娠反应的消退,孕妈妈的胃口会越来越好,逐渐进入孕期的“蜜月期”,这时如果孕妈妈不及时控制体重,还是一味高歌猛进,就有可能诱发孕期一系列的并发症。
活菌总数测定计数采用平板计数法[1]
1.2.7.2 芽孢数
先将发酵液在 80℃的水浴条件下加热 15 min,然后利用稀释平板菌落计数法来进行芽孢数的测定。
1.2.7.3 芽孢产率
芽孢产率=芽孢数/活菌总数×100%。
2 结果与分析
2.1QZB24-6的生长曲线
研究表明,0~6 h QZB24-6的数量缓慢增加,6 h之后,随着培养时间的延长,菌株迅速繁殖,总菌数也增多,到14 h后进入稳定期,菌体数量变化缓慢。试验确定菌龄为 12 h的培养液作为种子液,这时的菌液浓度高,细胞生命活动力强,种子繁殖处于最旺盛期。图1
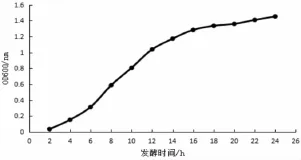
图1 菌株QZB24-6生长曲线Fig.1 Growth curve of QZB24-6
2.2 碳源
将基础发酵培养基中的碳源分别用 2%的葡萄糖、蔗糖、乳糖、可溶性淀粉、尿素、麦芽浸粉来替换制备发酵培养基,不加碳源的设为对照,摇床培养(30℃,160 r/min)48 h后,发酵液中的活菌及芽孢数用稀释平板计数法进行测定。结果表明,对QZB24-6生长情况效果好的碳源是乳糖,葡萄糖和蔗糖次之;可溶性淀粉对发酵液菌株芽孢形成量的影响比对照差。计算芽孢产率乳糖、蔗糖、葡萄糖等三种糖类对菌株活菌数的及芽孢的形成量的影响都良好,最终的芽孢产率均处于同一水平。图2,图3
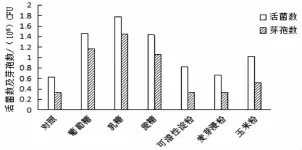
图2 不同碳源下菌株QZB24-6活菌数与芽孢形成量变化Fig.2 The influences of different carbon sources on viable count and sporulation of QZB24-6
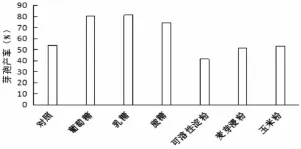
图3 不同碳源下菌株QZB24-6芽孢产率变化Fig.3 The influences of different carbon sources on spore-forming of QZB24-6
2.3 氮源筛选
在基础发酵培养基的基础上,把氮源分别用1%的牛肉膏、酵母膏、豆饼粉、硫酸铵、蛋白胨、尿素来替换,制备发酵培养基,不加碳源的设为对照,摇床培养(30℃,160 r/min)48 h后,发酵液中的活菌及芽孢数由稀释平板计数法进行测定。在这6种氮源里,对QZB24-6生长情况最好的氮源是酵母膏,次之为牛肉膏和蛋白胨,尿素的芽孢形成数与活菌数最差。计算芽孢产率酵母膏对菌株活菌数的及芽孢的形成量的影响良好,最终的芽孢产率显著高于其他氮源。图4,图5

图4 不同氮源下菌株QZB24-6活菌数与芽孢形成量变化Fig.4 The influences of different nitrogen on viable count and sporulation of QZB24-6
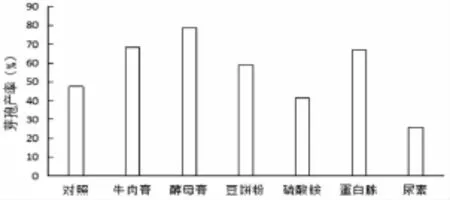
图5 不同氮源下菌株QZB24-6芽孢产率变化Fig.5 The influences of different nitrogen sources on spore-forming of QZB24-6
2.4 无机盐筛选
在基础发酵培养基的基础上,把无机盐分别用0.05%的磷酸氢二钾、硫酸镁、硫酸锰、硫酸锌、氯化钙、碳酸钙来代替,制备发酵培养基,不加碳源的设为对照,摇床培养(30℃,160 r/min)48 h后,由稀释平板计数法来测定发酵液中的活菌及芽孢数。在这6种无机盐里,对QZB24-6生长情况最好的无机盐是硫酸锰,次之为硫酸锌和硫酸镁;氯化钙对发酵液中菌株芽孢形成数与活菌数的影响,比对照还低。图6,图7

图6 不同无机盐下菌株QZB24-6活菌数与芽孢形成量变化Fig.6 The influences of different mineral salt on viable count and sporulation of QZB24-6

图7 不同无机盐下菌株QZB24-6芽孢产率变化Fig.7 The influences of different mineral salt on spore-forming of QZB24-6
2.5 发酵培养基成分正交试验优化
通过对碳源、氮源及无机盐进行单因素试验,最终选取乳糖、酵母膏、硫酸锰为QZB24-6的最佳的碳源、氮源及无机盐。为了知道各培养基成分之间的关系,对这三个因素进行 L9(33)的正交试验,列出各因素水平设计。表1
将乳糖、酵母膏、硫酸锰作为培养基的三个因素,进行的L9(33)的正交试验结果及各因素指标为2%乳糖、1.5%酵母膏和0.07%的硫酸锰为菌株QZB24-6的最适宜的发酵培养基成分配方。从R值可以得出,影响菌株QZB24-6的芽孢产率的主要因素依次为乳糖>酵母膏>硫酸锰。各因素的最佳水平为A2B2C3,在该条件下,菌株QZB24-6的最高芽孢产率可达到83.58%。表2

表1 发酵培养基正交试验因素水平Table 1 Factor and level of orthogonal experiment on fermentation medium

表2 菌株QZB24-6的发酵培养基优化正交试验设计及结果Table 2 The results from the orthogonal test for optimized composition of the ferment medium by QZB24-6
2.6 摇瓶发酵条件
2.6.1 温度
研究表明,在pH 7.0,160 r/min条件下培养48 h,对菌株QZB24-6的生长温度进行试验,选出最适宜的温度。结果表明,在 30~35℃内,发酵液中活菌数及芽孢形成量随着温度的增高而增大,35~37℃内处于相当平稳的状态,然后随着温度增高活菌数及芽孢形成量就慢慢降低。在32℃时菌株芽孢产率最高,达到 0.84×108cfu/mL;而这时的活菌数及芽孢产率低。因此,按芽孢数为标准选取35℃为菌株QZB24-6的最适宜生长温度。图8

图8 不同温度下菌株QZB24-6的芽孢产率变化Fig.8 The influences of temperature on spore-forming Bacillus velezensisQZB24-6
2.6.2pH
发酵培养基成分的离子化程度是由发酵培养基的pH值来决定的,它影响着菌株是否有效吸收利用培养基里各种营养物质,影响其细胞中的代谢酶,从而决定菌株的正常生长、繁殖。因此,将发酵培养基的pH值分别调到6、6.5、7、7.5、8,摇床培养(30℃、160 r/min)48 h后,测定发酵液活菌数、芽孢数及芽孢产率。研究表明,在pH 6~7芽孢产率处于相当稳定点状态,pH 6~7活菌数及芽孢数明显增加,在pH 7~8时,发酵液活菌数和芽孢数都开始下降。pH 7时芽孢数和芽孢产率分别达到1.14×108cfu/mL、85.07%。因此,确定最适pH值为7。图9

图9 不同pH下菌株QZB24-6芽孢产率变化Fig.9 The influences of pHon spore-forming of QZB24-6
2.6.3 时间
时间对细菌繁殖和芽孢的形成量影响很大。不同发酵时间对QZB24-6菌株的芽孢形成量的影响,研究表明,发酵时间在24 h时,该菌株活菌数和芽孢数的形成量较低,芽孢产率也较低;从36~48 h活菌数和芽孢数的增加缓慢,在24~36 h芽孢产率迅速增加;从48~72h活菌数和芽孢数迅速增加,可芽孢产率缓慢增加。到72 h活菌数和芽孢数分别达到2.76×108cfu/mL、2.38× 108cfu/mL。因此,选72 h为该QZB24-6菌株的最适发酵时间。图10

图10 不同时间下菌株QZB24-6的芽孢产率变化Fig.10 The influences of time on spore-forming of QZB24-6
2.6.4 接种量
接种量对该QZB24-6菌株活菌数和芽孢形成量的影响,结果表明,接种量为2%时活菌数和芽孢形成量较低,2%~4%时活菌数的形成量不大,而芽孢形成量多,分别达2.89×108cfu/mL、2.47×108cfu/mL,接种量多于4%时,发酵液中的活菌数和芽孢数的形成量逐渐降低。因此,确定最适接种量为4%。图11

图11 不同接种量下菌株QZB24-6芽孢产率变化Fig.11 The influences of inoculum sizeon spore-forming of QZB24-6
2.6.5 装液量
装液量对该QZB24-6菌株活菌数和芽孢形成量的影响,研究表明,用500mL的三角瓶进行摇瓶发酵装液量研究,装液量为50mL时发酵液中活菌数和芽孢形成量较高,分别2.49×108cfu/mL、1.87×108cfu/mL;装液量为100mL时活菌数及芽孢形成量达到最大值2.29×108cfu/mL,芽孢产率也较高,89.6%;随着装液量的增加活菌数缓慢增加,但影响芽孢的形成量。因此,选择发酵培养基装液量为100mL。图12

图12 不同装液量下菌株QZB24-6芽孢产率变化Fig.12 The influences of culture volumeon spore-forming of QZB24-6
2.6.6 转速
转速对QZB24-6菌株活菌数和芽孢形成量的影响结果表明,转速在 120~180 r/min活菌数和芽孢形成量及芽孢产率逐渐增加到最高值,分别达2.27×108cfu/mL、2.05×108cfu/mL、90.31%,过了180 r/min后活菌数和芽孢形成量就慢慢降低。芽孢产率随着转速的加大处于稳定的状态。因此,选择 180 r/min为蜡状芽孢杆菌QZB24-6的最适发酵转速。图13

图13 不同转速下菌株QZB24-6芽孢产率变化Fig.13 The influences of rotate speed spore-forming of QZB24-6
3 讨 论
以筛选出的对油菜具有促生作用的优良菌株QZB24-6为研究对象,以提高对其芽孢产率为目的,采用单因素和正交试验的方法对其发酵培养基进行优化,确定乳糖2%、酵母膏1.5%、硫酸锰0.07%、磷酸氢二钠0.4%、磷酸二氢钠0.2%为QZB24-6的发酵培养基,继而确定该菌株发酵条件为:温度35℃、pH值7.0、接种量4%、装液量100mL、转速为180 r/min下发酵72 h;最终发酵液中活菌数、芽孢数、芽孢产率分别为2.27× 108cfu/mL、2.05×108cfu/mL、90.31%。
芽孢杆菌是能产生抗逆性芽孢的细菌[8],在农业生产中作为生物肥料来应用,具有诱导植物抗病性、拮抗等作用,它通过产生一些抗菌物质来降低酵母、真菌、病毒等的生物活性[9]。因此,对所筛选出的芽孢杆菌进行发酵工艺的研究研制成一种生物肥料是很必要的。菌体的细胞质浓缩脱水后,形成一种具有抗逆作用的形状近似球形或者椭圆形的休眠体就是芽孢。细菌形成的芽孢能够让它在重新变为营养太细胞。发酵培养基中的各成分(碳源、氮源、无机盐及微量元素)对细菌芽孢的形成量的影响很大,而且发酵温度、时间、通气量、接种量、转速等也是影响细菌芽孢形成的重要因素。对发酵培养基单因素试验中可知,糖类作为碳源,提高芽孢杆菌芽孢形成量;酵母膏和牛肉膏也能促进芽孢的形成量;从无机盐对QZB24-6菌株生长和芽孢形成量的影响来看,Mn2+和 Mg2+起到促进芽孢形成的作用,是芽孢杆菌产生大量芽孢的最适无机盐。Mn2+加入量的增加会导致芽孢产量的降低[10],Mn2+加入量不能大于0.07%,不然会抑制菌体芽孢的形成,试验通过对发酵培养成分进行优化,最终确定Mn2+加入量为 0.07%时QZB24-6菌株的芽孢形成量达到最大值。
4 结 论
4.1 以筛选出的对油菜具有促生作用的优良菌株QZB24-6为研究对象,以提高对其芽孢产率为目的,采用单因素和正交试验的方法对其发酵培养基进行优化,最终确定乳糖 2%、酵母膏1.5%、硫酸锰0.07%、磷酸氢二钠0.4%、磷酸二氢钠0.2%为QZB24-6的发酵培养基。
4.2 对发酵条件进行了研究,该菌株产芽孢最适发酵温度35℃、pH 7.0、接种量4%、装液量100mL、180 r/min,发酵周期72 h。
4.3 通过优化培养基组分和培养基条件,蜡状芽孢杆菌QZB24-6发酵液中活菌数达到2.27× 108cfu/mL、芽孢数 2.05×108cfu/mL、芽孢产率为90.31%。
(
)
[1]徐世荣,陈壤,吴云鹏.细菌芽孢形成机制在微生态制剂生产中的应用[J].食品与生物技术学报,2007,26(4):121-126. XU Shi-rong,CHEN Rang,WU Yun-peng.(2007).Application of the Mechanism of Sporulation in Production of Pharmaceutical Probiotics[J].Journal of Food Science and Biotechnobgy,26(4):121-126.(in Chinese)
[2]陈波,丁延芹,马海林,等.樱桃根际促生细菌的筛选与鉴定[J].微生物学通报,2012,39(12):1 746-1 754. CHEN Bo,DING Yan-qin,MA Hai-lin,et al.(2013). Cherry rhizosphere bacteria screening and identification of the growth[J].Journal of Microbiology,39(12):1,746-1,754.(in Chinese)
[3]马海林,邢尚军,刘方春,等.冬枣根际3株促生细菌的筛选与鉴定[J].应用与环境生物学报,2013,19(4):650-654. MA Hai-lin,XIN Shang-jun,LIU Fang-chun,et al.(2013).Screening and Identification of Three Plant Growthpromoting Rhizobacteria from Winter Jujube(Ziziphus jujube Mill.)Rhizosphere[J].Chinese Journal of Applied and Environmental Biology,19(4):650-654.(in Chinese)
[4]Su,A.,Xie,G.,Li,B.,&Liu,B.(2003).Comparativepeiforniance of Bacillus spp.in growth promotion and suppression of tomato bacterial wilt caused by Ralstonia solanacearum.Journal of Zkejiang University(Agriculture and Life Sciences),30(6):603-610.
[5]Cavaglieri,L.R.,Passone,A.,& Etcheverry,M.G.(2004).Correlation between screening procedures to select root endophytes for biological control of Fusarium verticillioides in Zea mays L.Biological Control,31(3):259-267.
[6]甄静,郭直岳,谢宝恩.枯草芽孢杆菌 XK-1产芽孢条件的优化[J].中国农学通报,2012,28(27):146-151. ZHEN Jing,GUO Zhi-yue,XIE Bao-en.(2012).Optimization of Medium Composition for the Production of Bacillus subtilis XK-1 Spores[J].Chinese Agricultural Science Bulletin,28(27):146-151.(in Chinese)
[7]郭夏丽,狄源宁,王岩.枯草芽孢杆菌产芽孢条件的优化[J].中国土壤与肥料,2012,(3):99-103. GUO Xia-li,DI Yuan-ning,WANG Yan.(2012).Optimization of sporulation conditions of Bacillus subtilis[J].China Soils and Fertilizers,(3):99-103.(in Chinese)
[8]刘国红.芽孢杆菌的分类鉴定及其相关属的分类系统演变研究[D].福州:福建农林大学硕士论文,2009. LIU Guo-hong.(2009).The studies on classification and identification of Bacillus and systematic evolution in the genera related with Bacillus[D].Master Dissertation.Fujian Agriculture and Forestry University,Fuzhou.(in Chinese)
[9]谌晓曦,陈卫良,李德葆.375细菌及其拮抗物质对植物病原真菌的抑制[J].微生物通报,2003,30(3):67-71. CHEN Xiao-xi,CHEN Wei-liang,LI De-bao.(2003). The antagonistic activities of both Bacillus Cereus 357 and its antagonistic substance against botytis cinerea pers.and Rhizoctonia Solani[J].Microbiology,30(3):67-71.(in Chinese)
[10]范会兰,姜军坡,王世英,等.抗犊牛腹泻益生菌株BN-9产芽孢条件的优化[J].湖北农业科学,2009,48(2):405-409. FAN Hui-lan,JIANG Jun-po,WANG Shi-ying,et al.(2009).Optimization of the Spore Production Conditions of Strain BN-9 as Probiotics to Prevent Calf Diarrhea[J].Hubei Agricultural Sciences,48(2):405-409.(in Chinese)
Optimization of Fermentation Conditions for the Production of Spore Producing Bacteria from Rhizosphere of Rape
YANG Rong1,Guziya2,ZHAN Faqiang1,Hou Min1,Long Xuanqi1
(1.Research Institute of Applied Microbiology,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China;2.College of Life Science and Technology,Xinjiang University,Urumqi 830046,China)
【Objective】In order to improve the spore production rate and spore quantity of(Bacillus cereus)QZB24-6 against Fusarium wilt.【Method】The medium composition for the production of Bacillus cereus QZB24-6 spores was optimized by using the single factor and orthogonal tests.Various factors,such as carbon sources,nitrogen sources initial pH,temperature and fermentation time were investigated.【Result】The results showed that the optimum medium was as follows(g/L):milk sugar 2%,yeast extract 1.5%,MnSO40.07%,Na2HPO40.4%,NaH2PO40.2%.The optimum culture conditions were as follows:temperature 35℃,pH 7.0 in inoculum size 4%,liquid measure 100mL,rotate speed 180 r/min,fermentation time 72 h.【Conclusion】By optimizing the culture medium composition and culture conditions,the number of viable bacteria in the final fermentation broth,the number of spores,and the yield were 2.27×108cfu/mL,2.05×108cfu/mL and 90.31%,respectively.It laid the foundation for the application of Bacillus cereus QZB24-6 as a kind of microbial fertilizer.
rape;Bacillus cereus;fermentation;optimization;spore
S188+.2
A
1001-4330(2016)09-1700-08
10.6048/j.issn.1001-4330.2016.09.018
2016-04-26
自治区青年科技创新人才培养工程项目“新疆主要经济作物油菜有益根际微生物筛选及应用”;自治区科技成果转化专项资金项目(201554113)
杨蓉(1981-),女,新疆人,助理研究员,研究方向为土壤微生物,(E-mail)Lingxuan2519@126.com
(Cotresponding author):龙宣杞(1969-),女,四川人,研究员,研究方向为土壤微生物与微生态学,(E-mail)longxq_xj@sina. com
Fund project:Special funds for the transformation of scientific and technological achievements of Xinjiang(201554113),the youth science and technology innovation personnel training project"Screening and Application the of Beneficial Rhizosphere Microbial of Main Economic Crops in Xinjiang of Rape"

