源于Paecilomyces sp.FLH30内切β-1,3(4)葡聚糖酶基因在毕赤酵母中的表达
胡 玮,张慧玲,魏 欢,付婷婷,陈 勇,武 运
(1.新疆农业大学动物科学学院/新疆肉乳用草食动物营养与饲料重点实验室,乌鲁木齐 830052;2.新疆农业大学食品科学与药学学院,乌鲁木齐 830052)
源于Paecilomyces sp.FLH30内切β-1,3(4)葡聚糖酶基因在毕赤酵母中的表达
胡 玮1,2,张慧玲1,魏 欢1,付婷婷1,陈 勇1,武 运2
(1.新疆农业大学动物科学学院/新疆肉乳用草食动物营养与饲料重点实验室,乌鲁木齐 830052;2.新疆农业大学食品科学与药学学院,乌鲁木齐 830052)
【目的】β-1,3(4)-葡聚糖酶是一种重要的工业用酶,广泛地应用于饲料业、酿造业及纺织业。【方法】以来源于 Paecilomyces sp.FLH30的葡聚糖酶基因为研究对象。据毕赤酵母GS115对密码子的简并性和偏爱性,对来源于淡紫拟青霉(Paecilomyces lilacinus)β-1,3(4)-葡聚糖酶基因进行了优化,通过全基因技术合成了全长基因 GLUnm并构建重组酵母表达载体 pPIC9K-GLUnm,用 Sac I线性化重组质粒 pPIC9KGLUnm,电击转化至毕赤酵母GS115中进行表达。【结果】通过表型筛选,遗传霉素抗性筛选,经PCR鉴定表明,葡聚糖酶基因整合至酵母染色体DNA中。在试管中经甲醇诱导表达,并测定葡聚糖酶酶活性。在试管水平表达的酶活性是0.68 IU/mL,即可以认为在摇瓶表达水平的初始酶活性为0.68 IU/mL,将此菌株在摇瓶水平表达,酶活性在表达84 h为最高,是11.26 IU/mL。【结论】重组β-1,3(4)-葡聚糖酶的最适pH为 5.0,最适反应温度为50℃,在pH 5.0~8.0,温度37~50℃的条件下较稳定。
β-1,3(4)-葡聚糖酶;毕赤酵母;表达;酶学性质
0 引 言
【研究意义】β-葡聚糖酶(β-glucanase)是一类非淀粉多糖,是由β-1,3和/或β-1,4糖苷键连接的 D型葡聚糖聚合物[1]。β-葡聚糖酶广泛地应用于食品、生物质能源、医疗、纺织等各方面,在酿酒工业中,β-葡聚糖酶可以提高啤酒的品质和产量,尤其在糖化过程中可以降低啤酒中的凝胶沉淀[2]。在食品烘焙工业中,β-葡聚糖酶可以增大面团面积,从而缩短面团的醒发时间[3]。β-葡聚糖酶也可应用于功能性食品[4]的生产加工中。【前人研究进展】β-葡聚糖酶主要来源于植物和微生物中,已知的产葡聚糖酶的微生物有红发夫酵母 (Phaffia rhodozyma)、青霉(Penicillium pinophilum)、米黑根毛霉(Rhizomucor miehei)等[5]。有学者已经探究出了地衣芽孢杆菌、枯草芽孢杆菌、黑曲霉产β-葡聚糖酶的相关酶学性质,地衣芽孢杆菌所产出的β-葡聚糖酶的最适温度是55℃,最适 pH是5.5~7.0,枯草芽孢杆菌所产出的β-葡聚糖酶的最适温度是55℃,最适pH是4.5~7.0,黑曲霉所产生的β-葡聚糖酶的最适温度是45~60℃,最适pH是3.6~6.0[6]。【本研究切入点】拟青霉在深层发酵培养过程中可以产生大量的衍生物,其中有一种和吲哚乙酸产物相似,这种产物的显著的功效是能够在低浓度时促进植物根系的生长,从而能够明显地阻止线虫对植物根系的侵染,同时还能够促进植物的营养器官的成长。除此之外,拟青霉菌还能产生大量的葡聚糖酶、几丁质酶、细胞裂解酶和丝蛋白酶,通过获得的高效菌株,经过深层发酵产生的葡聚糖酶、蛋白酶和淀粉酶的活性会比普通菌株中产生的相关酶的衍生物的酶活性高。【拟解决的关键问题】研究以源于 Paecilomyces sp.FLH30葡聚糖酶基因,根据毕赤酵母对密码子的偏好性,在不改变氨基酸残基顺序的前提下对密码子进行优化,合成该基因成熟肽编码区的全长序列(GLUnm),在毕赤酵母GS115中进行了诱导表达[7],并对重组葡聚糖酶的酶学性质及底物特异性进行研究,筛选出产β-葡聚糖酶性能稳定的菌株,为后续研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌株与试剂
分泌型酵母表达载体pPIC9K购自自 Invitrogen公司,宿主菌毕赤酵母(Pichia pastoris)GS115由新疆畜牧科学院赠送,大肠杆菌 Escherichia coli DH5α由本实验室保存。
1.1.2 主要工具酶及试剂
限制性内切酶 Not I、Sac I和 EcoR I等,DL2000,DNA Marker,购自宝生物工程(大连)有限公司;DNA纯化试剂盒,质粒纯化试剂盒,购自天根生化科技(北京)有限公司;地衣多糖、YNB酵母氮源,购自北京鼎国昌盛生物技术有限公司,大麦β-葡聚糖购自上海普麦生物技术有限公司,其他试剂均为国产分析纯。
1.1.3 主要仪器及设备
核酸蛋白检测仪(Gene Quant,GE,德国),掌中型离心机(5415D,Eppendorf,德国),酶标仪(Infinite M200,TECEN,瑞士),酶标仪(Infinite M200,TECEN,瑞士),电泳仪(Powerpal Basic,BIO-RAD,美国),梯度PCR仪(My-Cycler,BIO-RAD,美国),半自动部分收集器(Frac-920,Amersham,美国),全自动凝胶成像系统(Gel Doc XR,BIO-RAD,美国)。
1.2 方 法
1.2.1 Paecilomyces sp.FLH30葡聚糖酶基因的优化与合成
在GenBank中检索出Paecilomyces sp.FLH30葡聚糖酶基因GenBank登录号:HQ825092)DNA序列,经SignalP 4.1软件在线分析去除信号肽编码区。根据毕赤酵母GS115对密码子的偏爱性及密码子的简并性、基因的 GC含量及最低自由能等,利用密码子在线优化工具JCat,对该基因的密码子进行优化,将优化后的核苷酸序列送至南京金斯瑞生物科技有限公司合成。
1.2.2 Paecilomyces sp.FLH30葡聚糖酶基因毕赤酵母工程菌的构建与筛选鉴定
将优化以后的 Paecilomyces sp.FLH30葡聚糖酶基因GLUn和酵母表达载体 pPIC9K用限制性内切酶EcoRⅠ和NotⅠ进行双酶切,将得到的酶切产物用DNA纯化试剂盒进行回收纯化。对纯化后的葡聚糖酶基因 GLUnm和表达载体用T4DNA连接酶进行连接,然后转化大肠杆菌 DH5α,经过菌落PCR的鉴定和限制性内切酶的鉴定无误后进行DNA测序获得重组质粒 pPIC9KGLUnm。将得到的重组质粒用限制性内切酶 Sac I线性化并且对得到的酶切产物进行纯化,将纯化后的酶切产物通过电击转化至毕赤酵母GS115的感受态细胞当中,将转化后的菌液均匀的涂布在配制好的培养基 MD平板上,于电热恒温培养箱29℃恒温培养48 h后,对重组菌落进行筛选。挑选出生长正常的菌落进行甲醇利用表型的确定。对甲醇利用表型表达正确的克隆经三代转代中间培养后,根据其对遗传霉素抗性大小G418梯度筛选出高拷贝的阳性克隆子。
重组酵母菌株在YPD-G418培养基上生长到肉眼可见时,以5’AOX1和3’AOX1作为引物,进行PCR。PCR反应条件为:95℃预变性5 min;然后94℃,60 s、65℃,60 s、72℃,60 s运行30 cycle;最后72℃延伸5 min。反应体系总体积为20 μL:上游引物和下游引物各 1 μL、Taq酶和DNA各 1 μL,dNTP需2 μL,10×PCR Buffer需2.5 μL,ddH2O需11.5 μL。接着在0.8%琼脂糖凝胶电泳检测扩增结果。将有特异扩增条带出现的克隆用YPD培养基在29°C恒温培养箱培养48 h,将得到的单克隆在YPD液体培养基中,29℃,220 r/min过夜培养,使得OD值在2~6,取750 μL菌液和250 μL丙三醇混匀,放入备好的高压灭菌的1.5mL离心管中,在-70℃冰箱中保存。
1.2.3 重组β-1,3(4)葡聚糖酶的诱导表达
1.2.3.1 重组β-1,3(4)葡聚糖酶在试管水平的诱导表达
将重组的酵母菌株划线接种于 YPD固体培养基,29℃培养48 h;沾取单克隆,接种至含5mL BMGY的试管中,在摇床29℃,220 r/min生长至OD600=2~6;室温 12 000 r/min离心 5 min收集细胞,去除上清,用1/5原培养基体积的 BMMY重悬收集到的细胞;置于试管中,用灭菌的纱布盖住试管口,置入摇床当中继续进行培养;每隔 24 h,加入甲醇,使得甲醇终浓度为0.5%为适宜,继续进行诱导表达;分泌表达时,将获得的上清液转移到灭菌过的离心管中,将上清及细胞沉淀存于-70℃冰箱直至开始检测。
1.2.3.2 重组β-1,3(4)葡聚糖酶在摇瓶水平的诱导表达
沾取单克隆接种到装有25mL BMGY培养基的 250mL摇瓶中,于 29℃、280 r/min培养至OD600=2~6(约需 16~18 h);将2.5mL的菌液接种至100mL BMGY的500mL摇瓶中,29℃、280 r/min培养至 OD600=2~6(对数生长期);收集菌体,用 BMMY重悬菌体,使 OD600=1.0左右;将所得的菌液置于 1 L的摇瓶中,用三层纱布封口,相同条件下继续诱导培养 96 h;每 24 h向培养基中添加甲醇至终浓度为0.5%;分别在0、12、24、36、48、60、72、84、96、108、120、132和144 h留取菌液样品1mL,最大转速离心,保留上清,存于-70℃冰箱备用。
1.2.3.3 重组酵母菌株的高效表达
使用10 L自动搅拌发酵罐,进行毕赤酵母深层发酵。设置培养温度为29℃,甲醇流速设置为400 μL/min,持续发酵诱导培养120 h。根据溶解氧的整体变化水平来相应的调整甲醇流速。在发酵过程中,每隔12 h取10mL样品待测。同时,取0、36和84 h的样品用刚果红平板染色法判断重组β-1,3(4)葡聚糖酶的酶活性。制备含 6 mg/mL的地衣多糖的琼脂平板,取 80 μL表达产物的上清液缓慢滴加至平板的空穴中,将平板放置37℃恒温培养箱中过夜培养,使用 2 mg/mL的刚果红染液染色30 min,使用 1 mg/mL的NaCl进行脱色1 h。可以根据平板上的透明圈的直径初步判断出表达产物的酶活性。
1.2.4 重组β-1,3(4)葡聚糖酶的酶学性质
1.2.4.1 重组β-1,3(4)葡聚糖酶活性的测定
重组葡聚糖酶活性采用二硝基水杨酸法测定。每个测定组设定2个重复,每个重复2个平行,以灭活菌液作为空白对照。取8 mg/mL的地衣多糖200 μL作为反应底物和100 μL待测酶液,震荡混匀,置于37℃水浴5 min。加入500 μL的DNS试剂,震荡混匀,于95℃水浴5 min。以流动的冷水终止反应后,采用Infinite M200于OD540nm测吸光值,对照葡萄糖标准曲线测算酶活性。1个葡聚糖酶活性单位(IU)为:以0.8%地衣多糖为底物,1 min在最适pH和最适反应温度下分解葡聚糖生成1 μmol还原糖所需的酶量。
1.2.4.2 重组β-1,3(4)葡聚糖酶的纯化
发酵产物经离心后,取 6mL上清于4℃、12 000 r/min离心,直到上清超滤浓缩至1mL为止。浓缩上清经 G-75葡聚糖凝胶进行层析纯化,以pH 5.0的0.2 mg/mL磷酸氢二钠0.1 mg/mL柠檬酸缓冲液作为洗脱液,采用部分收集器对洗脱组分进行收集。调节适合的流速,在每只收集管处停留1 min,每管取2 μL样品采用酶标仪于280 nm处测定吸光度,直至OD280回至基线后停止收集。根据 OD280值将处于同一吸收峰的样品进行合并,并测定合并样品的酶活性。
1.2.4.3 重组β-1,3(4)葡聚糖酶的最适反应温度及pH
最适反应温度的测定:取适量纯化后的重组β-1,3(4)葡聚糖酶液,分别在20、30、37、40、50、60、70、80和90℃下测定其酶活性。以酶活性最高者为100%,绘制温度 -相对酶活性曲线。
1.2.4.4 重组β-1,3(4)葡聚糖酶的最适反应pH
最适反应pH的测定:取适量纯化后的重组β-1,3(4)葡聚糖酶液,分别在pH为 2.2、3、4、5、5.6、6、7、8、9、10、10.5下在最适温度条件下测定酶活性。以酶活性最高者为100%,绘制 pH-相对酶活性曲线。
1.2.4.5 重组β-1,3(4)葡聚糖酶的温度稳定性
温度稳定性的测定:取适量纯化后的重组β-1,3(4)葡聚糖酶液,分别在 20、30、37、40、50、60、70、80和 90℃条件下保持30 min,在最适温度及pH值条件下测定其剩余酶活性,以0 min时取出的酶液的酶活性为100%。绘制温度-相对酶活性曲线。当剩余酶活性达到85%以上,即定义为稳定。
1.2.4.6 重组β-1,3(4)葡聚糖酶的pH的稳定性
pH稳定性的测定:取适量纯化后的重组β-1,3(4)葡聚糖酶液,分别在pH为2.2、3、4、5、5.6、6、7、8、9、10和10.5下保持30 min,在最适温度及pH值条件下测定其剩余酶活性。以酶活性最高者为 100%,绘制pH-相对酶活性曲线。当剩余酶活性达到85%以上,即定义为稳定。
2 结果与分析
2.1 源于 Paecilomyces sp.FLH30葡聚糖酶基因的优化
通过网址 http://www.ncbi.nlm.nih.gov/nuccore/HQ825092(GenBank登录号为 HQ825092)得到Paecilomyces sp.FLH30葡聚糖酶基因的优化前后的核苷酸序列。采用Jcat在线分析软件(http://www.jcat.de/)可对优化前后的序列进行比较。图1

图1 Paecilomyces sp.FLH30葡聚糖酶基因的优化前和优化后序列比较Fig.1 Alignment of before and optimized glucanase nucleotide sequence of Paecilomyces sp.FLH30
研究表明,Paecilomyces sp.FLH30葡聚糖酶基因优化前后的序列对比,优化后的序列和优化前的序列的相似性为86.05%。
优化后的Paecilomyces sp.FLH30葡聚糖酶基因 GLUnm的相对优化指数由 0.103 3提高到0.684 6,GC含量由优化前的66.22%变为优化后的49.05%,由此可知GC含量变化不大。这些数据表明优化后的葡聚糖酶基因 GLUnm更有利于在毕赤酵母GS115中表达。图1
2.2 重组质粒的酶切鉴定
研究表明,将pPIC9K-GLUnm重组质粒分别经 EcoR I单酶切,Not I单酶切,EcoR I和 Not I双酶切。重组质粒经过双酶切以后产生一条1.4 kb左右的条带,而空载体pPIC9K没有这个片段,表明目的基因已经连接到载体pPIC9K中。图2
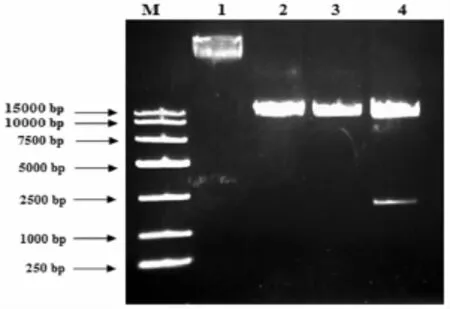
图2 重组质粒pPIC9K-GLUnm酶切鉴定Fig.2 Identification of expression plasmids for P.pastoris by digestion
2.3 重组酵母GS115的PCR鉴定
研究表明,GS115的PCR产物在2.2 kb有一条带,为GS115基因组DNA。pPIC9K-GS115的PCR产物在2.2 kb处产生出一条明显的条带,在0.5 kb处也出现有一条明显的条带。表明重组酵母中已经导进了目的基因当中。图3

图3 重组酵母GS115的PCR鉴定Fig.3 Identification of recombinant P.pastoris GS115 by PCR
2.4 重组β-1,3(4)葡聚糖酶在试管水平下酶活性
将筛选的转化子通过试管进行表达,26个抗5 mg/mL遗传霉素G418的克隆都具有葡聚糖酶活性,其中最高的是 120号,为 0.68 IU/mL。图4
2.5 重组β-1,3(4)葡聚糖酶在摇瓶水平下酶活性的比较
选取筛选的一株酶活性较高的120号菌株进行摇瓶水平表达。在36~48 h,随着时间的增加,酶活性缓慢上升,在 72~84 h,随着时间的增加,酶活性迅速上升,在 84 h之后酶活性开始下降,结果表明,摇瓶水平重组酵母表达酶活性在84 h时达到最高,为11.26 IU/mL。图5

图5 重组β-1,3(4)葡聚糖酶在摇瓶水平下的酶活性Fig.5 The enzyme activity of recombinant β-1,3(4)-dextran in shake flask
2.6 平板刚果红法鉴定重组β-1,3(4)葡聚糖酶活性
研究表明,毕赤酵母GS115和转化空表达载体 pPIC9K的酵母菌在连续培养84 h后没有产生透明圈,表明培养上清中没有检测到葡聚糖酶活性。而转化以后 120号单克隆重组毕赤酵母菌株,在诱导36 h时产生了清晰可见的透明圈,36 h时的透明圈的直径为17 mm,在连续培养96 h时的透明圈直径为22 mm。重组β-1,3(4)葡聚糖酶基因在毕赤酵母GS115中得到了表达,并且具有葡聚糖酶活性。图6
2.7 重组β-1,3(4)葡聚糖酶的纯化
研究表明,层析后出现了 2个比较大的峰。分别将12~24号试管的酶液和40~71号试管的酶液收集到一起,用 DNS法测定酶活性,发现12~24号试管的酶液有酶活性,而 40~71号试管的酶液无酶活性,说明12~24号试管的酶液是纯化的酶液。图7

图6 平板刚果红法鉴定重组β-1,3(4)葡聚糖酶活性Fig.6 Activity staining of secreted recombinant β-1,3(4)-dextran on plate observed after induction
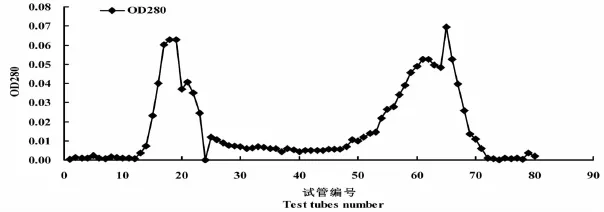
图7 G-75葡聚糖凝胶层析纯化中各试管 OD280的吸光值Fig.7 OD280of different tubes when purified by G-75 dextran gel chromatography
2.8 重组β-1,3(4)葡聚糖酶反应的最适pH及pH稳定性
研究表明,该酶的最适反应pH为5.0,在较高pH(6.0~10.5)下也有比较高的活性(70%以上),甚至在pH 9.5以后又有了升高的趋势,在10.5时高达96.90%;而在低pH(2.1~4.0)条件下酶活性很弱。图8

图8 重组β-1,3(4)葡聚糖酶反应的最适pHFig.8 The optimum pH of recombinant β-1,3(4)-glucanase reaction
研究表明,重组β-1,3(4)葡聚糖酶在pH 5.0~8.0的条件下具有较好的稳定性,剩余的活性在70%以上,在更低或更高的pH条件下也有最低40%的剩余酶活,表明该酶具有较强的耐酸碱性。图9

图9 重组β-1,3(4)葡聚糖酶反应的pH稳定性Fig.9 The pH stability of recombinant β-1,3(4)-glucanase reaction
2.9 重组β-1,3(4)葡聚糖酶反应的最适温度及温度稳定性
研究表明,该酶的最适反应温度为 50℃,另外在30~40℃也有较高的活性(60%以上);超过60℃以上则随温度的上升酶活性持续下降。这表明,重组β-1,3(4)葡聚糖酶对温度较为敏感,中低温条件下有较高的活性。图10

图10 重组β-1,3(4)葡聚糖酶反应的最适温度Fig.10 The optimum temperature of recombinant β-1,3(4)-glucanase reaction
研究表明,重组β-1,3(4)葡聚糖酶在37℃处理30 min后仍然保留了80%以上的酶活性,但是当温度超过60℃后,剩余酶活性迅速下降。当反应温度升高到90℃时,已基本无剩余活性。这表明,该酶在37~50℃左右的条件下有较好的稳定性。图11

图11 重组β-1,3(4)葡聚糖酶反应的温度稳定性Fig.11 The temperature stability of recombinant β-1,3(4)-glucanase reaction
3 讨 论
葡聚糖酶在食品、饲料、能源许多行业领域都得到了越来越广泛的应用,有着十分重要的应用前景。β-葡聚糖可分为β-1,3-1,4-葡聚糖(地衣多糖)、β-1,4-葡聚糖(纤维素)、β-1,3-葡聚糖(昆布多糖)和β-1,3(4)-葡聚糖在面包生产过程中,葡聚糖酶可以水解谷物面粉中的葡聚糖,使得面包的品质得到改善和提高[8]。β-葡聚糖酶在酿酒工业以及饲料工业当中也有很重要的商业应用价值,在酿酒工业中,β-葡聚糖酶能够提高麦汁的分离速度和麦汁浸出量,从而能够降低啤酒的浑浊度,达到提高啤酒的质量的目标。在饲料当中添加β-葡聚糖酶可有助于提高谷物的营养价值,有利于饲料的转化率,促进动物快速成长,也可起到减少动物腹泻率的作用,很多厂商都积极使用大麦等禾谷类作物选作优质的能量饲料来源。
目前,有多种新型葡聚糖酶基因在毕赤酵母表达系统中表达[9]。在真核表达体系当中,公认的最为常用的表达系统是巴斯德毕赤酵母(Pichia pastoris),其具有易于培养、便于基因工程操作[10-13]。毕赤酵母表达系统不但可以将异源表达的蛋白质分泌到毕赤酵母菌体之外[14],还可以进行进一步的高密度发酵[8],因而毕赤酵母表达系统在葡聚糖酶研究中受到很大的关注[15]。由于宿主在表达外源基因时会有不同的偏爱性,在对外源基因密码子优化时,主要应考虑稀有密码子的替换、消除 AT富集区和G+C含量的调整等[16]。为了使基因得到高水平的表达可以由人工合成或者定点突变宿主高频使用的密码子[17]。研究以源于 Paecilomyces sp.FLH30的葡聚糖酶基因为基础,根据毕赤酵母密码子的偏爱性对该基因进行了密码子优化,并且在毕赤酵母中得到了表达。
有报道认为,Mut+型表达速率较快,适于小分子蛋白的表达;流加适宜的碳源是提高外源基因在毕赤酵母中表达的重要措施之一。汪志浩等[18](2009)报道,甘油、山梨醇、乳酸与甲醇的混合添加均可以提高毕赤酵母表达碱性果胶酶的产量,其中山梨醇与甲醇的混合流加效果最为显著。通过双碳源混合流加可以提高细胞活力,增强醇氧化酶活力,提高毕赤酵母表达外源蛋白效率。在研究中,流加碳源为甲醇时,重组内切β-1,3(4)葡聚糖酶的活性达到了11.26 IU/mL。通过进一步优化流加碳源的组合,来源于Paecilomyces sp.FLH30的内切β-1,3(4)葡聚糖酶在毕赤酵母GS115中的表达水平可能还有继续提高的空间。
4 结 论
经密码子优化,来源于Paecilomyces sp. FLH30的葡聚糖酶基因在毕赤酵母细胞中获得表达,在试管水平表达酶活性为0.68 IU/mL,即该重组酵母菌株的初始酶活可以认定为0.68 IU/mL,作为摇瓶表达的初始酶活性。在摇瓶水平条件下,重组酵母表达的酶活性在84 h时达到最高,为11.26 IU/mL。纯化后的葡聚糖酶的最适温度是50℃,最适pH是5.0。
(
)
[1]张永勤,曾凡伟.β-葡聚糖酶活力测定方法的研究进展[J].食品科学,2011,32(19):316-320. ZHANG Yong-qin,ZENG Fan-wei.(2011).Research progress of determination methods for-Glucanase Activity[J]. Food Science,32(19):316-320.(in Chinese)
[2]吕丽丽,王瑞宾,王家林,等.高效β-葡聚糖酶对麦汁过滤速度的影响[J].酿酒科技,2010,(3):75-77. LV Li-li,WANG Rui-bin,WANG Jia-lin.(2010). Effects of High-efficiency β-glucanase Addition on Wort Filtration Rate[J].Liquor-Making Science&Technology,(3):75-77.(in Chinese)
[3]佘文熙,曾宇,赵俐娜,等.酵母葡聚糖鲭鱼鱼丸的研制及其质构特性和防腐效果的研究[J].食品工业,2015,36(9):133-135. SHE Wen-xi,ZENG Yu,ZHAO Li-na,et al.(2015). Study on Preparation and quality of yeast fish mackerel texture and antiseptic effect[J].Food Industry,36(9):133-135.(in Chinese)
[4]蔡成岗,蒋新龙,蒋昌海.β-葡聚糖结构功能与开发研究进展[J].农产品加工(学刊),2011,(9):114-117. CAI Chen-gang,JIANG Xin-long,JIANG Chan-hai.(2011).Progress in research on the structure function and development of β-dextran[J].Farm Products Processing,(9):114-117.(in Chinese)
[5]段会轲,熊善柏,胡筱波.酵母β-1,3-葡聚糖酶解产物体内抗肿瘤及抗氧化活性的测定[J].华中农业大学学报,2007,26(5):871-874. DUAN Hui-ke,XIONG Shan-bai,HU Xiao-bo.(2007). Study on Antitumor and Antioxidant Activities of Yeast β-1,3-glucan Hydrolysates in vivo[J].Journal of Huazhong Agricultural University,26(5):871-874.(in Chinese)
[6]汪艳,李晓,陈勇,等.来源于瘤胃厌氧真菌Neocallimastix frontalis木聚糖酶在毕赤酵母中的表达[J].生物技术通报,2015,31(5):186-193. WANG Yan,LI Xiao,CHEN Yong,et al.(2015).Expression of a Xylanase Gene Originated from Rumen Anaerobic Fungi Neocallimastix frontalis inPichia pastoris[J].Biotechnology Bulletin,31(5):186-193.(in Chinese)
[7]Bang,M.L.,Villadsen,I.,&Sandal,T.(1999).Cloning and characterization of an endo-β-1,3(4)glucanase and an aspartic protease from phaffia rhodozyma,cbs 6938.Applied Microbiology&Biotechnology,51(2):215-222.
[8]Zhou,C.Y.,Wang,Y.T.,Wu,M.C.,Wu,W.,&Li,D.F.(2009).Heterologous expression of xylanase ii from aspergillus usamii in pichia pastoris.Food Technology&Biotechnology,47(1):90-95.
[9]Chen X Y,Meng K,Shi P J,et al.(2012).High-level expression of a novel Penicillium endo-1,3(4)-β-D-glucanase with high specific activity in Pichia pastoris.Microbiol.Biotechnol,39(5):869-876.
[10]Luo,H.,Yang,J.,Yang,P.,Li,J.,Huang,H.,&Shi,P.,et al.(2010).Gene cloning and expression of a new acidic family 7 endo-β-1,3-1,4-glucanase from the acidophilic fungus bispora,sp.mey-1.Applied Microbiology&Biotechnology,85(4):1,015-1,023.
[11]Daly,R.,&Hearn,M.T.W.(2005).Expression of heter-ologous proteins in pichia pastoris:a useful experimental tool in protein engineering and production.Journal of Molecular Recognition,18(2):119-138.(in Chinese)
[12]蔡红英.青霉来源的半纤维素酶基因的克隆与表达[D].北京:中国农业科学院硕士论文,2011. CAI Hong-ying.(2011).Cloning and expression of the semi cellulose gene from the source of the strain[D].Master Dissertation.Chinese Academy of Agicultural Sciences,Beijing.(in Chinese)
[13]张桂敏.木聚糖酶基因的克隆、表达与酶学性质研究[D].武汉:华中农业大学博士论文,2006. ZHANG Gui-min.(2006).Cloning,expression and characterization of xylanase gene[D].PhD Dissertation.Huazhong Agricultural University,Wuhan.(in Chinese)
[14]江正强.微生物木聚糖酶的生产及其在食品工业中应用的研究进展[J].中国食品学报,2005,5(1):1-9. JIANG Zheng-qiang.(2005).Advance in Microorganism Xylanases and Their Application in Food Industry[J].Journal of Chinese Institute of Food Science and Technology,5(1):1-9.(in Chinese)
[15]韩学易,李治国,陈惠.饲用木聚糖酶基因的克隆及序列分析[J].中国饲料,2013,(4):16-21. HAN Xue-yi,LI Zhi-guo,CHEN Hui.(2013).Cloning and sequence analysis of feed xylanase enzyme gene[J].China Feed,(4):16-21.(in Chinese)
[16]Shumiao Z,Huang J,Zhang C,Deng L,Hu N,&Liang Y.(2010).High-level expression of an aspergillus niger endobeta-1,4-glucanase in pichia pastoris through gene codon optimization and synthesis.Journal of Microbiology&Biotechnology,20(3):467-473.(in Chinese)
[17]Zhao Shumiao,Jun Huang,Zhang Changyi,et al.(2010). High-level expression of an Aspergillus niger endo-β-1,4-glucanase in Pichia pastoris through gene codon optimization and synthesis[J].Joumal of Microbiology and Biotechnology,20(3):467-473.(in Chinese)
[18]汪志浩,张东旭,李江华,等.混合碳源流加对重组毕赤酵母生产碱性果胶酶的影响[J].生物工程学报,2009,25(12):1 955-1 961. Zhihao Wang,Dongxu Zhang,Jianghua Li,et al.(2009). Mixed carbon sources and influence of recombinantPichia pastoris producing alkaline pectinase[J].Journal of biological engineering,25(12):1,955-1,961.
Expression of the Paecilomyces sp.FLH30 endo β-1,3(4)Glucanase Gene in Pichia pastoris
HU Wei1,2,ZHANG Hui-ling1,WEI Huan1,FU Ting-ting1,CHEN Yong1,WU Yun2
(1.Xinjiang Key Laboratory of Herbivore Nutrition for Meat&Milk Production,College of Animal Science,Xinjiang Agricultural University,Urumqi 830052,China;2.College of Food and Pharmaceutical Sciences,Xinjiang Agricultural University,Urumqi 830052,China)
【Objective】β-1,3(4)glucanase is an important industrial enzyme,which is widely used in feed industry,brewing industry and textile industry.【Method】This study takes the Paecilomyces sp.FLH30 β-1,3(4)Glucanase Gene as the research object.According to the preference of the codon of Pichia pastoris GS115,from the Paecilomyces sp.FLH30 β-1,3(4)glucanase gene was optimized,full-length gene GLUnm was synthesized by full gene technique and the recombinant yeast expression vector pPIC9K-GLUnm was constructed,linearized recombinant plasmid pPIC9K-GLUnm with Sac I,electroporation was transformed into Pichia pastoris GS115 for expression.【Result】The hygromycin resistance phenotype screening,genetic screening,identified by PCR showed that the glucanase gene was integrated into yeast chromosome DNA.The expression was induced by methanol in the test tube,and the activity of the enzyme was determined.The enzyme activity was 0.68 IU/mL,which could be considered as the initial enzyme activity of 0.68 IU/mL.The expression of 84 h was highest and the enzyme activity was 0.68 IU/mL.【Conclusion】The results of enzymatic properties showed that the optimum pH was 5.0,the optimum reaction temperature was 50℃.The enzymatic properties was more stable at the temperature of 37-50℃ in pH 5.0-8.0.
β-1,3(4)-glucanase;Pichia pastoris;expression;enzymatic properties
Q939.97
A
1001-4330(2016)09-1715-11
10.6048/j.issn.1001-4330.2016.09.020
2016-04-26
新疆维吾尔自治区高技术研究项目(201211104);2015年新疆农业大学研究生科研创新项目(XJAUGRI2015011)
胡玮(1988-),女,新疆乌鲁木齐人,硕士研究生,研究方向为食品生物技术,(E-mail)huwei0709@163.com
(Cotresponding author):陈勇(1972-),男,四川德阳人,教授,博士,研究方向为酶的基因工程,(E-mail)xjaucy@hotmail.com武运(1965-),女,重庆人,教授,硕士,研究方向为食品生物技术,(E-mail)wuyunster@sina.com
Fund project:Xinjiang Uygur Autonomous Region high technology research project(No.201211104)and Xinjiang Augricultural University Postgraduate Innovative Research Project(XJAUGRI2015011)

