混合价态钒氧化物(V10O24·10H2O)的合成及其电容性能研究
张立宁,康 玲,邹慧君,陈联梅
(西华师范大学 a.化学化工学院;b.化学合成与污染控制重点实验室,四川 南充 637009)
混合价态钒氧化物(V10O24·10H2O)的合成及其电容性能研究
张立宁,康 玲,邹慧君,陈联梅
(西华师范大学 a.化学化工学院;b.化学合成与污染控制重点实验室,四川 南充 637009)
提出了一种新的简单水热法来合成混合价态V10O24·10H2O。以廉价的V2O5为原料,MnSO4为还原剂,水热法制备得到样品。利用XRD、XPS、EDS、TG和SEM测试了样品的晶体结构、钒元素的价态、元素组成、水分含量和形貌。首次探讨了V10O24·10H2O在水系电解质中的电容性能。电化学测试结果表明,V10O24·10H2O电极在电压窗口为(-0.2—0.9) V、1 mol·L-1KNO3中性溶液为电解液条件下,展现出最大比电容为157.0 F·g-1;3 000次循环后具有90.4%的比电容保持率。与文献报道的单一价态V2O5的循环性能相比较,这种混合价态钒氧化物V10O24·10H2O的循环性能明显好很多。
V2O5;MnSO4;V10O24·10H2O;电容性能;水系电解液
钒氧化物具有优异的电学、光学、化学性能,被广泛的应用于催化剂[1,2]、化学传感器[3,4]、场效应晶体管[5,6]、锂离子电池电极材料[7-9]等领域。 近年来, 钒氧化物因具有良好的反应活性、低廉的成本和充放电速率快等优点, 它们的电容性能引起了人们的重视, 这方面的研究报道也日益增多。
单一价态的V2O5是众多钒氧化物中被研究得最多的。 Lee等[10]首次报道了无定形水合V2O5的电容性能,在pH值为 6.67的KCl电解液中比电容可达到350 F·g-1,比电容保持率在100次循环后仅有55%。 Reddy等[11]合成了多孔V2O5晶型体粉末,在2 mol·L-1KCl溶液中的初始比电容为216 F·g-1,但是循环性能很差。 Yang等[12]发现空心球状的V2O5在LiNO3电解液中100次循环后比电容保持率只有70%。 Saravanakumar等[13]制备了网状V2O5,以K2SO4溶液作为电解液,初始比电容为316 F·g-1,600次循环比电容保持率为76%。 Qu等[14]以P123为模板剂制备了V2O5·0.6H2O纳米带,在K2SO4电解液中比电容下降非常快。 可见,文献所报道的V2O5电化学循环性能都不好,需要进一步改善提高。 由于V2O5是n型半导体,电子沿着V4+→O→V5+迁移,因此混合价态的钒氧化物比单一价态的V2O5有更高的导电率,从而能展现出更好的循环性能。
V10O24·nH2O是一种典型的混合价态钒氧化物,其中V(IV)含量与V(V)含量的比为1∶4,平均氧化态为4.8。目前,关于V10O24·nH2O研究报道很少。在有限的几篇文献中, 它们的制备方法都比较复杂。Occhiuzzi等[15]发现VO2或V2O3在空气中放置26个月后, 被缓慢氧化生成了V10O24·12H2O。Tang等[16]通过电解法将阳极金属钒片溶解生成VO3+和VO2+离子,再老化处理2天后得到V10O24·nH2O。Menezes等[17,18]以钒的醇盐为原料, 利用溶胶凝胶法制备了V10O24·9H2O。此法需要回流50h,效率只有70%。孙娟萍等[19]将V2O5粉末溶解于H2O2溶液中形成胶体,再利用溶剂替换工艺生成了V10O24·12H2O。可见,目前关于V10O24·nH2O的制备工艺比较复杂、耗时,因此需要进一步探索更简单有效的合成方法。
作者提出了一种新的简单水热法来合成V10O24·10H2O。以分析纯V2O5粉末作为原料,以MnSO4粉末作为还原剂,在140℃下水热反应16h就能得到样品。与文献报道的几种合成方法相比,此法具有原料便宜、操作简单、不耗时等优点。据我们所知,关于V10O24·10H2O的电容性能还未见报道,因此在本文中我们首次研究了V10O24·10H2O作为超级电容器的电极材料在1 mol·L-1KNO3和NaNO3中性电解液中的电容性能。测试结果表明,在1 mol·L-1KNO3中性电解液,电压窗口为(-0.2—0.9) V时,V10O24·10H2O电极展现出最大初始比电容157.0 F·g-1;3 000次循环后具有90.4%的比电容保持率。与文献报道的单一价态V2O5的循环性能相比较,这种混合价态钒氧化物V10O24·10H2O的循环性能明显好很多。
1 实验部分
1.1 样品制备
将1.0 g V2O5和1.0 g MnSO4分别加入到40 mL去离子水中,室温下磁力搅拌30 min,待搅拌时间结束,把含有V2O5和MnSO4的混合溶液转移至50 mL的水热釜中,其中水热反应时间为16 h,温度为140℃。反应时间结束后,过滤得到含有杂质的样品,将含有杂质的样品沉淀分别用去离子水和分析纯的丙酮清洗数次,60℃真空干燥24 h后得到V10O24·10H2O样品。
1.2 样品表征
利用日本Rigaku-D/max-rA型XRD仪表征样品的晶体结构与物相。利用英国Kratos-XSAM800型XPS仪表征钒元素氧化态。采用英国牛津EDS仪分析样品中的组成元素。采用德国Netzsch-STA/449F3型TG-DSC仪分析样品中水分含量。采用日本Hitachi-SU8020型SEM仪对样品形貌与粒度大小分析。
1.3 电化学性能测试
1.3.1 V10O24·10H2O电极的制备
将粘结剂(聚偏氟乙烯)、导电剂(乙炔黑)、活性物质(V10O24·10H2O)以5∶25∶70的质量比为比例混合,N-甲基-2-吡咯烷酮作为溶剂,常温条件下研磨40 min。待研磨完毕把混合样品放入70℃的真空干燥箱干燥一天, 再次研磨便得到样品粉末。取适量干燥后的样品粉末压在集流体(不锈钢网)上,真空干燥得到V10O24·10H2O电极。
1.3.2 V10O24·10H2O电极的电化学性能测试
循环伏安测试实验是通过V10O24·10H2O工作电极、铂电极、饱和甘汞电极组成的三电极体系完成的。所用的电解液为1 mol·L-1KNO3和NaNO3中性溶液, 所用的仪器为上海辰华电化学工作站(CHI660E)。
恒流充放电测试实验是将两个质量相同的V10O24·10H2O电极组装成对称的模拟超级电容器,以1 mol·L-1KNO3和NaNO3中性溶液作为电解液, 所用的仪器是新威电池程控测试仪。
2 结果与讨论
2.1 XRD、XPS、EDS和TG表征
图1为样品的XRD图。从图中可看出,粉末样品与PDF卡片(No. 25-1006)明显的几个衍射峰的峰位几乎是一致[19]的,表明所制备的粉末样品中V10O24大量存在。从图1中还可以看出,样品在6°左右的衍射峰(002)是最强的,其它衍射峰都相对比较弱,表明样品沿着(002)晶面生长,并形成了层状结构。根据衍射峰(002),计算出层间距为13.5Å。
图2为所制备样品的 XPS图。由图可知,结合能在517.50 eV和516.37 eV处的峰分别为V(V)和V(IV)的V2p3/2的特征峰,表明所制备的样品中钒元素存在两种价态——V(V)和V(IV)。它们的峰面积分别为7 608.5和1 805.5,从而计算出样品中含有V(V)的量与含有V(IV)的量的比约为4∶1,平均氧化数为4.8,与V10O24的化学式是一致的。V(IV)的存在表明部分V2O5与Mn2+发生了氧化还原反应,如下反应(1)所示。但是,在XRD图中没有发现MnO2的衍射峰,推测其原因:可能是MnO2含量太少,或者是MnO2处于无定形态。
5V2O5+Mn2++2H2O=V10O24+MnO2+2H+
(1)
为了检测样品中存在少量MnO2,我们对样品进行了EDS测试。图3为样品的EDS图。从图中可以看出,样品中除了含有大量的V和O,还含有少量Mn,证明样品中确实含有少量的锰氧化物。需要说明的是,Si元素来自硅片(EDS测试所用到的导电物质)。
图4为所样品的TG曲线图。由图4可以看出,样品热失重温度范围为30—550℃,主要分为两步进行。其中,150℃之前失水为物理吸附水(~5.4 wt%),150—550℃失水为层间水(~16.2 wt%)。由此可得层间水与V10O24的摩尔比为10∶1。因此,所制备的钒氧化物化学式为V10O24·10H2O。

2.2 SEM分析

图5为样品V10O24·10H2O的形貌图。由图可看出V10O24·10H2O样品是由不规则的带状构成,表明样品具有层状结构,这与前面XRD测试结果一致。但是,这些纳米带比较短,且相互缠绕堆积,导致孔隙率不是很高,影响电解质溶液在材料内部的扩散,使得本文中的V10O24·10H2O的初始比电容值比文献报道的V2O5初始比电容小[10,11,13]。
2.3 电化学性能测试
2.3.1 循环伏安测试
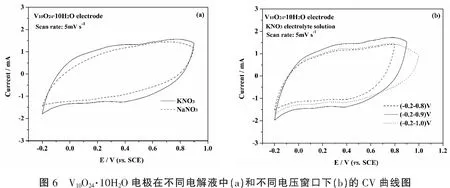
图6a为V10O24·10H2O电极在不同的中性电解液中的CV(循环伏安)曲线图。我们从图中可以看出,在KNO3电解液中V10O24·10H2O电极的CV曲线的面积大于在NaNO3电解液中的面积,表明V10O24·10H2O电极在KNO3中性电解液中的电容性能更好,可能是由以下两个原因所导致的:(1)水合K+半径小于水合Na+半径, 有利于部分K+扩散进入材料表层;(2)水合K+的电导率更高。
图6b为V10O24·10H2O电极在1 mol·L-1KNO3中不同电压窗口下的CV(循环伏安)曲线。由图可见,V10O24·10H2O电极在电压窗口(-0.2—0.9) V下的输出电流大,且最接近于矩形对称,因此推测V10O24·10H2O电极在(-0.2—0.9) V下的电容性能应该是最好的。
2.3.2 恒流充放电测试
图7为V10O24·10H2O电极在1 mol·L-1KNO3和NaNO3中性溶液为电解液,(-0.2—0.9) V为电压窗口下的充放电曲线(图7a)和循环性能曲线,由图7a可看出,V10O24·10H2O电极在KNO3电解液中的充放电曲线的面积更大。根据放电曲线,由公式(2)计算得出V10O24·10H2O电极在KNO3和NaNO3中性电解液中放电比电容(见图7b),结果得出V10O24·10H2O电极在KNO3中性电解液中的比电容更大,最大初始比电容为157.0 F·g-1;循环性能更好,3 000次循环比电容保持率为90.4%。文献报道V2O5的循环性能都不好。Lee等和Yang等报道100次循环后V2O5的比电容分别下降了55%和30%;Saravanakumar等[13]报道循环性能的稍好,600次循环后也下降了34%。然而,V10O24·10H2O的比电容在 3 000次循环才下降9.6%。显然,V10O24·10H2O的循环性能明显好于V2O5。
(2)

图8为V10O24·10H2O电极在1 mol·L-1KNO3中不同电压窗口下的充放电曲线。图8a中V10O24·10H2O电极在不同的电压窗口下充放电效率几乎达100%,表明V10O24·10H2O电极在不同的电压窗口下的电容性能都比较好。根据放电曲线,由公式(2)计算得出V10O24·10H2O电极在不同电压窗口下的放电比电容(见图8b)。由图8b可知,V10O24·10H2O电极的电容性能在(-0.2—0.9) V工作电压下是最好的,其次是(-0.2—0.9) V,最差的是(-0.2—0.8) V。

3 结 论
本文首次利用简单的水热法制备了V10O24·10H2O纳米带材料。通过XRD、XPS、EDS、TG和SEM测试表明所制备的样品主要成分为带状的V10O24·10H2O。循环伏安和恒流充放电法测试表明,V10O24·10H2O电极在1 mol·L-1KNO3中性电解液中、电位窗口为(-0.2—0.9) V时展现出最大的比电容为157.0 F·g-1;循环性能也比较好,3 000次循环后比电容保持率为90.4%。显然,混合价态V10O24·10H2O的循环性能明显好于单一价态的V2O5。综上所述,水热法合成的V10O24·10H2O纳米带具有作为超级电容器电极材料的潜力。
[1] SHAHI R R,YADAV T P,SHAZ M A,et al.Studies on dehydrogenation characteristic of Mg(NH2)2/LiH mixture admixed with vanadium and vanadium based catalysts (V,V2O5and VCl3)[J].Int J Hydrogen Energy,2010,35(1):238-246.
[2] PALMA V,BARBA D.Low temperature catalytic oxidation of H2S over V2O5/CeO2catalysts[J].Int J Hydrogen Energy,2014,39 (36):21524-21530.
[3] GUERRA E M,SILVA G R,MULATO M.Extended gate field effect transistor using V2O5xerogel sensing membrane by solegel method[J].Solid State Sci 2009,11 (2):456-460.
[4] LONG D X,XU Y,KANG S J,et al.Solution processed vanadium pentoxide as charge injection layer in polymer field-effect transistor with Mo electrodes[J].Org Electron 2015,17:66-76.
[5] SURESH R,GIRIBABU K,MANIGANDAN R,et al.New electrochemical sensor based on Ni-doped V2O5nanoplates modified glassy carbon electrode for selective determination of dopamine at nanomolar level[J].Sensor Actuat B-Chem 2014,202(4):440-447.
[6] LEROY C M,ACHARD M F,BABOT O,et al.Designing nanotextured vanadium oxide-based macroscopic fibers:application as alcoholic sensors[J].Chem.Mater.2007,19(16):3988-3999.
[7] SONG H,ZHANG C,LIU Y,et al.Facile synthesis of mesoporous V2O5nanosheets with superior rate capability and excellent cycling stability for lithium ion batteries[J].J.Power Sources,2015,294:1-7.
[8] NIU C,LI J,JIN H,et al.Self-template processed hierarchical V2O5nanobelts as cathode for high performance lithium ion battery[J].Electrochim.Acta 2015,182:621-628.
[9] ZHU K,MENG Y,QIU H,et al.Facile synthesis of V2O5nanoparticles as a capable cathode for high energy lithium-ion batteries[J].J.Alloys Compd.2015,650:370-373.
[10] LEE Y HEE,GOODENOUGH J B.Ideal supercapacitor behavior of amorphous V2O5·nH2O in potassium chloride (KCl) aqueous solution[J].J Solid State Chemmistry,1999,148(1):81-84.
[11] REDDY RAVINDER N,REEDY RAMANA G.Porous structured vanadium oxide electrodematerial for electrochemical capacitors[J].Journal of Power Sources,2006,156(2):700-704.
[12] YANG J,LAN T,LIU J,et al.Supercapacitor electrode of hollow spherical V2O5with a high pseudocapacitance in aqueous solution[J].Electrochim.Acta,2013,105(26):489-495.
[13] SARAVANAKUMAR B,PURUSHOTHAMAN KAMATCHI K.Interconnected V2O5nanoporous network for high-performance supercapacitors[J].Appl.Mater.Interfaces,2012,4(9):4484-4490.
[14] QU Q T,LIU L L,WU Y P,et al.Electrochemical behavior of V2O5·0.6H2O nanoribbons in neutral aqueous electrolyte solution[J].Electrochimica Acta,2013,96:8-12.
[15] OCCHIUZZI M,CORDISCHI D,DRAGONE R.Reactivity of some vanadium oxides:An EPR and XRD study[J].J.Solid State Chem,2005,178(5):1551-1558.
[16] TANG Y X,RUI X H,ZHANG Y,et al.Vanadium pentoxide cathode materials for high-performance lithium-ion batteries enabled by a hierarchical nanofl ower structure via an electrochemical process[J].J.Mater.Chem.A,2013,1 (1):82-88.
[17] MENEZES W G,REIS D M,OLIVEIRA M M,et al.Vanadium oxide nanostructures derived from a novel vanadium(IV) alkoxide precursor[J].Chem Phys Lett,2007,445(4-6): 293-296.
[18] MENEZES W G,REIS D M,BENEDETTI T M,et al.V2O5nanoparticles obtained from a synthetic bariandite-like vanadium oxide:Synthesis,characterization and electrochemical behavior in an ionic liquid[J].J Colloid Interf Sci,2009,337(2):586-593.
[19] 孙娟萍,吴广明,张明霞,等.新型钒氧化合物V10O24·12H2O的制备及交流阻抗特性[J].材料导报:研究篇,2009,23(8):22-24.
Synthesis of a Mixed-valence Vanadium Oxide (V10O24·10H2O) and Investigation on Its Capacitive Properties
ZHANG Lining,KANG Ling,ZOU Huijun,CHEN Lianmei
(a.College of Chemistry and Chemical Engineering;b.Chemical Synthsis and Pollution Control Key Lab of Sichuan Province,China West Normal University,Nanchong Sichuan 637009,China)
V10O24·10H2O nanoribbons were synthesized by a new hydrothermal method, starting from cheap V2O5and MnSO4.The crystal structure,oxidation state of vanadium element,elements,morphology and the water content of the as-prepared sample were characterized by XRD,XPS,EDS,TG and SEM.Capacitive properties of the V10O24·10H2O electrode were firstly investigated in 1 mol·L-1KNO3and NaNO3electrolytes by cyclic voltammetry and galvanostatic charge/discharge test.The best initial specific capacitance of 157.0 F g-1was achieved in 1 mol·L-1KNO3electrolyte at the working voltage of -0.2—0.9 V.After 3000 cycles,the capacity retention was 90.4%.Obviously,the mixed-valence V10O24·10H2O exhibited better cyclic stability in contrast with the single-valence V2O5.
V2O5;V10O24·10H2O nanoribbons;capacitive properties;aqueous electrolytes
1673-5072(2016)03-0279-06
2015-11-05 基金项目:西华师大科研项目(416198) 作者简介:张立宁(1987—),女,河北邢台人,硕士研究生,主要从事超级电容器电极材料研究。 通讯作者:陈联梅(1972—),女,重庆万州人,教授,主要从事无机功能材料研究。E-mail: chenlianmei845@163.com
O646.21;TM912.9
A
10.16246/j.issn.1673-5072.2016.03.009

