RASSF1A基因启动子甲基化状态与喉癌关系的实验研究
别远志 孙敬武 李万举
RASSF1A基因启动子甲基化状态与喉癌关系的实验研究
别远志1孙敬武1李万举1
目的 检测喉癌组织的抑制基因RAS相关区域家族1A(Ras associationdomain family 1,isoform A,RASSF1A)甲基化状态,并探讨RASSF1A启动子甲基化与喉癌的关系。方法 应用甲基化特异性PCR技术技术检测52例喉癌组织,52例相应癌旁组织及24例对照组织中RASSFIA基因启动子甲基化状态。按年龄、性别、肿瘤分化程度、肿瘤分期进行分组,分析RASSF1A基因启动子区甲基化情况与各组临床病理特征的关系。结果 ①喉癌组织、癌旁组织及对照组织中RASSFIA基因启动子区甲基化的例数分别65.4%、7.7%、0%。喉癌组甲基化发生率显著高于癌旁组和对照组,差异有显著统计学意义(P<0.05),而癌旁组甲基化发生率与对照组比较,差异无统计学意义(P>0.05)。②RASSF1A基因启动子甲基化情况与喉癌患者的年龄、性别及肿瘤的分化程度、及分期情况关系不明显,按上述临床病理特征分组,各组内比较差异均无统计学意义(P>0.05)。结论①喉癌组织中RASSF1A基因启动子区的甲基化,提示其与喉癌发生关系密切,可能喉癌发生过程中一个重要的分子机制。②不同肿瘤的分化及分期间甲基化程度无明显差异,提示RASSF1A基因发生甲基化可能是喉癌发生中的早期事件。③RASSF1A启动子甲基化有望成为早期诊断喉癌的一个分子标志。甲基化特异性PCR方法是一种快而灵敏的基因甲基化检测方法,有望应用于临床。
喉癌;RASSF1A基因;甲基化;甲基化特异性PCR
喉癌是耳鼻咽喉头颈外科常见的恶性肿瘤之一,占全身肿瘤的1%~5%[1],近年发病率有明显的增长趋势,仅2005年就新增病例16万,严重危害着人类的健康[2]。目前,研究喉癌发生、发展的分子生物学机制及肿瘤标志物,对于喉癌的预防、诊断、预后评价和化疗药物选择将有重大的意义,成为未来喉癌研究的热点。癌基因激活和抑癌基因的失活是人类肿瘤发生发展的主要遗传学机制,但其中以肿瘤抑制基因的失活是肿瘤发生的重要原因,抑癌基因RASSFlA是目前研究的热点。RASSF1A失活主要包括三种机制:RASSF1A启动子的甲基化、纯合子缺失和杂合子的丢失(loss of heterozygosity, LOH),大量文献研究表明,RASSFIA基因启动子区异常高甲基化是导致该基因失活的主要机制。目前多种肿瘤中都发现了RASSFlA的启动子甲基化,如乳腺癌、前列腺癌、鼻咽癌、卵巢癌、黑色素瘤、淋巴瘤、膀胱癌、胃癌等,但是喉癌的相对报道十分有限,为了进一步研究RASSFlA基因的甲基化与喉癌的发生密切相关,所以设计本次实验研究。
本实验采用甲基化特异性聚合酶链反应(Methylation specific polymerase Chain reaction,MSP)技术,应用甲基化特异性PCR技术检测52例喉癌组织及相应癌旁组织、24例对照组织中RASSFIA基因启动子甲基化状态。按年龄、性别、肿瘤分化程度、肿瘤分期进行分组,分析RASSF1A基因启动子区甲基化情况与各组临床病理特征的关系。探讨RASSF1A启动子甲基化与喉癌的关系。
材料与方法
1 研究对象
52例喉癌标本来自以2009年10月~2011年7月安徽省立医院耳鼻咽喉头颈外科住院治疗的病人,其中男性48例,女性4例,年龄42~78岁,平均60岁,所有患者术前均未接受化疗或放疗。喉癌组织、相应癌旁组织经病理检验证实,并确认手术标本切缘为阴性。所有喉癌均经组织病理学明确诊断,均为喉鳞状细胞癌,其中高分化鳞癌33例,中分化12例,低分化7例。按照国际抗癌联盟(UICC) TNM分类标准(2002),其中I级16例,II期14例,III期10例,IV12例。另外取喉良性疾病对照组24例患者,其中男性14例,女性10年,年龄28~60岁,平均43岁,病种包括:声带息肉,声带肉芽肿。以上所有的组织所有标本自取材后立即放入液氮中,后转入-70℃冰箱保存。52例喉患者及24例良性肿瘤患者(对照组),术前经患者及家属签字同意。
2 引物设计及合成
MSP原理:亚硫酸氢盐和氢醌能将DNA链上的胞嘧啶(C)转变为尿嘧啶(U),而当CpG上的胞嘧啶被甲基化后,这一转化将不会发生。这样甲基化和未甲基化的DNA序列经过亚硫酸氢盐修饰后,即可通过特异序列的引物区分开来。引物参照Gene bank及相关文献[14,15],分别识别甲基化特异性序列和非甲基化特异性序列,设计如下(表1)。

表1 甲基化特异性PCR反应引物序列
3 实验过程及步骤
3.1 组织标本DNA提取
采用康为世纪公司的DNA提取试剂盒(CW0546),按照说明先后试剂制配,然后根据说明书具体操作。
3.1.1 材料处理
①直接向100μl冷冻的抗凝血液样品中加入BufferGTL补足至200μl;
②取25mg组织切成小块,加入Buffer GTL用匀浆器匀浆处理,置于1.5ml离心管中。加入180μl Buffer GTL,将不同样品做好标记。
3.1.2 加入20μl Proteinase K,涡旋震荡使样品彻底混匀。
①血液标本,只需加入Proteinase K混匀,即可继续进行下一步操作。
②组织标本,加入Proteinase K混匀后,56℃水浴,直至组织完全裂解,孵育过程中可每隔一段时间颠倒(过夜)
3.1.3 加入200μl Buffer GL,涡旋震荡充分混匀。加入200μl无水乙醇,涡旋震荡充分混匀。
3.1.4 将步骤3所得溶液全部加入到已装入收集管(Collection Tube)的吸附柱(Spin Column DM)中,若一次不能加完溶液,可分多次转入。10,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中。
3.1.5 向吸附柱中加入500μl Buffer GW1(使用前检查是否已加入无水乙醇),10,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中。
3.1.6 向吸附柱中加入500μl Buffer GW2(使用前检查是否已加入无水乙醇),10,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中。
3.1.7 12,000rpm离心2分钟,倒掉收集管中的废液。将吸附柱置于室温数分钟,以彻底晾干。
3.1.8 将吸附柱置于一个新的离心管(自备)中,向吸附柱的中间部位悬空悬空加入50~200μl Buffer GE或灭菌水,室温放置2~5分钟,10,000rpm离心1分钟,收集DNA溶液,-20℃保存DNA。
3.2 DNA修饰
采用康为世纪公司的甲基化DNA检测试剂盒(CW2140),按照说明书具体步骤操作,进行DNA甲基化修饰剂及检测。
操作步骤
3.2.1 取20μl DNA样品,加入到离心管(自备)中,如果样品量不足,用水补至20μl。
3.2.2 向 DNA样品中加入 2.2μl的 M-Dilution Buffer,混匀样品。
3.2.3 42℃水浴30分钟。
3.2.4 向上步得到的样品中,加入220μl配制好的CT Conversion Reagent溶液,混匀,80℃恒温水浴锅中避光孵育60分钟。
3.2.5 向上步溶液中加入480μl M-Buffer PA,温和上下颠倒混匀。
3.2.6 柱平衡:向已装入收集管(Collection Tube)的吸附柱(Spin Column CS)中加入200μl Buffer PS,12,000 rpm离心2分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中。
3.2.7 将步骤5所得溶液全部加入到吸附柱(已装入收集管)中,室温放置2分钟,12,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中。
3.2.8 向吸附柱中加入500μl M-Buffer PA,12,000 rpm离心1分钟,倒掉收集管中的废液,将吸附柱放回收集管中。
3.2.9 向吸附柱中加入650μl M-Wash Buffer(使用前请先检查是否已加入无水乙醇),12,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱放回收集管中。
3.2.10 12,000rpm离心2分钟,倒掉废液,将吸附柱置于室温数分钟,以彻底晾干。
3.2.11 将吸附柱放入一个新的离心管(自备)中,向吸附膜中间位置悬空滴加20ul M-Elution Buffer(pH8.5),室温放置2分钟。12,000rpm离心1分钟收集DNA溶液。
3.2.12 向收集的20ulDNA中加入2.2ul M-Dilution Buffer,室温静止30分钟。
3.2.13 向溶液中加入500ul预冷的无水乙醇颠倒混匀,沉淀30分钟(建议置于-20℃沉淀,过夜沉淀效果更好)。
3.2.14 12,000rpm离心15分钟,轻轻倒掉上清,再用75%乙醇洗涤一次。
3.2.15 12,000rpm离心1分钟,倒掉上清,室温下待乙醇挥发后,加入20μl M-Elution Buffer溶解,DNA置于-20℃保存。
3.3 甲基化特异性PCR
采用康为世纪公司的2×GoldStar Best Master-Mix(含染料),按照说明进行相关操作。
3.4 PCR反应体系(表2)

表2 PCR反应体系
3.5 PCR反应条件(表3)

表3 PCR反应条件
3.6 结果检测
取5ulPCR产物与2ul上样缓冲液充分混匀后,加样至含有溴化乙锭(EB)的2.5%琼脂糖凝胶上,于盛有lxTAE缓冲液的电泳槽内电泳30分钟,电压100V,以凝胶成像分析仪(UVI)观察分析电泳结果
4 统计学处理
采用SPSS13.0软件进行数据分析。计数资料多组间比较采用行χ列表卡方检验,两组间比较采用Fisher’s确切概率法,以P<0.05认为差异有统计学意义,以P>0.05认为差异无显著统计学意义。
结果
1 PCR扩增产物电泳可以出现以上三种结果
①甲基化特异引物扩增出目的条带,而非甲基化特异引物无条带扩出,这种情况为甲基化(图A)。②非甲基化特异性引物扩增出目的条带,而甲基化引物无条带扩出,这种情况为非甲基化(图B)。③两对引物均扩增出目的条带,也属于甲基化(图C)。具

表3 组织中甲基化情况

图3 对照组组织PCR反应物凝胶电泳图N1、N2、N3为三个检测标本
2.2 RASSFIA基因甲基化与喉癌临床病理特征的关系见表4、图2。
2.2.1 性别因素
本研究中,男性48例发生甲基化为32例(66.7%);女性4例发生甲基化为2例(50%),两组差异无统计学意义(P>0.05)
2.2.2 年龄因素
分>60岁和<60岁两个年龄组,两组甲基化发生率为75.1%和55.6%,两组比较差别无统计学意体如图1。

图1 PCR扩增产物图
2 试验结果及分析
2.1 喉癌、癌旁组织及良性肿瘤的RASSF1A甲基化情况
52例喉癌组织、52例癌旁组织及24例对照组织中RASSFIA基因启动子区甲基化的例数分别为34例(65.4%)、4例(7.7%)、0例(0%)。喉癌组甲基化发生率显著高于癌旁组和喉良性肿瘤,差异有显著统计学意义(P<0.05),而癌旁组甲基化发生率与喉良性肿瘤比较,差异无统计学意义(P>0.05)。详见表3、图2,3,4。义(P>0.05)

图2 喉癌组织PCR反应物凝胶电泳图T1、T2、T3为三个检测标本
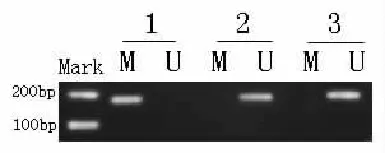
图4 癌旁组织PCR反应物凝胶电泳图1,2,3为三个检测标本
2.2.3 肿瘤分化程度
本研究中,高分化鳞癌,中分化鳞癌及低分化鳞癌分别是组织甲基化率分别是:68.7%,66.7%,57.2%.三组比较无统计学意义(P>0.05)
2.2.4 肿瘤临床分期
本研究中,根据肿瘤分期:I期,II期,III期,IV期甲基化率分别是:68.7%,71.4%,90.0%,91.7%。四组比较无统计学意义(P>0.05)。详见表4。
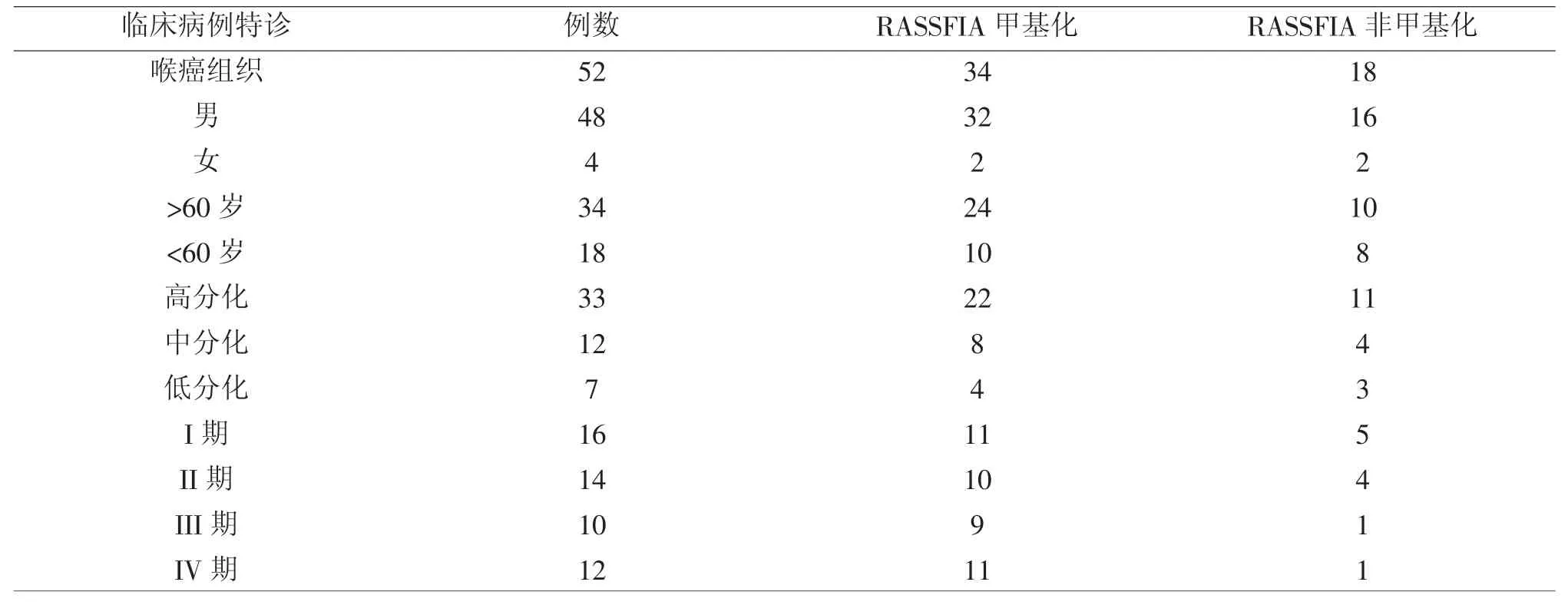
表4 甲基化与临床病理的关系
讨论
DNA甲基化是哺乳动物表观遗传学修饰的一种最重要形式,是DNA复制后调节的最常见方式之一,与胚胎正常发育、细胞定向分化等有关成为现在研究热点[3]。DNA甲基化是由DNA甲基转移酶介导,将S-腺甘甲硫氨酸上的甲基转移到胞嘧啶的C5位的碳原子上,使之变成5一甲基胞嘧啶,这种修饰反映主要发生在基因组DNA的CpG岛上。文献报道儿乎所有的管家基因都含有CpG岛,但是这种CpG岛大部分处于非甲基化状态,如果其发生甲基化,可导致基因表达收到抑制。DNA甲基化抑制基因表达的机制主要如下[4]:①甲基化的胞嘧啶突入DNA双螺旋大沟,影响转录因子与DNA结合。②甲基化CpG可激活阻遏蛋白因子从而抑制转录。③甲基化CpG与甲基化CpG结合蛋白结合有抑制转录的作用[5]。④启动子DNA甲基化与组蛋白去乙酞化之间具有协同抑制基因转录的作用等。大量研究表明,DNA异常甲基化在肿瘤形成中起着重要作用,尤其是抑癌基因的高甲基化导致其转录沉寂,表达失活,基因功能下降甚至丧失,与肿瘤发生、发展关系密切。
目前国内外有大量研究抑癌基因RASSFlA表达缺失及甲基化状态的报道,首先在肺癌中发现了RASSFlA启动子区甲基化及表达缺失[6],随后在乳腺癌、鼻咽癌、卵巢癌、黑色素瘤、膀胱癌、胃癌、肝癌等[7]恶性肿瘤中也发现RASSFlA启动子区甲基化,但其甲基化程度相差较大。Damann等报道:在原发性非小细胞肺癌甲基化比例:72%~78%;Yan等[8]用MSP分析报道乳腺癌中的比率是:49%~6l%; Byun等[9]对150个胃标本(包括15个癌细胞系)进行研究,发现RASSFIA失活约60%;徐婷娟等[10]通过数据分析等到结论:胃癌的病理分型及淋巴结转移与胃癌RASSF1A甲基化有相关性;杨静等[11]发现在喉癌组织中基因RASSFlA的甲基化率为62%,对照组基因无DNA甲基化,许承弼等[12]报道采用MSP方法检测RASSFlA基因在48例喉癌组织、34例发生了甲基化,其甲基化率:70%,说明喉癌的发生、及发展与抑癌基因的启动子区甲基化有关系。本研究应用MSP技术检测52例喉癌组织、癌旁组织及对照组织中RASSFIA基因启动子区甲基化的例数分别65.4%、7.7%、0%,喉癌组甲基化发生率显著高于癌旁组和对照组,差异有显著统计学意义(P<0.05)。而癌旁组甲基化发生率与对照组比较,差异无统计学意义(P>0.05),其结果基本符合前人的研究,提示:喉癌组织中RASSF1A基因启动子区的甲基化,提示其与喉癌发生关系密切,可能是喉癌发生过程中一个重要的分子机制。
Jian等[13]的研究显示在非小细胞肺癌中RASSFIA基因甲基化与性别及临床病理参数无明显相关性(P>O.05)与非小细胞肺癌的组织学类型有关,且发现与肺癌患者的五年生存率明显相关,也就是说RASSFIA基因甲基化是非小细胞肺癌特别是肺腺癌患者不良预后的因素之一。许承弼及杨静研究报告,即:DNA甲基化率与年龄、性别、分化程度、肿瘤T分期,病理类型和有无淋巴转移均不相关。本研究基本符合上诉结果,这说明RASSFlA基因发生甲基化可能是肿瘤发生中的早期事件,喉癌发展的全过程,而不局限于某个分期或分型。
人体外周血、腹水及其他体液如鼻咽癌患者的口、喉漱洗液,子宫内膜癌的阴道分泌物,乳腺癌的乳头分泌物,因其取材比较方便,正在作为新的肿瘤标志物,成为现在研究的热点。1989年Stroun等[14]第一次表明肿瘤患者外周血循环DNA可能具有原发肿瘤DNA的某些特征。马琳等[15]报道正常健康人血液循环DNA RASSFIA基因甲基化的发生率均为0,51例卵巢癌患者血液循环肿瘤RASSFIA甲基化的发生率为43.1%。一些文献证实外周血RASSFIA甲基化在肝癌[16]、肺癌等许多肿瘤的诊断中均有一定的价值,但是对于喉癌外周血的RASSFIA基因甲基化报道很少,对血清RASSFIA的检测很可能有利于喉癌的早期诊断,并有希望成为新型的肿瘤标志物。
综上所述,抑癌基因RASSFIA基因启动子区高甲基化与喉癌的发生密切相关,可能是喉癌早期发展中的一个分子事件。随着对RASSFIA基因研究的深入,患者外周血将RASSFIA启动子区高甲基化作为标志物,结合其他几种甲基化率高的基因,用甲基化特异性PCR法进行联合检测,有利于喉癌的早期诊断,并有希望成为新型的肿瘤标志物。大量文献报道,经甲基化抑制剂5-氮一2脱氧胞苷处理的肿瘤或癌细胞株,RASSF1A重新得以表达,同时肿瘤细胞生长受抑制,凋亡增多,其已应用于临床实验作为常规化疗方案的补充,用于治疗儿童白血病等肿瘤,并取得较好的疗效[17]。故抑制和逆转抑癌基因甲基化为防治肿瘤提供了新的思路,将有广阔的临床应用前景。
1 韩淼,徐志文.喉癌颈部淋巴结转移的临床病例分析.延安大学学报,2010,8(1):56-58.
2 Marioni G,Marchese-Ragona R,Cartei G,et a1.Current opinion in diagnosis and treatment of laryngeal carcinoma.Cancer Treat Rev,2006,32:504-515.
3 Catamotto D,Tommmasi S,Li M,et al.Short hairpin RNA-directed cytosine(GpG)methylation of Hela cells[J]. Mol Ther,2005,12(1):179-183.
4 Rober Son KD,Jones PA.DNA methylation:past,present and future directions[J].Carcinogenesis,2000,21(3):461.
5 Courtier B,Heard E,Auner P,et al.Xce hap lotypes show modified methylation in a region of the actice X chromosome lying-3’to xist[J].proc Natl Acad Sci USA, 1995,92:3531-3535.
6 Damann R,Li C,Yoon JH,et al.Epigenetic inactivation of a a RAS association domain family protein from the lung tumour suppressor Locus 3p21.3[J].Nat Gene,2000, 25(3):315-319.
7 叶婷,於琳,刘靳波,等.RASSF1A基因甲基化与肝细胞癌关系的Meta方差分析.山东医学,2015,55(6):85-88.
8 Yan PS,Shi H,Rahmatpanah F,et al.Diferential distribution of DNA methylation with in the RASSF1A CpG island in breat cancer[J].Cancer Res,2003,63(21):6178-6186.
9 Byun DS,Lee MG,Chae Ks,et al.Freguent igenetici inactivation of RASSF1A by aberrant promoter hypermethylation in human gastic adenocaracinoma[J].Cancer Res, 2001,61(19):7034-7038.
10 徐婷娟,胡世莲,徐维平,等.RASSF1A基因甲基化与胃癌的相关性分析,2013,16(6):609-612.
11 杨静,季文樾,曲亚荣,等.喉癌组织中RASSF1A基因表达缺失与DNA甲基化和组蛋白修饰的关系.中华耳鼻咽喉头颈外科杂志,2011,46(4):308-310.
12 许承弼,李长青,金春顺,等.喉鳞状细胞癌中RASSF1A基因启动子区甲基化及蛋白表达.吉林大学学报,2006, 32(2):326-329.
13 Jian Gu David,Berman.Aberrant Promoter Methylation. Profile and Association with survival in Patients with Non-small cell lung cancer[J].Clin Cancer Res,2006,12 (24):7329-7338.
14 Stroun M,Anker P,Maurice P,et al.Neoplastics of the DNA found in the plasma of cancer patients.Oncology, 1989,46:318-322.
15 Ibanez de Cacers I,Battagli C,Esteller M,et al.Tumor cell-specific BRCA1 and RASSF1A hypermethylation in serum,plasma,and peritoneal fluid from ovarian cancer patients[J].Cancer,2004,64(18):6476-6481.
16 Wang Y,Yuz,Wang T,etal.Indentification of epigenetic aberant promoter methylation of RASSF1A in serum DNA and clinicopathological significance in lunge cancer[J]. Lungr Cancer,2007,56(2):289-294.
17 Endon H,Yatabe Y,Shimizu S,et al.RASSF1A gene inactivation in non-small lung cancer and its clinical implication[J].Int J cancer,2003,106(1):46-51.
(收稿:2016-04-26 修回:2016-08-25)
Experimental study on the relationship between RASSF1A gene promoter methylation status and laryngeal carcinoma
BIE Yuanzhi,SUY Jingwe,LI Wanju
Department of Otorhinolaryngology Head and Neck Surgery,Anhui Provincial Hospital,Affilitiated to Anhui Medical University,Hefei,230001,China
Objective To detect the methylation status of suppressor gene RASSF1A in laryngeal carcinoma tissues and to investigate the relationship between the promoter methylation of RASSF1A and laryngeal carcinoma.Methods The promoter methylation status of RASSF1A gene in Laryngeal carcinoma tissues and corresponding adjacent tissues from 52 patients,and in normal tissues from 24 specimens was detected with methylation specific polymerase chain reaction(MSP).Grouping according to the age,sex,tumor differentiation degree and tumor stage,to analyze the association between the promoter methylation of RASSF1A gene and the clinicopathological features of each group.Results①The positive rate of promoter methylation of RASSF1A gene was significantly higher in laryngeal carcinoma than that in the adjacent tissues and normal controls(65.4%、7.7%、0%,P<0.05),but no significant difference was detected between the adjacent tissues and normal controls.②It was found that the promoter methylation of RASSF1A gene had no correlation with age,sex,tumor differentiation degree and T stage(P>0.05). Conclutions①Promoter methylation of RASSF1A gene presents in laryngeal carcinoma tissue suggests that it might be closely associated with the occurrence of laryngeal carcinoma,which may be an important molecular mechanism in the process of the occurrence of laryngeal carcinoma.②Promoter methylation degree of RASSF1A gene had no correlation with the differentiation degree and T stage,suggesting that it may be an early event in the occurrence of laryngeal carcinoma.③The detection of RASSF1A promoter methylation might become an important molecular marker for the early diagnosis of laryngeal carcinoma.MSP is a fast and sensitive method for methylation detection in the promoter region,which may be used in clinical diagnosis of laryngeal carcinoma.
laryngeal carcinoma;RASSF1A gene;Methylation;Methylation spcific polymerase chain rection(MSP)
10.16542/j.cnki.issn.1007-4856.2016.05.004
1安徽省立医院耳鼻咽喉头颈外科(合肥,230001)
孙敬武,主任医师.Email:entsunjingwu@hotmail.com

