EGFR和KRAS基因状态对肺癌脑转移放疗敏感性的影响
华丽,覃莉,岳海英,黄东宁
(广西医科大学第四附属医院 肿瘤科,广西 柳州 545005)
·论 著·
EGFR和KRAS基因状态对肺癌脑转移放疗敏感性的影响
华丽,覃莉,岳海英,黄东宁
(广西医科大学第四附属医院 肿瘤科,广西 柳州 545005)
目的:探讨表皮生长因子受体(EGFR)/KRAS基因状态与肺癌脑转移放疗敏感性的关系,选出放疗优势人群,为临床个体化治疗提供参考。方法:回顾性分析我院收治的非小细胞肺癌脑转移患者121例,所有患者接受全脑放疗[30 Gy·(10f)-1或40 Gy·(20f)-1]及病灶局部推量治疗[20 Gy·(10f)-1],评估不同基因表型对放疗敏感性及颅内疾病无进展生存期的影响。结果:121例患者中50例患者EGFR突变,10例KRAS突变,EGFR突变率为49%(50/102),KRAS突变率为16.7%(10/60)。mtEGFR患者对放疗的反应率明显高于wtEGFR(82%vs44%,P=0.000),mtEGFR患者颅内疾病无进展生存期长于wtEGFR(14个月vs9个月,P=0.000)。对wtEGFR组患者的KRAS基因型进行亚组分析表明,wtEGFR/mtKRAS与wtEGFR/wtKRAS两组间颅内疾病无进展生存期差异无统计学意义(P=0.188)。多因素分析显示,颅外转移病灶状态、脑转移个数、脑转移病灶大小、EGFR状态是颅内疾病无进展生存期的独立预后因素。结论:mtEGFR是非小细胞肺癌脑转移颅内疾病无进展生存期的独立预后因子,较wtEGFR、wtKRAS及mtKRAS有较高的放疗敏感性。
非小细胞肺癌; 脑转移; 放疗; 表皮生长因子受体; KRAS
非小细胞肺癌(NSCLC)是发病率、死亡率最高的恶性肿瘤之一,5年生存率不足15%[1]。而脑转移是最常见的转移部位,也是制约其生存的主要原因。放疗对脑转移的治疗反应率为50%~75%,是脑转移主要的治疗方式。随着分子生物学的发展,一部分肺癌患者的生存状况获得极大改善,中位生存时间可达20~30个月,有效率为70%~80%[2],这归因于酪氨酸激酶区的突变(mtEGFR)对酪氨酸激酶抑制剂(TKI)药物治疗的敏感性[3]。KRAS作为表皮生长因子受体(EGFR)信号转导途径的下游基因,在肺癌患者中突变率为15%~30%[4],其突变被认为是一种预后负相关因子,因为mtKRAS表现出对EGFR- TKI治疗的抵抗性及目前缺乏有效的靶向药物治疗[5- 6]。研究报道在NSCLC脑转移患者中,EGFR/KRAS不同表型与放疗敏感性具有一定的关系,但在预后和预测价值上还存在一定的争议[7- 10]。本研究回顾性分析我院NSCLC脑转移放疗患者的临床资料,以期根据EGFR/KRAS基因状态选出放疗优势人群,为个体化治疗方案制定提供依据。
1 资料与方法
1.1 一般资料
我院2012年8月至2014年10月收治NSCLC脑转移患者121例。所有病例均由病理组织学检查确诊,并经头颅MRI证实有脑转移,其中5例患者病理来源于脑转移病灶手术切除组织,2例同时有脑转移病灶及肺肿物组织病理诊断支持,2例分别来源于肝脏及椎体活检组织诊断。纳入研究的患者1年内均未接受过TKI类药物治疗,所有患者均签署知情同意书。
1.2 治疗方法
所有患者均接受全脑放疗[30 Gy·(10f)-1或40 Gy·(20f)-1]及病灶局部推量治疗[20 Gy·(10f)-1],放疗期间,部分患者根据疾病情况同时给予全身化疗。随访时期截止至2015年12月,随访时间从诊断脑转移开始计算,直至影像学评估颅内病灶进展时间为止。脑转移病灶治疗进展时间从接受脑转移放疗至评估颅内病灶进展时间。
1.3 基因检测
使用人EGFR基因突变定性检测试剂盒以及人KRAS基因突变检测试剂盒,试剂盒购自北京雅康博生物科技有限公司,利用LightCycler®480Ⅱ(Roche公司)检测各个样本中EGFR第18~21个外显子和KRAS第12、13位密码子的基因状态。
1.4 考察指标
(1) 颅内放疗反应率:根据RECIST 1.1指南进行评估。通过放疗前后头颅MR影像学的比较,部分缓解+完全缓解被认为对放疗有反应者。(2) 放疗相关毒性反应:采用不良事件常见术语标准3.0版本评价,记录所发生毒性反应情况,包括骨髓抑制、胃肠道反应、皮疹。
1.5 统计学处理
数据分析使用SPSS 17.0统计学软件,运用Logrank法单因素分析,采用Cox- Regression模型行多因素分析,同时在Kaplan- Meier模型下绘制生存曲线,以P<0.05表示差异具有统计学意义。
2 结 果
中位随访时间为15个月(4~20个月),无一例失访,随访率100%。其中23例死于颅外疾病进展,20例死于颅内疾病进展,9例为非肿瘤相关性死亡。121例患者中50例发生EGFR突变,10例发生KRAS突变,19例未进行EGFR基因分析,61例未进行KRAS基因分析,EGFR突变率为49%(50/102),KRAS突变率为16.7%(10/60)。
mtEGFR患者对放疗的反应率明显高于wtEGFR(82%vs44%,P=0.000),颅内疾病无进展生存期显著长于wtEGFR(14个月vs9个月,P=0.000),见图1。3例患者同时存在EGFR与KRAS突变。对wtEGFR患者行KRAS基因状态亚组分析,结果表明,wtEGFR/mtKRAS与wtEGFR/wtKRAS组间颅内疾病无进展生存期无统计学差异(P=0.188),见图2。单因素分析结果显示,年龄、原发灶控制状态、颅外转移病灶状态、脑转移个数、脑转移病灶大小、颅脑放疗期间化疗状态、EGFR及KRAS基因突变状态与颅内疾病无进展生存期相关(P<0.05),见表1。进一步行多因素分析,发现颅外转移病灶状态、脑转移个数、脑转移病灶大小、EGFR状态是颅内疾病无进展生存期的独立预后因素。
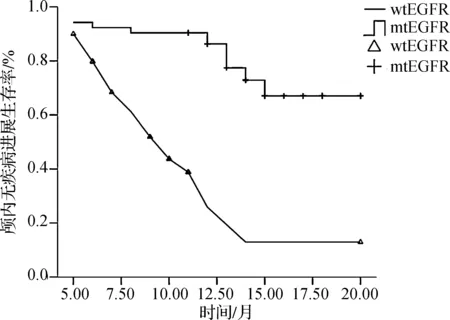
图1 mtEGFR与wtEGFR两组患者颅内疾病无进展生存期比较
Fig 1 Comparison of DFS of intracranial lesions in two groups of patients between mtEGFR and wtEGFR

图2 wtEGFR/mtKRAS与wtEGFR/wtKRAS两组患者颅内疾病无进展生存期比较
Fig 2 Comparison of DFS of intracranial lesions in two groups of patients between wtEGFR/mtKRAS and wtEGFR/wtKRAS
患者均没有出现Ⅲ级及以上放疗相关副反应和治疗相关性死亡。颅脑放疗的不良反应为放疗初期及放疗后期出现的放射性脑水肿,主要表现为头晕、头痛、恶心、呕吐,症状经脱水降颅压和营养脑神经治疗后均好转,此外还可见放射性皮炎及脱发表现。
表1 NSCLC脑转移患者临床资料及其与颅内疾病无进展生存期的关系
Tab 1 Clinical characteristics of patients with non- small cell lung cancer treated with radiotherapy for brain metastases, and their relation with DFS of intracranial lesions

临床参数例数(n=121)颅内疾病无进展生存期/月P值单因素分析多因素分析性别 男7410±4.0 女4711±4.70.204年龄 ≤56岁6411±4.9 >56岁5710±3.60.0190.322吸烟 有7210±4.1 无4911±4.70.349原发灶控制状态 控制4513±5.0 没有控制769±3.30.0010.363原发灶与脑转移出现时间 同时性5610±4.5 异时性6511±4.10.083颅外转移灶 有639±3.6 无5812±4.40.0000.000脑转移个数 ≤3个8712±4.4 >3个348±2.50.0000.000脑转移病灶大小 ≤2cm9011±4.4 >2cm317±3.40.0000.000放疗期间化疗 有7610±3.5 无4513±4.70.0000.480EGFR突变 有5014±3.9 无529±2.8 不清楚198±1.90.0000.000KRAS突变 有108±3.2 无5014±4.9 不清楚619±3.10.0000.122
3 讨 论
全脑放疗可增加血脑屏障通透性,有助于化疗药物进入脑组织[11]。既往对EGFR表型与放疗敏感性关系的研究中,多包含有联合EGFR- TKI的治疗。尽管厄洛替尼对脑脊液的渗透性只有2.5%~13%,吉非替尼为1%~10%[12],但接受脑放疗后,将会提高TKI对血脑屏障的渗透性。体外实验指出TKI能阻止细胞增殖和增强放疗反应[13- 14]。目前TKI对脑部放疗的临床影响作用还不清楚,而联合TKI治疗一定程度上可能会影响EGFR突变对放疗敏感性的分析。本研究入组患者1年内均未接受TKI治疗,有效避免了TKI对突变型表达研究的影响。
本研究结果显示mtEGFR患者脑转移对放疗的反应率及颅内无疾病进展时间均优于wtEGFR患者。Lee等[15]通过常规颅内影像随访显示,mtEGFR患者脑转移的放疗反应率为80%,高于wtEGFR的46%,颅内影像无疾病进展时间亦较野生型明显延长(21个月vs12个月)。Welsh等[16]报道厄洛替尼联合全脑放疗对mtEGFR及wtEGFR的反应率分别为90%、63%。本研究结果还显示EGFR的突变状态是颅内无疾病进展生存独立的预后因素,提示EGFR突变提高NSCLC脑转移患者的放疗敏感性,能使放疗获得更好的颅内局部控制率。体外细胞研究证实EGFR突变与放疗的关系,对于NSCLC,mtEGFR克隆基因接受电离照射后,细胞生存将会比wtEGFR减少500~1 000倍[17];还证实包含T790M突变的细胞株H1975在对吉非替尼产生耐药后,mtEGFR仍对电离辐射产生相似反应,提示mtEGFR的放疗敏感性独立于20号外显子T790M突变[17]。临床上,wtEGFR的NSCLC患者应接受更高剂量的脑部放疗,或配合更激进的脑部治疗,如立体定向放疗或神经外科切除术,而对于经过挑选后的mtEGFR患者,在联合TKI治疗的同时,有望减少脑部放疗剂量,而不会改变局部病灶的控制率。
EGFR突变可提高放疗敏感性,而EGFR过表达与细胞抵抗电离辐射相联系。EGFR突变,使细胞在接受电离照射后失去某些DNA双链断裂修复酶[18],或使这些关键酶(ERCC1)表达水平下调[19],甚至携带有染色体不正常的扩增,或失去细胞周期的调控[17]。然而,EGFR突变型NSCLC常常伴随EGFR基因拷贝数的扩增及蛋白的高表达。放疗诱导的EGFR激活,引起EGFR表达增加,保护肿瘤细胞逃逸凋亡,增加DNA修复能力,导致肿瘤细胞扩散[20]。但Lammering等[21]以腺病毒为载体,将显性失活突变体EGFR- CD533转导入人乳腺癌细胞系MDA- MB- 231,建立裸鼠异体移植肿瘤,通过过表达EGFR- CD533破坏EGFR功能,增强肿瘤对电离辐射的敏感性。对于肿瘤细胞内既有EGFR突变又有EGFR过表达时,两者与放疗相互作用的关系,目前仍没有相关文献报道,EGFR突变对放疗敏感效应可能要大于过表达对放疗抵抗作用,确切结论有待更进一步深入的研究。
本研究对wtEGFR组患者的KRAS基因状态亚组分析表明,wtEGFR/mtKRAS与wtEGFR/wtKRAS两组间颅内疾病无进展生存期差异不显著,提示KRAS状态与wtEGFR一样对放疗反应不敏感。研究认为不同的KRAS氨基酸底物可能以不同方式影响信号通路,或激活不同的信号传导通路,进而引起对放化疗不同的反应或临床行为表现[22]。如KRAS G12C对顺铂反应低,但对紫杉醇和培美曲塞敏感性增强,而G12V则对培美曲塞有更多的治疗抵抗[23]。
本研究不足之处:纳入病例数较少,尤其是病例中有相当一部分患者未接受KARS基因检测,一定程度上影响对放疗关系的分析,且无法对突变亚型做进一步分层分析。此外,患者绝大多数基因检测取材于原发病灶,研究[24]表明,原发病灶与远处转移病灶有存在基因状态不一致的可能,肿瘤异质性、标本类型及检测方法等都可能影响对放疗敏感性的判断。未来应该探索更多驱动基因的状态,了解它们对放疗敏感性的差异,更好地为临床选出放疗获益的优势人群,以制定出更合理的个体治疗方案。
[1] 张胜,曹远东,孙新臣,等.老年Ⅰ期非小细胞肺癌立体定向放疗疗效观察[J].东南大学学报:医学版,2013,32(1):67- 70.
[2] BAEK J H,SUN J M,MIN Y J,et al.Efficacy of EGFR tyrosine kinase inhibitors in patients with EGFR- mutated non- small cell lung cancer except both exon 19 deletion and exon 21 L858R:a retrospective analysis in Korea[J].Lung Cancer,2015,87(2):148- 154.
[3] HAN S W,KIM T Y,HWANG P G,et al.Predictive and prognostic impact of epidermal growth factor receptor mutation in non- small- cell lung cancer patients treated with gefitinib[J].J Clin Oncol,2005,23(11):2493- 2501.
[4] VARGHESE A M,SIMA C S,CHAFT J E,et al.Lungs don’t forget:comparison of the KRAS and EGFR mutation profile and survival of collegiate smokers and never smokers with advanced lung cancers[J].J Thorac Oncol,2013,8(1):123- 125.
[5] ROBERTS P J,STINCHCOMBE T E.KRAS mutation:should we test for it,and does it matter?[J].J Clin Oncol,2013,31(8):1112- 1121.
[6] JOHNSON M L,SIMA C S,CHAFT J,et al.Association of KRAS and EGFR mutations with survival in patients with advanced lung adenocarcinomas[J].Cancer,2013,119(2):356- 362.
[7] RENAUD S,SCHAEFFER M,VOEGELI A C,et al.Impact of EGFR mutations and KRAS amino acid substitution on the response to radiotherapy for brain metastasis of non- small- cell lung cancer[J].Future Oncol,2016,12(1):59- 70.
[8] MAK K S,GAINOR J F,NIEMIERKO A,et al.Significance of targeted therapy and genetic alterations in EGFR,ALK,or KRAS on survival in patients with non- small cell lung cancer treated with radiotherapy for brain metastases[J].Neuro Oncol,2015,17(2):296- 302.
[9] ZHUANG H,YUAN Z,WANG J,et al.Phase II study of whole brain radiotherapy with or without erlotinib in patients with multiple brain metastases from lung adenocarcinoma[J].Drug Des Devel Ther,2013,7:1179- 1186.
[10] SHIN D Y,KIM C H,PARK S,et al.EGFR mutation and brain metastasis in pulmonary adenocarcinomas[J].J Thorac Oncol,2014,9(2):195- 199.
[11] 蒋娅莉,陈海林,沈纲.全脑放疗联合替莫唑胺化疗治疗非小细胞肺癌脑转移的疗效观察[J].现代医学,2015,43(3):285- 288.
[12] BUREL- VANDENBOS F,AMBROSETTI D,COUTTS M,et al.EGFR mutation status in brain metastases of non- small cell lung carcinoma[J].J Neurooncol,2013,111(1):1- 10.
[13] TANAKA T,MUNSHI A,BROOKS C,et al.Gefitinib radiosensitizes non- small cell lung cancer cells by suppressing cellular DNA repair capacity[J].Clin Cancer Res,2008,14(4):1266- 1273.
[14] SATO Y,EBARA T,SUNAGA N,et al.Interaction of radiation and gefitinib on a human lung cancer cell line with mutant EGFR geneinvitro[J].Anticancer Res,2012,32(11):4877- 4881.
[15] LEE H L,CHUNG T S,TING L L,et al.EGFR mutations are associated with favorable intracranial response and progression- free survival following brain irradiation in non- small cell lung cancer patients with brain metastases[J].Radiat Oncol,2012,7:181.
[16] WELSH J W,KOMAKI R,AMINI A,et al.Phase II trial of erlotinib plus concurrent whole- brain radiation therapy for patients with brain metastases from non- small- cell lung cancer[J].J Clin Oncol,2013,31(7):895- 902.
[17] DAS A K,SATO M,STORY M D,et al.Non- small cell lung cancers with kinase domain mutations in the epidermal growth factor receptor are sensitive to ionizing radiation[J].Cancer Res,2006,66(19):9601- 9608.
[18] BANDYOPADHYAY D,MANDAL M,ADAM L,et al.Physical interaction between epidermal growth factor receptor and DNA- dependent protein kinase in mammalian cells[J].J Biol Chem,1998,273(3):1568- 1573.
[19] GANDARA D R,GRIMMINGER P,MACK P C,et al.Association of epidermal growth factor receptor activating mutations with low ERCC1 gene expression in non- small cell lung cancer[J].J Thorac Oncol,2010,5(12):1933- 1938.
[20] SCHMIDT- ULLRICH R K,MIKKELSEN R B,DENT P,et al.Radiation- induced proliferation of the human A431 squamous carcinoma cells is dependent on EGFR tyrosine phosphorylation[J].Oncogene,1997,15(10):1191- 1197.
[21] LAMMERING G,HEWIT T H,HAWKINS W T,et al.Epidermal growth factor receptor as a genetic therapy target for carcinoma cell radiosensitization[J].J Natl Cancer Inst,2001,93(12):921- 929.
[22] IHLE N T,BYERS L A,KIM E S,et al.Effect of KRAS oncogene substitutions on protein behavior:implications for signaling and clinical outcome[J].J Natl Cancer Inst,2012,104(3):228- 239.
[23] GARASSINO M C,MARABESE M,RUSCONI P,et al.Different types of K- Ras mutations could affect drug sensitivity and tumour behaviour in non- small- cell lung cancer[J].Ann Oncol,2011,22(1):235- 237.
[24] SUN L,ZHANG Q,LUAN H,et al.Comparison of KRAS and EGFR gene status between primary non- small cell lung cancer and local lymph node metastases:implications for clinical practice[J].J Exp Clin Cancer Res,2011,30:30.
Effects of genetic alteration in EGFR and KRAS on the radiosensitivity in patients with non- small cell lung cancer with brain metastases
HUA Li,QIN Li,YUE Hai- ying,HUANG Dong- ning
(DepartmentofOncology,theFourthAffiliatedHospitalofGaungxiMedicalUniversity,Liuzhou545005,China)
Objective: To study the effects of genetic alteration in epidermal growth factor receptor(EGFR)and KRAS on the radiosensitivity in patients with non- small cell lung cancer(NSCLC)with brain metastases. Methods: 121 cases of patients with NSCLC were enrolled into this study. All patients were accepted whole brain radiotherapy[30 Gy·(10f)-1or 40 Gy·(20f)-1]and local brain lesions boosted by 20 Gy·(10f)-1. The response rate(RR)and disease progression- free survival(DFS)of intracranial lesions, depending on genomic status of NSCLC were evaluated. Results: A total of 50 patients(49%, 50/102)harbored EGFR mutation(mtEGFR), and 10 patients(16.7%, 10/60)showed KRAS mutation(mtKRAS). RR and DFS were significantly higher for mtEGFR patients compared with wtEGFR patients(P=0.000). Subgroup analysis was carried out by KRAS status in wtEGFR patients, results showed that there was no difference between wtEGFR/mtKRAS patients and wtEGFR/wtKRAS patients in DFS of intracranial lesions(P=0.188). Conclusion: mtEGFR is an independent prognostic factor for DFS of intracranial lesions in NSCLC patients with brain metastases, and mtEGFR patients has higher sensitivity of radiotherapy than wtEGFR, wtKRAS and mtKRAS patients.
non- small cell lung cancer; brain metastases; radiotherapy; epidermal growth factor receptor; KRAS
2016- 05- 12
2016- 09- 14
广西科技攻关项目(1298015- 2- 6)
华丽(1984-),女,广西柳州人,主治医师,医学硕士。E- mail:zhfy2341@126.com
华丽,覃莉,岳海英,等.EGFR和KRAS基因状态对肺癌脑转移放疗敏感性的影响[J].东南大学学报:医学版,2016,35(6):947- 951.
R734.2
A
1671- 6264(2016)06- 0947- 05
10.3969/j.issn.1671- 6264.2016.06.024

