p63、P- gp、GST- π及Topo- Ⅱ在食管鳞癌组织中的表达
杨艳,杜云翔,张闯,韦淑贞
(1.蚌埠医学院,安徽 蚌埠 233000; 2.蚌埠医学院附属解放军八二医院,江苏 淮安 223001)
·论 著·
p63、P- gp、GST- π及Topo- Ⅱ在食管鳞癌组织中的表达
杨艳1,2,杜云翔2,张闯2,韦淑贞2
(1.蚌埠医学院,安徽 蚌埠 233000; 2.蚌埠医学院附属解放军八二医院,江苏 淮安 223001)
目的:观察比较p63、P- 糖蛋白(P- gp)、谷甘胱肽- S- 转移酶π(GST- π)、DNA拓扑异构酶(Topo- Ⅱ)在食管癌中的表达情况,并探讨其关系和临床意义。方法:采用免疫组化方法对168例食管鳞癌组织中p63、P- gp、GST- π、Topo- Ⅱ蛋白进行检测,分析其与病理特征的关系及协同表达的意义。结果:p63、P- gp、GST- π、Topo- Ⅱ蛋白在食管鳞癌中的阳性表达率分别为81.0%、57.1%、71.4%、78.6%。p63的表达与肿瘤的临床分期、浸润深度、淋巴结转移相关(P<0.05),P- gp和TopoⅡ的表达与淋巴转移有关(P<0.05),GST- π的表达与肿瘤分化程度、淋巴结转移有关(P<0.05)。p63的阳性表达与P- gp、GST- π呈正相关(r=0.193、0.197,P<0.05),P- gp与GST- π表达呈正相关(r=0.224,P<0.05),P- gp与TopoⅡ表达呈负相关(r=-0.218,P<0.05)。结论:p63、P- gp、GST- π及Topo- Ⅱ均与食管癌发生发展有关,对肿瘤化疗方案的选择和预后判断有重要的临床意义。
食管鳞癌; 免疫组化; p63; P- 糖蛋白; 谷甘胱肽- S- 转移酶π; DNA拓扑异构酶
食管癌(esophageal cancer,EC)是发生于食管上皮组织的常见恶性肿瘤,我国食管癌的发病率和死亡率均居全球首位,平均5年生存率为仅为10%左右。食管癌主要包括鳞癌和腺癌,我国则以鳞癌为主[1]。化疗是治疗食管癌的主要手段之一,但治疗效果不理想,其中重要症结在肿瘤细胞对化疗药物产生抵抗,形成多药耐药(multidrug resistance,MDR)。MDR的形成又是多种机制共同参与的结果,主要包括P- 糖蛋白(P- gp)、谷甘胱肽- S- 转移酶π(GST- π)过表达及DNA拓扑异构酶(Topo- Ⅱ)低表达等。本研究检测p63和P- gp、GST- π、Topo- Ⅱ蛋白在食管鳞癌中的表达水平,评价其与临床病理特征的关系及其在选择化疗方案时的临床应用价值。
1 资料与方法
1.1 一般资料
选择2012年2月至2015年11月蚌埠医学院附属解放军八二医院心胸外科和肿瘤外科手术切除的食管鳞癌石蜡组织168例,所有标本均有明确的病理诊断。其中男110例,女58例,年龄48~82岁,中位年龄63岁。病理类型均为食管鳞状细胞癌,患者均为首次住院,未进行放、化疗等治疗。食管癌患者临床分期按照2010年AJCC公布的食管癌TNM分期标准:Ⅰ期10例,Ⅱ期126例,Ⅲ期26例,Ⅳ期6例。食管鳞癌分化程度:高分化鳞癌52例,中分化鳞癌92例,低分化鳞癌24例。淋巴结转移情况:发生淋巴结转移者54例,未发生淋巴结转移者114例。浸润深度:浸润未达外膜者124例,浸润达食管外膜者44例。
1.2 实验试剂
鼠人抗p63、P- gp、GST- π、Topo- Ⅱ单克隆抗体及ElivisionTMplus试剂盒等均购自福州迈新生物技术开发有限公司。
1.3 方法
所有食管鳞癌组织石蜡切片按常规进行脱蜡,水化后用ElivisionTMplus法进行免疫组化染色,严格按照试剂盒说明操作。用已知表达的结肠癌组织切片标本作为阳性对照,PBS缓冲液代替一抗作为阴性对照。
1.4 判断标准
组织切片阳性表达判定:P- gp定位于胞浆和胞膜,GST- π定位于胞质,Topo- Ⅱ、p63定位于胞核,在上述部位出现棕黄色反应物为阳性反应。随机观察10个高倍视野,按阳性细胞所占百分比分为:(-),切片中无阳性细胞;(+),阳性细胞数<25%;(++),阳性细胞数25%~50%;(+++),阳性细胞数>50%。便于分析,本实验以(-)、(+)作为阴性表达,(++)、(+++)作为阳性表达。
1.5 统计学处理
采用SPSS 16.0统计软件包进行统计分析,各组间阳性率的比较用χ2检验或Fisher确切概率法,相关分析采用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 p63、P- gp、GST- π、Topo- Ⅱ蛋白在食管鳞癌中的表达
168例食管鳞癌组织中p63、P- gp、GST- π、TopoⅡ蛋白均高表达,阳性率分别为81.0%(136/168)、57.1%(96/168)、71.4%(120/168)、78.6%(132/168)。见图1~4。
2.2 食管鳞癌中p63、P- gp、GST- π、Topo- Ⅱ蛋白表达与临床病理特征的关系
p63蛋白的表达与肿瘤的TNM分期、浸润深度、淋巴结转移相关(P<0.05),与分化程度无关(P>0.05);P- gp和TopoⅡ蛋白的表达仅与淋巴转移有关(P<0.05),与而与其他病理特征无关(P>0.05);GST- π蛋白的表达与分化程度、淋巴结转移有关(P<0.05),与其他病理特征无关(P>0.05)。见表1。
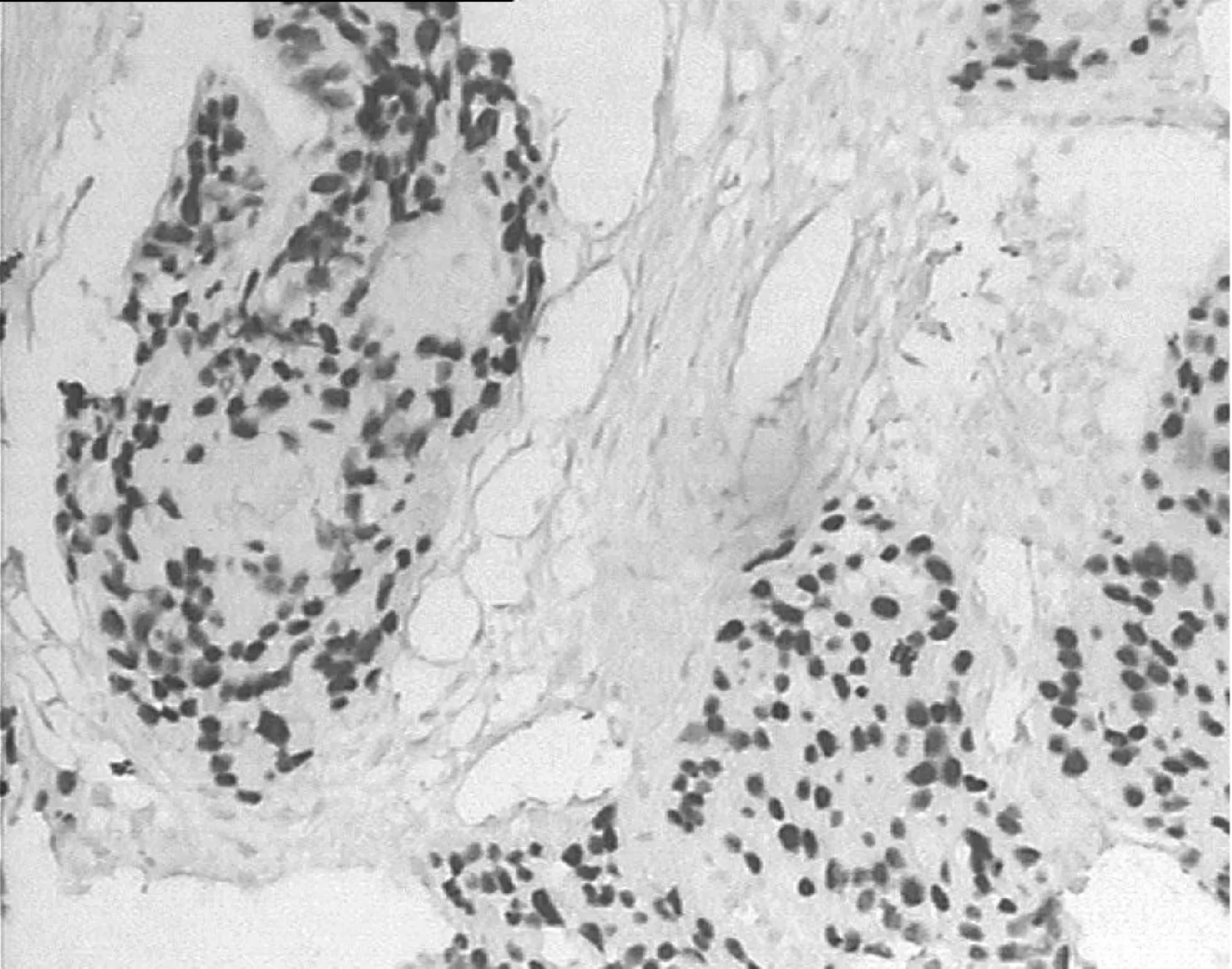
图1 p63在食管鳞癌中的阳性表达 ×200
Fig 1 p63 positive expression in esophageal squamous cell carcinoma ×200
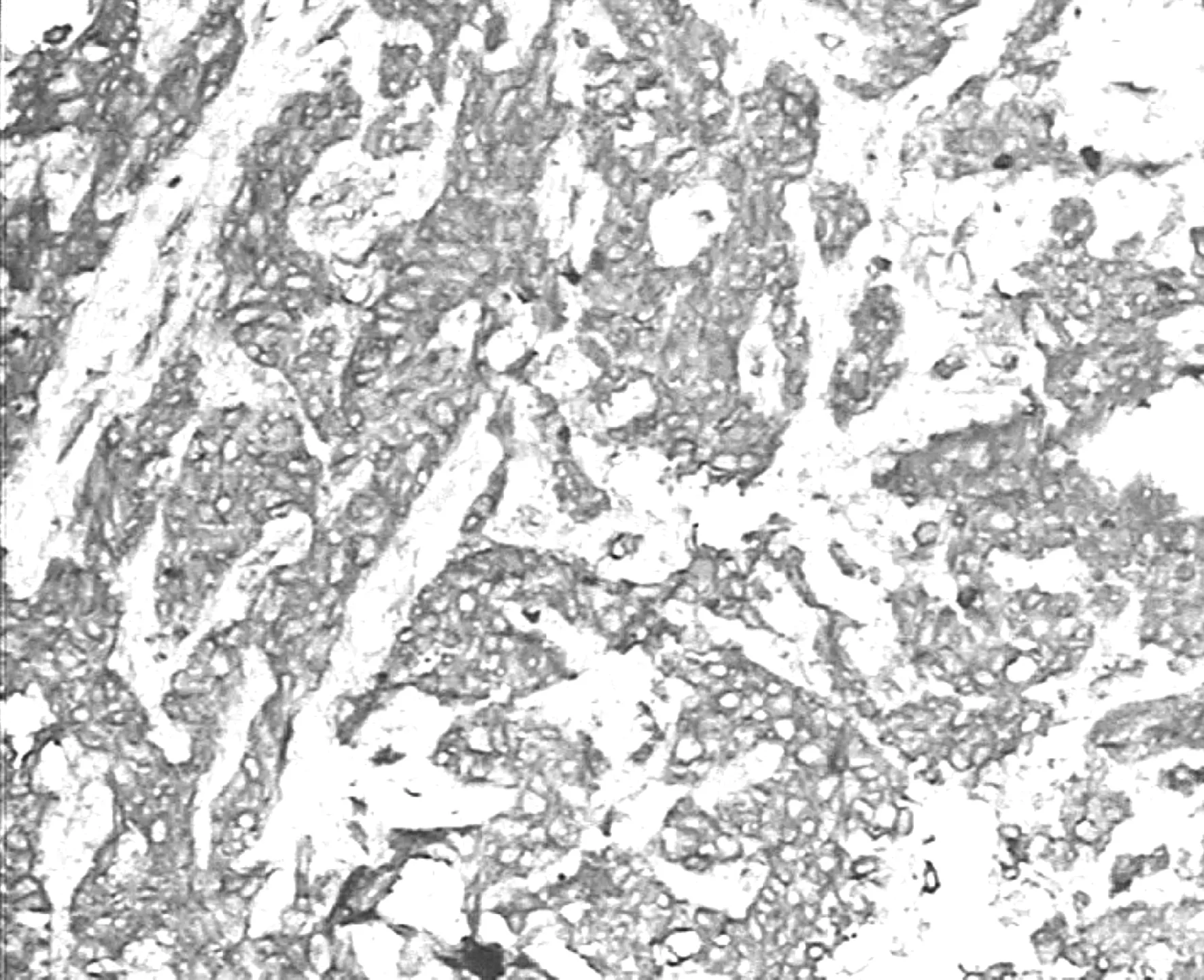
图2 P- gp在食管鳞癌中的阳性表达 ×200
Fig 2 P- gp positive expression in esophageal squamous cell carcinoma ×200

图3 GST- π在食管鳞癌中的阳性表达 ×200
Fig 3 GST- π positive expression in esophageal squamous cell carcinoma ×200
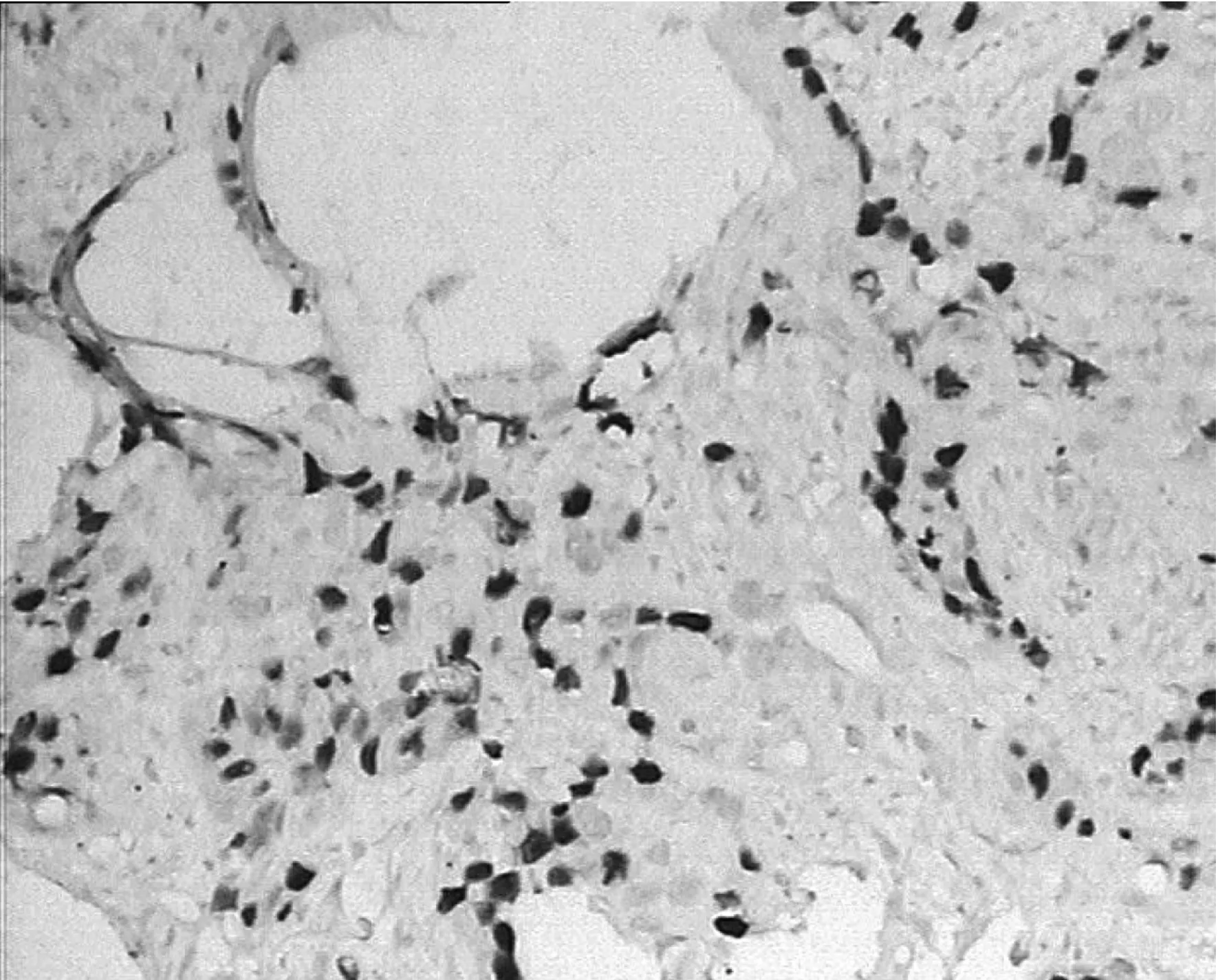
图4 Topo- Ⅱ在食管鳞癌中的阳性表达 ×200
Fig 4 Topo- Ⅱpositive expression in esophageal squamous cell carcinoma ×200
2.3 p63与P- gp、GST- π、Topo- Ⅱ在食管鳞癌组织中的相关性
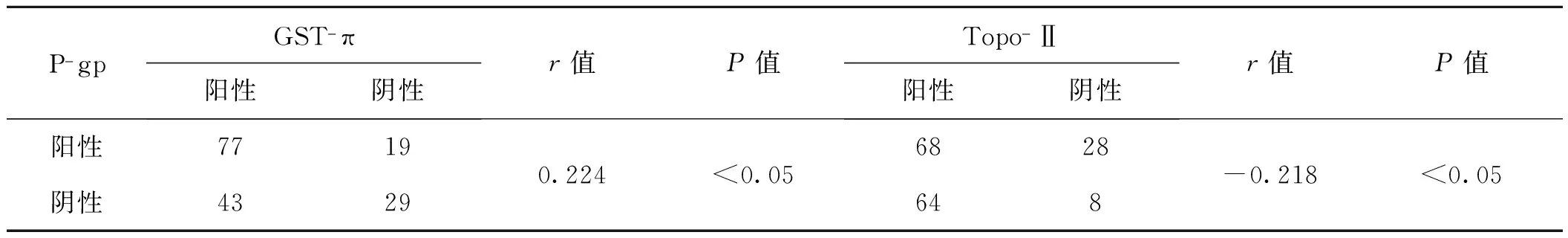
采用Spearman等级分析方法对食管癌组织中的p63与P- gp、GST- π、Topo- Ⅱ蛋白表达相关性进行分析,结果显示p63的表达与P- gp、GST- π呈正相关(r=0.193、0.197,P<0.05),与Topo- Ⅱ不相关(P>0.05),见表2。P- gp与GST- π表达呈正相关(r=0.224,P<0.05),与Topo- Ⅱ表达呈负相关(r=-0.218,P<0.05),见表3。
3 讨 论
食管癌的分期、分化程度、淋巴结转移和浸润深度是影响患者生存预后的重要因素,临床上发现对同一病理特征的患者给予相同治疗方案也会出现不同的效果,这使得病理特征预测预后的价值受到质疑。随着对生物标志物的深入研究和各种新型药物的问世,基因表型越来越受到关注,尤其是耐药基因的表达与临床患者化疗方案的确定、治疗疗效密切相关。目前研究较多的MDR基因为P- gp、GST- π、Topo- Ⅱ等。但在食管鳞癌组织中p63是否与MDR基因表达一致,研究较少。
P- gp是一种膜转运蛋白,在三磷酸腺苷(ATP)的参与下可与阿霉素类、长春新碱、紫杉醇等化疗药的药物分子结合,通过其自身的药泵作用将细胞内化疗药物转运至细胞外,使细胞内药物浓度降低,从而产生耐药[2]。本研究结果显示,P- gp在食管癌患者中阳性表达率为57.1%,在有淋巴结转移者阳性表达率(68.5%)高于无淋巴结转移者(51.8%),两者比较差异有统计学意义(P<0.05),说明食管鳞癌能激活P-gp的表达,对其检测不仅可判断淋巴结转移情况,而且还能预测化疗效果及预后情况。
表1 食管鳞癌p63、P- gp、GST- π、Topo- Ⅱ蛋白表达与临床病理特征的关系
Tab 1 The relation between the expression of p63, P- gp, GST- π, Topo- Ⅱ and clinical pathological features in esophageal squamous cell carcinoma
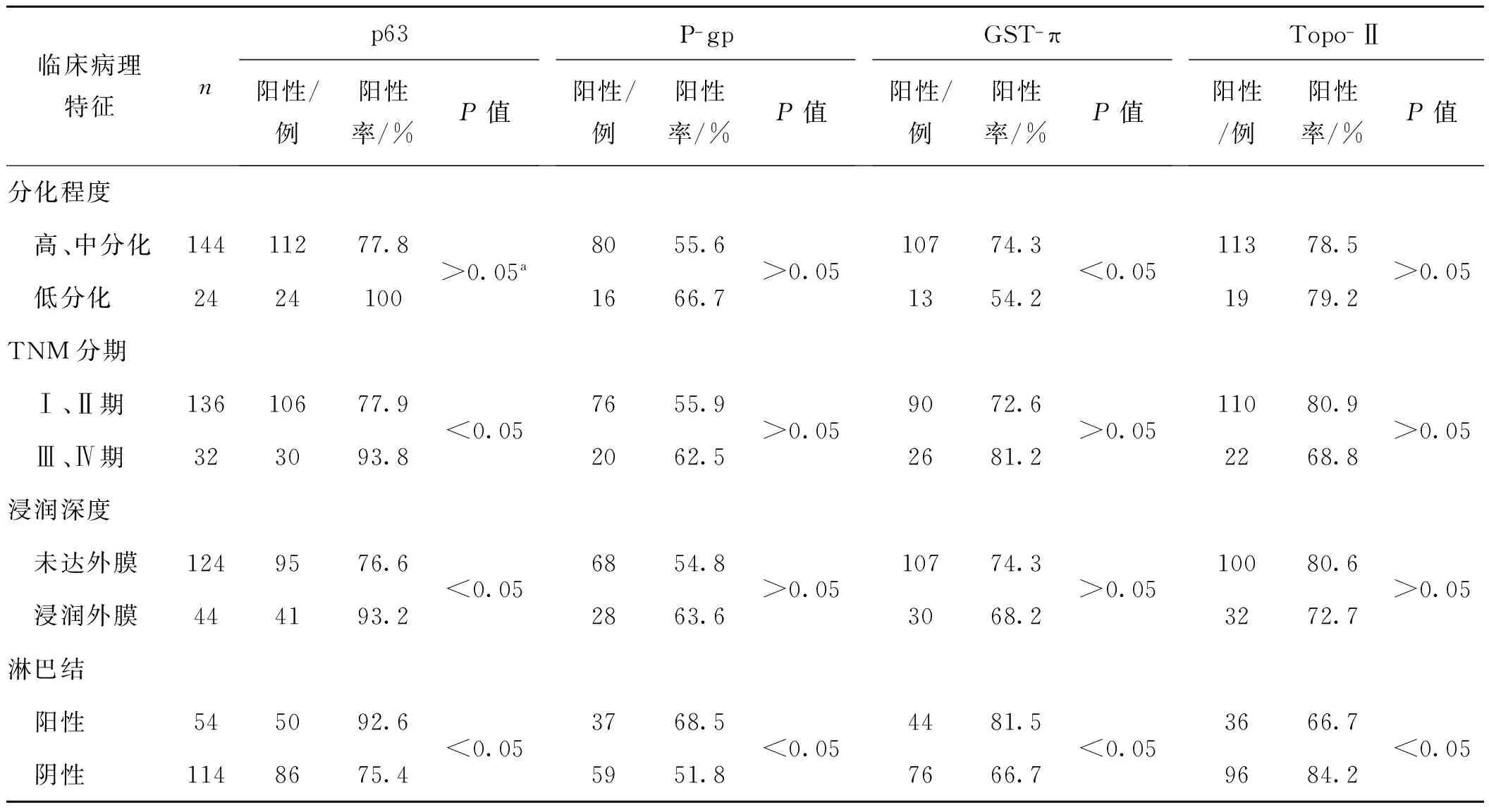
临床病理特征np63阳性/例阳性率/%P值P-gp阳性/例阳性率/%P值GST-π阳性/例阳性率/%P值Topo-Ⅱ阳性/例阳性率/%P值分化程度 高、中分化14411277.8 低分化2424100>0.05a8055.61666.7>0.0510774.31354.2<0.0511378.51979.2>0.05TNM分期 Ⅰ、Ⅱ期13610677.9 Ⅲ、Ⅳ期323093.8<0.057655.92062.5>0.059072.62681.2>0.0511080.92268.8>0.05浸润深度 未达外膜1249576.6 浸润外膜444193.2<0.056854.82863.6>0.0510774.33068.2>0.0510080.63272.7>0.05淋巴结 阳性545092.6 阴性1148675.4<0.053768.55951.8<0.054481.57666.7<0.053666.79684.2<0.05
a Fisher确切概率
表2 食管鳞癌患者p63与P- gp、GST- π、Topo- Ⅱ蛋白表达的相关性 例
Tab 2 The relationship between expression of p63 and P- gp, GST- π, Topo- Ⅱ in esophageal squamous cell carcinoma cases

表3 食管鳞癌患者P- gp与GST- π、Topo- Ⅱ表达的相关性 例
Tab 3 The relationship between expression of P- gp and GST- π,Topo- Ⅱ in esophageal squamous cell carcinoma cases
GST- π具有一定的转运和解毒生理功能,通过催化谷胱甘肽(GSH)与亲电子物质相结合,并与亲脂性细胞毒药物结合增加其水溶性,使药物代谢速度明显加快而产生耐药[3]。GST- π的表达主要与顺铂、阿霉素类、氮芥、环磷酰胺等药物耐药相关。本研究中食管鳞癌组织GST- π阳性表达率为71.4%,提示多数食管癌患者为原发性耐药;低分化鳞癌患者(54.2%)明显低于中、高分化鳞癌患者(74.3%),表明低分化鳞癌患者对化疗较为敏感,与唐郡等[4]研究结果一致,也与临床现象相符;有淋巴结转移者(81.5%)高于无淋巴结转移者(66.7%),且P- gp与GST- π的表达呈正相关关系,这与其他报道[5]相一致,表明P- gp和GST- π之间对MDR有协同作用,同时也是判断食管癌恶性程度和侵袭性较为客观的指标。
Topo- Ⅱ是重要的核酶,参与DNA复制、转录、翻译等生理功能及调节DNA空间构象结构[6]。柔红霉素、阿霉素、依托泊苷等抗癌药物主要通过对Topo- Ⅱ活性的抑制发挥作用,Topo- Ⅱ是肿瘤化疗重要的靶酶,高表达则对抗癌药物敏感,低表达则导致Topo- Ⅱ抑制剂细胞毒作用降低,从而引起MDR。本研究中的Topo- Ⅱ蛋白表达阳性率为78.6%,提示临床上食管癌较少出现Topo- Ⅱ介导的原发性耐药,可选择上述蒽环类、依托泊苷等抗癌药物进行治疗,其中有淋巴结转移者的表达(66.7%)低于无淋巴结转移者(84.2%)(P<0.05),且P- gp与Topo- Ⅱ的表达呈负相关关系,因此,可以认为食管鳞癌患者特别是有淋巴结转移者,对化疗不敏感可能与P- gp高表达和Topo- Ⅱ低表达有关。
p63是p53基因家族的一员,与p53基因具有高度同源性。Yang等[7]发现了p63在人类染色体第3q27- 29,包括TAp63和△Np63两个亚型。TAp63亚型含有类似p53的N端反式转录激活区域,能反式激活或抑制p53相关靶基因,阻滞细胞周期并诱导细胞凋亡[8]。有研究[9]表明,抑制TAp63的功能有助于化疗耐药。△Np63亚型因缺乏此区域不能诱导转录,以显性失活的方式抑制p53或TAp63的活性,起到抗凋亡的作用,同时发挥间接耐药作用。由此,推测p63的表达情况能够预测食管鳞癌对药物敏感性和耐药性。本实验结果显示,p63蛋白的表达与食管癌TNM临床分期、浸润深度及淋巴结转移有关,具有统计学意义(P<0.05),Ⅲ、Ⅳ期者p63蛋白阳性表达率(93.8%)高于Ⅰ、Ⅱ期者(77.9%),侵犯至外膜者p63阳性表达率(93.2%)高于未侵犯外膜者(76.6%),有淋巴结转移者p63阳性表达率(92.6%)明显高于无淋巴结转移者(75.4%)。且p63蛋白与P- gp、GST- π蛋白的表达呈正相关(r=0.193、0.197,P<0.05),与Topo- Ⅱ的表达无相关性(r=-0.106,P>0.05)。表明p63不仅参与食管癌的发生、发展、侵袭和转移,而且与P- gp、GST- π密切相关。可见介导食管鳞癌耐药的并非为独立基因,而是相互联系的,p63与MDR基因联合作用可能是临床上食管鳞癌患者出现MDR的主要原因。
综上所述,p63、P- gp、GST- π、Topo- Ⅱ4种蛋白均能反映食管鳞癌淋巴结转移情况,p63还能反映食管鳞癌临床分期和浸润深度,GST- π则与分化程度有一定关系,而且食管鳞癌的耐药与上述4种蛋白均有一定关系,联合检测它们的表达情况不仅有利于判断食管鳞癌生物学行为及预后,而且有利于判断食管鳞癌耐药情况及指导临床化疗方案的选择。
[1] JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69- 90.
[2] 杜惠惠,任强,刘晓民,等.P- 糖蛋白介导的肿瘤多药耐药机制及其逆转策略[J].中华肺部疾病杂志:电子版,2013,6(6):551- 553.
[3] GRASSILLI E,NARLOCH R,FEDERZONI E,et al.Inhibition of GSK3 B by- pass drug resistance of p53- null colonc carcinomas by enabling necroptosis in response to chemotherapy[J].Clin Cancer Res,2013,19(14):3820- 3831.
[4] 唐郡,阎晓初,彭贵勇,等.食管癌鳞状细胞癌P- gp、GST- π、Topo- Ⅱ的表达及临床意义[J].第三军医大学学报,2007,29(17):1692- 1695.
[5] 陈广灿,洪良利,黄杰雄,等.广东潮汕贲门癌组织中GST- π和P- gp的表达及其临床病理意义[J].癌变·畸变·突变,2016,28(1):36- 40.
[6] 俞鹏飞,徐琪,应杰儿,等.ToPoⅡ、MRP、GST- π 在胃癌组织中的表达及其与预后的关系[J].肿瘤学杂志,2011,17(4):249- 252.
[7] YANG A L,KAGHAD M,WANG Y,et al.p63,a p53 homolog at 3q27- 29,encodes multiple products with transactivating,death- inducing,and dominant- negative activities[J].Mol Cell,1998,2(3):305- 316.
[8] 张超,代红艳,卿晋,等.p63基因的研究进展[J].皮肤病与性病,2012,34(3):142- 144.
[9] MELINO G.p63 is a suppressor of tumorigenesis and metastasis interacting with mutant P53[J].Cell Death Differ,2011,18(9):1487- 1499.
Expression of p63,P- gp,GST- π and Topo- Ⅱ in esophageal squamous cell carcinoma
YANG Yan1,2,DU Yun- xiang2,ZHANG Chuang2,WEI Shu- zhen2
(1.BengbuMedicalCollege,Bengbu233000,China; 2.No.82HospitalofPeople’sLiberationArmySubsidiaryofBengbuMedicalColllege,Huai’an223001,China)
Objective: To observe and compare the expression of p63, P- glycoprotein(P- gp), glutathione S- transferase π(GST- π)and DNA topoisomerase Ⅱ(Topo- Ⅱ)in esophageal squamous cell carcinoma and discuss the relationships and clincal significance. Methods: The expression of p63, P- gp, GST- π and Topo- Ⅱ in 168 patients with esophageal squamous cell carcinoma were detected by immunohistochemistry, analyzing the relationship of clinicpathological characteristics and the meaning of co- expression. Results: The positive rate of p63, P- gp, GST- π and Topo- Ⅱin esophageal squamous cell carcinoma was 81.0%, 57.1%, 71.4% and 78.6%. p63 positive expression was significantly related to the patients’ esophageal clinical stage, invasion degree and lymph node metastasis(P<0.05). The expression of P- gp and Topo- Ⅱ were related to the lymph node metastasis(P<0.05). GST- π was related to the differentiation degree of esophageal cancer tissue and the lymph node metastasis(P<0.05). P- gp and GST- π separately had obviously positive correlation with p63(P<0.05). Positive correlation between the expreesion of P- gp and GST- π was observed(P<0.05), but there was a negative correlation between the expreesion of P- gp and Topo- Ⅱ(P<0.05). Conclusion: p63, P- gp, GST- πand Topo- Ⅱmay probably involve in the tumorigenesis and progress in esophageal squamous cell carcinoma, also might be used in the selection of chemotherapy regimens and in the prognosis of esophageal cancer.
esophageal squamous cell carcinoma; immunohistochemistry; p63; P- glycoprotein; Glutathione S- transferase; DNA topoisomerase Ⅱ
2016- 04- 12
2016- 07- 06
南京军区医学科技创新重点课题(12Z09)
杨艳(1990-),女,安徽阜阳人,在读硕士研究生。E- mail:yangyan1521212@163.com
韦淑贞 E- mail:weiwei8222@163.com
杨艳,杜云翔,张闯,等.p63、P- gp、GST- π及Topo- Ⅱ在食管鳞癌组织中的表达[J].东南大学学报:医学版,2016,35(6):927- 931.
R735.1
A
1671- 6264(2016)06- 0927- 05
10.3969/j.issn.1671- 6264.2016.06.020

