微生物转化灯盏乙素制备野黄芩素的研究
郑晨,沈琪华,董志红,梅建凤,易喻,应国清
微生物转化灯盏乙素制备野黄芩素的研究
郑晨,沈琪华,董志红,梅建凤,易喻,应国清
目的 野黄芩素较其糖苷——灯盏乙素具有更好的生理活性,开发将灯盏乙素转化为野黄芩素的生物转化工艺具有潜在的应用价值。方法 筛选专一性高的微生物菌株,利用其发酵清液作为粗酶液转化灯盏乙素为野黄芩素,优化产酶发酵培养基和转化条件,提高野黄芩素转化得率和产率。结果 筛选到一株黑曲霉 JH-2 菌株,该菌株产酶转化灯盏乙素为野黄芩素的专一性较高,产物降解性弱;优化后的较佳培养基组成为:蔗糖 20 g/L,(NH4)2SO45 g/L,酵母浸出粉 3 g/L,KH2PO41 g/L,MgSO40.5 g/L,FeSO40.01 g/L,pH 6.0;经转化条件优化后,提高了底物浓度和产物得率,在底物浓度为 3 g/L,35 ℃下转化 12 h,野黄芩素的得率可达 93.7%。结论 成功开发了一种简便高效的野黄芩素制备方法,具有一定的应用价值。
生物转化; 黑曲霉菌; 野黄芩素; 灯盏乙素
野黄芩素(scutellarein),又名高黄芩素、黄芩苷元和黄芩黄素等,属黄酮类化合物。野黄芩素的 7-O-β-葡萄糖醛酸苷即灯盏乙素(breviscapine),又名灯盏花乙素、野黄芩苷和黄芩素苷等[1]。灯盏乙素具有抗血小板凝聚、抗脑缺血、抗心肌缺血、松弛血管、抑制细胞增殖、抗高血压、抗氧化和抗糖尿病等药理作用,临床可用于治疗心脑血管疾病、胎儿宫内生长迟缓、肺心病、糖尿病和药物性肝损伤等,医疗用途十分广泛[2-3];并且,灯盏乙素对羟自由基、超氧阴离子和过氧化氢均有良好的清除作用,可能通过抑制氧化应激和增强机体抗氧化防御功能或其他途径来防治糖尿病肾病以及抗 HIV-1[4-5]。但是,灯盏乙素存在溶解性差、生物利用度低、体内半衰期短等问题[6]。近年来对灯盏乙素的体内代谢研究发现,野黄芩素才是灯盏乙素的活性代谢物,具有更强的生物活性,而且它口服易于吸收,体内代谢更稳定,生物利用度是灯盏乙素的 3 倍多[6-7]。因此,近年来对野黄芩素的研究、开发和利用倍受人们关注。
野黄芩素的天然来源较为缺乏,仅存在少数几种植物中,且含量极低[8],难以实现大规模生产;目前已有化学方法全合成野黄芩素[9],但合成步骤较长,收率偏低。相比之下,灯盏乙素在一些植物中含量则较高,如灯盏细辛、小飞蓬、黄芩和侧花黄芩等[1],可以从这些植物中大量获取,因此,可以通过化学或生物方法转化灯盏乙素为野黄芩素。目前,已有这方面的研究报道和专利申请[10-12],但都存在一定的不足,如酸水解法往往对苷元结构造成破坏,分离纯化困难,且转化率低,造成酸排放污染;生物转化法存在底物浓度不高,生产得率低等问题。为了克服目前现有野黄芩素生产方法的不足,本文采用微生物法转化灯盏乙素为野黄芩素(图 1),选择了一株转化能力较高的微生物菌株,经产酶发酵和转化条件优化后,生产效率较现有研究有显著提高。

灯盏乙素 野黄芩素
Figure 1 Scheme of breviscapine to scutellarein by biotransformation
1 材料与方法
1.1 材料
1.1.1 转化菌株 黑曲霉()XW-2(CCTCC M2011358)、MJ(CCTCC M2013329)和 JH-2(CCTCC M2014398)菌株由前期研究实验获得,均保藏于中国典型培养物保藏中心;黑曲霉 ZC03、ZC04、ZC08、ZC11 和 ZC14 菌株从土壤中分离(经 18s rDNA 序列分析鉴定)。
1.1.2 试剂 灯盏乙素标准品购自西安开来生物工程有限公司(批号 K150222,纯度 98%);野黄芩素标准品购自上海源叶生物科技有限公司(批号 KS0909CB14,纯度 98%);其他试剂均为市售分析纯、色谱纯或生物试剂。
1.1.3 仪器 LC-20AD 高效液相色谱仪为日本岛津仪器有限公司产品;YXQ-LS-70A 高压蒸汽灭菌锅为上海博迅实业有限公司产品;SW-CJ-1BU超净工作台为苏州安泰空气技术有限公司产品;DHP-9402 恒温培养箱为上海一恒科学仪器有限公司产品;HWY-2112 恒温振荡培养箱为上海智城分析仪器制造有限公司产品。
1.1.4 培养基 平板培养基采用马铃薯琼脂培养基(PDA),种子培养基采用马铃薯液体培养基(PDB)[13];初始产酶培养基的组成:蔗糖 10 g/L,(NH4)2SO43 g/L,酵母浸出粉 2 g/L,KH2PO41 g/L,MgSO40.5 g/L,FeSO40.01 g/L,pH 6.0。所有培养基经 121 ℃高压蒸汽灭菌 20 min。
1.2 方法
1.2.1 微生物培养 菌种筛选时,挑取各菌株孢子直接接种 50 ml 产酶培养基;产酶条件优化时,挑取菌株孢子接种 50 ml 种子培养基,于 30 ℃,200 r/min 振荡培养 2 d,再移取种子液 2.5 ml 接种 50 ml 产酶培养基。接种后的产酶培养基于30 ℃,200 r/min 振荡培养 3 d。
1.2.2 灯盏乙素的生物转化 产酶培养结束后,培养物用布氏漏斗抽滤,取 9.5 ml 滤液(粗酶液)于 50 ml 三角瓶中;灯盏乙素用 0.5 ml 甲醇溶解加入粗酶液中,于 30 ℃、200 r/min 振荡转化 8 ~ 12 h。
1.2.3 灯盏乙素和野黄芩素的浓度分析 采用 HPLC 法分析灯盏乙素和野黄芩素浓度,色谱柱为Phenomenex Luna C18 键合硅胶柱(5 μm,250 mm ×4.6 mm)。色谱检测条件:柱温为室温,流动相为体积比 9:1 的甲醇和 0.1% 的磷酸水溶液的混合物,流速 0.8 ml/min,检测波长 335 nm,进样量 20 μl。
转化反应结束后,转化液用 50 ml 乙酸乙酯萃取 2 遍,乙酸乙酯分液于圆底烧瓶中,减压蒸干乙酸乙酯后用 2 ml 甲醇溶解残留物,经适当倍数稀释和 0.45 μm 微孔滤膜过滤后,用 HPLC 分析样品中灯盏乙素和野黄芩素浓度,由相同分析条件下的标准品浓度-峰面积标准曲线计算样品中两者的浓度。
2 结果
2.1 转化菌株的筛选
黑曲霉的产糖苷酶的能力较强,是天然糖苷生物转化常用的菌种,所以选择了 8 株黑曲霉转化灯盏乙素,在底物浓度为 1 g/L,30 ℃下转化 8 h 后,不同菌株发酵制备的粗酶液转化样品中野黄芩素的浓度和转化得率见表 1。

表 1 不同黑曲霉菌株转化灯盏乙素生成野黄芩素的浓度和得率
由表 1 可见,所有菌株均能产酶转化灯盏乙素为野黄芩素,相比之下,JH-2 菌株的转化得率最高,达到 56.9 %。此时,转化体系中还残留大量灯盏乙素,说明底物未被水解成其他化合物,转化专一性良好。进一步优化产酶培养条件和转化条件,转化得率能得以提高。
2.2 产酶培养基主要成分浓度优化
以黑曲霉 JH-2 菌株为转化菌株,在初始产酶培养基的基础上,考察了培养基主要成分的浓度,即蔗糖、(NH4)2SO4和酵母浸出粉的浓度对野黄芩素得率的影响,在底物浓度为 1 g/L,30 ℃下转化 8 h 后,野黄芩素转化得率见图 2、图 3 和图 4。

野黄芩素得率(%)Yield of scutellarein (%)80706050403020 5 10 15 20 25 30 蔗糖浓度(g/L)Concentration of sucrose (g/L)
Figure 2 Effects of sucrose concentration on the yield of scutellarein

野黄芩素得率(%)Yield of scutellarein (%)9080706050 2 3 4 5 6 (NH4)2SO4浓度(g/L)Concentration of (NH4)2SO4 (g/L)
Figure 3 Effects of (NH4)2SO4concentration on the yield of scutellarein

野黄芩素得率(%)Yield of scutellarein (%)95908580757065 1 2 3 4 5 酵母浸出粉浓度(g/L)Concentration of yeast extracts (g/L)
Figure 4 Effects of yeast extracts concentration on the yield of scutellarein
由图 2 可见,当蔗糖浓度提高到 20 g/L 时,野黄芩素的转化得率最高,达到了 72.5%。如蔗糖浓度继续提高,菌体生物量虽然有明显增加,但野黄芩素的转化得率反而降低,这可能是因为菌体生长过旺,一些水解野黄芩素的酶类活性增加,如转化时间较长,野黄芩素就被降解。
由图 3 可见,当 (NH4)2SO4浓度从 2 g/L 增加到 5 g/L 时,野黄芩素的转化得率随 (NH4)2SO4浓度增加而提高,之后便不再增加,所以较佳的(NH4)2SO4浓度为 5 g/L,此时野黄芩素的转化得率为84.4%。
由图 4 可见,酵母浸出粉浓度对野黄芩素的转化得率有显著影响,从 1 g/L 增加到 3 g/L 时,野黄芩素的转化得率随之提高,所以较佳的酵母浸出粉浓度为 3 g/L,此时野黄芩素的转化得率为91.3%。考虑到利用此组成的培养基,野黄芩素的转化得率已经达到 91.3%,所以未对其他成分和 pH 进行优化。经上述优化后培养组成为:蔗糖 20 g/L,(NH4)2SO45 g/L,酵母浸出粉 3 g/L,KH2PO41 g/L,MgSO40.5 g/L,FeSO40.01 g/L,pH 6.0。
2.3 转化温度对野黄芩素得率的影响
酶催化过程需要一个适宜的温度范围,温度偏高或偏低均会影响酶的活力,继而影响反应过程的速度和产物的得率,为此考察了转化温度对野黄芩素得率的影响,在底物浓度为 1 g/L,不同温度下转化 8 h 后,野黄芩素的得率见图 5。
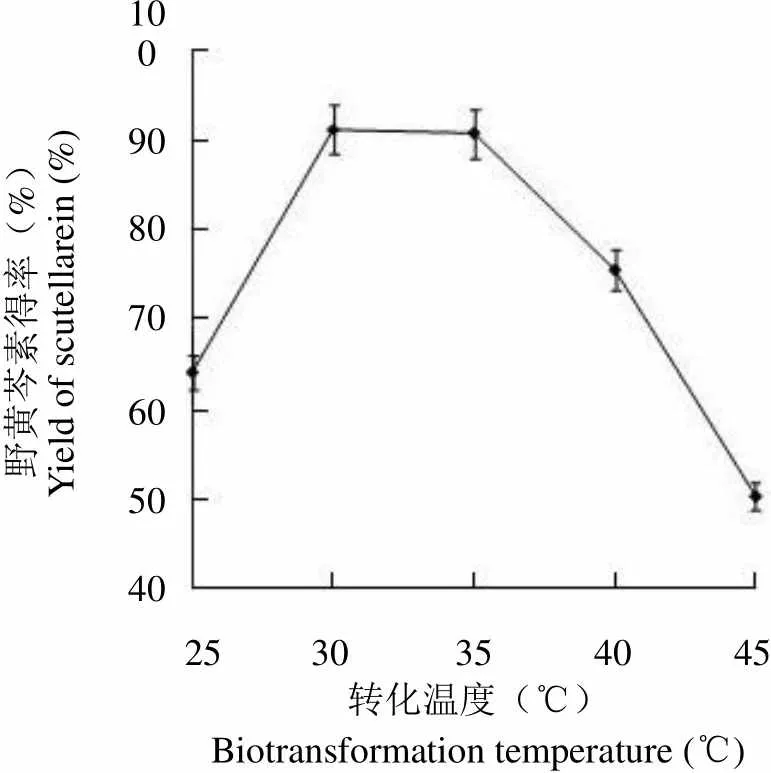
野黄芩素得率(%)Yield of scutellarein (%)100908070605040 25 30 35 40 45 转化温度(℃)Biotransformation temperature (℃)
Figure 5 Effects of biotransformation temperature on the yield of scutellarein
由图 5 可见,转化温度在 30 ~ 35 ℃之间,野黄芩素得率基本稳定,高于或低于这个温度范围,转化得率显著降低。
2.4 底物浓度对野黄芩素得率的影响
为了提高转化产率,对底物灯盏乙素浓度进行了优化,黑曲霉 JH-2 菌株产酶培养制备的粗酶液转化灯盏乙素,在不同底物浓度下,35 ℃下转化 8 h 后,野黄芩素的得率见图 6。
由图 6 可见,随着灯盏乙素浓度的提高,野黄芩素的转化得率逐渐下降。在灯盏乙素浓度 1 ~ 3 g/L 时,野黄芩素的得率下降并不显著,在 3 g/L 时,得率为 83.1%。
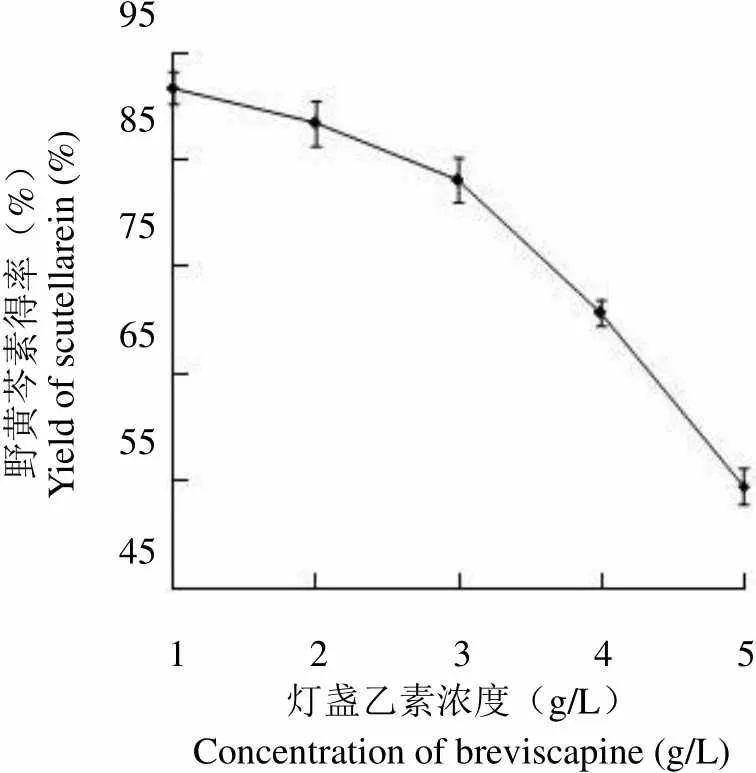
野黄芩素得率(%)Yield of scutellarein (%)958575655545 1 2 3 4 5 灯盏乙素浓度(g/L)Concentration of breviscapine (g/L)
Figure 6 Effects of breviscapine concentration on the yield of scutellarein
2.5 转化时间对野黄芩素得率的影响
在底物浓度提高的情况下,产物的转化得率与转化时间有很大关系,延长转化时间或许能提高转化得率。在底物浓度为 3 g/L,35 ℃条件下,转化时间对野黄芩素得率的影响见图7。
由图 7 可见,随着转化时间的延长,野黄芩素的得率逐渐提高,转化 12 h 时,转化体系中野黄芩素的浓度为 1.74 g/L,转化得率为93.7%;之后则有下降趋势,说明粗酶液中还存在一些野黄芩素的水解酶,转化时间过长则导致野黄芩素的水解。图 8 是灯盏乙素经 12 h 转化后HPLC 分析图谱,可以看出灯盏乙素仅有少量残留,野黄芩素的转化得率较高。
3 讨论
肠道菌群代谢对糖苷类的药效发挥起到重要作用,但并不是所有的糖苷都能被肠道菌分解成苷元而吸收利用。体外生物转化技术的应用,对开发以苷元为药效物质基础的高效制剂具有巨大的应用价值。由于微生物种类繁多、酶系丰富,制备容易等优点,微生物酶源的生物转化在糖苷转化中的应用,是中药生物技术研究领域的一个热点内容。近些年来,中药糖苷成分的体外生物转化研究已有较多报道与应用,如人参皂苷[14],但还有许多糖苷尚未得以研究开发。本文筛选出一株黑曲霉菌株 JH-2,能将灯盏乙素转化为野黄芩素,且专一性良好,经转化工艺优化后,可以获得较高的野黄芩素转化得率,具体工艺流程为:黑曲霉 JH-2 孢子接种 PDB 种子培养基,于 30 ℃,200 r/min 振荡培养 2 d,移取 5% 体积分数的种子液接种产酶培养基。经接种的产酶培养基于 30 ℃,200 r/min 振荡培养 3 d。产酶培养结束后,去除菌体的滤液中加入 3 g/L 的灯盏乙素,于 35 ℃、250 r/min 下转化 12 h,野黄芩素的转化得率可达 93.7%。较佳的产酶培养基组成为:蔗糖 20 g/L,(NH4)2SO45 g/L,酵母浸出粉 3 g/L,KH2PO41 g/L,MgSO40.5 g/L,FeSO40.01 g/L,pH 6.0。本文研究结果对野黄芩素的开发利用提供了新的方向,方法具有工艺简单,生产周期短、副产物少等优点,具有一定的应用前景。

野黄芩素得率(%)Yield of scutellarein (%)100806040200 2 4 6 8 10 12 14 16 转化时间(h)Biotransformation time (h)
Figure 7 Effects of biotransformation time on the yield of scutellarein

时间(min)
Time (min)
1:灯盏乙素和野黄芩素标准品;2:转化 0 h 对照;3:转化 12 h 样品
1: Standard breviscapine and scutellarein; 2: Breviscapine without biotransformation; 3: A sample after biotransformation for 12 h
图 8 生物转化灯盏乙素为野黄芩素 HPLC 分析图谱
Figure 8 HPLC chromatograms of breviscapine and scutellarein after biotransformation
[1] Yan C, Xu GL, Xie M, et al. Research progress on preparation of breviscapine and scutellarin. Chin Traditional Patent Med, 2015, 37(8):1785-1790. (in Chinese)
颜承, 徐冠玲, 谢梦, 等. 野黄芩苷和野黄芩素制备研究进展. 中成药, 2015, 37(8):1785-1790.
[2] Li L, Liu DY, Jiang J, et al. Research progress on pharmacology of breviscapine. Chin Traditional Herbal Drugs, 2006, 37(8):Appendix 9- Appendix 11. (in Chinese)
李丽, 刘东阳, 江骥, 等. 灯盏乙素药理学研究进展. 中草药, 2006, 37(8):附9-附11.
[3] Zhao J, Yang RH, Luo WX, et al. Experimental study on antioxidant activity of scutellarin in vitro. J Kunming Med Univ, 2015, 36(5):1-4. (in Chinese)
赵杰, 杨仁华, 罗文羲, 等. 灯盏乙素体外抗氧化活性的实验研究. 昆明医科大学学报, 2015, 36(5):1-4.
[4] Liu H, Yang XL, Zhou LZ, et al. Study on effects of scutellsrin on scavenging reactive oxygen. J Chin Med Mater, 2002, 25(7):491-493. (in Chinese)
刘宏, 杨祥良, 周林珠, 等. 灯盏花乙素清除活性氧作用的研究. 中药材, 2002, 25(7):491-493.
[5] Hao XH. Studies on the biopharmaceutics and pharmacokinetics of scutellarin in rats. Shenyang: Shenyang Pharmaceutical University, 2005. (in Chinese)
郝秀华. 灯盏乙素大鼠体内生物药剂学与药物动力学研究. 沈阳: 沈阳药科大学, 2005.
[6] Che QM, Pan LY, Chen Y, et al. Study on pharmacokinetics of scutellarein in rats. Chin Pharm J, 2007, 42(18):1418-1421. (in Chinese)
车庆明, 潘丽怡, 陈颖, 等. 灯盏花乙素苷元的药动学研究. 中国药学杂志, 2007, 42(18):1418-1421.
[7] Wang X, Xia H, Liu Y, et al. Simultaneous determination of three glucuronide conjugates of scutellarein in rat plasma by LC-MS/MS for pharmacokinetic study of breviscapine. J Chromatogr B Analyt Technol Biomed Life Sci, 2014, 965:79-84.
[8] Hu YH, Zhang H, Zhang ZF. Determination flavonoids and scutellarin in herbs ofgenus. Chin J Pharm Anal, 2005, 25(1):21-23. (in Chinese)
胡宇慧, 张浩, 张志锋. 飞蓬属多种植物的化学成分含量研究. 药物分析杂志, 2005, 25(1):21-23.
[9] Righi G, Silvestri IP, Barontini M, et al. Efficient synthesis of scutellarein. Nat Prod Res, 2012, 26(14):1278-1284.
[10] Liao XL, Yi D, Zhang M, et al. Preparation of scutellarein by hydrolysis of scutellarin. J Kunming Univ Sci Technol (Sci Technol), 2013, 38(6):102-106. (in Chinese)
廖霞俐, 易东, 张淼, 等. 灯盏花乙素水解制备野黄芩素. 昆明理工大学学报(自然科学版), 2013, 38(6):102-106.
[11] Qiu F, Chen LX, Yang LG, et al. Method for preparing scutellarein by usingAS3.795 for hydrolyzing scutellarin-7-O -glucuronide: China, 201210060469.5. 2012-08-01. (in Chinese)
邱峰, 陈丽霞, 杨立国, 等. 一种利用黑曲霉水解灯盏乙素制备野黄芩素的方法: 中国, 201210060469.5. 2012-08-01.
[12] Liao XL, Yang B, Yi D. Preparation method of scutellarein: China, 201310026336.0, 2013-05-15. (in Chinese)
廖霞俐, 杨波, 易东, 等. 一种野黄芩素的制备方法: 中国, 201310026336.0. 2013-05-15.
[13] Shen P, Chen XD. Microbiology experiment. 4th ed. Beijing: China Higher Education Press, 2007:241. (in Chinese)
沈萍, 陈向东. 微生物学实验. 4版. 北京: 高等教育出版社, 2007:241.
[14] Zhao FY, Chen ZH, Yu H, et al. Advances in studies on microbial transformation of ginsenosides. Chin Med Biotechnol, 2010, 5(3): 216-219. (in Chinese)
赵方允, 陈自宏, 虞泓, 等. 微生物转化人参皂苷研究进展. 中国医药生物技术, 2010, 5(3):216-219.
Microbial transformation of breviscapine to scutellarein
ZHENG Chen, SHEN Qi-hua, DONG Zhi-hong, MEI Jian-feng, YI Yu, YING Guo-qing
Gj
Objective To develop a process for biotransformation of breviscapine to scutellarein for its potential applications in the pharmaceutical industry.Methods Microbial strains were screened for selecting one with high specificity for biotransformation. The medium for producing enzyme and optimization of the biotransformation conditions were carried out to improve the yield and productivity.Results A strain designated as JH-2 was selected from eight strains ofto produce scutellarin with high specificity and low biodegradability. The optimized medium was composed of 20 g/L sucrose, 5 g/L (NH4)2SO4, 3 g/L yeast extracts, 1 g/L KH2PO4, 0.5 g/L MgSO4and 0.01 g/L FeSO4with initial pH at 6.0. After optimization of the biotransformation conditions, the yield reached 93.7% when the concentration of substrate was 3 g/L, and the biotransformation was conducted at 35 ℃ for 12 h.Conclusion The process developed in the study is simple and efficient with potential applications in the pharmaceutical industry.
Biotransformation;; Scutellarein; Breviscapine
MEI Jian-feng, Email: mrion@zjut.edu.cn
10.3969/j.issn.1673-713X.2016.06.007
310014 杭州,浙江工业大学药学院
梅建凤,Email:mrion@zjut.edu.cn
2016-09-23
Author Affiliation: College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China

