治疗感染性疾病抗体药物的概况及趋势
刘方杰,杨光,沈倍奋
治疗感染性疾病抗体药物的概况及趋势
刘方杰,杨光,沈倍奋
感染性疾病是指由致病微生物(细菌、病毒等)侵袭人体,从而引起机体发生一系列感染性临床症状的疾病。感染性疾病涉及范围广,影响全身各个器官和系统,严重威胁着人类的健康和生命。目前对于细菌感染,一般采用抗生素治疗,但是越来越多的耐药性菌株,尤其是超级细菌的出现,抗生素治疗受到了很大的挑战。同时对于病毒引发的感染,目前并无很好的预防和治疗措施。单克隆抗体药物具有特异性高,副作用小等优点,可以通过中和病毒、中和毒素、杀伤感染细胞、吞噬调理作用等多种方式抑制病原微生物感染,受到了越来越多的关注。近年来,抗感染抗体药物研究发展迅速,截止到 2016 年 9 月已经有 25 种抗感染单抗药物正在进行临床研究(表 1)。
2014 年西非埃博拉疫情爆发以来,实验性抗体药物 ZMapp 和中国研制的抗体药物 MIL77 成功用于埃博拉病毒病确诊患者的临床治疗[1-3],凸显了抗体药物在抗感染领域的优势和应用前景,本文将就抗体药物治疗感染性疾病的概况及其发展趋势进行重点综述。
1 单克隆抗体治疗感染性疾病概况
根据靶点不同,可以将抗感染抗体药物分为两类:抗细菌类感染抗体和抗病毒类感染抗体。
1.1 抗细菌类感染抗体
目前抗生素依然是抗细菌感染的主要药物,由于耐药基因的广泛传播,超级细菌不断出现和引发的感染是临床所面临最为棘手问题之一。细菌主要通过其毒素分子杀伤宿主细胞,引发机体感染。因此目前抗细菌类感染抗体药物的作用靶点主要是各种超级细菌和强致病菌分泌的各种毒素和毒素传递系统。
金黄色葡萄球菌是一种重要的革兰阳性致病菌,其能够引发肺炎、心内膜炎、毒素休克综合征和菌血症等一系列致死性感染。临床分离的金葡菌大都对一种或多种抗生素敏感性降低。金葡菌主要是通过分泌各种外毒素来引发机体感染,其中 α 溶血素是其致病的关键毒素。MEDI4893 是 MedImmune 公司研制的全人源 IgG1 单克隆抗体,该抗体以金葡菌分泌的外毒素α 溶血素为靶点,用于治疗金葡菌感染引起的肺炎。在免疫缺陷肺炎小鼠模型中,15 mg/kg 给药组能够有效提高感染小鼠的生存率,降低肺部菌量。当 MEDI4893 与万古霉素或利奈唑胺联合应用时,不仅能够提高小鼠的存活率(联合应用:80% ~ 90%,单独使用抗生素:30% ~ 40%),还能延长抗生素治疗的窗口期[4]。在新西兰白兔模型中,30 mg/kg 给药组能有效降低兔子皮肤的坏死率[5]。KBSA-301 是由 Aridis 公司研制的全人源单克隆抗体,其作用靶点与 MEDI4893 相同,用于治疗金葡菌感染引起的重症肺炎。514G3 是 XBiotech 公司研制的全人抗体,用于治疗耐药金葡菌感染导致的菌血症患者,目前以上抗体都处于 II 期临床试验阶段(https://www.clinicaltrials. gov)。
铜绿假单胞菌(pseudomonas aeruginosa,PA)又称绿脓杆菌,是一种广泛存在的革兰阴性致病菌,也是院内感染最主要的病原体之一。铜绿假单胞菌主要是通过特殊的蛋白分泌系统(包括 III 型和 IV 型分泌系统等),将细菌产生的毒力蛋白分子直接注射到宿主细胞内,干扰宿主细胞的正常功能,进而引发感染。MEDI3902 是由 MedImmune 公司研制的一种双功能抗体,该抗体以铜绿假单胞菌 III 型分泌系统(type III secretion system,TTSS)PcrV 蛋白和 PsI 胞外多糖为作用靶点,用于治疗铜绿假单胞菌引起的肺炎。在急性肺炎小鼠模型中,1 mg/kg 给药组可达 88% 保护率[6]。Kenta Biotech 开发的 panobacumab 是一种全人源单抗,靶点为 011 型铜绿假单胞菌脂多糖。在 II 期临床试验中,18 例 011 型肺炎患者分别于 1、4、7 d 静脉注射 1.2 mg/kg 的 panobacumab 进行辅助治疗,有效缩短治疗时间,并显示出良好的耐受性和安全性[7]。
炭疽杆菌是一种强致病性的革兰阳性菌。炭疽杆菌进入机体后,通过产生毒素而致组织及脏器发生出血性浸润、坏死和高度水肿,形成原发性皮肤炭疽、肠炭疽、肺炭疽等。obiltoxaximab(Anthim)是由 Elusys Therapeutics 公司开发的嵌合抗体。该抗体以炭疽毒素保护性抗原 PA 为靶点,用于治疗吸入式炭疽病。动物试验表明,与安慰剂组相比,obiltoxaximab 注射治疗的动物组有更高比例的动物存活率,obiltoxaximab 联合其他抗菌药物可提高生存率[8-9]。2016 年,美国食品药品监督管理局按照“动物疗效规则”批准该抗体上市[10-11]。
其他在研的抗细菌感染抗体有 Thallion 公司开发的 shigamab,是由两个嵌合单抗 caStx1 和 caStx2 组成的复方抗体,分别以志贺毒素 A、B 为靶点,用于治疗产志贺毒素大肠埃希菌感染及其引起的严重腹泻。Medarex 和 Bristol-Myers squibb 联合开发的 MK-3415A 也是由两个人源化单抗 CDA-1 和 CDA-2 组成的复方抗体,分别靶向艰难梭菌毒素 A 和 B,用于治疗艰难梭菌感染引起的腹泻。
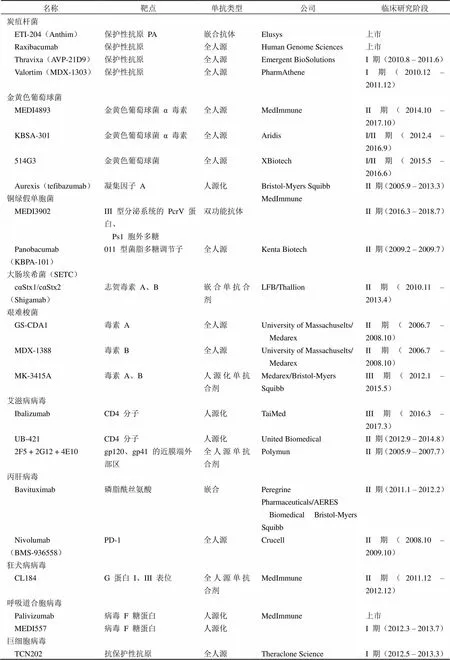
表 1 目前在研的抗细菌及病毒感染单克隆抗体
注:以上数据收集自 https://www.clinicaltrials.gov 网站。
1.2 抗病毒类感染抗体
对于病毒感染,目前并没有很好的预防和治疗措施。病毒主要是通过其表面蛋白与靶细胞膜上的病毒受体分子特异性结合而进入细胞,然后在病毒复制过程中对宿主细胞造成直接或者间接的损伤。抗病毒感染单抗的作用靶点主要是病毒的胞外蛋白或宿主细胞表面的受体分子,其作用机制是阻止病毒进入宿主细胞。
呼吸道合胞病毒(respiratory syncytial virus,RSV)是一种 RNA 病毒,主要感染新生儿和六个月以内的婴儿。感染后主要引起婴幼儿毛细支气管炎和肺炎,而且与婴幼儿哮喘的发病有关。RSV 主要通过其两个膜蛋白 F 和 G 诱导机体产生一系列的免疫反应,从而对机体造成损伤。1998 年,FDA 批准了 MedImmune 公司开发的人源化抗体帕利珠单抗(palivizumab、Synagis)用于预防不足 35 周早产儿的呼吸道合胞病毒感染。Palivizumab 是靶向 F 蛋白的人源化单克隆抗体,是第一个用于临床治疗的抗感染单抗[12]。
MedImmune 公司继 Synagis 后开发了第二代、第三代抗呼吸道合胞病毒抗体莫维珠单抗(motavizumab,Numax)、MEDI557。Motavizumab 可使患者产生荨麻疹等超敏反应,FDA 尚未批准该抗体上市[13]。MEDI557 目前正处于 I 期临床试验阶段。REGN2222[14]是由 Regeneron 研发的全人源抗体,该抗体靶向 RSV 病毒包膜 F 蛋白,目前正处于 III 期临床试验阶段。
人类免疫缺陷病毒(human immunodeficiency virus,HIV)是一种感染人类免疫系统细胞(CD4+T cell)的慢病毒,属于逆转录病毒的一种。HIV 通过破坏人体的 T 淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。HIV 的感染主要是通过病毒外壳蛋白 gp120 三聚体与 CD4 受体以及趋化因子协同受体(CCR5、CXCR4)结合来实现的。2F5、2G12和 4E10 是由 Polymun 公司研制的全人源单抗合剂,该抗体以病毒外壳蛋白 gp120 和 gp41 的近膜端外部区为靶点,用于阻断 HIV 逆转录病毒的传播[15]。目前,该抗体已经完成了 II 期临床研究。Ibalizumab 是由 TaiMed 公司研发的人源化单克隆抗体,该抗体以 CD4 分子为靶点。在 II 期临床试验中,120 名受过常规治疗的 HIV-1 感染患者接受 ibalizumab 为期 24 周的治疗(800 mg/次,每 2 周 1 次或者 2000 mg/次,每 4 周1 次)后,约 30% 的患者检测不到病毒载量,不良反应轻微[16]。
其他在研的抗病毒抗体有Peregrine Pharmaceuticals 和 AERES Biomedical 共同开发的抗丙肝病毒抗体 bavituximab、抗人巨细胞病毒(cytomegalovirus,CMV)感染抗体 TCN202、抗狂犬病病毒抗体 CL184 等。
2 抗感染抗体药物研发趋势
抗感染抗体药物虽然取得了一系列的进展,但是总体而言进展缓慢。至今美国 FDA 批准的 40 余个单抗药物中,用于治疗感染性疾病的只有三个:palivizumab(Synagis)抗呼吸道合胞病毒人源化单抗,raxibacumab(ABThrax)和 obiltoxaximab(Anthim)抗炭疽毒素 PA 抗原的人源单抗。很多抗感染的抗体如抗金葡菌感染的抗体 pagibaximab 和 aurograb 等,原本是很有希望的候选药,但均由于缺乏临床疗效,在 III 期临床试验阶段以失败而告终。这主要是因为病原体感染宿主是一个多步骤复杂过程,而人们对感染过程的分子机制研究不足,以及病原体抗原很容易发生变异。为了提高抗体治疗感染性疾病的效果,我们将从糖工程改造抗体、抗体药物与毒素分子偶联、多种抗体联用、新靶点发现四个方面探讨抗感染抗体药物发展的策略和趋势。
2.1 糖工程改造抗体
抗体依赖细胞介导的细胞毒性作用(ADCC)是抗体发挥抗感染功能的主要机制之一。抗体 Fc 段 Asn-297 位点处的核心岩藻糖水平对抗体的 ADCC 效应有很大影响。研究发现,去除核心岩藻糖后,可以增强抗体 Fc 段与 FcR 的结合能力从而能明显提高 ADCC 效应[17],降低抗体的使用剂量。例如,抗埃博拉病毒抗体药物 ZMapp 选择在无岩藻糖修饰的烟草表达系统生产。在非人灵长类动物(恒河猴)染毒模型中(1000 pfu,EBOV),埃博拉病毒感染后 1 h 给予 ZMapp 抗体治疗(给药剂量 16.7 mg/kg,每 4 天给药1 次,共给药 3 次),可达到 100% 保护率。而在相同条件下,CHO 细胞表达的 ZMapp 给药剂量为 50 mg/kg 时,可达到 50% 保护率[18]。
2.2 抗体偶联药物
抗体偶联药物(antibody-drug conjugate,ADC)是指通过体外化学偶联的方法将抗体分子和细胞毒效应分子联合在一起,将抗体的靶向性和药物的强细胞毒性相结合,从而增强抗体的抗感染能力。金葡菌的胞内寄生是导致金葡菌感染难以治愈的重要原因之一。为了清除胞内寄生的金葡菌,Lehar 等[19]将一种利福平类抗生素通过化学键与一种 anti-β-GlcNAC WTA(金黄色葡萄球菌表面的糖类分子)人源单克隆抗体 IgG1 相连。anti-β-GlcNAC WTA 抗体与游离的金黄色葡萄球菌结合,然后通过 Fc 介导的调理吞噬作用进入吞噬细胞内部。在细胞内,抗体与抗生素之间的化学键会在酶的作用下被破坏,于是利福平类抗生素被释放出来并将隐藏在吞噬细胞内的金葡菌杀死。在小鼠感染模型中(尾静脉注射 2 × 107cfu MRSA),感染后 24 h 分别给予 AAC 药物(50 mg/kg,单次给药)和万古霉素(110 mg/kg,一天两次)治疗。实验结果表明,与万古霉素相比,AAC 药物能够更好地清除体内的金黄色葡萄球菌。
2.3 组合抗体
组合抗体是将识别不同表位或不同抗原的多种抗体进行组合,形成一种广谱抗体或者复方抗体来治疗感染性疾病。这种治疗方法也称为鸡尾酒疗法。我们研制的抗埃博拉病毒抗体 MIL77 就是由 MIL77-1、MIL77-2 和 MIL77-3 三种嵌合单克隆抗体组成,它们分别靶向埃博拉病毒 GP 蛋白的 GP2、GP1-C 和 sGP 结构域。通过阻断埃博拉病毒表面抗原 GP 与宿主细胞表面受体相互作用以及介导 ADCC 等免疫效应发挥抗病毒机制。在后续的研究中,我们与加拿大公共卫生局的邱香果教授合作研究发现,MIL77-1 与 MIL77-3 两株抗体联合应用具有良好的保护活性。
在非人灵长类动物(恒河猴)染毒模型中(肌肉注射 1000 × TCID50EBOV/Mak-C05),埃博拉病毒感染后第3 天给予 MIL77 抗体治疗(MIL77-1 和 MIL77-3 2 株抗体按 2:1 混合后,给药剂量 50 mg/kg,每 3 天给药 1 次,共给药 3 次),可达到 100% 保护率[20]。其他多抗体组合的鸡尾酒疗法还有抗 HIV 抗体药物(2F5、2G12 和 4E10 组合制剂)[15]、抗狂犬病毒抗体 CL184[21]等。这些抗体都展现出优于单抗的抗感染活性。
2.4 重组多克隆抗体
重组多克隆抗体就是模拟天然免疫方式,用一个混合的细胞库同时表达针对同一个抗原或不同抗原的多种不同抗体。多克隆抗体联合应用可以产生针对靶抗原的抗体协同作用,这种作用能更有效地调动效应机制,包括调理作用、位阻、中和毒素、凝集或沉淀、ADCC 和 CDC。重组多克隆抗体克服了抗血清和单克隆抗体的缺点,成为治疗复杂疾病,如感染性疾病的安全有效制剂。而且,跟鸡尾酒疗法相比,重组多克隆抗体技术可以实现多个抗体“一批”制备,这大大减轻了产业化的研发压力和经济压力[22]。
Rozrolimupab(Sym001)是由丹麦 Symphogen 公司开发的全人抗 RhD 抗原的重组多克隆抗体,总共由 25 种抗 RhD 抗体组成,主要用于治疗先天性血小板减少性紫癜。61 人参与的 II 期临床试验结果显示,rozrolimupab 可以快速地产生血小板反应,其疗效和安全性与源于血浆的免疫球蛋白产品类似[23]。Symphogen 公司还拥有抗痘苗病毒重组多抗(编号为 Sym002)和抗 RSV重组多抗药物(编号为 Sym003)正在研制中。
2.5 新靶点发现
病原体感染机体后,会通过多种方式来逃避或抵抗机体的免疫系统,从而保证在机体内的生存、繁殖,继而引发感染。采用特异性的抗体药物抑制病原体的免疫逃逸或激活机体免疫系统是治疗感染性疾病的一个重要研究方向。例如,金葡菌感染宿主后会分泌 eLtaS 蛋白,该蛋白通过与补体蛋白 C3b 相互作用减弱了吞噬细胞对金葡菌的吞噬调理作用。我们的研究结果表明,MAE4抗 eLtaS 单克隆抗体通过阻断 eLtaS 介导的免疫逃逸反应,显著降低细菌对机体的感染,为抗金葡菌感染治疗提供了一种新的方法[24]。同时,Gardiner 等[25]的研究结果表明,免疫检查点抑制抗体 nivolumab 通过与 T 细胞表面 PD1 分子相结合,激活了机体的免疫系统,从而发挥抗丙肝病毒感染的效果。目前,nivolumab 治疗慢性丙肝病毒感染已经进入临床 II 期研究。
3 展望
近年来,随着基因工程抗体技术的快速发展,抗感染抗体药物的研发取得了一系列的进展。但是,由于病原体感染机体非常复杂,包括病原体体内的定植、感染等多个过程,这其中有多种病原分子和宿主分子共同参与,而一种抗体通常只能靶向一种分子,同时常规的抗体药物难以进入细胞内和透过血脑屏障等,这都限制了抗感染抗体药物的研发。不过随着病原体感染机制的详细揭示,新的抗感染策略的提出以及抗体研发技术的进一步发展,我们有理由相信抗体药物在抗感染领域有着广阔的应用前景。
[1] Qiu X, Wong G, Audet J, et al. Reversion of advanced Ebola virus disease in nonhuman primates with ZMapp. Nature, 2014, 514(7520): 47-53.
[2] English.news.cn. Chinese drug MIL-77 used to cure British Ebola patient. 2015-04-01 [2016-09-19]. http://news.xinhuanet.com/english/ 2015-04/01/c_134114151.htm.
[3] Smitha Mundasad. British medic declared free of Ebola. BBC News, 2015-03-27 [2016-09-19]. http://www.bbc.com/news/health-32088310.
[4] Hua L, Cohen TS, Shi Y, et al. MEDI4893* promotes survival and extends the antibiotic treatment window in a Staphylococcus aureus immunocompromised pneumonia model. Antimicrob Agents Chemother, 2015, 59(8):4526-4532.
[5] Le VT, Tkaczyk C, Chau S, et al. Acute bacterial skin and skin structure infection: Critical role of alpha-toxin and protective effects of its neutralization by a human antibody. Antimicrob Agents Chemother, 2016, 60(10):5640-5648.
[6] DiGiandomenico A, Keller AE, Gao C, et al. A multifunctional bispecific antibody protects against Pseudomonas aeruginosa. Sci Transl Med, 2014, 6(262):262ra155.
[7] Lu Q, Rouby JJ, Laterre PF, et al. Pharmacokinetics and safety of panobacumab: specific adjunctive immunotherapy in critical patients with nosocomial Pseudomonas aeruginosa O11 pneumonia. J Antimicrob Chemother, 2011, 66(5):1110-1116.
[8] Biron B, Beck K, Dyer D, et al. Efficacy of ETI-204 monoclonal antibody as an adjunct therapy in a New Zealand white rabbit partial survival model for inhalational anthrax. Antimicrob Agents Chemother, 2015, 59(4):2206-2214.
[9] Yamamoto BJ, Shadiack AM, Carpenter S, et al. Obiltoxaximab prevents disseminated bacillus anthracis infection and improves survival during pre- and postexposure prophylaxis in animal models of inhalational anthrax. Antimicrob Agents Chemother, 2016, 60(10): 5796-5805.
[10] Greig SL. Obiltoxaximab: first global approval. Drugs, 2016, 76(7): 823-830.
[11] Kummerfeldt CE. Raxibacumab: potential role in the treatment of inhalational anthrax. Infect Drug Resist, 2014, 7:101-109.
[12] Georgescu G, Chemaly RF. Palivizumab: where to from here? Expert Opin Biol Ther, 2009, 9(1):139-147.
[13] Ramilo O, Lagos R, Sáez-Llorens X, et al. Motavizumab treatment of infants hospitalized with respiratory syncytial virus infection does not decrease viral load or severity of illness. Pediatr Infect Dis J, 2014, 33(7):703-709.
[14] Reichert JM. Antibodies to watch in 2016. MAbs, 2016, 8(2):197-204.
[15] Morris GC, Wiggins RC, Woodhall SC, et al. MABGEL 1: first phase 1 trial of the anti-HIV-1 monoclonal antibodies 2F5, 4E10 and 2G12 as a vaginal microbicide. PLoS One, 2014, 9(12):e116153.
[16] Bruno CJ, Jacobson JM. Ibalizumab: an anti-CD4 monoclonal antibody for the treatment of HIV-1 infection. J Antimicrob Chemother, 2010, 65(9):1839-1841.
[17] Ferrara C, Grau S, Jäger C, et al. Unique carbohydrate-carbohydrate interactions are required for high affinity binding between FcgammaRIII and antibodies lacking core fucose. Proc Natl Acad Sci U S A, 2011, 108(31):12669-12674.
[18] Olinger GG Jr, Pettitt J, Kim D, et al. Delayed treatment of Ebola virus infection with plant-derived monoclonal antibodies provides protection in rhesus macaques. Proc Natl Acad Sci USA, 2012, 109(44):18030-18035.
[19] Lehar SM, Pillow T, Xu M, et al. Novel antibody-antibiotic conjugate eliminates intracellular S. aureus. Nature, 2015, 527(7578):323-328.
[20] Qiu X, Audet J, Lv M, et al. Two-mAb cocktail protects macaques against the Makona variant of Ebola virus. Sci Transl Med, 2016, 8(329):329ra33.
[21] Bakker ABH, Python C, Kissling CJ, et al. First administration to humans of a monoclonal antibody cocktail against rabies virus: safety, tolerability, and neutralizing activity. Vaccine, 2008, 26(47):5922- 5927.
[22] Rasmussen SK, Rasmussen LK, Weilguny D, et al. Manufacture of recombinant polyclonal antibodies. Biotechnol Lett, 2007, 29(6):845- 852.
[23] Robak T, Windyga J, Trelinski J, et al. Rozrolimupab, a mixture of 25 recombinant human monoclonal RhD antibodies, in the treatment of primary immune thrombocytopenia. Blood, 2012, 120(18):3670-3676.
[24] Liu Y, Feng J, Lu Q, et al. MAE4, an eLtaS monoclonal antibody blocks Staphylococcus aureus virulence. Sci Rep, 2015, 5:17215.
[25] Gardiner D, Lalezari J, Lawitz E, et al. A randomized, double-blind, placebo-controlled assessment of BMS-936558, a fully human monoclonal antibody to programmed death-1 (PD-1), in patients with chronic hepatitis C virus infection. PLoS One, 2013, 8(5):e63818.
100850 北京,军事医学科学院基础医学研究所
沈倍奋,Email:shenbf0714@163.com
2016-09-20
10.3969/j.issn.1673-713X.2016.06.012

