注射用脑蛋白水解物对大鼠肾上腺嗜铬细胞瘤细胞增殖与MPP+ 诱导的氧化损伤的影响
窦玥莹,刘衡,张娜,刘璐,邓洪斌
注射用脑蛋白水解物对大鼠肾上腺嗜铬细胞瘤细胞增殖与MPP+诱导的氧化损伤的影响
窦玥莹,刘衡,张娜,刘璐,邓洪斌
目的 探究注射用脑蛋白水解物对大鼠肾上腺嗜铬细胞瘤(PC12)细胞增殖与 1-甲基-4-苯基吡啶(MPP+)诱导的细胞氧化损伤的影响,为建立评价脑蛋白水解物活力检测方法提供科学依据。方法 通过 MPP+损伤 PC12 细胞后,采用 MTT 法测定不同厂家、不同浓度的注射用脑蛋白水解物对 PC12 细胞的修复作用,通过测定其吸光度与正常细胞吸光度的比值来计算样品对 PC12 细胞损伤的修复率,以此作为注射用脑蛋白水解物活力考察的指标。同时还对注射用脑蛋白水解物对于 MPP+损伤的不同亚型的PC12 细胞作用进行了研究。结果 注射用脑蛋白水解物作用时间为 48 h、浓度为60 μg/ml 时对 MPP+诱导的PC12 细胞的氧化损伤具有较好保护作用,并且对低分化型的 PC12 细胞具有更明显的保护作用。结论 注射用脑蛋白水解物可促进低分化型 PC12 细胞的增殖,并减轻 MPP+的损伤作用。研究建立的活力测定方法已经被国家标准采纳。
PC12 细胞; MPP+; MTT; 注射用脑蛋白水解物
脑蛋白水解物是从健康的猪脑中提取得到的一种活性肽类水解物,含有多种氨基酸、卵磷脂及脑磷脂等,对于神经系统具有重要的保护作用。脑蛋白水解物能够显著提高使用者的记忆力及注意力,因而临床上常用于阿尔茨海默症(老年痴呆)等神经系统疾病的治疗。目前国内生产注射用脑蛋白水解物的厂家较多,因此需要建立合适的活性检测指标对其进行质量考察[1]。PC12 细胞是大鼠肾上腺髓质嗜铬瘤分化的细胞株,其受体及合成的递质均与中脑多巴胺能神经元十分接近,具有典型的神经细胞特征,因此广泛应用于神经细胞死亡方式和神经毒性损害的研究。目前,在具有神经保护作用的药物筛选中,PC12 细胞模型已得到广泛应用[2]。
目前文献报道较多的 PC12 细胞损伤模型有 H2O2损伤模型和 1-甲基-4-苯基吡啶(MPP+)损伤模型。H2O2化学性质不稳定,遇光、热以及长期存放都容易降解。我们前期的研究中也发现,用 H2O2损伤模型评价注射用脑蛋白水解物活力的结果重现性较差,因此本研究中我们采用 MPP+损伤模型。MPP+为 1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)经神经胶质细胞内的单胺氧化酶 B 催化后产生的有毒阳离子,它可杀死大脑中黑质致密部产生多巴胺的神经细胞[3]。MPP+在引发产生多巴胺神经细胞死亡上具有高度选择性,PC12 细胞上的多巴胺转运蛋白可将 MPP+转运至细胞内,引起线粒体功能的损伤。同时,MPP+还诱导细胞产生大量活性氧簇(ROS),会进一步损伤线粒体并最终导致细胞死亡。因此,MPP+损伤 PC12 细胞模型已成为筛选具有神经保护作用药物的常用模型之一[4]。
本研究采用 MTT 法测定正常组、损伤组及实验组的吸光度值并计算样品对 PC12 细胞损伤的修复率,来研究注射用脑蛋白水解物对 MPP+损伤的 PC12 细胞的保护作用,并以此作为注射用脑蛋白水解物活力考察的指标。
1 材料与方法
1.1 材料
1.1.1 细胞株大鼠肾上腺嗜铬细胞瘤悬浮型、低分化型及高分化型 PC12 细胞株均来自中国科学院细胞库。
1.1.2 药物与试剂 注射用脑蛋白水解物样品为随机购买的各生产企业的市售商品:施普善(进口脑蛋白水解物,批号 224066 、CR9497);河北智同(批号 0131012、0131202、0131216);海南通用(批号 20130814-3、20130906-1);哈尔滨三联(批号 120202D1);山西普德(批号20131014、20131214);广东百科(批号1309042、1309051);广东隆赋(批号 20130712-1);北京四环科宝(批号13102028、13092023);DMEM 培养基、RPMI 1640 培养基、0.25% 胰蛋白酶-EDTA 溶液和青霉素/链霉素溶液均购自美国 Hyclone 公司;马血清购自美国 Gibco 公司;新生胎牛血清购自杭州四季青公司;MPP+和 MTT 购自美国 Sigma 公司;其他试剂均为国产分析纯。
1.1.3 器材及仪器 3111 型 CO2培养箱为美国 Thermo 公司产品;生物安全柜为新加坡 Esco 公司产品;倒置显微镜为日本 Olympus 公司产品;iMark 多波长酶标仪为美国 Bio-Rad 公司产品;单道和多道移液器为德国 Eppendorf 公司产品;96 孔细胞培养板为美国康宁公司产品。
1.2 方法
1.2.1 分组 ①空白对照组,仅加入 DMEM 或 RPMI 1640 完全培养液;②正常细胞组,仅加入 PC12 细胞;③损伤组,在细胞培养体系中仅加入 MPP+;④实验组,在细胞培养体系中先后加入注射用脑蛋白水解物及 MPP+。
1.2.2 细胞培养 大鼠肾上腺嗜铬细胞瘤低分化型 PC12 细胞株,使用含 5% 马血清和 5% 胎牛血清的 DMEM 完全培养液传代培养;高分化型 PC12 细胞株,使用含 10% 胎牛血清的 RPMI 1640 完全培养液传代培养;悬浮型 PC12 细胞株,使用含 2.5% 马血清和 15% 胎牛血清的 RPMI 1640 完全培养液传代培养。
1.2.3 不同浓度 MPP+对细胞增殖的影响 取对数生长期的 PC12 细胞,经胰酶消化后制成细胞悬液,以 5 × 104个/ml 的浓度接种于 96 孔细胞培养板,每孔 100 μl,设置空白对照组、正常细胞组及损伤组,每组3 个复孔。置 37 ℃,5% CO2的无菌培养箱内培养 24 h 后,于损伤组中加入MPP+,使其终浓度分别为 0.25、0.5、0.75、1.0、1.25、1.5 mmol/L。以培养液作为空白对照,于无菌培养箱内培养 24 h。培养结束前 4 h,每孔加入5 mg/ml MTT 溶液 20 μl。结束培养后用 2 ml 注射器吸去上清,每孔加入 150 μl 二甲基亚砜,振荡 10 min 后,于 570 nm 处测定吸光度值。
1.2.4 不同浓度注射用脑蛋白水解物对 MPP+诱导的细胞损伤的影响 接种细胞时设置空白对照组、正常细胞组、损伤组及实验组,每组 3 个复孔,细胞接种方法如 1.2.3。置入 37 ℃,5% CO2的无菌培养箱内培养 24 h 后,实验组中分别加入新鲜配制的不同浓度的注射用脑蛋白水解物(10、30、60、90、120、240 μg/ml)各 100 μl[5],以 DMEM 完全培养液作为空白对照,置于无菌培养箱培养 48 h 后,于实验组和损伤组中加入 3.75 mmol/L 浓度的 MPP+50 μl,使 MPP+的终浓度为 0.75 mmol/L,同时以培养基作为空白对照,于无菌培养箱内培养 24 h。培养结束前 4 h,每孔加入5 mg/ml MTT 溶液 20 μl。培养结束后用 2 ml 注射器吸去上清,每孔加入 150 μl 二甲基亚砜,振荡 10 min 后,于 570 nm 处测定吸光度值。
1.2.5 注射用脑蛋白水解物作用时间的确定 接种细胞时设置空白对照组、正常细胞组、损伤组及实验组,每组 3 个复孔,细胞接种方法如 1.2.3。置入 37 ℃,5% CO2的无菌培养箱内培养 24 h 后,实验组中加入新鲜配制的注射用脑蛋白水解物(60 μg/ml)100 μl,以 DMEM 完全培养液作为空白对照,置于无菌培养箱分别培养 24 和 48 h 后,于实验组和损伤组中加入 3.75 mmol/L 浓度的 MPP+50 μl,使 MPP+的终浓度为 0.75 mmol/L,同时以培养基作为空白对照,于无菌培养箱内培养 24 h。培养结束前 4 h,每孔加入 5 mg/ml MTT 溶液 20 μl。培养结束后用 2 ml 注射器吸去上清,每孔加入 150 μl 二甲基亚砜,振荡 10 min 后,于 570 nm 处测定吸光度值。
1.2.6 注射用脑蛋白水解物对 MPP+诱导的细胞损伤的影响 接种细胞时设置空白对照组、正常细胞组、损伤组及实验组,每组 3 个复孔,细胞接种方法如 1.2.3。置入 37 ℃,5% CO2的无菌培养箱内培养 24 h 后,实验组中加入新鲜配制的不同厂家、不同批次的 60 μg/ml 的注射用脑蛋白水解物 100 μl,以 DMEM 完全培养液作为空白对照。置于无菌培养箱培养 48 h 后,于实验组和损伤组中加入 3.75 mmol/L 浓度的 MPP+50 μl,使 MPP+的终浓度为 0.75 mmol/L,同时以培养基作为空白对照,于无菌培养箱内培养 24 h。培养结束前 4 h,每孔加入 5 mg/ml MTT 溶液 20 μl。结束培养后用 2 ml 注射器吸去上清,每孔加入 150 μl 二甲基亚砜,振荡 10 min 后,于 570 nm 处测定吸光度值。
1.2.7 不同 PC12 细胞亚型对注射用脑蛋白水解物活力测定的影响 12000 个/孔接种悬浮型和高分化型 PC12 于 96 孔板中。置入 37 ℃,5% CO2的无菌培养箱内培养 24 h 后,实验组中加入新鲜配制的 60 μg/ml 的注射用脑蛋白水解物 100 μl,以 RPMI 1640 完全培养液作为空白对照。置于无菌培养箱培养 48 h 后,于实验组和损伤组中加入 3.75 mmol/L 浓度的 MPP+50 μl,使 MPP+的终浓度为 0.75 mmol/L,同时以培养基作为空白对照,于无菌培养箱内培养 24 h。培养结束前 4 h,对于悬浮型 PC12,每孔加入 5 mg/ml MTS 溶液 20 μl,结束培养后振荡混匀于 570 nm 处测定吸光度值;对于高分化型 PC12,每孔加入 5 mg/ml MTT 溶液 20 μl。结束培养后用 2 ml 注射器吸去上清,每孔加入 150 μl 二甲基亚砜,振荡 10 min 后,于 570 nm处测定吸光度值。
以下面两式计算 MPP+损伤率和注射用脑蛋白水解物修复率:
损伤率 =(c–i)/c× 100%
修复率 =(x–i)/(c–i)× 100%。
其中:c为正常细胞组平均吸光度 – 空白对照组平均吸光度;
i为损伤细胞组平均吸光度 – 空白对照组平均吸光度;
x为供试品组平均吸光度 – 空白对照组平均吸光度。
1.3 统计学处理
每次实验至少设置三个重复组,各组内的相对标准差应不超过 15%,以此评价系统适用性。如果检测到一个异常值,只要其他组相对标准差符合计算标准,该异常值可以删除。损伤率为 20% ~ 50% 时,试验成立。
2 结果
2.1 MPP+对细胞增殖的影响
为确定 MPP+损伤 PC12 细胞的最佳浓度,我们在 PC12 细胞中加入不同浓度的 MPP+后,用 MTT 法测定细胞的存活率。由图 1 可知,0.75 mmol/L 浓度的 MPP+溶液作用 PC12 细胞24 h 后,对 PC12 细胞的损伤作用已达最大,损伤率为 50.82%,因此后续实验中选用该浓度的 MPP+进行实验。

损伤率(%)Damage rate (%)6050403020100 0.25 0.50 0.75 1.00 1.25 1.50 MPP+(mmol/L)
Figure 1 Different concentration of MPP+-induced reductions in PC12 cell viability
2.2 注射用脑蛋白水解物对细胞增殖的影响
为确定注射用脑蛋白水解物发挥作用的最佳浓度,我们用不同浓度的脑蛋白水解物处理 PC12 细胞后,加入终浓度为 0.75 mmol/L 的 MPP+,用 MTT 法测定细胞的存活率。由图 2 的结果可知,注射用脑蛋白水解物对 MPP+所致 PC12 细胞的氧化损伤具有保护作用,且当药物浓度为 60 μg/ml 时,对损伤的 PC12 修复作用最为明显,因此后续实验中选取 60 μg/ml 的脑蛋白水解物进行实验。
对比图2和图3可以看出,经过ARIMA模型修正后的预测结果较与单一的BP神经网络预测值具有更高的精度,且洪峰值更接近于径流量的观测值。为检验模型预测精度,选用纳什效率系数(NSE)、洪峰误差百分比以及峰现时差作为模型对径流量模拟的评价指标,其具体公式如下:
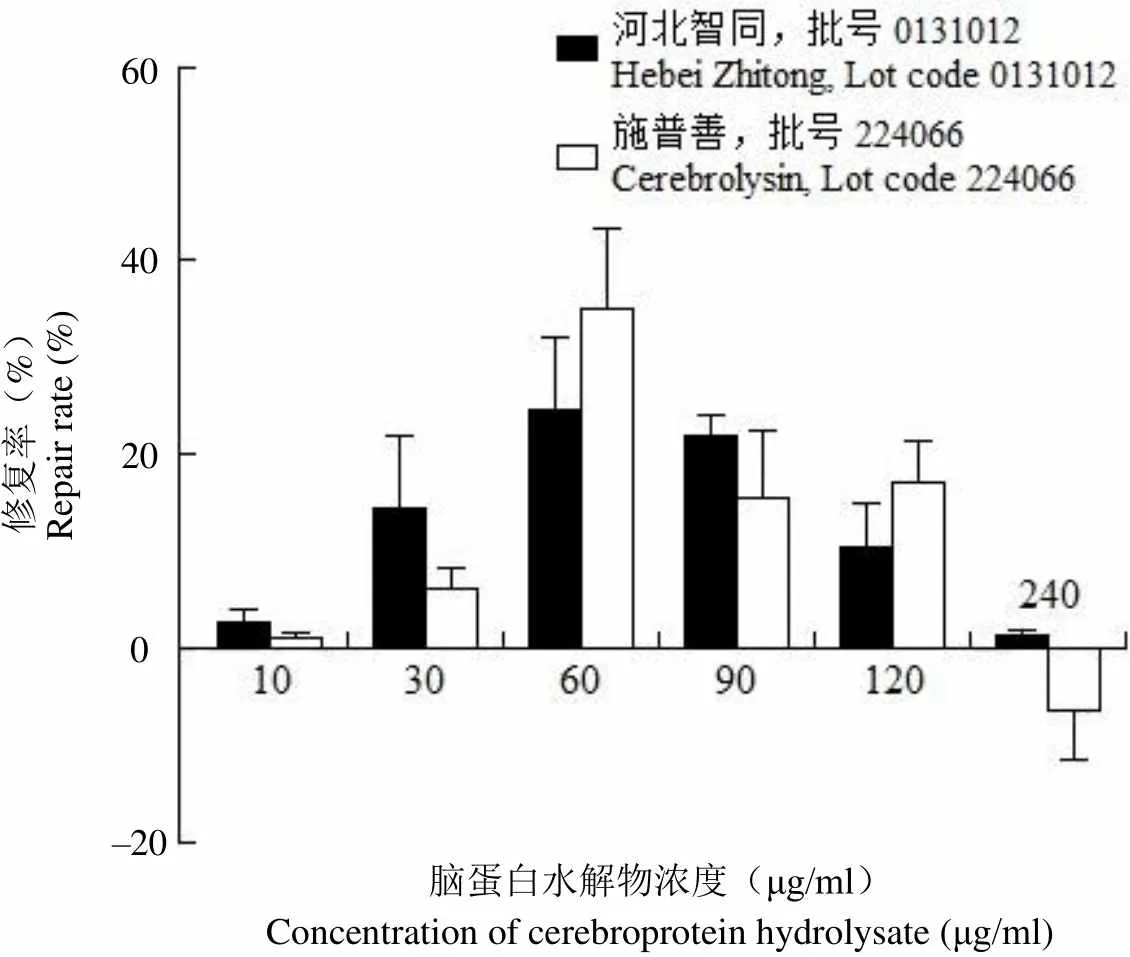
修复率(%)Repair rate (%)6040200–20 脑蛋白水解物浓度(μg/ml)Concentration of cerebroprotein hydrolysate (μg/ml)
Figure 2 Effect of cerebroprotein hydrolysate with different concentration against MPP+-induced reductions in PC12 cell viability
2.3 注射用脑蛋白水解物作用时间的确定
为确定注射用脑蛋白水解物发挥作用的最佳时间,我们用 60 μg/ml 的脑蛋白水解物处理 PC12 细胞 24 或 48 h 后,加入终浓度为 0.75 mmol/L 的 MPP+,用 MTT 法测定细胞的存活率。由图 3 结果可知,注射用脑蛋白水解物作用 48 h 后,对 MPP+损伤 PC12 细胞的修复率要明显好于 24 h 的修复率。因此,我们将脑蛋白水解物对 PC12 细胞修复作用的最佳作用时间确定为 48 h。

修复率(%)Repair rate (%)100500 A1 A2 A3 B1 脑蛋白水解物Cerebroprotein hydrolysate
Figure 3 Effect of cerebroprotein hydrolysate from different time against MPP+-induced reductions in PC12 cell viability
2.4 注射用脑蛋白水解物对 MPP+损伤细胞的影响
通过上述实验我们确定了注射用脑蛋白水解物活力测定方法中的几个关键影响因素:MPP+的使用浓度为 0.75 mmol/L,注射用脑蛋白水解物的使用浓度为 60 μg/ml,作用时间为 48 h。按照上述条件,我们对不同厂家,不同批次的注射用脑蛋白水解物的活力进行了测定。
图 4 的结果说明,MPP+损伤模型可用于评价不同厂家注射用脑蛋白水解物的活性。本次实验采用的是复苏后传至第 3 代的 PC12 细胞,细胞生长尚未到最佳状态,但大多数厂家的注射用脑蛋白水解物对 MPP+损伤 PC12 细胞的修复率都在 30% 以上,而复方氨基酸溶液则没有修复作用。以后随着 PC12 细胞状态的回升,注射用脑蛋白水解物的修复率会进一步上升。
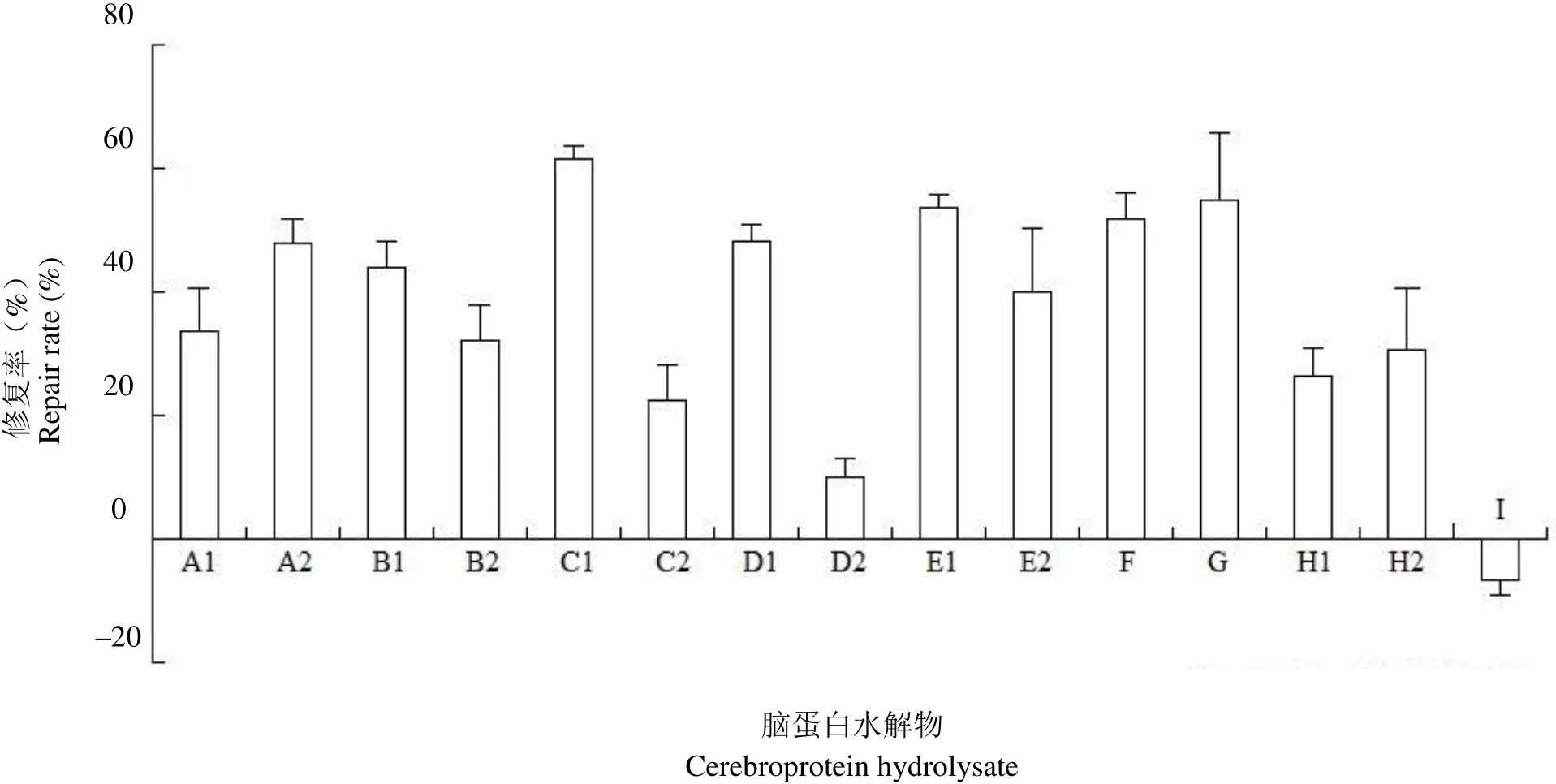
修复率(%)Repair rate (%)806040200–20 脑蛋白水解物Cerebroprotein hydrolysate
Figure 4 Effect of cerebroprotein hydrolysate from different manufacturers against MPP+-induced reductions in PC12 cell viability
2.5 不同 PC12 细胞亚型对注射用脑蛋白水解物活力测定的影响
PC12 细胞除了低分化型外,还有悬浮型和高分化型两种亚型。为了考察后两种 PC12 细胞亚型是否适用于注射用脑蛋白水解物活力评价,我们进行了注射用脑蛋白水解物对悬浮型和高分化型 PC12 细胞损伤修复作用的研究。
由图 5 和图 6结果可知,不同厂家脑蛋白水解物对悬浮型和高分化型的 PC12 细胞的修复率均不理想,因此不宜用于注射用脑蛋白水解物活力测定。

修复率(%)Repair rate (%)151050–5–10–15 脑蛋白水解物Cerebroprotein hydrolysate
Figure 5 Effect of cerebroprotein hydrolysate from different manufacturers against MPP+-induced reductions in floating PC12 cell viability

修复率(%)Repair rate (%)1050–5–10 脑蛋白水解物Cerebroprotein hydrolysate
Figure 6 Effect of cerebroprotein hydrolysate from different manufacturers against MPP+-induced reductions in highly differentiated PC12 cell viability
3 讨论
脑蛋白水解物作为特异性氨基酸及小分子肽复合物,可以通过多种方式改善神经元的代谢,保护神经细胞免受损害[8]。脑蛋白水解物可以穿透血脑屏障,促进神经纤维的生长,调节呼吸链来抵抗细胞的氧化损伤,从而改善脑部细胞的代谢,起到治疗神经退行性疾病的作用[9]。
本研究中我们分别考察了注射用脑蛋白水解物活力测定方法中 MPP+的浓度、脑蛋白水解物的浓度以及作用时间等关键因素,确定了 MPP+损伤模型的具体条件为:PC12 细胞按 5000 个/孔接种至 96 孔板培养 24 h 后,加入 60 μg/ml 的注射用脑蛋白水解物作用 48 h,之后加入终浓度为 0.75 mmol/L 的 MPP+溶液,作用 24 h。同样的实验条件下,我们的研究结果表明,注射用脑蛋白水解物对低分化型 PC12 细胞的活力要明显好于悬浮型或高分化型的 PC12 细胞,可能由于高分化型的 PC12 细胞对于 MPP+有着更高的敏感性,因此活力测定方法模型选用低分化型的 PC12 细胞。本方法选用的低分化型 PC12 细胞来自中国科学院细胞库,为防止其向高分化型转变,培养液中需加入 5% 的马血清[10]。PC12 细胞的状态仍是影响活力测定结果的主要因素之一。刚复苏 2 代内的 PC12 细胞不可用于活力测定,应将细胞多传代几次,待细胞进入对数生长期后再进行活力测定。同时每次实验时建议最好加入阳性药物(如施普善)作为对照,以增加实验结果的准确性[11]。
本研究建立的活力测定方法已经被国家标准采纳[注射用脑蛋白水解物(I),标准编号:WS1-XH-017-2016]。
[1] An L, Han X, Li H, et al. Effects and mechanism of cerebroprotein hydrolysate on learning and memory ability in mice. Genet Mol Res, 2016, 15(3): gmr8804.
[2] Hu T, Liu XY, Guo HB, et al. Comparative study on neuroprotective effects of active componants of several traditional Chinese medicines on H2O2-induced PC12 cells injury. Chin J Clin Pharmacol Ther, 2010, 15(1):53-58. (in Chinese)
胡涛, 刘晓岩, 郭宏宝, 等. 三种中药活性部位对H2O2致PC12细胞损伤保护作用的比较研究. 中国临床药理学与治疗学, 2010, 15(1):53-58.
[3] Chen AH, Zhang P, Yin WL, et al. Role of aldehyde dehydrogenase 2 in 1-methy-4-phenylpyridinium ion-induced aldehyde stress and cytotoxicity in PC12 cells. Neurochem Res, 2014, 39(9):1767-1775.
[4] Farshbaf MJ, Forouzanfar M, Ghaedi K, et al. Nurr1 and PPARγ protect PC12 cells against MPP+, toxicity: involvement of selective genes, anti-inflammatory, ROS generation, and antimitochondrial impairment. Mol Cell Biochem, 2016, 420(1-2):29-42.
[5] Jiang YH, Liang WY. Effects of cerebroprotein hydrolysate for injection on PC12 pheochromocytoma cells proliferation and oxidative damage. China Med Herald, 2011, 8(10):30-31. (in Chinese)
蒋玉辉, 梁蔚阳. 注射用脑蛋白水解物对大鼠肾上腺嗜铬细胞瘤细胞增殖与氧化损伤的影响. 中国医药导报, 2011, 8(10):30-31.
[6] Kim GH, Kim JE, Rhie SJ, et al. The role of oxidative stress in neurodegenerative diseases. Exp Neurobiol, 2015, 24(4):325-340.
[7] Wang JJ, Zhang T, Niu DB, et al. Doxycycline-regulated co-expression of GDNF and TH in PC12 cells. Neurosci Lett, 2006, 401(1):142-145.
[8] Zhang DD, Wang XY. Cerebroprotein hydrolysate injection in the treatment of Alzheimer’ disease. China Pharm, 2006, 15(15):27-28. (in Chinese)
张道东, 王秀英. 脑蛋白水解物注射液治疗阿尔茨海默病的临床研究. 中国药业, 2006, 15(15):27-28.
[9] Tapu M, Bicu D, Tapu F, et al. The efficacy of cerebrolysin in vascular dementia. J Neurol Sci, 2009, 283(1-2):286.
[10] Hur J, Jeong HJ, Park J, et al. Chloride channel 4 is required for nerve growth factor-induced TrkA signaling and neurite outgrowth in PC12 cells and cortical neurons. Neuroscience, 2013, 253:389-397.
[11] Li YH, Wu ZZ, Zhang XL, et al. Study on the antagonistic effect of natural cerebrolysin on PC12 cells apoptosis induced by Aβ1-40. Shenzhen J Integrated Traditional Chin West Med, 2010, 20(6):333- 337, 340, cover 3. (in Chinese)
李映红, 吴正治, 张晓丽, 等. 天然脑活素对Aβ1-40诱导PC12细胞凋亡的拮抗作用研究. 深圳中西医结合杂志, 2010, 20(6):333- 337, 340, 封3.
Effects of cerebroprotein hydrolysate injection on PC12 pheochromocytoma cells proliferation and MPP+induced damages
DOU Yue-ying, LIU Heng, ZHANG Na, LIU Lu, DENG Hong-bin
Gj
Objective To study the effects of cerebroprotein hydrolysate injection on the proliferation and MPP+induced damages in rat pheochromocytoma cells (PC12).Methods Cerebroprotein hydrolysate injection was used to protect PC12 cells from MPP+induced damages. The bioactivity of cerebroprotein hydrolysate injection on different PC12 cell subtypes was determined by MTT assay, and the ratio of absorbance denoted its rehabilitation rate. Results With cerebroprotein hydrolysate injection 48 hours pre-treatment, the survival rate of MPP+damaged PC12 cells was increased, and the optimal concentration was 60 μg/ml. Cerebroprotein hydrolysate injection reached better result for poorly differentiated PC12 cells.Conclusion Cerebroprotein hydrolysate injection protects against MPP+-induced reductions in PC12 cell viability and increased proliferation of PC12 cells. Our method has been adopted by Chinese Pharmacopoeia Commission (WS1-XH-017-2016).
PC12 cells; MPP+; MTT; Cerebroprotein hydrolysate for injection
DENG Hong-bin, Email: hdeng@imb.pumc.edu.cn
10.3969/j.issn.1673-713X.2016.06.006
北京协和医学院研究生创新基金(2015-1007-23)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所生化室(窦玥莹、张娜、刘璐、邓洪斌);072656 保定,河北智同生物制药有限公司(刘衡)
邓洪斌,Email:hdeng@imb.pumc.edu.cn
2016-09-29
Author Affiliations: Department of Biochemistry, The Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (DOU Yue-ying, ZHANG Na, LIU Lu, DENG Hong-bin); Hebei Zhitong Pharmaceutical Group Co., Ltd., Baoding 072656, China (LIU Heng)

