神经电生理监测技术联合神经导航技术在大脑中央区病变手术中的应用
蒋佩龙 庆晓东 贡志刚 雒仁玺 林松 兰青
神经电生理监测技术联合神经导航技术在大脑中央区病变手术中的应用
蒋佩龙 庆晓东 贡志刚 雒仁玺 林松 兰青
目的 探讨神经电生理监测技术联合神经导航技术在大脑中央区病变手术治疗中的应用价值。方法 对11例大脑中央区病变患者,在手术中选择性应用神经导航和神经电生理监测技术(头皮体感诱发电位、皮质体感诱发电位、头皮运动诱发电位、头皮直接皮质电刺激)定位功能区,显微操作下切除病灶。结果 术中行神经导航8例(其中4例行基于锥体束成像的功能神经导航);行头皮体感诱发电位监测7例,1例波幅下降,调整操作后恢复;行皮质体感诱发电位监测8例,5例能记录到位相倒置波形或主波渐变波形;行头皮运动诱发电位监测2例,直接皮层刺激共4例,1例能引发肢体运动和(或)肌电反应。病变全部切除8例,近全切除1例,大部分切除2例。术后有8例患者症状改善,3例症状无恶化,所有患者均未出现新发神经功能障碍。结论 在大脑中央区病变手术中,神经电生理监测技术联合神经导航技术可精确定位病灶和重要感觉运动功能区,能有效提高手术效果,保障手术安全,减少术后神经功能缺失。
电生理监测 神经导航 中央区
在大脑中央区病变的手术中,术者常利用颅脑解剖标志凭经验进行大体定位,但由于个体存在差异,这种方法常不准确。基于MRI、CT影像的神经导航可以较为精确地对中央沟及病灶进行解剖学定位,但病变及周边组织的水肿可压迫、推移、侵犯甚至破坏中央前后回及其下传导束而造成脑功能区结构的变异、移位或重塑,使得基于普通神经影像资料的神经导航并不能实现皮质功能区以及皮质下纤维传导束的功能定位。近年来,功能MRI影像技术飞速发展,其中弥散张量成像(diffusion tensor imaging,DTI)技术可方便、准确地显示包含锥体束在内的重要纤维传导束,因此基于这类功能影像的神经导航理论上讲可以较好地显示功能区结构,但是实际应用中发现术中脑组织漂移会使导航的精确度明显下降,并且术中无法实时察觉患者功能改变情况。幸运的是,术中神经电生理监测技术的开发应用为解决这一难题带来了希望。笔者在大脑中央区病灶的手术中尝试联合应用DTI神经导航技术及诱发电位监测技术,实现了对病灶及传导束的准确定位,并开展了术中实时功能监测,在精确切除病灶的同时较好地保留了脑功能,现将结果报道如下。
1 资料和方法
1.1 一般资料 收集2008年5月至2010年4月宁波市鄞州第二医院入住的病变位于大脑中央区域的11例手术患者,男8例,女3例,年龄25~86岁,中位年龄50.3岁。病变直径2~6cm,位于额叶后部8例,顶叶前部3例。病理性质:星形细胞瘤5例,脑膜瘤2例,少突胶质细胞瘤1例,炎性假瘤1例,脑动静脉畸形1例,自发血肿1例。术前主要症状:肢体运动障碍5例,头痛4例,癫痫4例,中枢性面瘫1例(部分病例同时有肢体运动障碍和癫痫症状)。
1.2 影像学检查 使用Philips Achive 1.5T超导MRI仪,采用6通道头线圈进行扫描。每例患者均行常规MRI扫描:横轴SE T1W和TSE T2WI、矢状位SE T1WI、横轴位DTI及注入对比剂Gd-DTPA增强后扫描。
1.3 神经导航
1.3.1 导航图像扫描 常规导航序列扫描参数:按每公斤体重0.1mmol剂量注射对比剂Gd-DTPA后行SE序列T1WI横轴位增强扫描;TR:550ms;TE:15ms;NSA:2;FOV:230;层厚:1.00mm;层间隔:0;采集矩阵:0.85× 0.85×1.40;重建矩阵:0.60×0.60×0.70。
DTI扫描参数:采用单次激发平面回波技术进行信号采集,回波因子:39;采用SENSE技术,SENSE因子:2;采集矩阵:116×71;FOV:230mm;层厚:3mm,层间距:0;采集数据28层,TR:6 206ms,TE:55ms;采用双b值,b=0,800s/mm2;采集像素:1.98×2.54×3.0(M×P×S);重建像素:0.95×0.95×3.0(M×P×S);MPG:32个方向;平均扫描时间10min。
1.3.2 图像后处理 数据采集后传输到DELL PC机进行离线处理。PC机配置:CPU P4 2.8G,内存2.0G;操作系统Windows XP。处理软件采用DTIstudio 2.4(约翰霍普金斯大学提供)。在计算张量值之前,先利用DTIstudio中的AIR软件对图像进行自动校准。校准后的图像经2位高年资磁共振医师仔细观察后除去有明显变形或伪影的图像;然后通过软件计算出张量值、本征矢量值等参数及相应图像。
1.3.3 纤维束重建 锥体束三维重建:采用的FA阈值为0.20,角度阈值为65°。采用多个ROI方法:第1个ROI放置于脑干,第2个ROI选取在两侧大脑半球额叶中央前回处,两者之间采用逻辑“and”运算。最后使用“not”功能去除杂乱的纤维束。重建后图像经DTIstudio软件保存为BMP格式的横轴位灰阶图像。
1.3.4 图像格式转换 使用软件Power Dicom 3.5软件(德国MHGS公司提供)将横轴位BMP格式图像转换为DICOM格式图像,再按照DTI扫描原始图像逐层加入其DICOM文件中的关键信息,包括患者信息、图像方位等DICOM信息。
1.3.5 导航影像融合 分别将普通导航3D序列图像和经转换的DICOM格式横轴位的纤维束图像传输至美国史赛克(Stryker-Leibinger)6000-115型导航系统。控制两者之间的匹配误差在1.0mm以内。
1.4 电生理监测方法 采用美国Nicolet公司Endeavor-CR16术中电生理监护仪。头皮电极放置部位参照国际10/20系统。
1.4.1 体感诱发电位(somatosensoryevokedpotential,SEP)
1.4.1.1 头皮体感诱发电位(scalp somatosensory evoked potential,SSEP) 刺激电极分别置于两侧的正中神经和(或)胫神经分布区域,记录电极分别置于C3、C4和(或)Cz后2cm处,参考电极置于Fz。方波刺激,刺激强度10~40mA,频率2~5Hz,平均叠加200次,观察正中神经对应的N20-P25波及胫后神经对应的P40-N50波。
1.4.1.2 皮层体感诱发电位(cortical somatosensory evoked potential,CSEP) 刺激电极放置部位及参数设置同头皮体感诱发电位,记录电极采用1×8皮层电极(电极直径约3mm,间隔5mm)。开颅后把条形电极尽量与中央沟垂直放置于脑表面,根据位相倒置情况定位中央沟位置,根据N20-P25波所在电极位置定位感觉区皮层(中央后回),根据P20-N25波所在电极位置定位运动区皮层(中央前回)。
1.4.2 运动诱发电位(motor evoked potential,MEP)
1.4.2.1 头皮运动诱发电位(scalp motor evoked poten-tial,SMEP) 参考电极置于前额(Fz),刺激电极置于左侧中央前回附近头皮(C3前2cm),右侧中央前回附近头皮(C4前2cm)或头顶Cz前2cm处;记录电极分别置于手掌的拇短展肌或足底的拇展肌及小腿的胫前肌。刺激采用5个方波组成的串刺激,刺激强度100~400V。
1.4.2.2 直接皮质电刺激(direct cortical electrical stimulation,DCES) 如果受开颅位置影响而无法在头皮C3前2cm、C4前2cm或Cz前2cm处放置刺激电极的话,利用1×8皮层电极的第一、二电极直接刺激术野暴露的皮质,方波脉冲,刺激频率60Hz,强度1~20mA,刺激时长1ms,观察对侧上下肢肢体肌肉(主要是足拇展肌及手拇短展肌)反应或肌电信号,以确定运动功能区。
1.5 手术方法 所有患者均在全麻下施行手术,手术开始前应用导航系统对病灶及大脑中央沟位置进行初步定位,并在头皮上作好标记,而后设计手术切口的位置、大小及形状,作最小限度骨瓣开颅。打开硬脑膜后,先行导航下的中央前后回初步定位,之后结合电生理技术进行功能区精细定位。所有病灶均在显微镜下小心切除,位于脑表面的病变直接从其表面切除,对于未直接暴露于脑表面的病变则选择从脑沟或无功能的脑皮层进入。术中使用导航确定病变切除的大致范围,病灶靠近中央前回的还通过皮质电刺激对功能区皮质进行精确定位,在保全功能性结构的前提下尽可能多地切除病变。术后所有患者在1周内复查头部MRI或CT,随访2周至1年。
2 结果
2.1 导航及纤维束成像结果 本组11例患者有2例因经济原因、1例因急诊手术而未能行导航,其余8例患者术前影像学资料均顺利输入导航仪,其中4例病灶与中央前回关系密切的患者还行DTI扫描,对锥体束进行纤维束重建,并将重建图像融入导航系统。
2.2 神经电生理监测及手术结果 神经电生理监测及手术结果详见表1。头皮体感诱发电位监测7例,均记录到满意的波形,术中1例出现下肢P40-N50波波幅明显下降,放松脑压板后,减轻对脑组织的牵拉后波幅逐渐回升,手术结束时恢复至正常水平,术后未见明显神经系统并发症。采用皮质体感诱发电位监测8例,其中1例能记录到典型的皮质体感诱发电位位相倒置波形,即N20-P25波倒置为P20-N25波,两者所在电极之间为中央沟。4例出现N20-P25波或P20-N25波,并呈现渐变形态(主波波幅逐渐变大或变小),根据诱发电位波形波幅变化趋势,可初步定出皮质运动区(中央前回)或皮质感觉区(中央后回)的部位。采用运动诱发电位监测共6例,其中头皮运动诱发电位2例,术中均未见明显异常信号改变,术毕肌力同术前。另外根据体感诱发电位所初步定位的中央前回区域,对4例患者中央前回及病灶周边皮层进行直接皮质电刺激(DCES),引发肢体运动或肌电反应者1例,在手术时尽量避开能引发肢体和(或)肌电反应的区域,术中病灶均实现全切,且术后肌力同术前。其余3例未得到确切波形,其中1例在术后曾出现一过性肌力下降,后逐渐好转并好于术前。显微镜下病灶全部切除8例,近全切除1例,大部分切除2例。术后功能改善8例,无变化3例。病例2、5术后早期曾出现一过性神经功能减退,术后12d内均恢复到术前水平或较术前改善。
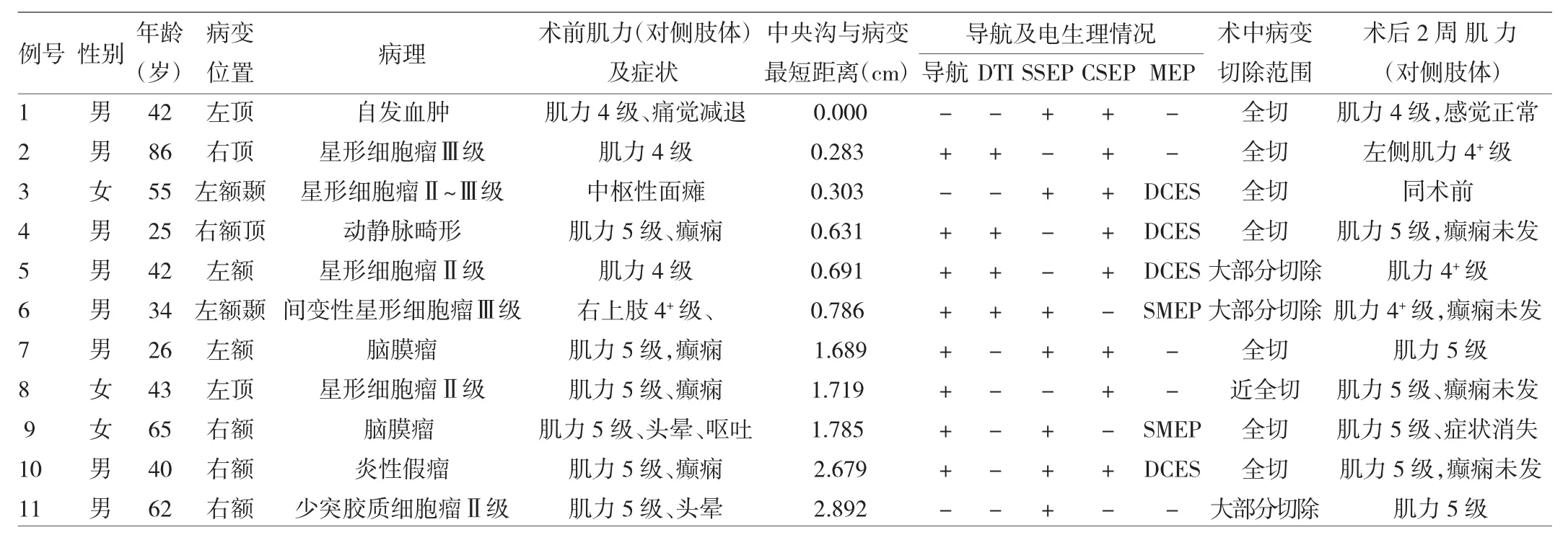
表1 11例患者神经电生理监测及手术结果
3 讨论
随着神经导航技术的出现,根据头颅解剖定位病灶的传统方法已经逐渐被淘汰,目前在国内大医院,神经导航已被广泛应用于各种颅脑手术中。本组8例患者中在神经导航指引下均采用个性化设计的切口,不仅能满足完全显露病灶的需要,而且可避免术中脑皮质过多的暴露,降低脑皮质损伤的风险。此外,导航在术中可实时定位,动态示踪,随时观察病灶切除程度;还可根据中央沟的位置初步判断中央前后回区域,避免误伤。
然而,众多研究发现受病灶压迫推移和浸润破坏等影响,脑主要功能区及白质纤维素会产生移位或重新分布[1],但是基于普通MRI、CT影像的普通神经导航并不能显示出脑内白质纤维束的形态及走形,而明确这些脑内白质纤维束与病变的确切位置关系对于神经外科医师制定合适的手术方案、采取合适的治疗措施至关重要。1996年Pierpaoli等[2]发表了人脑DTI的研究论文,该技术能勾画出脑白质主要纤维的解剖结构图,是目前唯一能在活体显示脑纤维束完整性和方向性的无创性手段。在本组患者中,笔者对其中4例病灶靠近中央前回的患者尝试进行锥体束重建,随后根据其所提供的信息设计适宜的手术入路,即选择无重要纤维束通过的入路到达肿瘤。
由于神经导航系统采用的影像资料来自患者术前,而不是实时采集,故手术中因为病变切除、脑脊液释放等诸多因素导致脑组织出现漂移时容易产生定位误差,所以神经导航并不绝对可靠。除神经导航外,在一些发达国家及国内一些较大型的神经外科中心,术中电生理监测技术作为一种术中神经功能实时监测手段亦被广泛应用于神经外科手术当中。因此笔者尝试在使用神经导航的基础上再联合相关电生理监测技术,以便更好地保护脑功能区。
由于体感诱发电位各波潜伏期相对稳定,且各波的发生源较为明确,故很早即被用于术中监护感觉通路的功能状态[3]。本研究对7例患者进行了头皮体感诱发电位监测,其中1例出现P40-N50波波幅下降,放松脑压板一段时间,待波幅回升后再重新放置脑压板,并减轻牵拉力度,随后波形逐渐恢复至正常水平,术后无神经并发症。另4例因头部切口影响电极的放置,且随着手术的进行,脑实质可能会明显塌陷而远离头皮,导致头皮体感诱发电位监测不出或表现异常,故对这4例患者未行头皮体感诱发电位监测,而是将皮层电极直接置于脑表面行皮层体感诱发电位监测。
随着术中电生理技术的发展,皮层体感诱发电位采用条状皮层电极在脑表面直接记录刺激来获得波形,较头皮体感诱发电位更稳定,波幅更高。应用该方法可以在全麻状态下通过刺激患者外周神经(如正中神经),在大脑皮质表面记录躯体感觉诱发电位的信号,电极越靠近感觉区或运动区,所获波形越好,波幅越大。此外,由于中央前回细胞轴突的走向主要是皮层向外周,而中央后回细胞轴突的走向正好相反,所以皮层体感诱发电位在中央沟两侧可以记录到极具特征性的位相倒置的波形,术中可以根据中央区位相倒置的诱发电位来区别大脑皮质的运动区和感觉区,这已被认为是非常实用和可靠的方法[4]。
本组患者均在全麻下进行手术,6例患者记录到满意的皮质体感诱发电位位相倒置波形或渐变波形,根据记录波形的电极位置定位中央前后回。根据此定位,成功避开功能区皮质,在手术显微镜下满意切除病灶。术后神经功能改善或无变化,未出现新的功能障碍,功能区的准确定位有利于安全开展病灶的全切除或扩大切除,从而提高外科手术治疗效果[5]。
不过有时体感诱发电位不能正确反映运动系统的完整性,运动诱发电位可以弥补这一不足,它可以直接实时监测皮质运动区和运动传导通路。Maesawa等[6]在28例累计锥体束的脑胶质瘤患者中行皮质下电刺激定位运动通路监测,据此指导手术切除范围,可使手术更加安全。本组1例患者在术中显露病灶后,采用直接皮质电刺激术刺激病灶后方表面皮质,在对侧拇短展肌的肌电图上可出现动作电位,并出现大拇指的屈伸运动。术中在分离并切除AVM期间注意保护该区域并反复电刺激该区域,发现动作电位始终存在。AVM切除后将皮层电极置于残腔壁,作皮质下电刺激,未能引出类似的动作电位,说明残腔壁处锥体束并未被暴露而未受到影响。术后患者肢体肌力正常。由此可见,术中直接皮层电刺激可定位脑功能区,可明确病灶与功能区的关系,可在保全功能的前提下,可以指导术者大胆切除病灶。
以往皮层电刺激需要大骨瓣开颅,大范围暴露脑组织后像探雷一样对较大区域进行刺激探查,费时费力,且增加了颅内感染的机会。有了神经导航后,切口、骨瓣得到最小化设计,病灶得到精确定位,功能区也实现了初步定位,因此需要电刺激仔细探查的范围大大缩小,操作时间也随之大大缩短,能够快速准确地完成功能区定位。在导航指引病灶切除的同时,还可利用电生理技术实时监测脑功能变化情况。若电生理信号未有恶化表现,则可大胆争取全切病灶;若电生理信号发生异常改变,可及时示警,采取措施甚至终止手术以避免严重不良后果出现。另外,根据导航显示的病灶切除范围以及根据术中电生理信号改变情况还可预测手术效果及术后功能状态。
综上所述,使用神经导航可以准确定位病灶,实施个性化切口,减少不必要的脑皮质暴露。DTI可清晰显示脑内锥体束及病灶的关系,基于该成像技术的功能神经导航可初步定位功能区,缩小电生理探查范围,从而缩短手术时间。术中通过连续监测头皮体感诱发电位和头皮运动诱发电位,可实时监护感觉、运动传导通路的功能状态。术中应用皮质体感诱发电位的位相倒置技术可定位中央前后回,直接皮质电刺激术可进一步精确定位运动区皮层及皮层下结构,能在切除病变的同时监测运动传导通路的功能状态。联合运用这些技术可有效提高手术效果,保障手术安全,减少术后神经功能缺失[7]。当然电生理监测技术亦有其不足之处,监测结果有时会受到术中麻醉药物使用、患者个体差异及电子设备干扰等因素的影响,从而无法得到良好的结果[8]。所以不仅要求监测者需具备相对丰富的监测经验,能够结合术中导航、术中超声及术中荧光等多种工具进行判断,还要与麻醉医生相互合作,共同参与,这也体现了现代精准医学的要求以及多学科合作的精神。
[1]Corbetta M,Burton H,Sinclair R J,et al.Functional reorganization and stability of somatosensory motor cortical topography in a tetraplegic subject with late recovery[J].Proc Natl Acad Sci U S A, 2002,99(26):17066-17071.
[2]Pierpaoli C,Jezzard P,Basser P J,et al.Diffusion tensor MR imaging of the human brain[J].Radiology,1996,201(3):637-648.
[3]Suzuki A,Yasui N.Intraoperative location of the central sulcus by cortical somatosensory evoked potentials in brain tumor[J].J Neurosurg,1992,76(5):867-870.
[4]Simon M V,Chiappa K H,Borges L F.Phase reversal of somatosensory evoked potentials triggered by gracilis tract stimulation:case report of a new technique for neurophysiologic dorsal column mapping[J].Neurosurgery,2012,70(3):E783-E788.
[5]梁日生,林于峰,宋施委,等.神经导航和皮质体感诱发电位联合定位大脑中央沟的应用研究[J].福建医科大学学报,2009,43(3):210-213.
[6]Maesawa S,Fujii M,Nskahara N,et al.Intraoperative tractography and motor evoked potential(MEP)monitoring in surgery for gliomas around the corticospinal tract[J].World Neurosurg,2010, 74(1):153-161.
[7]康德智,郑霖飞,林元相,等.融合影像导航和电生理监测显微手术治疗运动区肿瘤[J].解剖与临床,2011,16(5):370-373.
[8]吴劲松,许耿,毛颖,等.华山医院术中神经电生理监测临床实践规范介绍[J].中国现代神经疾病杂志,2012,12(6):660-668.
Clinical application of neural electrophysiological monitoring combined with neuronavigation in operation on cerebral central region lesions
JIANG Peilong,QING Xiaodong,GONG Zhigang,et al.Department of Neurosurgery,Yinzhou Second People's Hospital, Ningbo 315100,China
【 Abstract】 Objective To evaluate the clinical application of combination of evoked potential monitoring and neuronavigation in operations on lesions in the cerebral central region Methods Eleven patients with central region lesions underwent microscopic resection.During the operation eloquent cortex was located by selective application of neuronavigation and neurophysiological monitoring techniques,including scalp somatosensory evoked potentials,cortical somatosensory evoked potentials and direct cortical electrical stimulation. Results Neuronavigation was performed intraoperatively in 8 patients,4 of whom received functional neuronavigation to illustrate pyramidal tracts.Moreover,scalp somatosensory evoked potentials were monitored in 7 patients;decreased potentials were observed in 1 case,but the patient was fully recovered after proper adjustment of surgical manipulation.Cortical somatosensory evoked potentials were monitored in 8 cases,and reversal potentials or similar waves were detected in 5 of them.Scalp motor evoked potentials and direct cortical electrical stimulation were performed in 2 and 4 patients respectively,1 of whom showed corresponding limb movements and (or)EMG responses.Among 11 patients,7 got total resection,1 got subtotal resection and 3 partial resection.Postoperatively,no patients showed deteriorated or newly developed symptoms;the symptoms were improved successfully in 8 patients. Conclusion Combined application of evoked potential monitoring and neuronavigation in operations on lesions of the central region,is critical to precisely distinguish lesions and eloquent sensorimotor structures in the brain,and therefore it can improve surgical effects,and reduce postoperative neurological deficits.
Electrophysiological monitoring Neuronavigation Central region
2015-10-30)
(本文编辑:严玮雯)
315100 宁波市鄞州第二医院神经外科(蒋佩龙、庆晓东、雒仁玺、林松);苏州市中医院神经外科(贡志刚);苏州大学附属第二医院神经外科(兰青)
庆晓东,E-mail:blissnavi@163.com

