水稻和土壤中呋虫胺残留的固相萃取/液相色谱-串联质谱分析方法
王冬兰,简 秋,郑尊涛,宋稳成,孙 星,朱 宏,杨邦保
(1.农业部农产品质量安全控制技术与标准重点实验室/农业部农产品质量安全风险评估实验室(南京),江苏 南京 210014;2.农业部农药检定所,北京 100125)
水稻和土壤中呋虫胺残留的固相萃取/液相色谱-串联质谱分析方法
王冬兰1*,简 秋2,郑尊涛2,宋稳成2,孙 星1,朱 宏1,杨邦保1
(1.农业部农产品质量安全控制技术与标准重点实验室/农业部农产品质量安全风险评估实验室(南京),江苏 南京 210014;2.农业部农药检定所,北京 100125)
建立了呋虫胺在水稻(糙米、稻壳和稻草3种基质)和土壤中残留的液相色谱-电喷雾串联质谱(LC-ESI MS/MS)检测方法。各基质经乙腈提取,PSA柱净化后,以Agilent ZORBAX SB-C18色谱柱分离,电喷雾电离串联质谱正离子多重反应监测(MRM)模式进行测定。在不同加标水平下,对呋虫胺在4种不同基质中的回收率和相对标准偏差(RSD) 进行测定。结果表明,呋虫胺在糙米中的回收率为73.8%~97.2%,RSD为3.1%~9.9%;在稻壳中的回收率为77.6%~80.3%,RSD为2.5%~5.8%;在稻草中的回收率为76.0%~94.0%,RSD为4.8%~8.8%;在土壤中的回收率为83.6%~93.3%,RSD为4.6%~6.4%。该方法具有样品前处理简单、快速、分析时间短的特点,灵敏度、准确度和精密度均符合农药残留检测要求。
呋虫胺;水稻;土壤;固相萃取;液相色谱-电喷雾串联质谱(LC-MS/MS)
呋虫胺(Dinotefuran)是日本三井东压化学株式会社开发,并在2002年上市的新型烟碱类杀虫剂,是唯一不含氯原子和芳环的新型烟碱,其特征取代基为(四氢-3-呋喃)-甲基,被称为第三代烟碱类杀虫剂[1-2]。其杀虫机理为通过作用于乙酰胆碱受体(AChR),与激动剂(AC1)竞争AChR上的结合位点,使昆虫不断出现神经冲动从而阻断正常的神经传递,使昆虫死亡。从与受体的结合活性看,呋虫胺比其它新烟碱类的杀虫剂差两位数以上,经分析,其可能与还存在其他结合位点有关[3-5]。该药杀虫谱很广,不仅可作为农用杀虫剂防治水稻、蔬菜和水果上的各种害虫(如飞虱、蚜虫、叶蝉、粉虱、跳甲等),还可用于卫生害虫的防治,作用于已对其它杀虫剂产生抗性的蚊子时效果良好[6-10]。目前该药在我国登记的产品共4个,剂型主要为可溶性粒剂、水分散粒剂和可湿性粉剂,登记作物为水稻和黄瓜[11],但尚未制定其在这2种农产品中的最大残留限量标准,美国和欧盟也未制定,而日本对该药在糙米中的最大残留限量标准值为2 mg/kg。Hem等[12]采用LC-MS/MS方法分析了辣椒中的呋虫胺,Rahman等[13]报道了甜瓜中呋虫胺的LC-MS/MS分析方法,Rahman等[14]研究了茶叶中呋虫胺残留分析的基质效应,Watanabe等[15]在2011年开发了呋虫胺的酶联免疫分析方法。但水稻(糙米、稻壳和稻草)和土壤中呋虫胺的残留分析方法尚未见报道,且Hem等[12]开发的方法检出限和定量下限分别为0.05 mg/kg和0.15 mg/kg,该方法不够灵敏。为评价该药在食品和环境中的安全性,制定其在农产品中的最大残留限量标准,有必要开展呋虫胺在水稻和土壤中的残留检测方法研究。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1200SL G6410A液相色谱-串联质谱联用仪(美国安捷伦公司),N-EVAP11224孔氮吹仪(德国邦德公司),24位SPE净化装置(美国色谱科公司),SZ-120搅拌机(广东美的生活电器制造有限公司),IKAT18匀浆机(德国IKA公司),JY2002电子天平(上海精密科学仪器有限公司)。
呋虫胺标准品(含量98%,德国Dr.Ehrenstorfer公司);乙腈、甲醇、丙酮(HPLC级,德国Merck公司),氨基柱(Amino),N-丙基乙二胺柱(PSA)、弗罗里硅土柱(Florisil)、氨基+活性碳柱(Amino-Carbon)和N-丙基乙二胺+活性碳柱(PSA-Carbon)(北京艾杰尔科技有限公司)。
1.2 标准溶液的配制
精确称取呋虫胺标准品(精确至0.1 mg),以乙腈溶解并定容至50.0 mL,配成标准母液(1 000 mg/L)。用流动相稀释至100 mg/L,再分别用流动相、糙米、稻壳、茎杆和土壤4种不同空白基质提取液逐级稀释,配制成0.01,0.02,0.05,0.1,0.2,0.5 mg/L系列浓度的标准工作液。
1.3 样品前处理
提取:准确称取各类样品(植株10.0 g、土壤20.0 g、糙米20.0 g、谷壳10.0 g)于100 mL三角瓶中,分别加入40 mL不同提取溶液(乙腈、甲醇和丙酮),振荡提取2 h,过滤,取滤液1 mL待净化。
净化:PSA小柱经4 mL丙酮活化后,将1 mL提取液转入活化小柱中并收集滤液。再加入10 mL丙酮进行洗脱,收集合并洗脱液,氮吹至干,以1 mL乙腈定容,待测。
1.4 色谱-质谱条件
色谱柱:Agilent ZORBAX SB-C18(2.1 mm×150 mm,粒径3.5 μm)及ZORBAX SB-Aq Narrow-Bore Guard Column(2.1 mm×12.5 mm,5 μm,预柱)。流动相:乙腈-水(70∶30),流速:0.3 mL/min,进样体积:5.0 μL。
质谱条件:电喷雾离子源,正离子电离(ESI+)模式;离子源温度350 ℃;雾化气压力40 psi;毛细管电压为4.0 kV;去溶气流速:10 L/min;去溶气温度:350 ℃;干燥气流速:10 L/min;在分析过程中,采用多反应监测模式(MRM),以保留时间和离子对信息进行定性分析;以母离子和响应值最高的子离子进行定量分析。在上述仪器条件下,呋虫胺的保留时间为3.5 min左右,呋虫胺的监测母离子(m/z)为203,定性子离子(m/z)为129和157,定量子离子(m/z)为157,碰撞能量均为8 V。
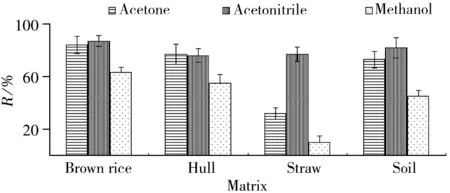
图1 不同提取溶剂时的提取效率Fig.1 Extraction efficiencies of different solutions
2 结果与讨论
2.1 提取溶剂的选择
提取溶剂的选择依据是目标组分以及所测样品的性质[16]。农药残留检测常用的提取剂有乙腈、丙酮、甲醇等[17]。在0.01 mg/kg加标水平下,不同溶剂(乙腈、丙酮、甲醇)对糙米、稻壳、稻草和土壤中呋虫胺残留的提取效率见图1。结果表明,乙腈对以上4种不同基质中呋虫胺残留的提取效率最高(76%~87%),而甲醇的提取效率最差(10%~63%),丙酮对稻草中呋虫胺的提取效率为32%,而对另外3种基质中呋虫胺的提取效率为73%~84%。由于呋虫胺在水中和不同有机溶剂中的溶解度差异较大,如20 ℃时其溶解度在水中为40 g/L ,在二甲苯中为73 mg/L,在丙酮中为8 g/L,在甲醇中为57 g/L,但难溶于正己烷和环己烷等有机物。同时由于甲醇与水互溶,且稻草含水量比其他基质高,导致提取液体积的变化(增大)比其他基质更大,因此甲醇对稻草中呋虫胺的提取效率最差。因此,本实验选用乙腈作为4种不同基质中呋虫胺残留的提取溶剂。
2.2 SPE净化柱的选择
分别选用氨基柱(Amino)、N-丙基乙二胺柱(PSA)、弗罗里硅土柱(Florisil)、氨基+活性碳柱(Amino-carbon)和N-丙基乙二胺+活性碳柱(PSA-carbon) 5种净化柱对糙米、稻壳、稻草和土壤4种基质中的呋虫胺进行净化,以丙酮作为洗脱溶剂。结果表明,在0.01 mg/kg加标水平下,PSA小柱对不同基质提取液中呋虫胺的净化效果好,回收率高(74%~87%);Amino小柱对4种基质提取液中呋虫胺的回收率较低(55%~67%);由于活性碳可能会对呋虫胺有吸附作用,因此2种含活性碳的净化小柱(Amino-carbon,PSA-carbon)与Florisil小柱对呋虫胺的回收率最低(41%~55%)。因此本研究选用PSA净化小柱作为不同基质提取液的SPE净化小柱。
2.3 洗脱液的选择
固相萃取的洗脱液一般选择甲醇、乙腈或丙酮,本研究分别选用丙酮、乙腈、甲醇和乙腈-丙酮(1∶1)作为PSA净化小柱洗脱液。结果表明,丙酮洗脱液对糙米、稻壳、稻草和土壤4种基质中呋虫胺的回收率最高(77%~87%);乙腈及乙腈-丙酮(1∶1)洗脱液对4种基质中呋虫胺的回收率相近(48%~67%);但采用甲醇作为洗脱液时,对呋虫胺的回收率最差(23%~33%)。因此本文选用丙酮作为PSA净化小柱的洗脱液。
表1 呋虫胺在不同溶剂中的标准曲线参数
Table 1 Parameters of linear curves of dinotefuran dissolved in different solvents

SolventRegressionequationr2Mobilephasey=17924999x-1380209959Extractfrombrownricey=5708594x+3822309995Extractfromhully=5022910x+4851109995Extractfromstrawy=3584122x+232509996Extractfromsoily=101169462x-4088309994
*y:peak area;x:mass concentration,mg/L
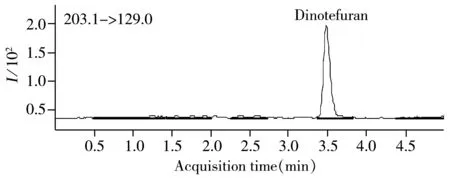
图2 呋虫胺在流动相中的色谱图(0.01 mg/L)Fig.2 Typical chromatogram of dinotefuran(0.01 mg/L)
2.4 线性范围与检出限
以乙腈作为提取液,PSA填料小柱作为SPE净化柱,丙酮作为SPE洗脱液,分别用流动相、糙米空白基质提取液、稻壳空白基质提取液、稻草空白基质提取液和土壤空白基质提取液配制0.01,0.02,0.05,0.1,0.2,0.5 mg/L的系列浓度标准溶液,进样量5.0 μL,平行测定3次。当呋虫胺的质量浓度为0.01~0.5 mg/L时,呋虫胺在流动相和不同基质中的线性回归方程见表1。结果表明,与流动相相比,糙米、稻壳和稻草基质的检测基质效应较大,而土壤基质效应较小。呋虫胺在不同基质中的检出限(按信噪比S/N=3计)均为0.05 ng。呋虫胺在流动相中的色谱图见图2。
2.5 回收率、精密度与最低检测浓度
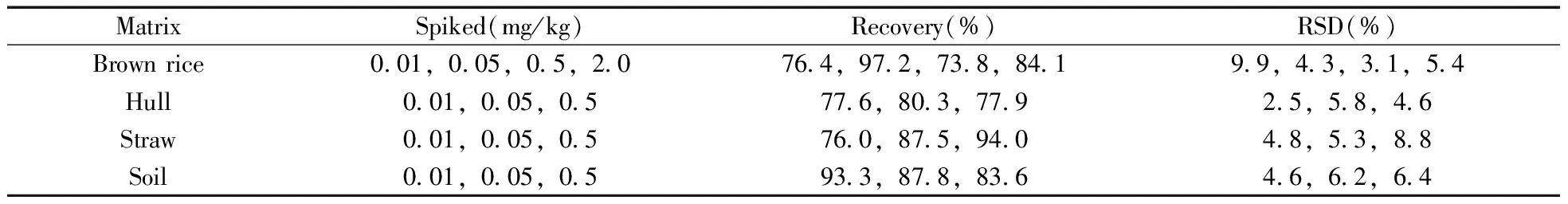
用对照水稻和土壤样品进行呋虫胺标准溶液的加标回收率实验,每个加标水平重复5次。在空白稻壳、稻草和土壤中分别添加0.01,0.05,0.5 mg/kg 3个水平,糙米中添加0.01,0.05,0.5,2.0 mg/kg 4个水平时,呋虫胺在稻壳中的回收率为77.6%~80.3%,RSD为2.5%~5.8%;在稻草中的回收率为76.0%~94.0%,RSD为4.8%~8.8%;在土壤中的回收率为83.6%~93.3%,RSD为4.6%~6.4%;在糙米中的回收率为73.8%~97.2%,RSD为3.1%~9.9%(表2)。呋虫胺在4种基质中的最低检测浓度均为0.01 mg/kg,回收率和RSD均符合NY/T 788-2004《农药残留试验准则》的要求[18]。
表2 呋虫胺在水稻和土壤中的加标回收率与相对标准偏差(n=5)
Table 2 Recoveries and RSDs of dinotefuran in rice and soil(n=5)
MatrixSpiked(mg/kg)Recovery(%)RSD(%)Brownrice001,005,05,20764,972,738,84199,43,31,54Hull001,005,05776,803,77925,58,46Straw001,005,05760,875,94048,53,88Soil001,005,05933,878,83646,62,64
2.6 实际样品的测定
采用本文建立的方法,对南京市农贸市场所销售的10批次大米样品和南京市郊区种植水稻地的土壤(5个不同田间点)样品中的呋虫胺残留量进行了分析。结果表明,10批次大米和土壤中均未检出呋虫胺残留(<0.01 mg/kg)。
3 结 论
本研究采用乙腈提取,PSA SPE柱净化,液相色谱分离,串联四极杆质谱检测,成功建立了糙米、稻壳、稻草和土壤4种基质中杀虫剂呋虫胺的快速检测方法。在0.01~2.0 mg/kg加标水平下,呋虫胺在上述4种基质中的回收率为73.8%~97.2%,RSD为2.5%~9.9%。该方法具有操作简单、分离效果好、线性范围宽、回收率高、精密度好和分析效率高等特点,适用于水稻中呋虫胺残留的市场监测及该药的残留登记试验。
[1] Zhao C,Yang W G,Hu Y H,Wan Y S,Lu X T.ModernPesticide(赵聪,杨文革,胡永红,万元松,陆修涛.现代农药),2009,8(2):13-19.
[2] Li D,Zhao Y,Li H Y,Huang Z H.PesticideScienceandAdministration(李杜,赵炎,李红云,黄志华.农药科学与管理),2012,33(9):12-14.
[3] Tang Z Q,Du X H,Feng C J.Chemistry(唐自强,堵锡华,冯长君.化学通报),2014,77(6):545-549.
[4] Cheng Z M.ModernPesticide(程志明.世界农药),2005,27(1):1-5.
[5] Liu A C,Zhang L,Tan Z Y,Liu F.ModernPesticide(刘安昌,张良,谭珍友,刘芳.世界农药),2009,31(2):22-30.
[6] Franc M,Genchi C,Bouhsira E,Warin S,Kaltsatos V,Baduel L,Genchi M.Veter.Parasitol.,2012,189:333-337.
[7] Arthur F H,Fontenot E A.JournalofStoredProductsResearch,2013,55:55-61.
[8] Wakita T,Kinoshita K,Yamada E,Yasui N,Kawahara N,Naoi A,Nakaya M,Ebihara K,Matsuno H,Kodaka K.PestManagementScience,2003,59:1016-1022.
[9] Wang B D,Gao R T,Mastro V C,Reardon R C.J.Econ.Entomol.,2005,98:2292-2300.
[10] Corbel V,Duchon S,Zaim M,Hougard J M.J.Med.Entomol.,2004,41:712-717.
[11] 中国农药信息网.http://www.chinapesticide.gov.cn.
[12] Hem L,Abd El-Aty A M,Park J H,Shim J H.J.KoreanChem.Soc.,2012,55:765-768.
[13] Rahman M M,Park J H,Abd El-Aty A M,Choi J H,Yang A,Park K H,Mahmud M N U A,Im G J,Shim J H.FoodChem.,2013,136:1038-1046.
[14] Rahman M M,Abd El-Aty A M,Choi J H,Kim S W,Shin S C,Shim J H.FoodChem.,2015,168:445-453.
[15] Watanabe E,Baba K,Miyake S.Talanta,2011,84:1107-1111.
[16] Li R,Chu D K,Zhang P J,Gao Y Q,Huang S Y.J.Instrum.Anal.(李蓉,储大可,张朋杰,高永清,黄思允.分析测试学报),2015,34(5):502-511.
[17] Li P P,Cheng J,Le Y.J.Instrum.Anal.(李萍萍,程景,乐渊.分析测试学报),2015,34(4):421-427.
[18] NY/T 788-2004.GuidelineonPesticideResidueTrials.Beijing:Chinese Agricultural Press(农药残留试验准则.中国农业出版社),2004.
Analytical Method for Determination of Dinotefuran Residues in Rice and Soil by SPE/HPLC-MS/MS
WANG Dong-lan1*,JIAN Qiu2,ZHENG Zun-tao2,SONG Wen-cheng2,SUN Xing1,ZHU Hong1,YANG Bang-bao1
(1.Key Laboratory of Control Technology and Standard for Agro-product Safety and Quality,Ministry of Agriculture, P.R.China/Key Lab of Agro-product Safety Risk Evaluation(Nanjing),Ministry of Agriculture,P.R.China, Nanjing 210014,China;2.Institute for the Control of Agrochemicals,Ministry of Agriculture,P.R.China, Beijing 100125,China)
A simple and sensitive method was developed for the determination of dinotefuran residues in brown rice,hull,straw and soil.The residues of dinotefuran in different matrix were extracted with acetonitrile.After cleaned with PSA column,the extract was separated on an Agilent ZORBAX SB-C18analytical column,and determined by liquid chromatography-tandem mass spectrometry(LC-MS/MS) under multiple reaction monitoring(MRM) mode.The method was validated at different fortification levels in brown rice,hull,straw and soils.The recoveries for brown rice at three fortification levels ranged from 73.8% to 97.2% with relative standard deviations(RSDs) not more than 9.9%.The recoveries for hull were between 77.6% and 80.3% with RSDs not more than 5.8%.The recoveries for straw were between 76.0% and 94.0% with RSDs not more than 8.8%.The recoveries for soil were between 83.6% and 93.3% with RSDs not more than 6.4%.The results showed that the method is simple and rapid,and its sensitivity and accuracy could meet the requirements for pesticide residue analysis.
dinotefuran; rice;soil;solid phase extraction(SPE);liquid chromatography-tandem mass spectrometry(LC-MS/MS)
2015-07-07;
2015-08-21
江苏省农业自主创新资金项目(CX(14)2060)
10.3969/j.issn.1004-4957.2016.03.017
O657.72;F767.2
A
1004-4957(2016)03-0351-04
*通讯作者:王冬兰,副研究员,研究方向:农产品和农业环境安全性分析,Tel:025-84391116,E-mail:wangdonglan2013@163.com

