滴滴涕单克隆抗体的制备及其评价
杨星星,毕思远,朱 海,顾大勇
(1.广东省深圳市易瑞生物技术有限公司,广东 深圳 518102;2.深圳市检验检疫科学研究院,广东 深圳 518045 )
滴滴涕单克隆抗体的制备及其评价
杨星星1,毕思远1,朱 海1,顾大勇2*
(1.广东省深圳市易瑞生物技术有限公司,广东 深圳 518102;2.深圳市检验检疫科学研究院,广东 深圳 518045 )
以滴滴涕(DDT)的特征部分为基础设计并合成了半抗原4-{4-[2,2,2-三氯-1-(4-氯-苯基)-乙基]-苯基}-丁酸(DDT-H1)、4-[4-(2,2,2-三氯-1-对甲苯基-乙基)-苯基]-丁酸(DDT-H2),并采用活泼酯法制备免疫原 DDT-H1-BSA,以及混合酸酐法制备包被原DDT-H1-OVA、DDT-H2-OVA;用DDT-H1-BSA对小鼠进行免疫,通过细胞融合、筛选、克隆等步骤得到1株能稳定分泌DDT农药抗体的单克隆细胞株。细胞株经扩大培养后,注射小鼠体内产生腹水,并将其用辛酸-硫酸铵和protein A柱子纯化出单克隆抗体。其分泌的单克隆抗体免疫球蛋白亚类为IgG1,单抗腹水的效价为1.68×105,亲和力Ka为5.238×1011L·mol-1,与其它几种代谢物有一定的交叉反应。在此基础上,利用获得的单抗研究建立DDT的间接竞争酶联免疫吸附检测法(icELISA)。结果表明,所建立的间接竞争 ELISA 方法的线性范围(IC20~IC80)为 6.6~521.8 ng/mL,可用于检测农副产品、环境中残留的DDT及其代谢物。
滴滴涕;单克隆抗体;酶联免疫检测;代谢物
有机氯农药滴滴涕(DDT)作为广谱杀虫剂从20世纪50年代开始在全世界范围内广泛使用。这一类含氯原子的有机合成杀虫剂,具有极高的脂溶性和稳定性,可在生物体内富集很高的浓度,且在环境中降解缓慢,其活性成分为p,p′-DDT,属持久性有机污染物(POPs)[1-2]。DDT在沉积物中的两种主要分解物为2,2-双(4-氯苯基)-1,1-二氯乙烯(DDE)和2,2-双(4-氯苯基)-1,1-二氯乙烷(DDD),而DDD 本身也用作杀虫剂。DDT在动物组织内可以缓慢降解为2,2-双(4-氯苯基)乙酸(DDA),但是DDA本身并不在体内积累,而是作为人或动物与DDT暴露接触的指标[3]。由于这些代谢物具有较高的亲脂性和生物富集作用,易在动物脂肪中积累,造成长期毒性[4-6]。此外,DDT还具有潜在的基因毒性、内分泌干扰作用和致癌性,可能造成包括糖尿病在内的多种疾病[7-10]。尽管从2004年起,DDT已被列为违禁化学物,但目前仍有25个国家将其作为控制疟疾的药物继续使用,其对生态环境和人体健康存在的风险使人们对DDT及其代谢物的残留剂量和分布日益关注。
目前国内外对DDT及其代谢物残留的检测主要依靠仪器分析方法[11-14],其样品前处理复杂,所需仪器昂贵,不适于大量样品的分析检测。免疫分析方法因操作简便、快捷、灵敏度高、通量高,已成为食品安全快速筛选检测的主要方法之一。而国内目前只有针对DDT代谢物DDA的免疫检测方法[15-16],该方法以DDA作为半抗原,通过碳二亚胺法与载体蛋白偶联制备抗原,其制备的抗体只能检测DDA,不能检测DDT及其它种类的代谢物。本研究尝试制备可用于检测DDT及其多个代谢物的高灵敏度的“宽谱”单克隆抗体,在文献方法[17]的基础上对半抗原的结构进行重新设计,并在抗体筛选过程中对包被抗原进行适当挑选,研发出可用于快速检测DDT及其关键有害代谢物的检测试剂。
1 实验部分
1.1 实验材料
1.1.1 主要试剂 牛血清白蛋白(BSA)、卵清蛋白(OVA)、TLC薄层层析板(GF254)、弗氏完全佐剂、弗氏不完全佐剂、辣根过氧化物酶(HRP)、3,3′,5,5′-四甲基联苯胺(TMB)均为 Sigma 产品,农药标准品(Dr.Ehrenstorfer GmbH,德国),其它化学试剂均为分析纯。
1.1.2 实验动物 Balb/c小鼠,雌性,7~8周龄,体重20~22 g;普通级雌性昆明鼠(广东省实验动物中心);鼠骨髓瘤细胞SP2/0(深圳市易瑞生物技术有限公司,实验室保存)。
1.1.3 仪 器 倒置显微镜(日本Olympus公司);Multiskan MK3酶标仪、二氧化碳培养箱(美国Thermo公司);酶标板自动洗涤机(美国Bio-tech公司);API 3000液质联用仪(美国AB公司)。
1.2 实验方法
1.2.1 半抗原的合成 称取3.28 g水合氯醛、2 mL氯苯(或者2 mL甲苯)和1.6 g 4-苯基丁酸,置于圆底烧瓶中,水浴加热搅拌直至所有晶体溶解,将圆底烧瓶置于冰浴下,缓慢加入7 mL 96%的浓硫酸,0 ℃下磁力搅拌,1.5 h后将混合物倒入冰水中,用乙酸乙酯萃取,蒸干有机溶剂后用硅胶柱纯化得到终产物DDT-H1(X=Cl)、DDT-H2(X=CH3),具体合成路线如图1所示。
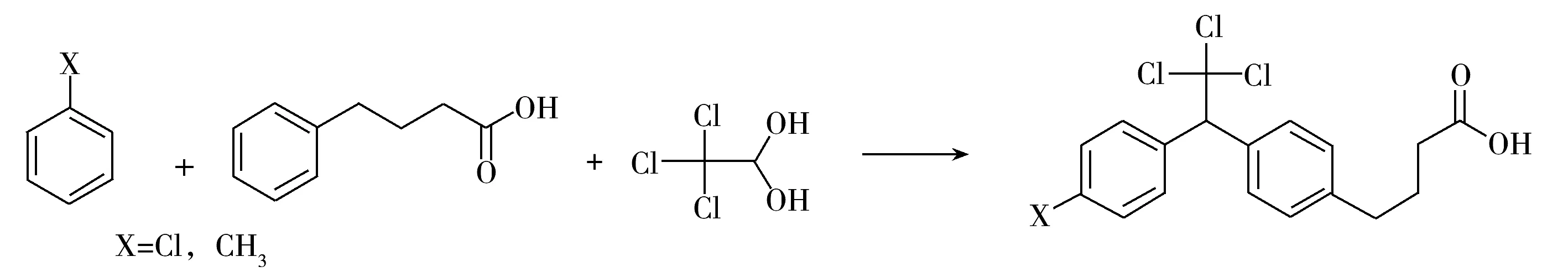
图1 DDT半抗原的合成路线Fig.1 The synthesis scheme of DDT hapten
1.2.2 免疫原与包被原的制备 活泼酯法制备免疫原DDT-H1-BSA:将16.05 mg半抗原DDT-H1(50 mmol)、6.8 mg N-羟基琥珀酰亚胺(NHS,50 mmol)和12.15 mg二环己基碳二亚胺(DCC,50 mmol)溶于1 mL无水N,N-二甲基甲酰胺(DMF)中,室温下搅拌反应18 h,反应液于4 000 r/min离心5 min,吸取上清活化液。再称量120 mg BSA溶于8 mL碳酸盐缓冲溶液(0.05 mol/L,pH 9.6)中,缓慢分次滴加400 μL活化液,室温下搅拌反应3 h,再将黄色反应液装入透析袋,用0.01 mol/L磷酸盐缓冲液(PBS,pH 7.4)透析,每4 h换液1次,换液7~8次,透析后于4 000 r/min离心5 min,上清液于-20 ℃保存。
混合酸酐法制备包被抗原DDT-H1-OVA和DDT-H2-OVA:称取5.4 mg半抗原DDT-H1(或DDT-H2)约18 mmol溶于200 μL无水DMF中,按顺序依次加入4.27 μL(约18 mmol)三正丁胺和2.34 μL(约18 mmol)氯甲酸异丁酯,室温下搅拌反应1 h。将30 mg OVA 溶于2 mL碳酸盐缓冲溶液中,搅拌下缓慢滴加100 μL上一步反应液,室温下搅拌反应3 h后,透析、离心,于-20 ℃保存。
1.2.3 免疫方案 取7~8周龄Balb/c雌性小鼠,将制备的免疫抗原与弗氏完全佐剂等量混合,完全乳化后,腹部皮下注射,剂量为含DDT-H1-BSA 100 μg,以后每隔3周以同剂量取人工抗原与弗氏不完全佐剂混合乳化后皮下多点注射,免疫4次后测定其效价和抑制率,选取效价和抑制率较高的小鼠进行细胞融合,融合前3 d加倍剂量强化免疫1次。
1.2.4 抗血清效价的测定 利用间接ELISA测定,以不同浓度的DDT-H1-OVA和DDT-H2-OVA分别包被酶标板,小鼠抗血清倍比稀释。采用方阵滴定法优化包被抗原浓度和抗血清工作浓度,选择吸光值A450 nm约为1.0时的抗原浓度和抗体稀释度作为工作浓度,采用间接竞争ELISA检测血清的抑制效果。效价高、抑制效果好的小鼠加强免疫,用于细胞融合。
1.2.5 细胞融合及单克隆抗体制备 将小鼠骨髓瘤SP2/0细胞与脾细胞以5∶1的比例混合,在50%PEG下融合,洗涤、离心后以HAT培养基悬浮,接种于含饲养细胞的96孔培养板中,在37 ℃ 5%的CO2培养箱中培养。
1.2.6 杂交瘤细胞筛选及亚克隆 融合后6~9 d用HT培养液半量换液1次,在12~14 d后根据增殖情况改用完全培养液。待细胞贴壁至占板孔1/3时,取上清液,采用间接ELISA和间接竞争ELISA法进行阳性杂交瘤细胞筛选,对阳性并有竞争抑制反应的微孔进行显微克隆和有限稀释(亚克隆)。如此反复克隆2~5次,待所克隆的所有孔上清液中抗体阳性率为100%时,挑取单克隆细胞,扩大培养,建株。
1.2.7 腹水制备及抗体亚型鉴定 提前1周注射0.5 mL液体石蜡至Balb/c小鼠腹腔。将细胞(每只小鼠1 mL,含约(1~2)×108个细胞)腹腔注射小鼠腹部10~15 d,待小鼠腹部明显膨大时采集腹水。ELISA法测定其效价,间接ELISA法鉴定单克隆抗体的免疫球蛋白类型和亚类。
1.2.8 抗体纯化 采用饱和硫酸铵沉淀法除去杂蛋白,再经过Protein A柱子纯化出IgG,并采用考马斯亮蓝G250法检测蛋白浓度。
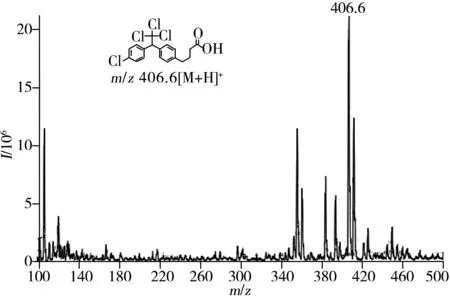
图2 DDT半抗原DDT-H1的质谱图Fig.2 MS spectrum of DDT-H1 hapten

图3 DDT半抗原DDT-H2的质谱图Fig.3 MS spectrum of DDT-H2 hapten
1.2.9 单克隆抗体的亲和常数(Ka)测定 以1 μg/mL DDT-H2-OVA包被,间接ELISA法测定不同浓度的抗DDT单克隆抗体与包被抗原反应的A450 nm,以单克隆抗体浓度为横坐标,A450 nm值为纵坐标,绘制反应曲线,并在曲线上找到趋于平坦段A450 nm值的50%所对应的单克隆抗体浓度,以其倒数作为亲和常数Ka。
1.2.10 单克隆抗体间竞争ELISA方法的建立 用棋盘滴定确定最佳包被浓度和抗体稀释倍数,采用常规ELISA操作步骤,建立稳定灵敏的ELISA间接竞争方法。四参数拟合曲线,计算IC50,定量检测范围并确定检出限。
2 结果与讨论
2.1 半抗原的鉴定
上述合成的目标物DDT-H1、DDT-H2经液相色谱-质谱(LC-MS)测定,结果如图2~3所示。从图2可知,DDT-H1的分子离子峰为m/z406.6[M+H]+,且该峰旁有一系列同位素峰m/z411.6和m/z412.7等;从图3可知,DDT-H2的分子离子峰为m/z383.1[M-H]-,且该峰旁有一系列同位素峰m/z382.3和387.2等。这些峰均与该化合物的分子量相符。
2.2 人工抗原的鉴定
在波长200~350 nm区间,对各人工抗原的紫外吸收光谱进行测定,以鉴定半抗原与载体蛋白(BSA或OVA)是否偶联成功[18]。图4A中DDT-H1-BSA的波峰偏移至245~246 nm,波谷偏移至241 nm,OD值均明显增大;DDT-H1-OVA的波峰波谷均消失,OD变化不大。图4B中DDT-H2-OVA的波谷稍偏移至254~256 nm,OD值变化不大。以上结果说明3种人工抗原均已成功合成。

Fig.4 UV spectra of DDT-H1-BSA/OVA(A)and DDT-H2-OVA(B)
2.3 抗血清效果分析
血清中抗体的效价越高,说明有效抗体浓度越高,即小鼠的脾脏中激活的 B淋巴细胞越多,越有利于细胞融合。分别用浓度为1 μg/mL的DDT-H1-OVA和 DDT-H2-OVA于4 ℃过夜包板,测试抗血清的竞争变化,两者的包被浓度皆由棋盘滴定法初步确定,其中小鼠C免疫产生的血清效价最高。采用浓度分别为0,200 ng/mL的DDT-H1-OVA和 DDT-H2-OVA作为抑制药物,对不同小鼠的血清进行间接竞争ELISA检测,结果以A450 nm值表示。抑制情况如表1所示,3只小鼠中,当以DDT-H2-OVA作为筛选的包被原,添加200 ng/mL药物时,小鼠B血清的抑制率高达70.5%,因此选择小鼠B进行细胞融合。
表1 不同包被原对DDT的抗血清抑制效果
Table 1 Inhibitory effects of DDT antiserum by using different coating antigens

RatserumDilutionratioDDT-H1-OVADDT-H2-OVA0ng/mL200ng/mLInbibition/%0ng/mL200ng/mLInbibition/%A30001152080130510210531480B45001130064642810850320705C55000958079317212160624487
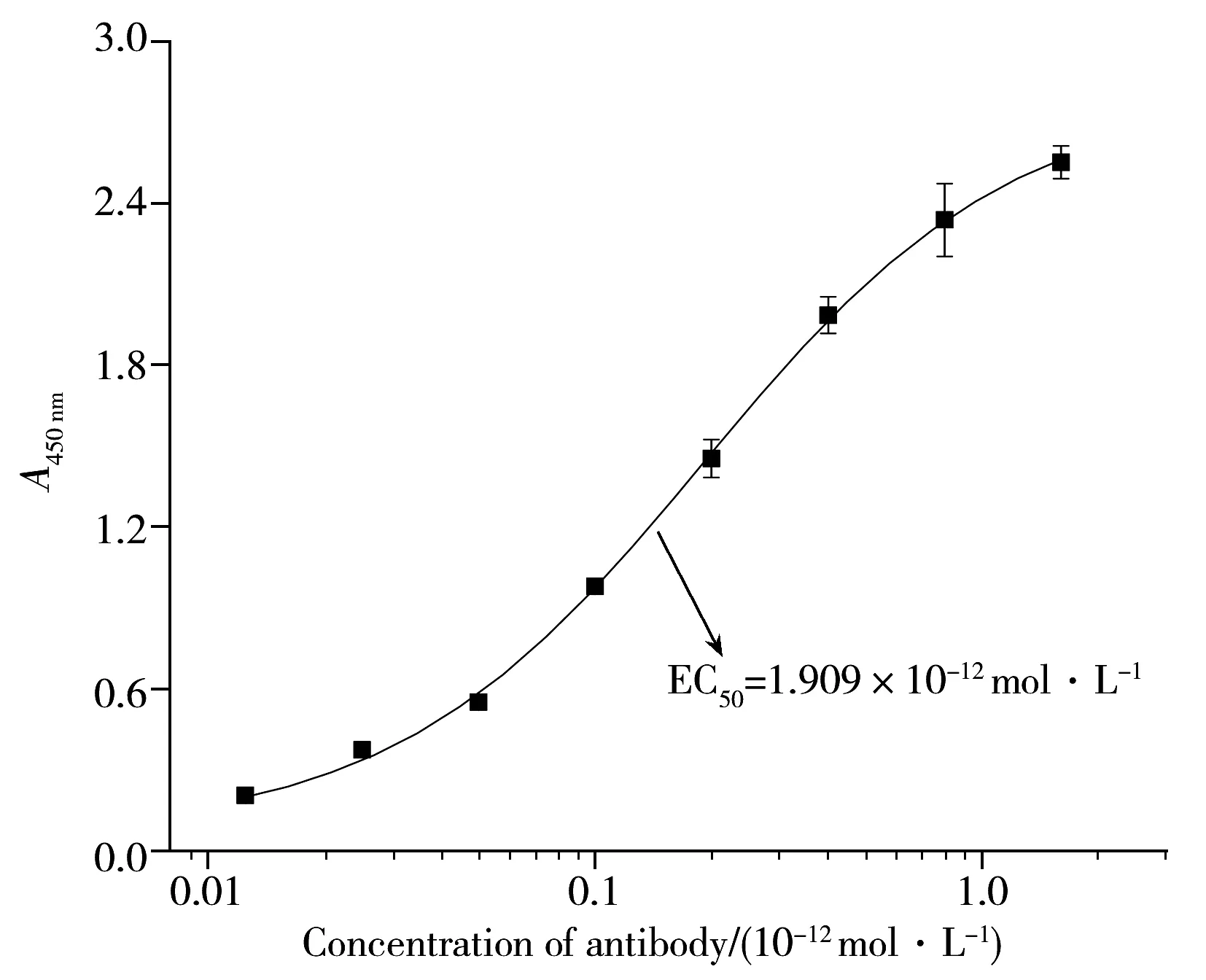
图5 抗体亲和力的测定Fig.5 Determination of affinity of antibody
2.4 单克隆抗体亚类的鉴定与腹水效价测定
经过细胞融合、筛选、克隆得到1株稳定分泌抗DDT抗体的杂交瘤细胞3C5。以1 μg/mL的DDT-H2-OVA包被酶标板,采用icELISA方法检测其腹水抗体亚型。检测结果抗体亚型为IgG1,用icELISA得到腹水的效价为1.68×105。
2.5 单克隆抗体的亲和常数测定
以1 μg/mL的DDT-H2-OVA包被酶标板,icELISA法测定单克隆抗体的亲和力,结果如图5所示,取趋于平坦段即A450 nm为2.4的50%所对应的单克隆抗体浓度,以其倒数作为亲和常数(Ka),所获单克隆抗体的Ka为5.238×1011L·mol-1。
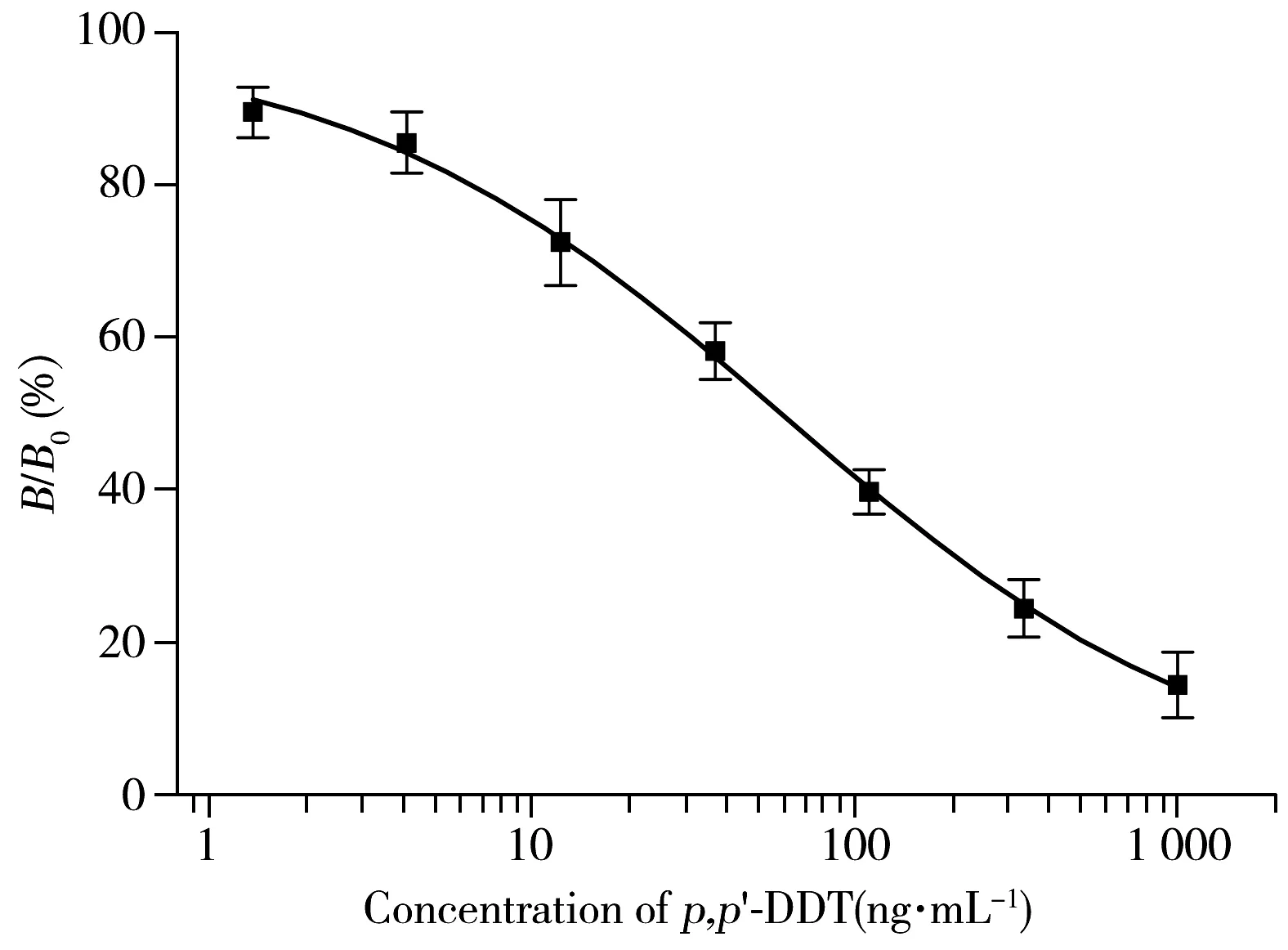
图6 DDT的 icELISA标准曲线Fig.6 icELISA standard curve of DDT
2.6 抗体灵敏度的测定
采用Originlab 7.5的四参数拟合模块对间接竞争ELISA反应曲线进行S拟合,如图6所示,计算曲线IC50值为61.1 ng/mL,其线性范围(IC20~IC80)为6.6~521.8 ng/mL。
2.7 抗体特异性的测定

通过表2 的交叉反应率可以看出,该抗体具有较宽的特异性,对p,p′-DDD的交叉反应率高于100%,对o,p′-DDT、p,p′-DDE、o,p′-DDE、o,p′-DDD 4个药物的交叉反应率在10%~100%之间,而对三氯杀螨醇(Dicofol)的交叉反应率则低于10%。说明氯苯基三氯乙烷部分是其重要的决定簇,直接影响抗体的特异性;三氯杀螨醇则由于在此部分多了1个羟基而导致其与抗体的结合能力大大减弱;此外,另1个苯环上氯的相对位置也决定了交叉反应率,其中对位的交叉反应率最高,邻位较低,可能是邻位结构的药物的空间位阻较大不能深入抗体的口袋腔中导致不能与之紧密结合。
表2 单克隆抗体与p,p′-DDT类似物的交叉反应率
Table 2 Cross reactivity of polyclonal antibody with analogous compound ofp,p′-DDT

CompoundStructureIC50(μg/L)CR(%)p,p′⁃DDT611100o,p′⁃DDT1465417p,p′⁃DDE801763o,p′⁃DDE2212276p,p′⁃DDD4561340o,p′⁃DDD1389440Dicofol>6000<001
3 结 论
本文筛选出一株细胞株3C5,采用icELISA方法检测其腹水抗体亚型为IgG1,腹水的效价为1.68×105,单克隆抗体的Ka为5.238×1011L·mol-1。该抗体对p,p′-DDT 的 IC50为61.1 μg/L,检测的线性范围(IC20~IC80)为6.6~521.8 ng/mL,与其它几种代谢物有一定的交叉反应率。实验制备的单抗完全满足检测要求,为研制快速检测DDT的其它免疫检测方法奠定了基础。
[1] Sarkar U K,Basheer V S,Singh A K,Srivastava S M.BullEnviron.Contam.Toxicol.,2003,70:485-493.
[2] Chiu T C,Yen J H,Liu T L,Wang Y S.BullEnviron.Contam.Toxicol.,2004,72:821-828.
[3] Liu R Y,Dong Y H,Xu D Y,Liang Y B.J.Agro-Environ.Sci.(刘仁沿,董玉华,徐道艳,梁玉波.农业环境科学学报),2008,27(2):805-812.
[4] Wang X T,Chu S G,Xu X B.BullEnviron.Contam.Toxicol.,2003,70:351-358.
[5] Hu J X,Dou Y W,Zhao Z Y,Zhang J B,Liu J G,Zhao L J.Environ.Pollut.Control(胡建信,窦艳伟,赵子鹰,张剑波,刘建国,赵丽娟.环境污染与防治),2006,28(3):222-225.
[6] Xing Z W,Liu C Y,Bi L G,Wang H X,Wang F.Agrochemicals(邢兆伍,刘存玉,毕立国,王红星,王峰.农药),2006,45(10):672-674.
[7] Sturgeon S R,Potischman N,Rothman N,Brinton L A,Hoover R N,Brock J W,Needham L L.CancerCausesControl,1998,9:417-424.
[8] Weiderpass E,Baron J A,Adami H O,Magnusson C,Lindgren A,Bergstrm R,Correia N,Persson I.CancerEpidemiolBiomarkerPrev.,2000,9:487-493.
[9] Gunnar T,Lars H,Alexander G.Reprod.Toxicol.,2004,(19):5-26.
[10] Mcglynn K A,Abnet C C,Zhang M D,Sun X D,Fan J H,O'Brien T R.J.Nat.CancerInst.,2006,98(14):1005-1010.
[11] Wang Y F,Chen X H,Fu X H.Chin.J.Chromatogr.(王玉飞,陈晓红,傅小红.色谱),2007,25(1):112.
[12] Chen D,Luo Y P.J.Instrum.Anal.(陈东,罗倚坪.分析测试学报),2014,33(1):83-87.
[13] Zhou C,Wang Z C,Luo M B,Yao P P,Yuan Z Z.J.Instrum.Anal.(周纯,王志畅,罗明标,姚培培,袁自遵.分析测试学报),2013,32(11):1354-1358.
[14] Shi Z X,Yang X,Feng J F,Xiao Z X,Wu Y N.Chin.J.FoodHyg.(施致雄,杨欣,封锦芳,肖忠新,吴永宁.中国食品卫生杂志),2006,18(6):497-502.
[15] Li W,Liu R Y,Xu D Y,Liu L,Liang Y B.Chin.J.HealthLab.Technol.(李伟,刘仁沿,许道艳,刘磊,梁玉波.中国卫生检验杂志),2010,20(5):970-973.
[16] Liu L,Liu R Y,Xu D Y,Jiang T J,Liang Y B.Chin.J.Appl.Environ.Biol.(刘磊,刘仁沿,许道艳,江天久,梁玉波.应用与环境生物学报),2014,20(5):925-928.
[17] Abad A,Manclu′s J J,Mojarrad F,Mercader J V,Miranda M A,Primo J,Guardiola V,Montoya A.J.Agric.FoodChem.,1997,45:3694-3702.
[18] Singh K V,Kaur J,Varshney G C,Raje M,Suri C R.BioconjugateChem.,2004,15(1):168-173.
Preparation and Evaluation of DDT Monoclonal Antibody
YANG Xing-xing1,BI Si-yuan1,ZHU Hai1,GU Da-yong2*
(1.Shenzhen Bioeasy Biotechnologies Co.Ltd.,Shenzhen 518102,China;2.Shenzhen Academy of Inspection and Quarantine,Shenzhen 518045,China)
The haptens 4-{4-[2,2,2-trichloro-1-(4-chloro-phenyl)-ethyl]-phenyl}-butyric acid(DDT-H1),4-[4-(2,2,2-trichloro-1-p-tolyl-ethyl)-phenyl]-butyric acid(DDT-H2) were designed and synthesized on the basis of characteristics part of DDT,and artificial antigens DDT-H1-BSA(immmue antigen),and DDT-H1-OVA.DDT-H2-OVA(coating antigens)were prepared by coupling with the carrier proteins using active ester method and mixture anhydrides method,respectively.The monoclonal antibody(MAb)against DDT was produced by immunity DDT-H1-BSA,cell fusion,screening,cloning.The MAb was prepared from ascetic fluids of Balb/c,which was purified with saturated ammonium sulfate followed by affinity chromatography on protein A.The monoclonal antibody characterized by IgG1 isotype showed a high cross-reactivity to some metabolites.The enzyme linked immunosorbent assay(ELISA)titer of ascites was 1.68×105,and the affinity of antibody(Ka)was 5.238×1011L·mol-1.An indirect competitive ELISA was founded base on the monoclonal antibody.The results of indirect competitive ELISA showed that the linear range of the calibration curves ranged from 6.6 ng/mL to 521.8 ng/mL.The method could be applied in the detection of DDT and its metabolites in agriculture products and environment.
dichlorodiphenyltrichloroethane(DDT);monoclonal antibody;ELISA;metabolites
2015-07-27;
2015-09-15
深圳市科技研发资金项目(CXZZ20130322112111131);深圳市战略新兴产业发展专项资金(GCZX20140509163151273);广东省特支计划-科技创业领军人才项目(2014TY01R099)
10.3969/j.issn.1004-4957.2016.03.003
O766.1;R392.11
A
1004-4957(2016)03-0271-06
*通讯作者:顾大勇,博士,研究员,研究方向:生物芯片、生物传感器技术,Tel:0755-83391344,E-mail:wanhood@163.com

