分散固相萃取/高效液相色谱-离子阱飞行时间高分辨质谱法对纺织品中全氟化合物的快速筛查和确证
王美玲,戴洁芸,成 婧,赵晓亚,牛增元,颜鸿飞,李拥军*
(1.湖南出入境检验检疫局技术中心,湖南 长沙 410004;2.湖北出入境检验检疫局技术中心,湖北武汉 430022;3.山东出入境检验检疫局技术中心,山东 青岛 266002 )
分散固相萃取/高效液相色谱-离子阱飞行时间高分辨质谱法对纺织品中全氟化合物的快速筛查和确证
王美玲1,戴洁芸1,成 婧1,赵晓亚2,牛增元3,颜鸿飞1,李拥军1*
(1.湖南出入境检验检疫局技术中心,湖南 长沙 410004;2.湖北出入境检验检疫局技术中心,湖北武汉 430022;3.山东出入境检验检疫局技术中心,山东 青岛 266002 )
采用液相色谱离子阱飞行时间串联质谱(LC-MS-IT-TOF) 技术,结合分散固相萃取净化方法,建立了纺织品中全氟化合物快速筛查、定性识别和准确定量的分析方法,构建了14种全氟化合物的多级碎片离子质谱图数据库。样品用甲醇超声提取,提取液经C18吸附剂净化后,以C8色谱柱(150 mm×4.6 mm,3.5 μm)分离,5 mmol/L 乙酸铵-甲醇为流动相梯度洗脱。考察了吸附剂种类和用量对加标回收率的影响,优化了净化条件。结果显示,14种全氟化合物的检出限为1~10 μg/kg,在10,50,100 μg/kg 3个加标水平下的平均回收率为49.2%~101.4%,相对标准偏差为1.1%~14.0%。该方法利用精确质量数匹配和自建标准谱库检索进行快速筛查,并使用保留时间和多级特征碎片离子进行定性确证,具有简便、快速、高效、准确等优点,可用于纺织品中全氟化合物的快速筛查和确证。
纺织品;全氟化合物;离子阱飞行时间串联质谱;筛查;分散固相萃取;高效液相色谱
全氟化合物(PFCs)主要包括全氟辛烷磺酰基化合物和全氟辛酸及其盐等,是一类具有优良热稳定性、化学稳定性及表面活性等特性的含氟化合物[1],在纺织品工业中应用广泛,织物整理剂、防水和防污处理剂以及抗紫外线、抗菌等功能性后整理助剂中均含有全氟化合物[2]。研究表明,全氟化合物具有持久性和生物累积性,是目前最难分解的有机污染物之一,且具有很高的全身多脏器毒性[3-4]。近年来,一些发达国家出台了相应的法规,禁止或限制全氟化合物在纺织品中的使用。如欧盟2006/122/EC指令规定:市场上制成品中全氟辛烷磺酰基化合物的含量不能超过50 mg/kg,纺织品或涂料中全氟辛酸的限制含量为1 μg/mg。2009年全氟辛磺酸及盐和全氟辛基磺酰氟被列入《关于持久性有机污染物的斯德哥尔摩公约》中,在全球范围内限制使用。2015年国际环保纺织协会规定全氟辛酸在Ⅰ级纺织品中限量值由2013年的0.10 mg/kg降为0.05 mg/kg;并在新标准的考察目录中新增4种长链全氟化合物(全氟十一烷酸、全氟十二烷酸、全氟十三酸、全氟代十四酸),限量值与全氟辛酸相同。国际上对纺织品中全氟化合物的监控日益严格,限制的化合物种类也逐步增多。而我国一些企业并未开发出很好的替代品,全氟化合物仍被广泛使用,这势必会给我国纺织品出口带来质量风险以及给人类健康造成重大影响。因此建立纺织品中全氟化合物的快速筛查和确证方法显得十分必要。
国内外已报道的有关纺织品中全氟化合物的分析方法中,样品前处理一般采用超声萃取[5-9]、加速溶剂萃取[10]、索氏提取和固相萃取等[11];检测技术主要有气相色谱(GC)[5]、气相色谱-质谱(GC-MS)[6,11]和液相色谱-质谱(LC-MS/MS)[8-10]。然而这些方法涉及的PFC种类有限,如只限于全氟辛烷磺酸盐和全氟辛酸的定性或定量分析,无法对无标准品的非特定目标物进行有效筛查。目前,全氟化合物分析研究中最突出的问题是缺少标准对照品。全氟烷基化合物的种类繁多,存在着多种同分异构体和同系物(以全氟辛烷磺酸为例,有11种同分异构体),由于缺少相应的标准品,检测难度较大。离子阱飞行时间串联质谱(IT-TOF-MS)兼具离子阱和高分辨飞行时间质谱的检测能力,能够进行精确质量数测定,同时还能提供多级质谱碎片离子信息,可对目标化合物和非目标化合物进行快速筛查和确证。近年来,IT-TOF-MS技术已成功应用于食品中多种农药残留筛查和保健食品中非法添加物及结构类似物的筛选及确证分析[12-13]。分散固相萃取技术(QuEChERS)具有操作简便、分析速度快、样品及试剂消耗量少等优点。本文基于QuEChERS的快速提取方法,结合离子阱-飞行时间质谱技术,建立了纺织品中14种全氟化合物的快速筛查和确证方法,在较短时间内实现了对纺织品中可能存在的全氟化合物的筛查分析,并应用于实际样品的检测。
1 实验部分
1.1 仪器与试剂
液相色谱-离子阱-飞行时间串联质谱(日本岛津公司);工作站LC MS solution V 3.6。超声波清洗器(美国Branson公司)。Sigma 2-16P 高速离心机(德国Sigma公司);ZYI-300型纺织品检验制样机(海南速易检验设备有限公司)。
甲醇、乙腈(色谱纯,德国Merck公司);乙酸铵(色谱纯,美国ACS试剂公司);实验用水为超纯水(美国Millipore超纯水仪制备)。N-丙基乙二胺吸附剂(PSA) 、十八烷基键合硅胶吸附剂(C18-封端) 和石墨化碳黑吸附剂(GCB) 购于天津博纳艾杰尔公司。
全氟戊酸(Perfluoropentanoic acid,PFPeA)、全氟丁磺酸(Nonafluorobutane-1-sulfonic acid,PFBS)、全氟己酸(Undecafluorohexanoic acid,PFHxA)、全氟庚酸(Perfluoroheptanoic acid,PFHpA)、全氟辛酸(Perfluorooctanoic acid,PFOA)、全氟壬酸(Perfluorononanoic acid,PFNA)、全氟辛烷磺酸钾(Potassium heptadecafluoro-1-octanesulfonate,PFOS)、全氟辛基磺酰胺(Perfluoroctanesulfonamide,PFOSA)、全氟癸酸(Perfluorodecanoic acid,PFDA)、全氟十一烷酸(Perfluoroundecanoic acid,PFUdA)、全氟十二烷酸(Perfluorododecanoic acid,PFDoA)、全氟十三烷酸(Perfluorotridecanoic acid,PFTrDA)、全氟十四烷酸(Perfluorotetradecanoic acid,PFTeDA)、全氟十六烷酸(Perfluorohexadecanoic acid,PFHxDA)14 种全氟化合物标准品的纯度大于98%,均购自美国Aldrich化学试剂公司和德国Dr.Ehrenstorfer公司。
全氟化合物标准溶液:分别准确称取适量的各标准品,用甲醇溶解并定容,配成1.0 mg/mL的标准储备液,-18 ℃下保存。以甲醇稀释上述标准储备液,配成不同浓度的混合标准溶液,于4 ℃下保存。
样品制备:将棉、毛、麻、丝、人造纤维、合成纤维等不同种类的纺织品用纺织品自动制样机切割成5 mm×5 mm均匀小块。
1.2 样品前处理
称取1.0 g制备好的试样于50 mL聚丙烯离心管中,加入10 mL甲醇,超声提取30 min后,以8 000 r/min 离心5 min,取2 mL上清液加入10 mg C18粉末吸附剂,充分涡旋后,以18 000 r/min 离心3 min,取上清液过0.22 μm有机滤膜待测定。
1.3 色谱-质谱条件
色谱柱:Agilent ZORBAX Eclipse XDB-C8柱(3.5 μm,4.6 mm×150 mm);流动相:A为5 mmol/L 乙酸铵溶液,B为甲醇;梯度洗脱程序:0~5 min,30%~70%B;5~10 min,70%~90% B;10~15 min,90%~95% B,15~15.1 min,95% ~30%B,15.1~19 min,30%B。流速:0.5 mL/min,柱温为40 ℃;进样量:10 μL。
离子源:ESI,负离子扫描;扫描范围:m/z100~1 000;加热模块温度:200 ℃;曲形脱溶剂管(CDL)温度:200 ℃;雾化气流速:1.5 L/min;干燥气流速:10 L/min;离子源电压:-3.5 kV;检测器电压:1.7 kV;质量数校准方法:自动调谐优化电压,外标法校准质量数。高分辨数据筛查软件为Met ID Solution。
2 结果与讨论
2.1 色谱-质谱条件的优化
由于PFCs带有羧基或磺酸基,易去质子化,故采用ESI负离子模式,母离子为[M-H]-;PFCs同时具有疏水和疏油的特性,且有一定的表面活性,采用普通的C18色谱柱时,色谱峰保留时间较长、拖尾严重,特别是对于长链化合物(如全氟十六酸)有很强的保留,即使用100%乙腈也很难洗脱下来。本实验采用C8色谱柱,在流动相中加入少量乙酸铵,一方面能减少拖尾,改善峰形,另一方面能提高去质子化能力,提高灵敏度。实验比较了不同浓度乙酸铵(5,10,20 mmol/L)对PFCs分离的影响,结果显示较高浓度的乙酸铵对分离度影响不大,反而对质谱检测有较强的抑制作用。与乙腈相比,采用甲醇作为流动相,各化合物的分离度更好。通过优化,采用Agilent ZORBAX Eclipse XDB-C8柱进行分离,以5 mmol/L乙酸铵-甲醇溶液进行梯度洗脱。在此条件下,14种PFCs化合物可达到良好的分离和检测。
2.2 精确质量数、保留时间及多级碎片离子
PFCs化合物的精确质量数、保留时间、质量误差及多级碎片离子见表1。通过碎片离子质谱图分析,发现全氟烷基羧酸类化合物的一级裂解主要是CO2丢失,生成[M-H-44]-二级碎片离子,再进一步丢失C3F6(m/z150)基团或逐个丢失CF2(m/z50) 基团得到三级碎片离子。全氟烷基磺酸类化合物的一级裂解主要是丢失SO3,形成[M-H-80]-,而后与全氟烷基羧酸类化合物的裂解方式相同,进一步丢失C3F6基团(m/z150)或逐个丢失CF2(m/z50) 得到三级碎片离子[8]。根据全氟烷基羧酸和全氟烷基磺酸类化合物的碎片离子特征可以进行定性判定和结构推导。
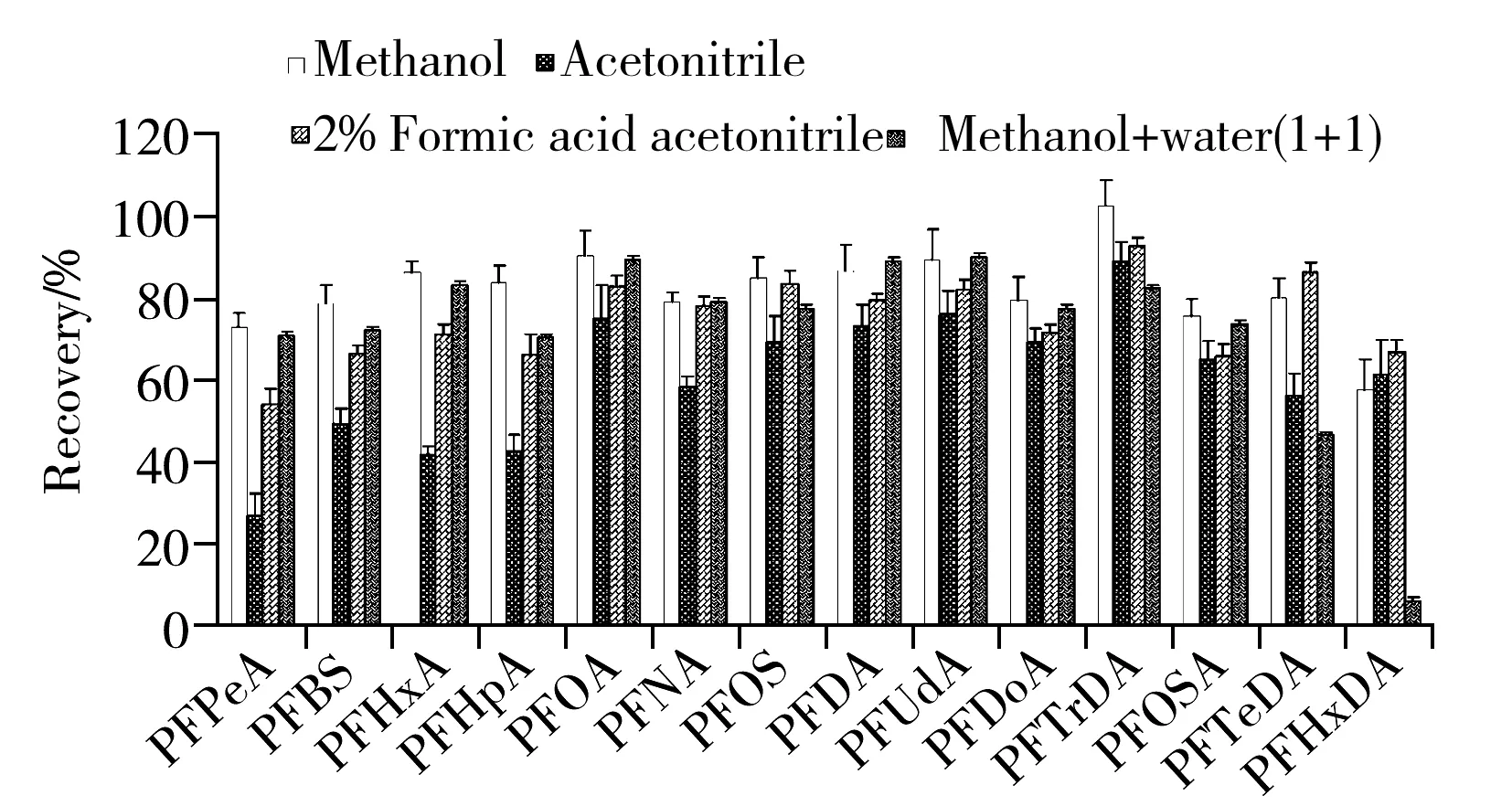
图1 提取溶剂的优化Fig.1 Optimization of extraction solutions
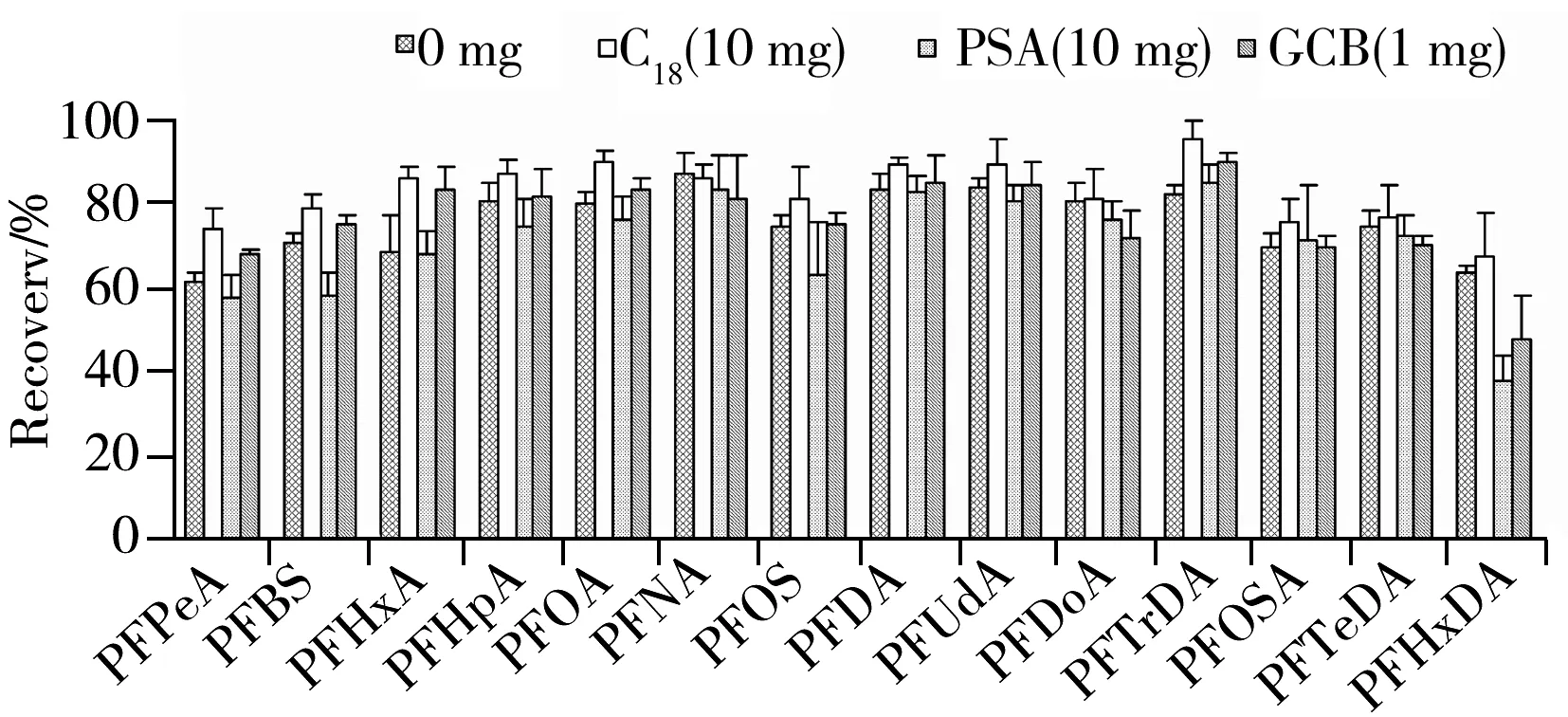
图2 不同吸附剂对回收率的影响Fig.2 Effect of different adsorbents on the recoveries of PFCs

图3 C18吸附剂用量对回收率的影响Fig.3 Effect of C18 adsorbent dosage on recoveries of PFCs
2.3 样品前处理条件的优化
2.3.1 提取溶剂的选择 目前已报道的纺织品或皮革中全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)的检测方法中,样品前处理方法有索氏提取、超声提取和快速溶剂萃取[5-11],但以超声提取法最为简便、经济。本研究参考已有文献[7-8]采用超声提取,同时考察了乙腈、甲醇、2%甲酸乙腈、甲醇-水(1∶1)等作为提取溶剂的提取效果。取5.0 g阴性棉布样品,加入适量的PFCs混合标准溶液15 mL,于室温下浸泡12 h,待溶液完全被样品吸收,晾干后,对提取溶剂进行优化。分别用乙腈、甲醇、2%甲酸乙腈、甲醇-水进行超声波振荡提取,回收率结果见图1。由图1可见,甲醇的提取效率最高。因此实验选用甲醇作为提取溶剂。
2.3.2 净化条件的优化 全氟化合物检测中常采用固相萃取小柱净化,如WAX弱阴离子交换萃取柱、HLB固相萃取柱和C18反相固相萃取小柱等[7,11]。这些方法操作繁琐、耗时,且成本较高。本研究则采用分散固相萃取进行净化,考察了不净化以及添加C18、PSA和石墨化碳黑(GCB)对PFCs回收率的影响(见图2)。结果显示,PSA对目标化合物的吸附较大,这与文献[14]报道相符,是因为PFCs属于有机酸类物质,在甲醇溶液中PSA上的胺基与PFCs上的羧基存在着较强的电荷吸附作用。石墨化碳黑表面含有苯二酚类、醌类、苯并呋喃等氧复合物,使其表面带有正电荷,具有阴离子交换功能,而全氟化合物是阴离子表面活性剂,因此石墨化碳黑对目标化合物也有一定的吸附性。C18对目标化合物的吸附较少,但随着用量的增加,对长链全氟羧酸也有一定的吸附。进一步考察了C18用量( 1~100 mg) 对回收率和净化结果的影响(见图3),结果显示,C18用量为10 mg时的去杂质效果最好,且能满足大部分化合物的回收率要求,故C18用量选择10 mg。
表1 14种化合物的分子式、保留时间、精确质量数、质量误差以及质谱碎片离子
Table 1 Molecular formulas,retention times,diagnostic precursor ions,sequential multistage fragment ions (MS2and MS3) and theoretical accurate masses of 14 perfluorinated compounds
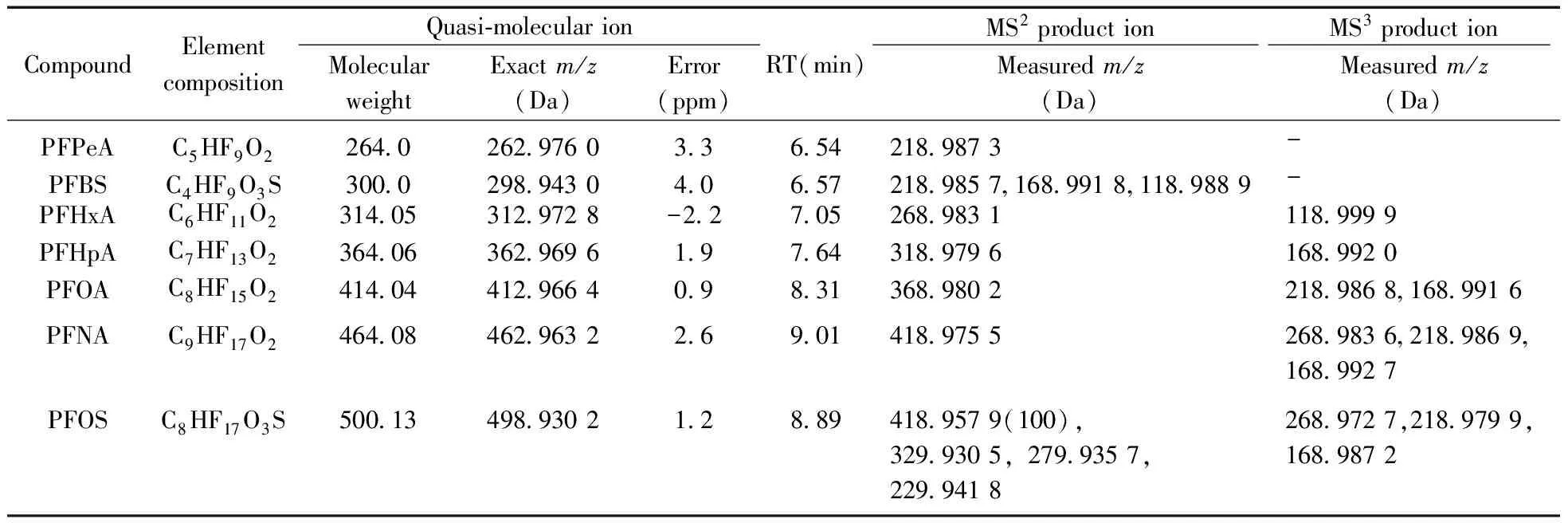
CompoundElementcompositionQuasi⁃molecularionMolecularweightExactm/z(Da)Error(ppm)RT(min)MS2productionMS3productionMeasuredm/z(Da)Measuredm/z(Da)PFPeAC5HF9O226402629760336542189873-PFBSC4HF9O3S3000298943040657218985716899181189889-PFHxAC6HF11O2314053129728-2270526898311189999PFHpAC7HF13O23640636296961976431897961689920PFOAC8HF15O241404412966409831368980221898681689916PFNAC9HF17O2464084629632269014189755268983621898691689927PFOSC8HF17O3S500134989302128894189579(100),3299305,2799357,22994182689727,2189799,1689872
(续表1)
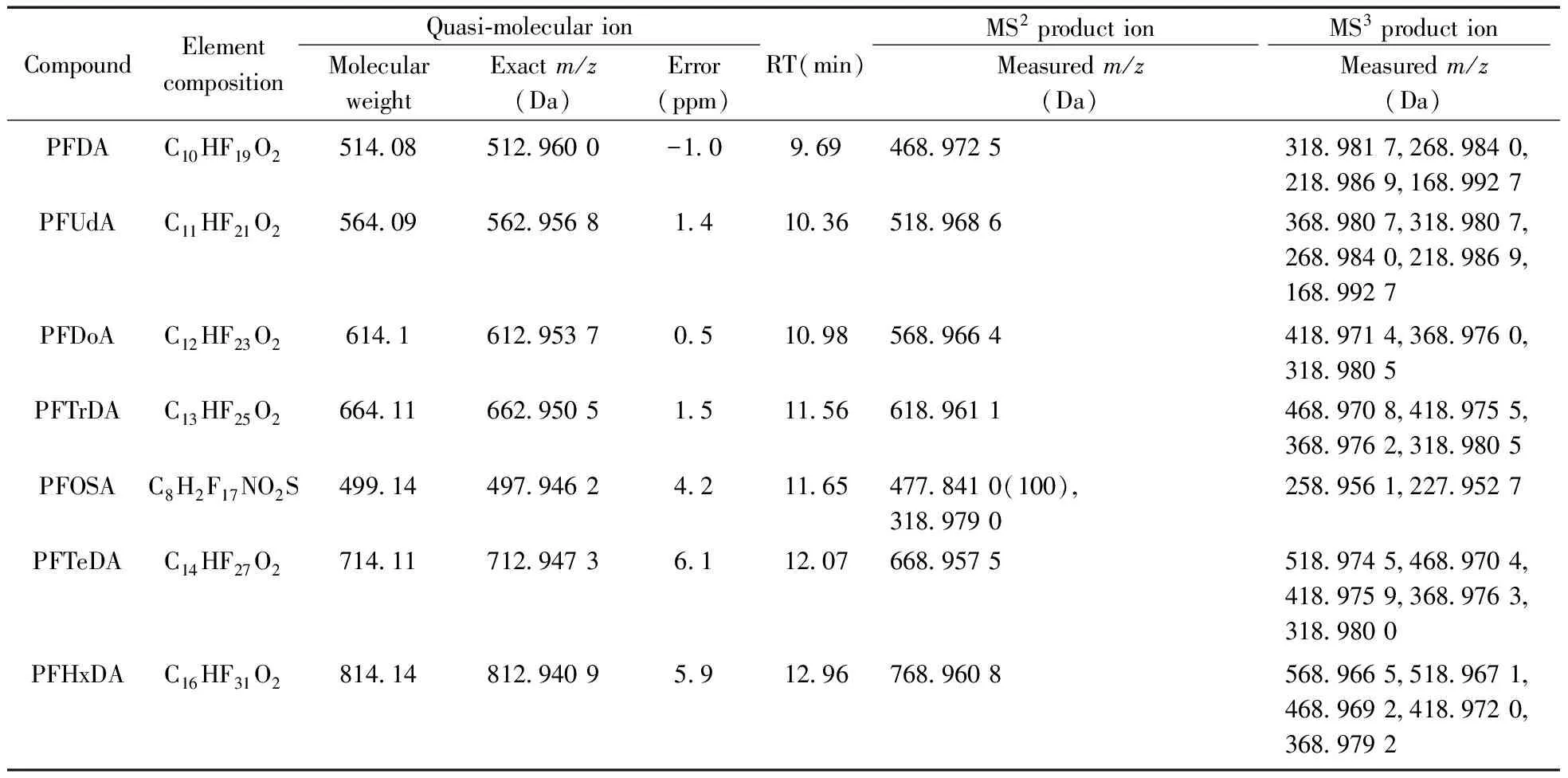
CompoundElementcompositionQuasi⁃molecularionMolecularweightExactm/z(Da)Error(ppm)RT(min)MS2productionMS3productionMeasuredm/z(Da)Measuredm/z(Da)PFDAC10HF19O2514085129600-1096946897253189817268984021898691689927PFUdAC11HF21O2564095629568141036518968636898073189807268984021898691689927PFDoAC12HF23O2614161295370510985689664418971436897603189805PFTrDAC13HF25O266411662950515115661896114689708418975536897623189805PFOSAC8H2F17NO2S4991449794624211654778410(100)318979025895612279527PFTeDAC14HF27O2714117129473611207668957551897454689704418975936897633189800PFHxDAC16HF31O2814148129409591296768960856896655189671468969241897203689792
-:not available
2.4 空白干扰的消除
为了防止实验用品带来的污染,实验过程中应避免使用聚四氟乙烯材质的用品(如色谱管路、器皿和试剂瓶盖等),因此本实验采用的色谱管路为测定全氟化合物专用的peek塑料管和不锈钢管。同时大多数全氟化合物会不可逆地吸附在玻璃表面,实验中也应避免使用玻璃容器。本实验使用的离心管和进样小瓶均为聚丙烯材质。
2.5 线性范围、方法检出限、回收率与精密度
用甲醇配制系列不同浓度的混合标准溶液进行测定,以各组分的峰面积对质量浓度绘制标准曲线,求得各化合物的线性回归方程和相关系数,外标法定量。负离子模式下,该高分辨质谱的提取精确质量数色谱图中基线噪声极低,几乎可以忽略,因此在确定方法检出限(LOD)时,参考已有文献[15]方法用空白基质提取液逐级稀释标准溶液至仪器所能检出的最低浓度,换算为方法的LOD(表2)。以阴性棉布和涤纶样品进行低、中、高3个水平(10,50,100 μg/kg)的加标回收率实验,每个浓度水平平行测定6次,平均回收率和相对标准偏差(RSD)结果如表2所示。除全氟十六烷酸的回收率偏低外,其他化合物的平均回收率为60.9%~101.4%,RSD为1.1%~14.0%。采用空白基质配制标准曲线,考察基质效应的影响,结果发现样品基质对全氟十六烷酸存在很强的抑制作用,抑制率高达40%,导致其回收率偏低,而其他化合物的基质效应则不明显。
2.6 定性筛查及确证
实际样品检测时,将所获得总离子流图,应用精确质量数提取,通过检索精确质量数谱库,得到每种化合物与精确质量谱库中化合物的匹配度,并根据保留时间及多级特征碎片离子进行确证。图4为含有全氟丁磺酸的涤纶样品的精确质量数离子提取色谱图和一级、二级碎片离子质谱图,由于高分辨质谱的分辨率高,能提供精确质量数,同时根据保留时间和多级碎片离子确认,能显著提高方法的选择性,减少假阳性结果。对样品中非目标物进行定性分析时,首先根据精确质量数,运用分子式预测软件推测其可能的元素组成、化学式以及不饱和度,然后通过多级质谱功能,分析其特征碎片离子,并与全氟烷基羧酸和全氟烷基磺酸类化合物裂解过程中产生的共同特征碎片离子相比较,推导出可能的结构式及质谱裂解途径。因此该方法能够在无标准物质的情况下进行筛查。
表2 14种全氟化合物的线性范围、相关系数、检出限、平均回收率及相对标准偏差(n=6)
Table 2 Linear ranges,correlation coefficients (r),limits of detection (LOD),average recoveries and RSDs of perfluorinated compounds(n=6)
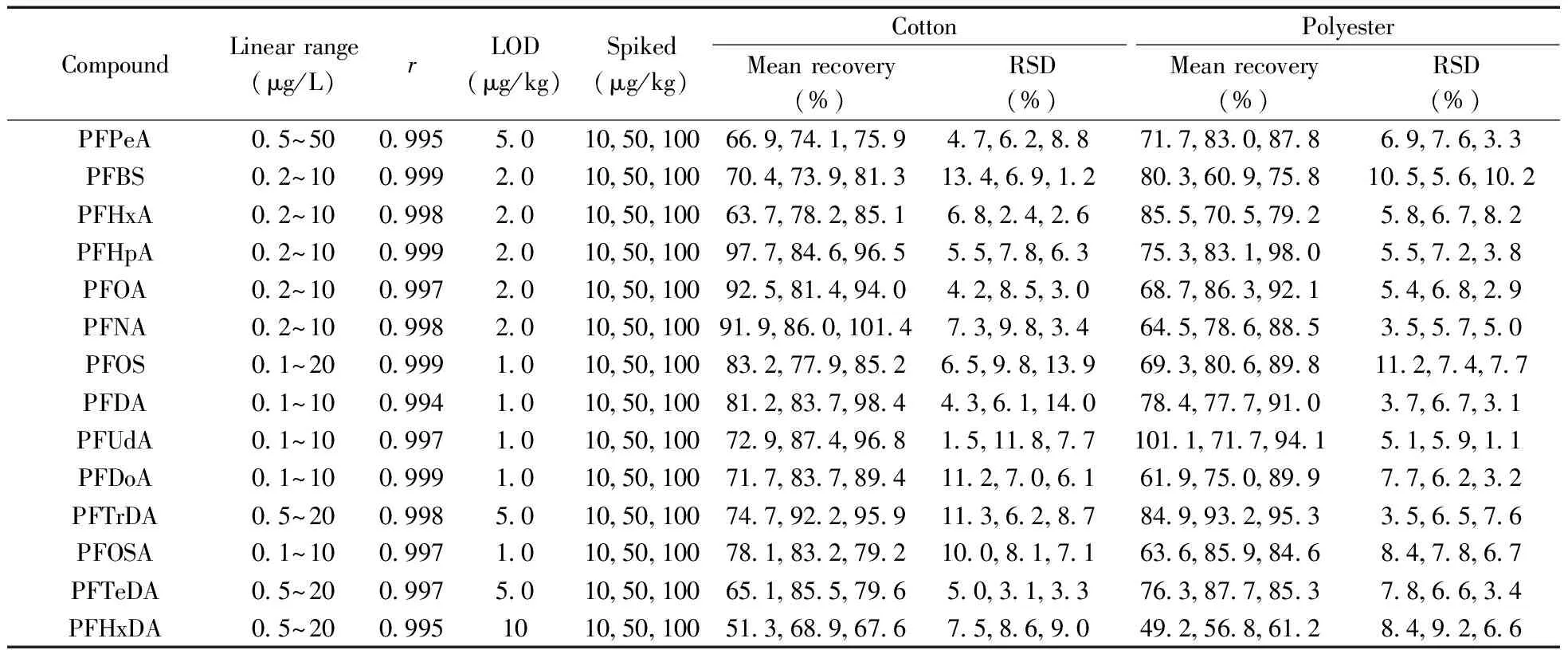
CompoundLinearrange(μg/L)rLOD(μg/kg)Spiked(μg/kg)CottonPolyesterMeanrecovery(%)RSD(%)Meanrecovery(%)RSD(%)PFPeA05~500995501050100669741759476288717830878697633PFBS02~100999201050100704739813134691280360975810556102PFHxA02~100998201050100637782851682426855705792586782PFHpA02~100999201050100977846965557863753831980557238PFOA02~100997201050100925814940428530687863921546829PFNA02~1009982010501009198601014739834645786885355750PFOS01~20099910105010083277985265981396938068981127477PFDA01~1009941010501008128379844361140784777910376731PFUdA01~10099710105010072987496815118771011717941515911PFDoA01~1009991010501007178378941127061619750899776232PFTrDA05~2009985010501007479229591136287849932953356576PFOSA01~1009971010501007818327921008171636859846847867PFTeDA05~200997501050100651855796503133763877853786634PFHxDA05~200995101050100513689676758690492568612849266
2.7 实际样品的测定
应用本方法对48个纺织样品(棉、麻、丝、纯涤、棉涤混纺、棉涤腈纶混纺纤维等)进行测定。结果检出全氟丁磺酸,其含量范围为0.08~1.65 mg/kg。少数样品检出全氟辛基磺酸,但其含量均低于0.03 mg/kg。图4为某一样品中全氟丁磺酸的提取离子流图和一级、二级质谱图。
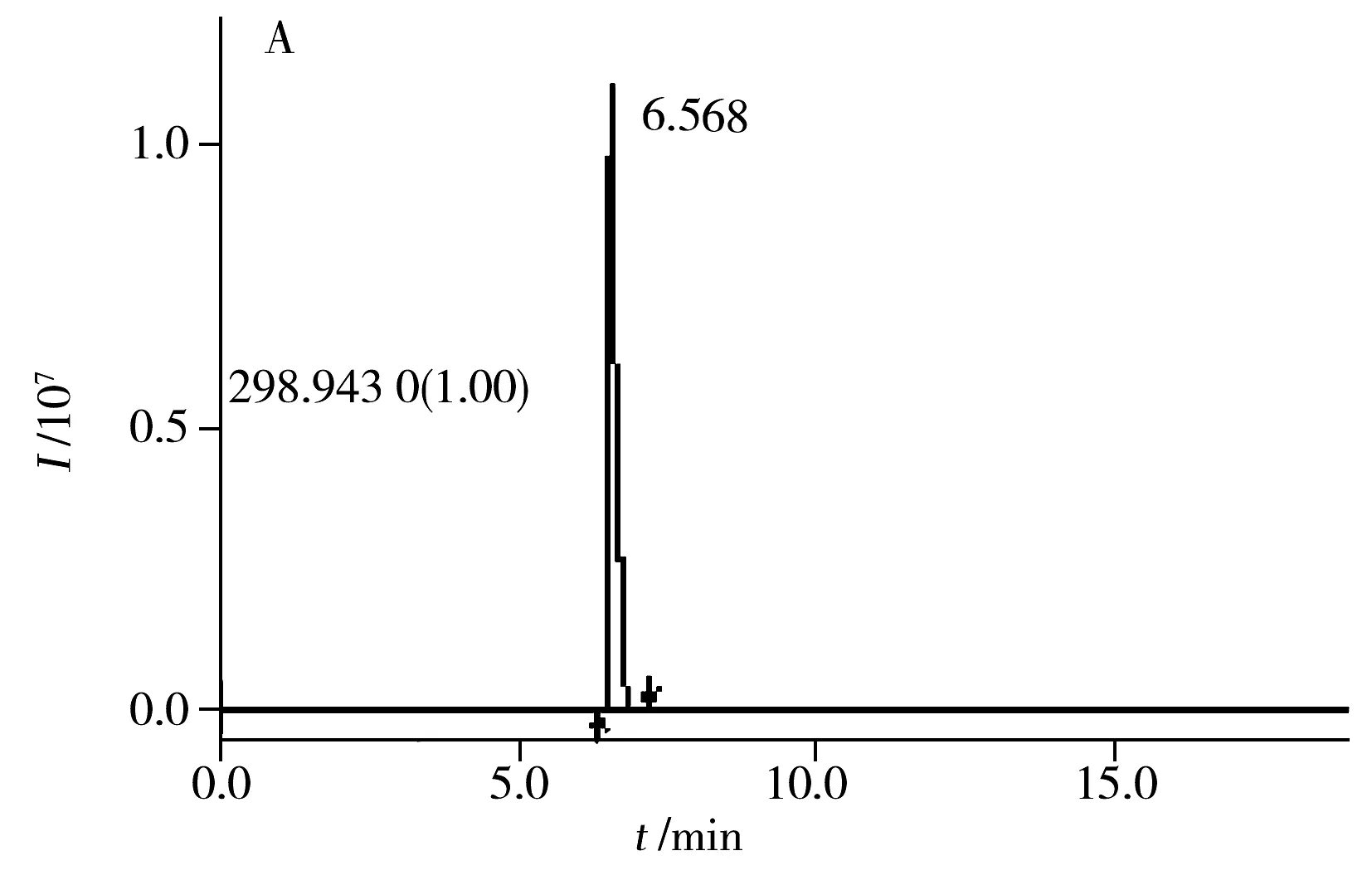
Fig.4 Extracted ion chromatogram of PFBS in a polyester sample (A) and its MS(B) and MS2(C) spectra
3 结 论
本文建立了纺织品中14 种全氟化合物的液相色谱-离子阱-飞行时间串联质谱的筛查和确证方法。样品经甲醇提取,QuEChERS 技术净化后,通过离子阱-飞行时间质谱的精确质量数匹配和二级特征碎片离子标准谱库检索进行确证。该方法简便、快速、选择性高、抗干扰性好,可在无标准物质的情况下,通过精确质量数对非目标物进行快速筛查,并通过谱库检索、分子式预测以及多级碎片离子质谱进行鉴定。方法适用于纺织品中全氟化合物的快速筛查和定量分析。
[1] Shi Y L,Pan Y Y,Wang J M,Cai Y Q.Prog.Chem.(史亚利,潘媛媛,王杰明,蔡亚岐.化学进展),2009,21(213):369-376.
[2] Zhai Z Y.ShanghaiTextileSci.Technol.(翟震宇.上海纺织科技),2008,36(9):51-53.
[3] Luebker D J,Case M T,York R G,Moore J A,Hansen K J,Butenhoff J L.Toxicolgy,2005,215(1/2):126- 148.[4] Luebker D J,York R G,Hansen K J,Moore J A,Butenhoff J L.Toxicology,2005,215(1/2):149 -169.
[5] Wang L,Shao C Y,Zhang Z,Wen X H.Chin.J.Anal.Lab.(王麟,邵超英,张琢,温晓华.分析试验室),2010,5(9):62-65.
[6] Wang J Q,Lin D L,Wang G X,Li R,Lei N.Dyeing&Finishing(王建庆,林丹丽,王改侠,李戎,雷宁.印染),2010,17:35-39.
[7] Zhang X L,Liu C H,Xian Y P,Mai X X.J.Instrum.Anal.(张晓利,刘崇华,冼燕萍,麦晓霞.分析测试学报),2010,29(12):1182-1185.
[8] Huang X L,Wu H Q,Huang F,Lin X S,Zhu Z X.Chin.J.Anal.Chem.(黄晓兰,吴惠勤,黄芳,林晓珊,朱志鑫.分析化学),2007,35(11):1591-1595.
[9] SN/T 2842-2011.Determination of Perfluorooctane Sulfonoic Acid and Perfluorooctanoic Acid in Textiles-Liquid Chromatography-Tandem Mass Spectrometry Method.Import and Export Industry Testing Standards(纺织品中全氟辛烷磺酸和全氟辛酸的测定 液相色谱-串联质谱法.进出口行业检测标准).
[10] Yu H P,Lu L J,Zhang D H,Mou J,Zhou X,Li A J,Han D C,Rong H.J.TextileRes.(于徊萍,卢利军,张代辉,牟峻,周晓,李爱军,韩大川,荣会.纺织学报),2008,29(5):80-83.
[11] Yu F,Jia K L,Li J,Yang J,Sun H.Phys.Test.Chem.Anal.:Chem.Anal.(于峰,贾科玲,李娇,杨箭,孙海.理化检验:化学分册),2015,2:176-179.
[12] Wang M L,Zeng L,Yan H F,Li Y J,Dai H.J.Instrum.Anal.(王美玲,曾乐,颜鸿飞,李拥军,戴华.分析测试学报),2014,33(3):239-247.
[13] Guo B,Wang M L,Liu Y Y,Zhou J,Dai H,Huang Z Q,Shen L L,Zhang Q S,Chen B.J.Agric.FoodChem.(郭宾,王美玲,刘妍妍,周静,戴华,黄志强,申玲玲,张庆生,陈波.农业食品化学),2015,63(31):6954-6967.
[14] Feng S,Lan F,Wu X P,Shen J C,Yue Z F,Xiong B B.FoodSci.(冯沙, 蓝芳,吴晓萍,沈金灿,岳振峰,熊贝贝.食品科学),2013,34(22):143-149.
[15] Xiu X L,Luo X,Niu Z Y,Ye X W,Tang Z X,Li J Y,Wang Y W,Du W.Chin.J.Chromatogr.(修晓丽,罗忻,牛增元,叶曦雯,汤志旭,李晶莹,王勇为,杜伟.色谱),2013,31(10):961-968.
Rapid Screening and Confirmation of Perfluorinated Compounds in Textiles by Dispersive Solid Phase Extraction Coupled with High Performance Liquid Chromatography-Ion Trap-Time of Flight-Tandem Mass Spectrometry
WANG Mei-ling1,DAI Jie-yun1,CHENG Jing1,ZHAO Xiao-ya2,NIU Zeng-yuan3,YAN Hong-fei1,LI Yong-jun1*
(1.Inspection and Quarantine Technology Center,Hunan Entry-Exit Inspection and Quarantine Bureau,Changsha 410004,China;2.Inspection and Quarantine Technology Center,Hubei Entry-Exit Inspection and Quarantine Bureau,Wuhan 430022,China;3.Inspection and Quarantine Technology Center,Shandong Entry-Exit Inspection and Quarantine Bureau,Qingdao 266002,China)
A method was developed for the screening,confirmation and quantification of perfluorinated compounds in textiles by liquid chromatography-ion trap-time of flight-tandem mass spectrometry (LC-MS-IT-TOF) combined with dispersive solid phase extraction.The multiple-stage fragments ion mass spectrometry database of 14 target compounds was established.The analytes in samples were extracted with methanol under ultrasonic extraction,and the extract was cleaned up with a C18sorbents.In the chromatographic analysis,14 target compounds were separated on a C8chromatographic column (150 mm×4.6 mm,3.5 μm) by gradient elution using methanol - 5 mmol/L ammonium acetate as mobile phase.The effects of species and dosages of the sorbents on recoveries of 14 target compounds were studied,and the purification conditions were optimized.The results showed that the method detection limits of the target compounds ranged from 1 μg/kg to 10 μg/kg. The average recoveries of 14 compounds at three spiked concentration levels(10,50,100 μg/kg) were in the range of 49.2%-101.4% with relative standard deviations(RSDs) of 1.1%-14.0%.The screening of analytes was performed by precision mass matching acquired by full scanning and library searching.The confirmatory analysis for target compounds was performed with the retention time and qualitative fragments.This method is simple,fast,credible and highly sensitive.It could be applied in the simultaneous screening and identification of perfluorinated compounds in textiles.
textiles;perfluorinated compounds;ion trap-time of flight tandem mass spectrometry (IT-TOF-MS);screening;dispersive solid phase extraction;high performance liquid chromatography
2015-08-06;
2015-09-14
质检公益性行业科研专项项目(201310062-2)
研究报告
10.3969/j.issn.1004-4957.2016.03.001
O657.63;TL281
A
1004-4957(2016)03-0257-07
*通讯作者:李拥军,研究员,研究方向:食品中农兽药残留的检测,Tel:0731-85627820,E-mail:Liyj@hrnciq.gov.cn

