三维有序金掺杂纳米TiO2修饰电极用于抗肿瘤药物与DNA相互作用的研究
彭心声,朱丽丽,刘彦蕊,杜江燕,2,3*
(1.南京师范大学 化学与材料科学学院,江苏 南京 210046;2.江苏省生物功能材料重点实验室,
三维有序金掺杂纳米TiO2修饰电极用于抗肿瘤药物与DNA相互作用的研究
彭心声1,朱丽丽1,刘彦蕊1,杜江燕1,2,3*
(1.南京师范大学 化学与材料科学学院,江苏 南京 210046;2.江苏省生物功能材料重点实验室,
江苏 南京 210046;3.江苏省新型动力电池重点实验室,江苏 南京 210046)
利用模板法在氧化铟锡(ITO)电极表面制备了三维有序多孔结构的金掺杂纳米TiO2薄膜修饰电极(3DOM GTD/ITO),并在此修饰电极上成功固定小牛胸腺DNA(ctDNA),从而构建了一种新型的DNA生物传感器(DNA/3DOM GTD/ITO),并通过透射电镜(TEM)、扫描电镜(SEM)对修饰电极的表面形貌进行表征。采用电化学交流阻抗(EIS)法研究了ctDNA在3DOM GTD/ITO修饰电极表面的固定情况,结果表明,ctDNA已被成功地固定在3DOM GTD/ITO修饰电极表面。采用循环伏安法、微分脉冲伏安法等电化学方法研究了抗肿瘤药物槲皮素(Qu)在3DOM GTD/ITO修饰电极表面的电化学性质及与ctDNA的相互作用。结果表明,Qu在3DOM GTD/ITO修饰电极表面有1对准可逆的氧化还原峰,其氧化还原反应为2电子和2质子的转移过程。Qu可与固定在修饰电极上的ctDNA发生较强的结合作用,其结合常数(K)为3.61×106L/mol。循环伏安实验、紫外-可见吸收光谱、分子荧光光谱、圆二色性光谱均表明Qu与ctDNA之间的相互作用模式为嵌插作用。Qu与ctDNA的碱基结合具有序列选择性,对Qu与聚(dG-dC)及聚(dA-dT)的结合常数进行计算,得到结合常数比K(dG-dC )/K(dA-dT)=3.5,表明Qu与ctDNA发生嵌插作用时更倾向于结合在GC富集区域。
三维有序多孔结构;金掺杂纳米TiO2;DNA修饰电极;槲皮素;嵌插作用;序列选择性
DNA(脱氧核糖核酸)是所有生物的基本遗传物质,一些药物分子与DNA的作用,会引起DNA生理和物理化学性质的变化,从而影响其转译和复制过程。研究药物分子与DNA的相互作用,有助于人们了解DNA与药物分子的相互作用方式,对新型药物的设计合成具有重要意义。DNA电化学传感器能对许多重要的小分子化合物(包括环境污染物、致癌物、药物等)进行分子识别,可用于DNA与这些物质相互作用的研究[1]。通过研究DNA修饰电极上小分子与DNA作用前后的电化学信号变化,可以探讨小分子与DNA的相互作用机理、作用模式及结合位点,以及结合常数、碱基选择性等信息[2]。
槲皮素( Quercetin,Qu) 是许多天然中草药如银杏叶、高良姜、鱼腥草、柴胡等的主要成分[3],属于黄酮醇类化合物,化学命名为3,3′,4′,5,7-五羟基黄酮,具有抗病毒、抗过敏、抑制血小板聚集、抗炎和抗肿瘤活性。槲皮素能显著抑制促癌剂的作用,抑制离体恶性细胞的生长,抑制艾氏腹水癌细胞DNA、RNA和蛋白质合成,是目前已知的最强抗癌剂之一[4-6]。
目前,关于Qu与DNA相互作用的电化学研究已有报道,如周晶等[7]研究了Qu与DNA的作用,指出其作用模式为静电作用;李南强等[8]对Qu与DNA作用的活性作用位点及其反应动力学和作用机理进行了研究,指出DNA与Qu的活性作用位点为Qu的B环上3′,4′位的羟基。但上述研究大部分在Qu与DNA溶液中进行,所需试剂量大,且存在较大的背景干扰。因此,研制新型的DNA电化学传感器,并在此基础上开展抗肿瘤药物与DNA的相互作用研究,具有重要的理论意义及应用价值。
在电化学生物传感器的制备中,生物活性分子在电极表面的固定直接关系到生物传感器的稳定性、重现性、灵敏度等性能,是制备过程中的关键步骤。本课题组采用模板法制备了三维有序金掺杂纳米TiO2薄膜修饰电极(3DOM GTD/ITO),并在修饰电极表面成功固定了辣根过氧化物酶(HRP)、肌红蛋白(HB)、细胞色素C(Cyt C)以及DNA等生物分子[9-13],构建了酶及DNA生物电化学传感器。该修饰电极比表面积大,吸附能力强,具有良好的生物相容性和电催化活性。此外,该材料的三维有序多孔结构可以有效控制DNA在电极上固定的取向,避免固载过程中引起DNA的变性和失活。
本研究基于在3DOM GTD/ITO电极表面构建的DNA电化学传感器(DNA/3DOM GTD/ITO),通过电化学及紫外-可见吸收光谱、分子荧光光谱、圆二色性光谱等实验方法研究了Qu与DNA相互作用的结合模式、结合常数,以及Qu与DNA作用的序列选择性,为该DNA修饰电极用于抗肿瘤药物分子与DNA等生物大分子的相互作用研究提供了新方法。
1 实验部分
1.1 试剂与仪器
小牛胸腺DNA(ctDNA,美国Sigma公司),槲皮素(Qu,国药集团化学试剂有限公司),氯金酸(分析纯,上海试剂一厂),聚苯乙烯微球(PS,1%,290±15 nm,实验室自制);ITO玻璃(西安泰金工业电化学技术有限公司,R<20 Ω/cm2),实验时切割成60 mm ×10 mm ×1.2 mm。其他试剂均为分析纯,溶液用二次水配制。
ctDNA溶液的配制:取5 mg 的ctDNA置于10 mL离心管中,向其中加入5 mL二次水,将此离心管放入冰浴中搅拌6 h,直至DNA完全溶解,即得到1 mg/mL的ctDNA储备液。ctDNA储备液用1 mL离心管分装,置于-20 ℃冰柜中保存备用。ctDNA溶液的浓度通过测定DNA在260 nm处吸光度来确定(摩尔吸光系数ε260=6 600 mol·cm-1[14])。实验所用ctDNA溶液的质量浓度为0.2 mg/mL,浓度为1.13×10-4mol/L。
DNA寡核苷酸序列由上海生工生物工程股份有限公司合成,分别为:(dA-dT)26:AAATTTAATTAATTTTAAATTAATTA;(dG-dC)26:GGGCCCGGCCGGCCCCGGGCCGGCCG。
CHI 760型电化学工作站(上海辰华仪器有限公司),JSM 7600F型扫描电子显微镜(日本电子公司),H-7650型透射电镜(日本Hitachi公司),Cary50型紫外吸收分光光谱仪(北京普析通用公司),Chriascan型数字式圆二色性光谱仪(Applied Photophysis公司),Cary Eclipse型分子荧光光谱仪(美国瓦里安公司)。
1.2 修饰电极的制备
清洗ITO玻片:首先将ITO玻片在碱液(氢氧化钠和乙醇混合溶液配制)中浸泡30 min,再依次在异丙醇、乙醇、二次水中各超声30 min,用二次水冲洗玻片3次,自然晾干后备用。
组装模板:利用蒸发自组装法,将1%的PS小球乙醇溶液置于称量瓶中(35 mm×70 mm),然后将处理好的ITO玻片悬于其中,40 ℃下在真空干燥箱中放置约3 d。随着乙醇的挥发,PS小球将自动组装在ITO玻片上,之后将该玻片于95 ℃烘箱中恒温2 h,使PS小球在ITO电极上固化,即得PS小球模板。
灌装溶胶:掺金纳米TiO2溶胶按文献[15]方法制备。将制备的溶胶超声10 min,得到金纳米TiO2溶胶悬浊液。取5 μL悬浊液,沿模板斜面缓缓滴下,直至溶胶浸润整片模板。室温晾干,再次滴加制备的溶胶,重复上述灌装过程2次,室温晾干,备用。
高温煅烧去除模板:采用马弗炉高温煅烧去除模板中的PS小球,以2 ℃/min升温至500 ℃后恒温2 h,再以2 ℃/min降至室温,留在ITO玻片上的多孔有序结构即为三维有序金掺杂纳米TiO2,记为3DOM GTD/ITO。
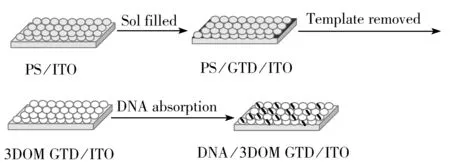
图1 修饰电极的制备过程示意图Fig.1 Schematic diagram of preparation process of the modified electrode
固定DNA:将10 μL CT-DNA溶液滴在上述电极上,至溶液均匀地浸润整片电极,置于4 ℃冰箱中,静置过夜。取出电极用二次水清洗3次,以除去非特异性吸附的DNA,置于4 ℃下晾干,即得DNA/3DOM GTD/ITO电极,于4 ℃下储存,备用。上述DNA修饰电极制备过程见图1。
1.3 实验方法
紫外-可见吸收光谱:以0.1 mol/L 的HAc-NaAc缓冲溶液(pH 5.5)为参比溶液,在1 cm的比色皿中,于200~500 nm范围内测定Qu与DNA作用前后溶液的紫外-可见吸收光谱。
分子荧光光谱:以0.1 mol/L的HAc-NaAc缓冲溶液(pH 5.5)为参比溶液,λex为421 nm,在λem500~700 nm范围内测定5.0×10-5mol/L Qu与不同浓度DNA溶液相互作用的分子荧光光谱。
圆二色性光谱:以pH 7.4的PBS为参比溶液,在1 cm的石英比色皿中,以120 nm/min的扫描速率,在260~350 nm范围内连续扫描DNA与Qu作用前后DNA溶液的圆二色性光谱。
电化学实验:使用传统的三电极体系,工作电极为制备的修饰电极,参比电极为饱和甘汞电极(SCE),对电极为铂电极,所有电位均相对于SCE。药物分子Qu与DNA相互作用的循环伏安实验在0.1 mol/L的HAc-NaAc缓冲溶液(pH 5.5)中进行,扫速为200 mV/s,电位范围为0~0.5 V。不同修饰电极的循环伏安实验在5.0×10-3mol/L的[Fe(CN)6]4-/3-及0.1 mol/L KCl的支持电解质溶液中进行,电位范围为-0.6~1.0 V,扫速为10 mV/s。交流阻抗分析在5.0×10-3mol/L的[Fe(CN)6]4-/3-+0.1 mol/L KCl溶液中进行,开路电压为0.211 V,频率为0.1~10 000 Hz。实验前通入高纯氮气15 min除氧,实验中保持氮气氛围,所有实验均在25 ℃下进行。
2 结果与讨论
2.1 修饰电极的形貌表征
采用透射电镜实验(TEM)表征纳米金在TiO2溶胶中的分布及金纳米粒子的粒径。结果显示,金纳米粒子均匀分布在纳米TiO2溶胶中,且粒径均一(约20 nm),无团聚现象。
采用扫描电镜(SEM)对三维有序多孔结构制备过程中电极表面的形貌进行表征。图2A为自组装PS微球模板的SEM图,可以看到PS微球均匀地排列在ITO上;图2B为灌装溶胶后PS模板的SEM图,掺金的纳米TiO2溶胶已均匀地灌装到PS微球的缝隙中;图2C为煅烧后在ITO玻片电极表面得到的三维有序多孔结构,制备的三维多孔结构层次清晰、表面整齐有序、孔径均一。
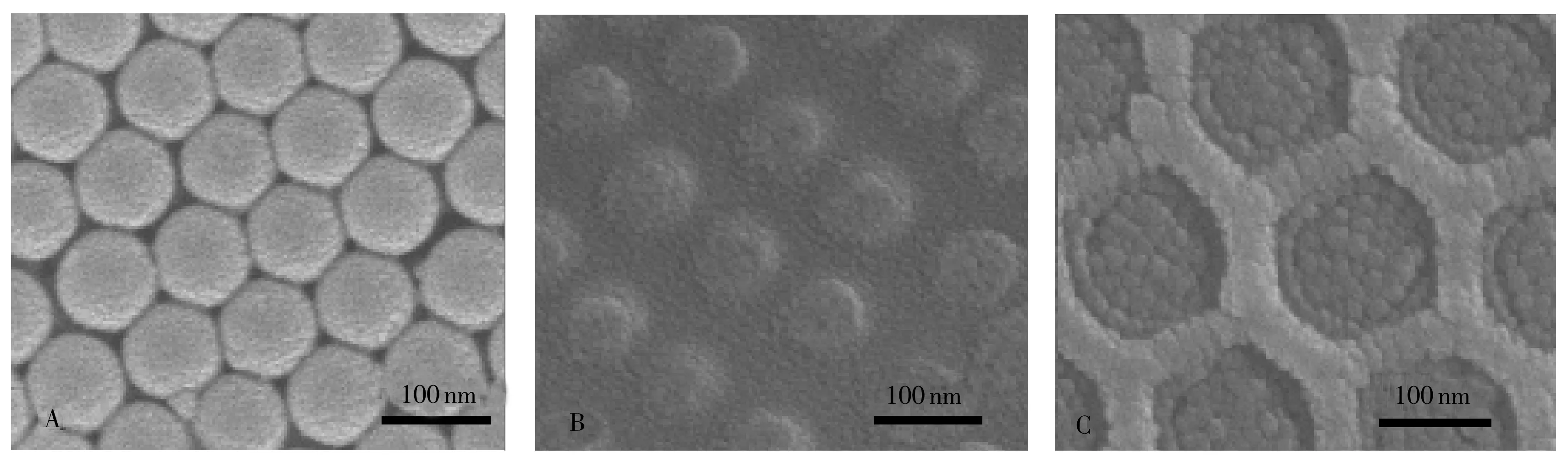
图2 PS模板(A)、PS-GTD(B)与3DOM GTD(C)的SEM图Fig.2 SEM images of PS template(A),PS template-GTD(B) and 3DOM GTD(C)
2.2 修饰电极的电化学表征
在扫速为10 mV/s,电位范围为-0.6~1.0 V时,考察了不同修饰电极在5.0 ×10-6mol/L[Fe(CN)6]4-/3-和0.1 mol/L KCl的支持电解质溶液中的循环伏安图(见图3A)。可观察到,在3DOM GTD/ITO修饰电极上,[Fe(CN)6]4-/3-有1对很好的氧化还原峰,分别为Epa=0.41 V,Epc=-0.041 V,峰电位差ΔEp=0.451 V(图3曲线a)。在DNA/3DOM GTD/ITO修饰电极上,[Fe(CN)6]4-/3-的氧化还原峰电流明显降低(图3A曲线b),且峰电位差增大为ΔEp=0.559 V,这是因为ctDNA分子的磷酸骨架带负电荷,排斥同样带负电荷的[Fe(CN)6]4-/3-接近电极,使[Fe(CN)6]4-/3-在电极表面的电子转移速率降低[2],因此[Fe(CN)6]4-/3-的氧化还原峰电流降低,实验结果表明ctDNA已成功固定在修饰电极上。
Fig.3 Cyclic voltammograms(A) and EIS spectra(B) of different electrodes
a.3DOM GTD/ITO,b.DNA/3DOM GTD/ITO ,c.ITO;buffer:5.0 ×10-6mol/L[Fe(CN)6]4-/3-+0.1 mol/L KCl
电化学阻抗谱(EIS)可以提供不同修饰电极表面的阻抗变化信息[16],EIS图中半圆的直径越大,表明电极表面电子转移的阻抗值越大。图3B为不同修饰电极在[Fe(CN)6]4-/3-溶液中的EIS图,从图中可以看出,不同电极的交流阻抗值按以下顺序减小:DNA/3DOM GTD/ITO>3DOM GTD/ITO>ITO。由于纳米TiO2是半导体材料,其修饰到ITO电极上使电极的电阻有所增大。当电极表面吸附ctDNA后,其电阻明显增大,表明ctDNA已成功地固定在修饰电极上,吸附的ctDNA阻碍了[Fe(CN)6]4-/3-和电极之间的电子转移。
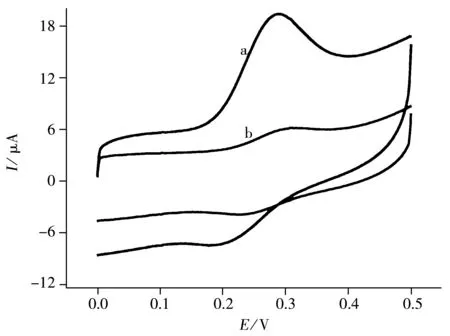
图4 不同修饰电极上Qu在0.1 mol/L HAc-NaAc缓冲溶液(pH 5.5)中的循环伏安图Fig.4 Cyclic voltammograms of Qu at various electrodes in 0.1 mol/L HAc-NaAc buffer(pH 5.5) a.3DOM GTD/ITO,b.DNA/3DOM GTD/ITO;scan rate:0.2 V/s
在0~0.5 V电位范围内,扫速为200 mV/s时,不同修饰电极置于5.0×10-4mol/L的Qu和0.1 mol/L的HAc-NaAc缓冲溶液(pH 5.5)中的循环伏安图见图4。由图4a可以看出,在3DOM GTD/ITO修饰电极上,Qu有1对准可逆的氧化还原峰,其阳极峰电位(Epa)和阴极峰电位(Epc)分别为0.289 V和0.178 V,电位差为0.111 V,氧化还原式电位E0′为0.234 V。在DNA/3DOM GTD/ITO修饰电极上(图4b),其Epa和Epc分别是0.309 V和0.239 V,电位差为0.07 V,氧化还原式电位E0′为0.274 V。在DNA修饰电极上,Qu氧化还原峰电流均有不同程度地减小,且式电位发生正移,ΔE0′=0.04 V。
考察了不同pH值的HAc-NaAc缓冲溶液对Qu电化学活性的影响。结果显示,随着缓冲液pH值的增加,Qu的氧化峰电流逐渐增加,当pH值为5.5时,峰电流达到最大,此后随着pH值继续增大,峰电流反而减小。因此,实验采用pH 5.5的HAc-NaAc缓冲溶液为支持电解质。
循环伏安实验中,考察了Qu氧化峰电位与支持电解质pH值的关系曲线。根据线性方程的相关系数(r2=0.998 5)和曲线斜率(-0.07),通过能斯特方程计算出Qu氧化还原反应中,电子转移数与质子转移数均为2,这与文献[2]报道的Qu在DNA修饰玻碳电极上的电化学研究结论一致。
Qu的氧化还原反应过程如图5所示,Qu的分子结构中A环为苯甲酰,B环为肉桂酰,其中B环上3′,4′位的羟基是氧化还原活性基团。
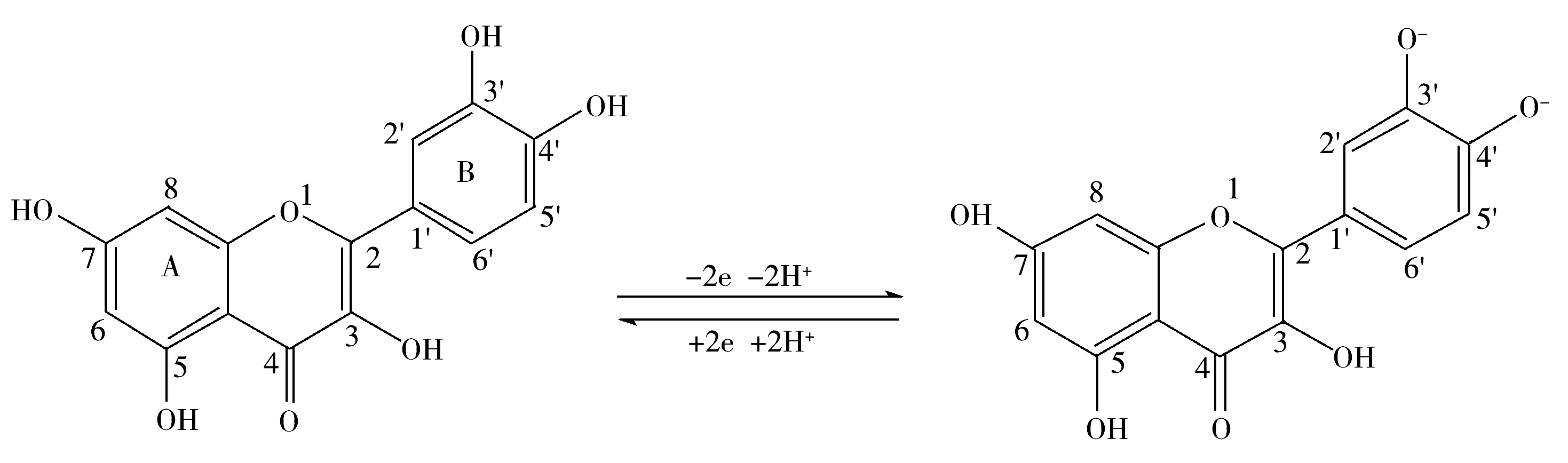
图5 槲皮素的氧化还原反应过程[2]Fig.5 The electrochemical reaction process of Qu[2]
2.3 Qu与DNA的结合模式及结合常数
通常认为,小分子与DNA之间的作用方式主要有嵌插作用、沟槽结合及静电作用。Bard等[17]提出,当小分子与DNA发生作用时,如果其氧化还原式电位E0′向负方向偏移,则小分子与DNA发生静电作用;如果式电位E0′向正方向偏移,则发生嵌插作用。本研究的电化学实验表明,当在3DOM GTD/ITO修饰电极上固定ctDNA后,Qu的氧化还原式电位E0′由0.234 V正移至0.274 V,因此,在DNA/3DOM GTD/ITO修饰电极上,Qu与DNA的作用方式为嵌插作用。在Qu与DNA的嵌插作用中,其分子结构的平面性是关键因素,它的平面结构使其几乎与DNA含氮碱基相邻的平面平行,有利于Qu插入到DNA的双螺旋结构中。这种嵌插作用部分掩蔽了Qu的电活性部位,因此电化学实验中观察到Qu的氧化还原反应峰电流减小。
Solimani 等[18-20]使用线性二色性光谱研究了Qu与DNA的结合方式,研究表明,Qu可以嵌插到DNA中形成DNA-Qu复合物。对于Qu和DNA形成复合物的结合常数,可以根据引入DNA前后Qu峰电流差值的倒数1/ΔI与Qu浓度1/[Qu]m的关系式计算[21]:1/ΔI=1/ΔImax+1/(K×ΔImax×[Qu]m),式中,ΔI表示引入DNA前后Qu峰电流的差值,ΔImax为峰电流差值的最大值,K为Qu和DNA的结合常数。如果Qu与DNA只形成一种简单的超分子化合物,则1/ΔI与1/[Qu]m呈线性。本实验中,1/ΔI与cQu-2呈线性,线性方程为ΔI-1=0.120 6cQu-2+4.35×105,相关系数r2=0.996 8,得出结合数m=2,即Qu与DNA形成了一种DNA-2Qu的复合物。由斜率(0.120 6)和截距(4.35×105),可求出Qu和DNA的结合常数K=3.61×106L/mol。
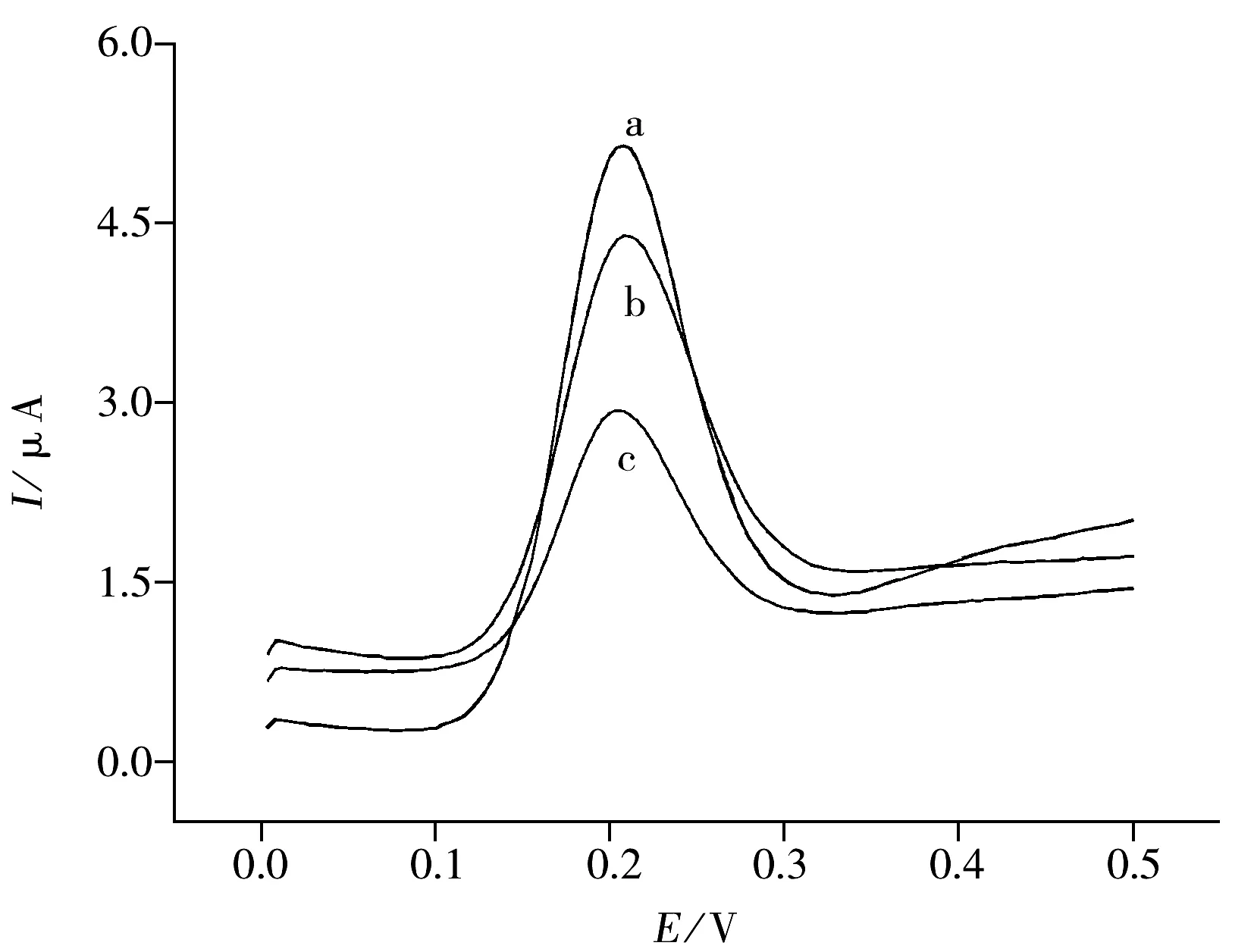
图6 不同修饰电极上Qu在0.1 mol/L HAc-NaAc缓冲溶液(pH 5.5)中的示差脉冲伏安图Fig.6 Differential pulse voltammograms of Qu at various electrodes a.3DOM GTD/ITO,b.(dA-dT)26/3DOM GTD/ITO,c.(dG-dC)26/3DOM GTD/ITO;0.1 mol/L HAc-NaAc(pH 5.5);scan rate:0.2 V/s
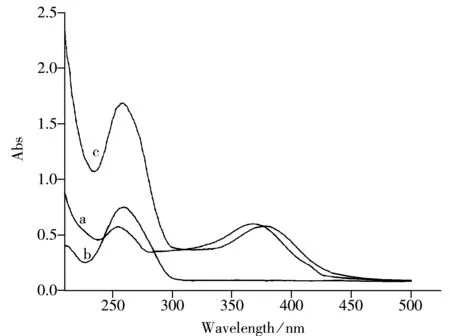
图7 Qu及DNA在0.1 mol/L HAc-NaAc缓冲溶液(pH 5.5)中的紫外可见吸收光谱图Fig.7 UV-Vis spectra of Qu and DNA in 0.1 mol/L HAc-NaAc buffer(pH 5.5)a.5.0×10-5 mol/L Qu,b.1.13×10-4 mol/L DNA, c.5.0×10-5 mol/L Qu+1.13×10-4 mol/L DNA
2.4 Qu与DNA结合的序列选择性
图6为Qu在不同修饰电极上的示差脉冲伏安图。由图可见,Qu在(dG-dC)26碱基序列DNA修饰电极(曲线c)上的峰电流减小值是(dA-dT)26碱基序列DNA修饰电极(曲线b)的2.3倍。研究了Qu在3DOM GTD/ITO、(dA-dT)26/3DOM GTD/ITO及(dG-dC)26/3DOM GTD/ITO修饰电极上峰电流与Qu浓度的关系曲线。结果表明,Qu在(dG-dC)26碱基序列DNA修饰电极上的峰电流值最低,表明Qu对DNA的GC碱基序列表现出更高的序列选择性,由此推测Qu与ctDNA发生嵌插作用时更倾向于结合在GC富集区域。
ctDNA是典型的B型DNA,具有宽而浅大沟结构,有利于黄酮类化合物Qu的插入。通常稠合芳环体系与DNA作用时倾向于结合在GC富集区[22],为进一步确定Qu与DNA碱基序列结合的选择性,按照“2.3”所述方法分别计算Qu与(dG-dC)26,(dA-dT)26碱基序列作用的结合常数,得到KdA-dT=5.40×106L/mol,KdG-dC=1.90×107L/mol,即K(dG-dC )/K(dA-dT)=3.5。此数据表明,Qu与ctDNA发生嵌插作用时更倾向于结合在GC富集区域。
2.5 Qu与ctDNA相互作用的光谱表征
2.5.1 Qu与ctDNA相互作用的紫外-可见吸收光谱 Qu及DNA在0.1 mol/L的HAc-NaAc缓冲溶液(pH 5.5)中的紫外可见吸收光谱见图7。其中曲线a 为Qu的紫外-可见吸收光谱,最大吸收峰为λQu1=254 nm,λQu2=368 nm。曲线b为ctDNA的紫外-可见吸收光谱,最大吸收峰为λDNA=260 nm。曲线c为Qu与ctDNA混合溶液的紫外-可见吸收光谱,可观察到Qu与ctDNA作用后,Qu在368 nm处的最大吸收峰吸光度减小,且最大吸收峰从368 nm红移至376 nm,表现出减色红移效应。通常认为,小分子与DNA发生相互作用后,如果其吸收光谱上观察到减色、等吸收点、光谱红移等3种光谱现象,则表明小分子与DNA以嵌插方式键合;若吸收光谱受DNA的影响较小,无减色效应和红移现象,则说明小分子与DNA之间存在静电作用。这是因为嵌入的小分子与DNA碱基对可发生π电子堆积,作用配体的π空轨道与碱基的π轨道发生偶合,使能量降低,导致π→π跃迁能量减小,从而产生红移现象;同时,偶合后的π轨道因部分填充电子,使π→π跃迁几率减小,产生减色效应[23]。因此,紫外-可见光谱实验结果表明Qu与ctDNA间的作用方式符合嵌插作用特征。
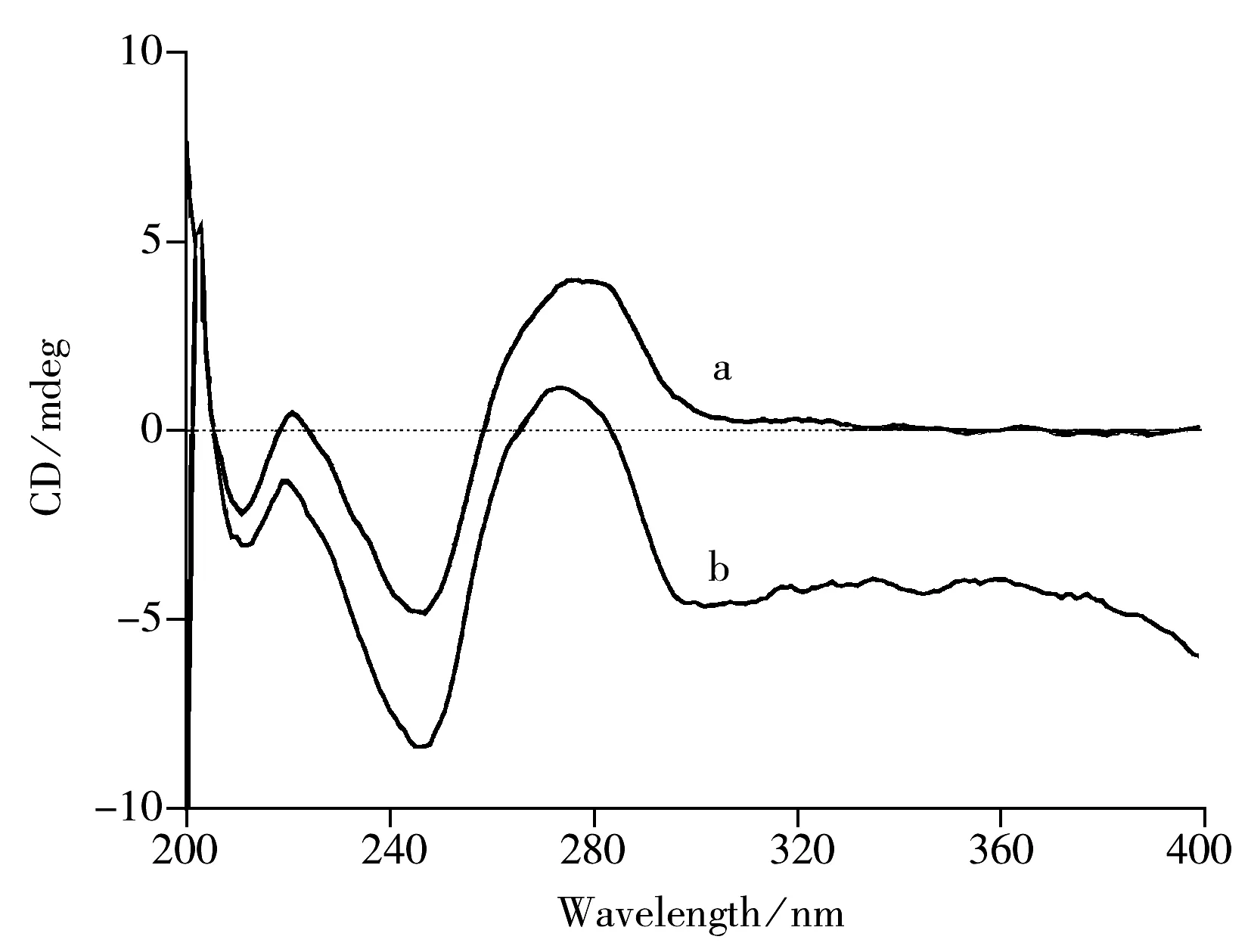
图8 Qu及DNA在0.1 mol/L HAc-NaAc缓冲溶液(pH 5.5)中的圆二色性光谱Fig.8 CD spectra of Qu and DNA in 0.1 mol/L HAc-NaAc buffer(pH 5.5)a.5.65×10-4 mol/L DNA,b.1.0×10-3 mol/L Qu+5.65×10-4 mol/L DNA
2.5.2 Qu与DNA相互作用的分子荧光光谱 在pH 5.5的HAc-NaAc缓冲溶液中,向5.0×10-5mol/L的Qu溶液中加入不同浓度ctDNA后,扫描体系的荧光光谱。结果显示,Qu的荧光强度随着DNA浓度的增大而增大。这是由于Qu分子具有平面结构的共轭π键使其具有荧光,当其B环嵌入到DNA双螺旋结构的碱基对之间后,Qu的平面性增加且减少了溶剂分子对其的碰撞,因此Qu的荧光强度增强[24]。此外有文献对Qu及EB与DNA的竞争结合进行了研究[25],发现Qu可通过嵌插结合的方式取代EB-DNA复合物中的EB分子。
2.5.3 Qu与DNA相互作用的圆二色性光谱 圆二色性光谱(CD)是研究DNA与配基(包括小分子和蛋白质等大分子)相互作用的有力工具[26]。DNA的CD信号是由其骨架结构中的不对称糖分子和由这些糖分子的构型决定的螺旋结构产生的,根据配基对原有DNA的CD信号的影响,以及诱导产生的圆二色性光谱新信号(ICD)的不同特点,不仅可以得知配基与DNA间存在的相互作用,还可以推断配基与DNA结合的不同模式[26]。标准B型DNA的CD 正峰出现在280 nm附近,负峰位于245 nm附近,这些波带分别源自于碱基和聚核苷酸双螺旋结构间的堆积作用[27-28]。图8中曲线a是ctDNA在HAc-NaAc缓冲溶液(pH 5.5)中的CD光谱,其正峰分别为221 nm和276 nm,负峰为247 nm。曲线b为加入Qu后DNA的CD光谱,其正峰分别为221,272 nm,负峰为247 nm。由图可见,加入Qu后DNA在276 nm的CD谱峰位置发生位移(Δλ=4 nm),且正、负峰的强度也发生明显变化,说明Qu的加入引起了DNA构象的改变。通常平面的芳环分子通过嵌入作用插入到DNA双螺旋分子碱基对的片层间时,会引起双螺旋解旋及DNA分子伸长,结合常数一般在1.0×105~1.0×1011L/mol之间[29-30]。根据“2.3”计算得到的Qu与DNA作用的结合常数(K=3.61×106L/mol)符合小分子与DNA间嵌插作用方式的结合常数特征。此外,当小分子与DNA之间以嵌插作用方式结合时,小分子嵌入会导致碱基堆积作用发生明显的分裂,使DNA的碱基堆积力强度受到影响,使其CD谱峰信号强度明显减小[31]。由图8可见,随着Qu的加入,DNA的CD信号强度明显减小,符合小分子与DNA间的嵌插结合,进一步证实了Qu与DNA间的作用方式为嵌插作用。
3 结 论
本文采用模板法制备了3DOM GTD 薄膜修饰电极,并构建了一种新型的DNA生物传感器(DNA/3DOM GTD/ITO)。基于该DNA生物传感器,研究了抗肿瘤药物小分子Qu与DNA间相互作用的结合模式、结合位点及序列选择性,建立了一种方法简便、成本低廉的研究药物小分子与DNA相互作用的新方法。该DNA生物传感器也可应用于其他药物小分子与生物大分子(如酶、蛋白质等)相互作用的研究,为研究抗癌药物与生物大分子的作用模式、作用机理以及设计合成新型药物提供了新的思路,具有较好的实际意义和应用前景。
[1] Luan C L,Cheng S X,Jiang X H,Ma W S.FoodSci.(栾崇林,程顺喜,蒋晓华,马文石.食品科学),2008,29(8):689-692.
[2] Kang J W,Zhuo L,Lu X Q,Wu H X.J.NorthwestNormalUniv.:Nat.Sci.Ed.(康敬万,卓琳,卢小泉,吴海霞.西北师范大学学报:自然科学版),2003,39(4):57-61.
[3] Li G Z,Liu Y M.Chin.J.Anal.Chem.(李桂芝,刘永明.分析化学),2002,30(8):1022.
[4] Jakubowicz G J,Paduch R,Gawron A,Kandefer S M.FoliaHistochem.Cytobiol.,2002,40(1):31-35.
[5] She J,Mo L E,Kang T B.Chin.J.Med.Chem.(佘戟,莫丽儿,康铁邦.中国药物化学杂志),1998,8(4):287-289.
[6] Rekha J,Souren P,Young R P,Jaehong H,Sun C K.J.Photochem.Photobiol.B,2014,131:96-103.
[7] Zhou J,Wang L F,Tang N.Transit.MetalChem.,2001,26:57-63.
[8] Zhu Z W,Li C,Li N Q.Microchem.J.,2002,71(1):57-63.
[9] Li J L,Han T,Wei N N,Du J Y.Biosens.Bioelectron.,2009,25(4):773-777.
[10] Wei N N,Xin X,Du J Y,Li J L.Biosens.Bioelectron.,2011,26(8):3602-3607.
[11] An L L,Chang Y C,Du J Y.Chin.Appl.Chem.(安玲玲,常颖萃,杜江燕.应用化学),2013,30(2):171-177.[12] Chang Y C,Du J Y.J.Anal.Sci.(常颖萃,杜江燕.分析科学学报) ,2012,28(5):603-607.
[13] Yu J J,Hu Y,Peng X S,Zhu L L,Du J Y.J.Instrum.Anal.(尉洁净,胡越,彭心声,朱丽丽,杜江燕.分析测试学报),2015,34(4):401-406.
[14] Ding H Y,Song L Q,Chen J R,Wang X S,Zhang B W.Acta.Chim.Sin.(丁慧颖,宋林青,陈景荣,王雪松,张宝文.化学学报),2006,64(17):1799-1804.
[15] Wei N N,Han T,Deng G Z,Li J L,Du J Y.ThinSolidFilms,2011,519(8):2409-2414.
[16] Feng J J,Zhao G,Xu J J,Chen H Y.Anal.Biochem.,2005,342(2):280-286.
[17] Carter M T,Rodriguez M,Bard A J.J.Am.Chem.Soc.,1989,111(24):8901-8911.
[18] Solimani R,Bayon F,Domini I,Pifferi P G,Todesco P E,Marconi G,Samori B.J.Agric.FoodChem.,1995,43(4):876-882.
[19] Solimani R.Int.J.Biol.Macromol.,1996,18(4):287-295.
[20] Solimani R.Biochim.Biophys.Acta,1997,1336(2):281-294.
[21] Qu F,Li N Q,Jiang Y Y.Anal.Chim.Acta,1997,344:97-108.
[22] Barton J K,Danishefsky A T,Goldberg J M.J.Am.Chem.Soc.,1984,106:2172-2176.
[23] Li H,Le X Y,Wu J Z,Liu J,Ji L N,Jiang X,Li W S,Xu Z H.ActaChim.Sin.(李红,乐学义,吴建中,刘婕,计亮年,蒋雄,李伟善,徐政和.化学学报),2003,61(2):245-250.
[24] Song Y M,Kang J W,Lu X Q,Wang Z H,Gao J Z.Chem.J.Chin.Univ.(宋玉民,康敬万,卢小泉,王志华,高锦章.高等学校化学学报),2003,24(2):249-251.
[25] Zhuo L.J.ChongqingTechnol.BusinessUniv:Nat.Sci.Ed.(卓琳.重庆工商大学学报:自然科学版),2006,23(6):560-563.
[26] Garbett N C,Ragazzon P A,Chaires J B.Nat.Protoc.,2007,2:3166-3172.
[27] Berova N,Nakanishi K, Woody R W.CircularDichroism:PrinciplesandApplications.2nd ed.New York:Wiley-VCH,2000:703-718.
[28] Hrishikesh J,Abhigyan S,Krishna G,Partha H.RSCAdv.,2014,4:1015-1024.
[29] Martinez R,Chacon-Garcia L.Curr.Med.Chem.,2005,12:127-151.
[30] Chaires J B.Biopolymers,1997,44:201-215.
[31] Sarkar D,Das P,Basak S,Chattopadhyay N.J.Phys.Chem.B,2008,112:9243-9249.
Study on Interaction between Antitumor Drug and DNA by Three-dimensionally Ordered Gold-nanoparticle-doped Titanium Dioxide Modified Electrode
PENG Xin-sheng1,ZHU Li-li1,LIU Yan-rui1,DU Jiang-yan1,2,3*
(1.College of Chemistry and Materials Science,Nanjing Normal University,Nanjing 210046,China;2.Jiangsu Key Laboratory of Biofunctional Materials,Nanjing 210046,China;3.Jiangsu Key Laboratory of New Power Batteries,Nanjing 210046,China)
A novel DNA biosensor was fabricated with three-dimensionally ordered macroporous gold-nanoparticle-doped titanium dioxide(3DOM GTD) film on the indium-tin oxide(ITO) electrode surface by the colloidal crystal template technique,and calf thymus DNA(ctDNA)was immobilized on the 3DOM GTD/ITO successfully.The morphology of the modified electrode was characterized by transmission electron microscopy(TEM) and scanning electron microscopy(SEM).The immobilization of ctDNA on the surface of 3DOM GTD/ITO modified electrode was investigated by electrochemical impedance spectroscopy(EIS).The EIS experimental results showed that ctDNA was successfully immobilized on the 3DOM GTD/ITO modified electrode.The electrochemical properties of the antitumor drug quercetin (Qu) and the interaction between Qu and ctDNA were studied on 3DOM GTD/ITO modified electrode by cyclic voltammograms (CV) and differential pulse voltammograms(DPV) method.The result showed that Qu had a pair of quasi-reversible redox peak on 3DOM GTD/ITO modified electrode,and the transfer process of 2 electrons and 2 protons was an involved in the electrode reaction.There was a strong interaction between Qu and ctDNA immobilized on the modified electrode,and the binding constantKwas 3.61×106L/mol.The binding mode between Qu and ctDNA was an intercalation confirmed by CV,UV-Vis absorption spectra (UV-Vis),fluorescence spectra (FL) and circular dichroism spectra (CD) experiments .The sequence selectivity of binding between Qu and ctDNA was investigated,and the binding constants of Qu and poly (dG-dC) and poly (dA-dT) were calculated,respectively,according to the results of CV experiments.The binding constant ratioK(dG-dC )/K(dA-dT)was obtained to be 3.5,indicating that Qu bound to the GC region preferentially when Qu interacted with ctDNA.
three-dimensionally ordered macroporous (3DOM);gold-nanoparticle-doped titaniumdioxide (GTD);DNA modified electrode;quercetin (Qu);intercalation;sequence selectivity
2015-09-17;
2015-09-30
江苏省常州四药制药有限公司合作项目(S11090BY1502)
10.3969/j.issn.1004-4957.2016.03.004
O657.1;Q523
A
1004-4957(2016)03-0277-08
*通讯作者:杜江燕,教授,研究方向:生物传感器,Tel:025-85891767,E-mail:dujiangyan@njnu.edu.cn

