小肝癌与不典型增生结节的差异糖蛋白筛选及其聚糖结构鉴定
李 薇 张 舒 尚舒欣 金光植 秦 雪 丛文铭 刘银坤
(1复旦大学附属中山医院肝癌研究所-教育部癌变与侵袭原理重点实验室 上海 200032; 2 复旦大学生物医学研究院 上海 200032;3 第二军医大学附属东方肝胆外科医院病理科 上海 200438; 4 广西医科大学第一附属医院临床实验室 南宁 530021)
小肝癌与不典型增生结节的差异糖蛋白筛选及其聚糖结构鉴定
李 薇1,2▲张 舒1▲尚舒欣4金光植3秦 雪4丛文铭3刘银坤1,2△
(1复旦大学附属中山医院肝癌研究所-教育部癌变与侵袭原理重点实验室 上海 200032;2复旦大学生物医学研究院 上海 200032;3第二军医大学附属东方肝胆外科医院病理科 上海 200438;4广西医科大学第一附属医院临床实验室 南宁 530021)
目的 筛选不典型增生结节(dysplastic nodule,DN)和小肝癌(small hepatocellular carcinoma,sHCC)之间的差异糖蛋白,并分析其聚糖结构,为肝癌的早期诊断提供参考。方法 对DN和sHCC各15例的石蜡组织切片进行蛋白质修复和提取;运用定量蛋白质组学技术鉴定DN和sHCC中的差异糖蛋白;利用IPA分析差异糖蛋白功能与相关信号通路,筛选出与肿瘤相关的差异糖蛋白;纯化目标糖蛋白,优化抗体辅助凝集素芯片技术(antibody overlay lectin microarray)分析其聚糖结构。结果 本研究共鉴定到26个差异糖蛋白;IPA分析筛选得到肿瘤相关的重要差异糖蛋白为α-1 抗胰蛋白酶(α-1-antitrypsin,A1AT)和补体C3;相比于DN,sHCC中A1AT与凝集素CAL、GSL I、JAC、GSL II、PHA-L、GNL、WGA等亲和的聚糖结构增多,C3与CSL、LTL、WFL亲和的聚糖结构增多,此结果说明在sHCC中,A1AT的T/Tn抗原、三/四天线的N-聚糖结构、高甘露糖和唾液酸等结构的含量增加;而C3的N-乙酰半乳糖胺(GalNAc)、Lewis X 抗原[Fucα3(Galβ4)GlcNAc]、H-type 2 抗原[Fucα2(Galβ4)]和半乳糖β(1,3/1,6) 连接N-乙酰半乳糖[Galβ3(-6)GalNAc]结构增多。结论 在DN和sHCC中,A1AT、C3聚糖结构的变化可能为肝癌早期诊断提供新的糖生物学标志物。
不典型增生结节; 小肝癌; 差异糖蛋白; 凝集素
肝细胞性肝癌(hepatocellular carcinoma,HCC)是一种多基因、多因素、病理机制复杂的常见恶性肿瘤。肝硬化到肝癌的阶段可分为肝硬化、不典型增生结节(dysplasticnodule,DN)和小肝癌(small hepatocellular carcinoma,sHCC)的发展过程。不典型增生结节(dysplastic nodule,DN)发生在HBV、HCV感染的肝脏,继而发展成为sHCC并进入进展期。硬化肝中的不典型增生结节DN被公认为是肝癌癌前病变的标志物。理想的肝癌标志物需有较高的特异性和敏感性,能够在肝癌早期提示诊断。目前可利用定量蛋白质组学技术定性定量检测差异蛋白质,筛选出具有临床标志意义的关键蛋白质分子。
糖基化(glycosylation)是常见的蛋白质翻译后修饰,在一系列糖基转移酶作用下形成不同的糖链(glycan)。糖链在很多关键的生物学过程中起到重要作用,如细胞黏附、分子运输和清除、受体激活、信号转导以及内吞作用等。糖链的变化还与恶性肿瘤的发生和转移有关,某些抗原决定簇,如sialyl Lewis X (sLex)、sialylated Tn (sTn)和Lewis Y (Ley),常出现于恶性肿瘤中。研究差异糖蛋白在肝病进程中的变化可从糖基化修饰的状态着手,为肝病进展的动态监测提供可能。
抗体辅助的凝集素芯片技术(图1)是以凝集素芯片为基础,用于研究目标糖蛋白的糖链结构的新型技术,它将凝集素芯片与样品孵育后,继续与目标蛋白抗体反应,得到目标糖蛋白的糖链结构信息[1]。
本研究旨在通过定量蛋白质组学联合抗体辅助的凝集素芯片技术,寻找区分sHCC与DN的差异糖蛋白,并解析关键糖蛋白的聚糖结构。以期为肝癌的早期诊断及进一步揭示肝癌致病机制提供一定的科学依据。
材 料 和 方 法
试剂 FFPE组织蛋白提取缓冲液及TEAB(美国Sigma公司);Pierce Direct IP Kit、BCA蛋白定量试剂(美国Thermo公司);iTRAQ Reagent Kit(美国Applied Biosystems公司);乙腈(德国Merck公司);蛋白酶抑制剂(不含EDTA)和测序级胰蛋白酶(瑞士Roche公司);乙醇、乙酸、异丙醇均为国产分析纯;考马斯亮蓝R350(美国GE公司);C-18脱盐柱(美国Waters公司);抗A1AT抗体、抗C3抗体(英国Abcam公司); Lighting Link Rapid Conjugation System(英国Innova Biosciences公司);兔血清(上海钰森生物技术有限公司);人血清多克隆IgG、Durapore PVDF表面滤膜(33 mm,0.45 μm,美国Millipore公司);Lowbind低吸附管(德国Eppendorf公司)。
仪器 Thermo Scientific Savant DNA SpeedVac离心浓缩系统(美国Thermo公司);色谱仪采用Prominence UFLC系统(日本SHIMAZU公司),强阳离子交换柱(Polysulfoethyla谱柱,2.1 mm×100 mm,5 μm,20 nm,美国Nest Group公司),反相色谱柱(ZORBAX 300SB-C18谱柱,5 μm,30 nm,0.1×15 mm,德国Microm公司),QSTAR XL LC/MS/MS(美国Applied Biosystems公司);荧光扫描仪LuxScan 10K-A(博奥生物集团有限公司)。
样本筛选 DN和sHCC病灶各15例,蜡块组织切成7 μm,载于玻片后,60 ℃烘干直至切片组织与载玻片之间无气泡。切片置于二甲苯中进行1次脱蜡(20 min)。95%乙醇和75%乙醇各1 min使之水化,流水冲洗。热风烘干后对病灶部分进行精确切割。对蛋白进行修复和提取,异丙醇沉淀,采用BCA试剂盒进行蛋白质定量。
定量蛋白质组学分析 每组100 μg总蛋白进行还原烷基化,胰蛋白酶酶解过夜,进行标记反应。采用阳离子交换色谱和反相色谱分别进行分离后,通过在线连接的QSTAR XL MS/MS质谱仪进行串联质谱分析,在信息依赖性获取模式(information dependent acquisition mode,IDA)下进行。原始数据利用Applied Biosystems ProteinPilot software 3.1进行蛋白质数据库的搜索和差异蛋白质筛选。根据Swiss Prot(http://www.uniprot.org)数据库对iTRAQ筛选的差异蛋白质进行糖基化修饰检索,再根据NetNGlyc 1.0 Server、NetOGlyc 4.0 Server数据库对筛选结果进行阈值检验,对最终结果进行IPA分析。
抗体辅助的凝集素芯片技术 使用Pierce Direct IP Kit 分离纯化A1AT和C3,使用Lightning Link Rapid Conjugation System 标记试剂盒,分别对两种糖蛋白的蛋白质抗体进行Cy5标记。标记后体系中A1AT抗体浓度为1.67 mg/mL,C3抗体浓度为0.89 mg/mL。选择条件优化后的最佳封闭剂、孵育液及抗体浓度。PBSTx稀释蛋白质样品,取70 μL覆盖点样区,20°C湿盒孵育12 h,PBSTx清洗芯片5 min,重复3次,甩干。取纯兔血清70 μL覆盖点样区,室温湿盒孵育0.5 h,PBSTx清洗芯片5 min,重复3次,甩干。使用A1AT、C3 的Cy5标记抗体按1∶100稀释,PBSTx稀释后各取70 μL覆盖点样区,室温湿盒孵育1 h,甩干孵育液,PBSTx清洗芯片5 min,重复3次,甩干。将芯片插入荧光扫描仪LuxScan 10K-A,打开扫描软件LuxScan 3.0,设置扫描条件Power=20,PMT=650,分辨率为5 μm,扫描信号后提取相应数据,信噪比≥1.5为阳性点,取每6个重复点的信噪比数值计算均值。
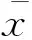
结 果
差异糖蛋白筛选 通过3次生物学重复实验,共鉴定得到:相对于DN,18个糖蛋白在sHCC中表达升高,8个则降低(表1)。
Function条形图显示这些差异糖蛋白可能与多种疾病相关联,并且富集于每种疾病的差异糖蛋白分布较均匀。这些相关的疾病与功能包括:癌症、肝脏系统的发育与功能及相关肝脏疾病、细胞的生长增殖和生存死亡、细胞间的相互作用与信号转导、蛋白质合成等(图2A)。Pathway条形图分析发现较多差异糖蛋白集中在LXR/RXR的激活作用和急性应答信号通路上(图2B)。IPA的网络分析图提示,sHCC中表达升高的A1AT与ERK1/2、IL-1、VEGF、促炎因子和MMP相关。另一上调蛋白质C3与ERK1/2、P38MAPK、IL-1、VEGF和促炎因子相关(图2C)。
这些信号通路或细胞因子与肿瘤发生发展密切相关。如与A1AT、C3关联的ERK1/2是常在肿瘤中呈异常活化状态的信号通路,VEGF/VEGFR-2介导的信号通路可以调控血管内皮细胞的增殖、迁移,这些信号通路均有利于肿瘤细胞的扩散、转移。这说明A1AT与C3是可以直接或间接参与肿瘤发生、发展、侵袭和转移的关键性分子。

表1 在sHCC中表达上调和下调的糖蛋白(相对于DN)
抗体辅助的凝集素芯片技术的优化 为精确检测FFPE组织蛋白中目标糖蛋白的聚糖结构,对抗体辅助的凝集素芯片技术中的封闭剂、孵育缓冲液和抗体浓度进行了优化,并确定了样品检测限。
封闭剂的优化 蛋白质样品孵育后将残余的凝集素位点掩盖,以防止Cy5标记的抗体与之结合而导致假阳性。常用的封闭剂为人血清多克隆IgG、鼠或兔多克隆IgG[2-3]。本次实验中使用纯兔血清和人类血清多克隆IgG作为封闭剂,比较发现人血清多克隆IgG封闭后的芯片荧光背景值大于纯兔血清,带有荧光信号的凝集素样品数也较多(图3),说明封闭效果不及纯兔血清,故选择纯兔血清作为封闭剂。
孵育缓冲液的优化 为确定不同浓度的非离子型去垢剂调配的孵育液以及常用凝集素芯片孵育液中BSA的使用对孵育效果的影响,比较0.01%、0.1%、1% TritonX 100-PBS,0.01%、0.1%、1%及Tween 20-PBS,1% BSA+1% TritonX 100-PBS及1% BSA + 1% Tween 20-PBS这8种孵育缓冲液的孵育效果。选取荧光信号较佳的凝集素GNL、HHL、HAL、NML,发现信号主要随非离子型去垢剂浓度提高而增强;在TritonX 100/Tween 20浓度较低时,Tween 20的孵育效果较好,而当其浓度达到1%时,二者效果相当。传统凝集素芯片的孵育缓冲液使用BSA,而本实验发现加入BSA的效果不及单一使用非离子型去垢剂的效果,说明BSA的使用可能导致过度封闭而减弱信号。本次实验选择使用效果较好的1% TritonX 100-PBS作为孵育缓冲液(图4)。
A:Function analysis of differential glycoproteins between DN and sHCC.B:Pathway analysis of differential glycoproteins between DN and sHCC.The quantity of glycoproteins corresponding to pathway was positively related to the depth of color.C:Network of signaling pathways and differential glycoproteins.Red represented up-regulated expression,and green represented down-regulated expression.The level of regulation was positively related to the depth of color.
图2 DN与sHCC中的差异糖蛋白IPA分析
Fig 2 IPA for differential glycoproteins between DN and sHCC
Detected by Cy5 labeled anti-C3 antibody (resolution:5 μm).
图3 人类血清多克隆IgG和纯兔血清的封闭效果
Fig 3 Blocking with human serum polyclonal IgG and pure rabbit serum
抗体浓度的优化 以1∶400、1∶200、1∶100、1∶50、1∶25稀释Cy5标记的A1AT、C3抗体,平均荧光强度随抗体浓度的改变发生变化。对于A1AT抗体,GNL、HHL的平均荧光强度随抗体浓度升高而增强,在1∶100时,信号强度进入平台期;而对于C3抗体,HAL、NML的荧光信号最初随抗体浓度升高而增强,但并非抗体浓度越大其信号越强,而是在1∶200~1∶100间信号最佳。因此,选择1∶100作为A1AT和C3的抗体稀释倍数(图5)。
样品检测限的确定 使用浓度为10、102、103、104、105ng/mL的蛋白质样品进行检测,发现在蛋白质浓度为10 ng/mL时即有检测信号,并且荧光检测信号随样品浓度的提高而增强(图6),说明本实验所用凝集素芯片及实验方法具有较高的灵敏度。
分析比较A1AT和C3聚糖结构的变化 本研究采用DN和sHCC石蜡组织切片各15例,每5例混合,生物学重复3次(第1次:5例DNvs.5例sHCC; 第2次:5例DNvs.5例sHCC;第3次:5例DNvs. 5例sHCC)。分别从DN、sHCC组织切片中提取蛋白质,再分别纯化得到A1AT和C3,采用优化后的抗体辅助的凝集素芯片技术进行聚糖结构检测,其中凝集素芯片为本实验室自行点制,具有50种凝集素。图7A为凝集素微阵列对照表;图7B为2张凝集素芯片结合信号强度图,左图为DN中A1AT的聚糖结构检测结果,右图为sHCC中A1AT的聚糖结构检测结果;图7C显示A1AT在DN、sHCC中结合的18种具有统计学差异的凝集素。表2则详细显示出这18种凝集素名称及其识别的聚糖结构。3次重复实验结果显示:相对于DN,在sHCC中,A1AT对凝集素CFL、RCAI、SJA、VVL的亲和作用减弱;而对凝集素BPL、CAL、CSL、DBA、GNL、GSL Ⅰ、GSL Ⅱ、HPL、JAC、LPL、PHA-L、PTL2、VAL、WGA的亲和作用增强。此结果提示在sHCC中,A1AT的半乳糖β1,4连接的N-乙酰半乳糖胺(Galβ1,4GlcNAc)、末端连接的N-乙酰半乳糖胺(α/β-linked terminal GalNAc)结构减少;而半乳糖β1,3连接的N-乙酰半乳糖胺(Galβ1,3GalNAc)、黏蛋白T/Tn抗原(T/Tn antigen)、三/四天线复杂型N-聚糖(Tri/tetra-antennary complex-type N-glycan)、高甘露糖(High mannose)和唾液酸(NeuAc)结构增多。
GNL (A) and HHL (B) were incubated with A1AT in 8 kinds of incubation buffer (S/N≥1.5).HAL (C) and NML (D) were incubated with C3 in 8 kinds of incubation buffer (S/N≥1.5).
图4 优化用于抗体辅助凝集素芯片技术的孵育缓冲液
Fig 4 Optimization of incubation buffer for antibody overlay lectin microarray
GNL (A) and HHL (B) were incubated with different concentrations of anti-A1AT antibody (S/N≥1.5).HAL (C) and NML (D) were incubated with different concentration of anti-C3 antibody (S/N≥1.5).
图 5 优化用于抗体辅助凝集素芯片技术的抗体浓度
Fig 5 Optimization of antibody concentration for antibody overlay lectin microarray
A: The limits of detection for A1AT was detected,and the mean fluorescence intensities were increased with elevated concentrations of sample (S/N≥1.5).B: The limits of detection for C3 was detected,and the mean fluorescence intensities were increased with elevated concentrations of sample (S/N≥1.5).
图6 抗体辅助凝集素芯片技术的样品检测限
Fig 6 Limit of detection for antibody overlay lectin microarray
A:The lectin microarray contains 50 lectin spots with different binding specificities;B:Signals of A1AT in DN and sHCC;C:The altered glycan structures of A1AT were detected in sHCC compared with DN ((1)P<0.05,(2)P<0.01,(3)P<0.001).
图7 A1AT在DN和sHCC中的聚糖结构变化
Fig 7 Glycan structure analysis of A1AT in DN and sHCC
图8B显示C3在DN(左图)和sHCC(右图)中的聚糖结构检测结果。图8C显示相对于DN,C3在sHCC中结合的5种具有统计学差异的凝集素,表3详细列出了这5种凝集素名称及其亲和的聚糖结构。分析结果显示,相对于DN,在sHCC中,C3对凝集素SNA、VAL的亲和作用减弱;对凝集素CSL、LTL、WFL的亲和作用增强。说明在sHCC中,C3的Sialyl-Tn(Siaα2-6GalNAc),β连接的N-乙酰半乳糖胺(βGalNAc)结构减少;而N-乙酰半乳糖胺(GalNAc)、Lewis X 抗原[Fucα3(Galβ4)GlcNAc]、H-type 2 抗原[Fucα2(Galβ4)GlcNAc]、半乳糖β(1,3/1,6)连接的N-乙酰半乳糖胺[Galβ3(-6)GalNAc]结构增多。
讨 论
糖基化修饰调控多种细胞功能,与多种病理生理过程(如细胞恶性转化、肿瘤发生及转移)相联系[4]。糖蛋白/糖标志物是可靠的预测标志物[5],可以弥补AFP在早诊中的不足(敏感性41%~65%)[6-7]。目前用于区分诊断肝癌和DN的分子标记物(如HSP70、GPC3、CD34等)的特异性和灵敏度均不够理想。另有研究报道血清中的某些miRNA可作为诊断DN和早期肝癌的指标[8],但寻找差异糖蛋白及聚糖结构的改变作为区分诊断sHCC和DN的分子标记物的研究尚不多见。

表2 与A1AT反应的18种凝集素及其特异性结合的聚糖结构

表3 与C3反应的5种凝集素及其特异性结合的聚糖结构
本研究的IPA分析结果显示,A1AT、C3与多种信号通路相关,包括ERK1/2、IL-1、VEGF、P38MAPK等常在肿瘤发生发展的病理学过程中被激活的通路,其中ERK1/2、P38MAPK与细胞周期、生存、分化、衰老、凋亡密切相关[9-10];IL-1与慢性炎症有关,增加了致瘤突变导致肿瘤的风险[11];VEGF与肿瘤的病理性生长有关,能促进细胞的侵袭与转移[12]。
在DN演化至sHCC的过程中,A1AT的T/Tn抗原增多,而T/Tn抗原是肿瘤特异性的O-聚糖结构,常出现在肿瘤晚期[13],在结肠癌[14]、胃癌[15]、胰腺癌[16]中表达上调,可促进肿瘤细胞的侵袭转移。Niang等[17]发现在人类乳腺癌细胞中,用VVL识别到α/β-linked terminal GalNAc即O-GalNAc(Tn)抗原,Tn抗原修饰关键转录因子FOXA1从而促使雌激素应答基因的表达,利于癌发展,说明其与恶性转化有关。而本次实验中却发现在恶性程度较高的sHCC中,此结构含量较DN减少,可能与不同癌种在发展进程中存在差异有关。
唾液酸转移酶ST6GalNAc I将唾液酸添加到Tn上形成Sialyl-Tn,改变了癌细胞之间、癌细胞与胞外基质间的相互作用,从而促进侵袭和转移[18]。除此之外,sialyl Lewis X/sialyl Lewis A也是作为细胞黏附分子的配体,其过表达促进肿瘤的转移[19]。
A:The lectin microarray contains 50 lectin spots with different binding specificities; B:Signals of C3 in DN and sHCC;C:The altered glycan structures of C3 were detected in sHCC compared with DN.(1)P<0.05,(2)P<0.01.
图8 C3在DN和sHCC中的聚糖结构变化
Fig 8 Glycan structure analysis of C3 in DN and sHCC
这些说明唾液酸的增加与细胞的恶性转化有关。此外,N-聚糖三、四天线的增加利于肿瘤转移,已有报道显示人和鼠的肝癌中高甘露糖增多。
与凝集素RCAⅠ亲和的聚糖结构是Galβ4GlcNAc, A1AT的此聚糖结构在sHCC中含量减少。Zhou等[20]研究中发现其在三阴性乳腺癌中表达并与转移能力呈负相关,它的表达能够抑制癌细胞的侵袭、运动、黏附和识别膜蛋白的能力。说明与RCAⅠ亲和的聚糖结构在转移中起着关键的作用。这与我们的实验结果相符,恶性程度更高的sHCC中Galβ4GlcNAc的表达降低。
在C3的聚糖结构变化中,H-type 2抗原和Lewis X抗原的含量在sHCC中升高。H-抗原与肿瘤的侵袭转移有关,含量增加会导致肿瘤恶化,家族成员H-type 2抗原在肿瘤组织中过表达;Lewis X则在多种癌中表达上升,以上说明它们的表达与肿瘤发展相关[21]。
在sHCC中,C3上的α2,6唾液酸(Siaα2-6GalNAc)结构较DN减少。研究发现α2,6唾液酸在转移性肝癌中表达下调[22];而Li等[23]也指出α2,6唾液酸在诱导转移的EMT细胞中表达减少。这说明α2,6唾液酸结构的表达并非完全与肝癌的恶性程度呈正相关。
本研究通过定量蛋白质组学技术鉴定了DN和sHCC的26个差异糖蛋白。利用IPA分析,发现差异糖蛋白A1AT和C3参与的信号通路ERK1/2、IL-1、VEGF、P38MAPK均与肿瘤的发生发展有关。进而比较分析了A1AT和C3的聚糖结构,发现多种与肿瘤发展相关的糖型含量在sHCC中增多,同时发现sHCC中C3的α2,6唾液酸结构相对DN减少。这些差异聚糖结构可作为区分诊断DN和sHCC的潜在标志物,从而使肝癌的早期诊断更具针对性和特异性。
致谢 晏国全老师在定量蛋白质组学分析上给予指导与帮助;张扬老师在IPA生物信息学分析上给予指导与帮助;李岩老师在石蜡组织的蛋白质修复与提取的实验技术上给予指导和帮助。
[1] TREUMANN A,THIEDE B.Isobaric protein and peptide quantification: perspectives and issues[J].ExpertRevProteomic,2010,7(5): 647-653.
[2] KUNO A,IKEHARA Y,TANAKA Y,etal.Multilectin assay for detecting fibrosis-specific glyco-alteration by means of lectin microarray[J].ClinChem,2011,57(1): 48-56.
[3] TATENO H,MATSUSHIMA A,HIEMORI K,etal.Podocalyxin is a glycoprotein ligand of the human pluripotent stem cell-specific probe rBC2LCN[J].StemCellTranslMed,2013,2(4): 265-273.
[4] SEMAAN SM,WANG X,MARSHALL AG,etal.Identification of potential glycoprotein biomarkers in estrogen receptor positive (ER+) and negative (ER-) human breast cancer tissues by LC-LTQ/FT-ICR mass spectrometry[J].JCancer,2012,3: 269-284.
[5] TELFORD JE,DOHERTY MA,THARMALINGAM T,etal.Discovering new clinical markers in the field of glycomics[J].BiochemSocTrans,2011,39(1): 327-330.
[6] MECHREF Y,HU Y,GARCIA A,etal.Identifying cancer biomarkers by mass spectrometry-based glycomics[J].Electrophoresis,2012,33(12): 1755-1767.
[7] NAKAGAWA T,MIYOSHI E,YAKUSHIJIN T,etal.Glycomic analysis of alpha-fetoprotein L3 in hepatoma cell lines and hepatocellular carcinoma patients[J].JProteomeRes,2008,7(6): 2222-2233.
[8] HUNG CH,HU TH,LU SN,etal.Circulating microRNAs as biomarkers for diagnosis of early hepatocellular carcinoma associated with hepatitis B virus[J].IntJCancer,2015,138: 714-720.
[9] LIU QH,SHI ML,SUN C,etal.Role of the ERK1/2 pathway in tumor chemoresistance and tumor therapy[J].BioorgMedChemLett,2015,25(2): 192-197.
[10] LIU H,HE J,YANG J.Tumor cell p38 MAPK: A trigger of cancer bone osteolysis[J].CancerCellMicroenviron,2015,2(1): e464.
[11] VORONOV E,CARMI Y,APTE RN.The role IL-1 in tumor-mediated angiogenesis[J].FrontPhysiol,2014,5: 114.
[12] FERRARA N,GERBER HP,LECOUTER J.The biology of VEGF and its receptors[J].NatMed,2003,9(6): 669-676.
[13] 吴士良.黏蛋白型O-聚糖:结构、功能及与肿瘤的相关性[J].生命科学,2011,23(6): 563-568.
[14] INAGAKI Y,GAO J,SONG P,etal.Clinicopathological utility of sialoglycoconjugates in diagnosing and treating colorectal cancer[J].WorldJGastroenterol,2014,20(20): 6123-6132.
[15] YAMASHITA Y,CHUNG YS,HORIE R,etal.Alterations in gastric mucin with malignant transformation: novel pathway for mucin synthesis[J].JNatlCancerInst,1995,87(6): 441-446.
[16] MADSEN CB,WANDALL HH,PEDERSEN AE.Potential for novel MUC1 glycopeptide-specific antibody in passive cancer immunotherapy[J].ImmunopharmacolImmunotoxicol,2013,35(6): 649-652.
[17] NIANG B,JIN L,CHEN X,etal.GalNAc-T4 putatively modulates the estrogen regulatory network through FOXA1 glycosylation in human breast cancer cells[J].MolCellBiochem,2015,5:114.
[18] JU T,WANG Y,ARYAL RP,etal.Tn and sialyl-Tn antigens,aberrant O-glycomics as human disease markers[J].ProteomClinAppl,2013,7(9-10): 618-631.
[19] DALL′OLIO F,MALAGOLINI N,CHIRICOLO M,etal.The expanding roles of the Sd(a)/Cad carbohydrate antigen and its cognate glycosyltransferase B4GALNT2[J].BiochimBiophysActa,2014,1840(1): 443-453.
[20] ZHOU SM,CHENG L,GUO SJ,etal.Lectin RCA-I specifically binds to metastasis-associated cell surface glycans in triple-negative breast cancer[J].BreastCancerRes,2015,17: 36.
[21] GILDERSLEEVE JC,WANG B,ACHILEFU S,etal.Glycan array analysis of the antigen repertoire targeted by tumor-binding antibodies[J].BioorgMedChemLett,2012,22(22): 6839-6843.
[22] 孙海艳,李岩,郭坤,等.肝癌转移相关的骨桥蛋白表达及其糖基化的改变[J].中华肝脏病杂志,2011,19(12): 904-907.
[23] LI S,MO C,PENG Q,etal.Cell surface glycan alterations in epithelial mesenchymal transition process of Huh7 hepatocellular carcinoma cell[J].PLoSOne,2013,8(8): e71273.
Glycan structure analyses of differential glycoproteins for distinguishing small hepatocellular carcinoma from dysplastic nodules
LI Wei1,2▲, ZHANG Shu1▲, SHANG Shu-xin4, JIN Guang-zhi3, QIN Xue4,CONG Wen-ming3, LIU Yin-kun1,2△
(1KeyLaboratoryofCarcinogenesisandCancerInvasion,MinistryofEducation-LiverCancerInstitute,ZhongshanHospital,FudanUniversity,Shanghai200032,China;2InstitutesofBiomedicalSciences,FudanUniversity,Shanghai200032,China;3DepartmentofPathology,EasternHepatobiliarySurgeryHospital,theSecondMilitaryMedicalUniversity,Shanghai200438,China;4DepartmentofClinicalLaboratory,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,GuangxiProvince,China)
Objective To screen differential glycoproteins between dysplastic nodule (DN) and small hepatocellular carcinoma (sHCC) and to analyze glycan structures for early diagnosis of hepatocellular carcinoma (HCC). Methods Tissue proteins were repaired and extracted from 15 cases of paraffin embedded tissues of DN and sHCC,respectively.Quantitative proteomics technology was used to identify differential glycoproteins between DN and sHCC.The function and related signaling pathways of differential glycoproteins were analyzed with ingenuity pathway analysis (IPA) to find target glycoproteins associated with tumorigenesis and tumor progression.Optimized antibody overlay lectin microarray was applied to analyze glycan structures of target glycoproteins which were purified from paraffin embedded tissues. Results Twenty-six differential glycoproteins were identified by quantitative proteomics technology.Alpha-1-antitrypsin (A1AT) and complement C3 were found to be associated with tumorigenesis and tumor progression using IPA.Compared with DN,lectins CAL,GSL Ⅰ,JAC,GSL Ⅱ,PHA-L,GNL and WGA showed increasing trend in A1AT of sHCC.This implied that glycans containing T/Tn antigen,tri- or tetra-antennary N-glycan,high mannose structure and NeuAc were increased in A1AT of sHCC.Meanwhile,the binding abilities of CSL,LTL and WFL were increased in C3 of sHCC,which showed that the GalNAc,Lewis X,H-type 2 antigen and Galβ3(-6)GalNAc were increased in C3 of sHCC. Conclusions Glycan structures variation of A1AT and C3 between DN and sHCC may contribute to establishment of novel glycobiomarkers for early diagnosis of HCC.
dysplastic nodule; small hepatocellular carcinoma; differential glycoproteins; lectin
国家自然科学基金(21505022)
R44, R73
A
10.3969/j.issn.1672-8467.2016.06.001
2016-03-08;编辑:段佳)
▲LI Wei and ZHANG Shu contributed equally to this work
△Corresponding author E-mail:liu.yinkun@zs-hospital.sh.cn
*This work was supported by the National Natural Science Foundation of China (21505022).

