IgA肾病血脂异常与临床病理分析*
赖玉萍,张 舟,梁燕娟,尤永森,李 舸, 刘洪梅
(广东省佛山市顺德区桂洲医院内五科 528000)
论著·临床研究
IgA肾病血脂异常与临床病理分析*
赖玉萍,张 舟,梁燕娟,尤永森,李 舸, 刘洪梅
(广东省佛山市顺德区桂洲医院内五科 528000)
目的 探讨血脂异常与IgA肾病临床及病理的关系。方法 收集自2008年1月至2015年11月肾活检诊断为IgA肾病患者178例。分别使用Lee氏分级及牛津分级对IgA肾病患者进行病理分级。分别探讨血脂异常、高三酰甘油血症、高胆固醇血症与IgA肾病临床及病理之间的关系。结果 IgA肾病伴血脂异常尤其是伴高三酰甘油血症者,24 h尿蛋白定量升高,有较高的血肌酐和较低的eGFR。IgA肾病伴血脂异常尤其是伴高三酰甘油血症者,肾小管萎缩和(或)间质纤维化者比例高(58.5%)。结论 应加强对IgA肾病患者血脂异常的认识,积极地降脂治疗,延缓IgA肾病的进展。
IgA肾病;血脂异常;高三酰甘油血症;高胆固醇血症
IgA肾病是世界范围内最常见的原发性肾小球疾病[1-2]。在中国,IgA肾病占原发性肾小球疾病的45%~50%,大约1/3未经治疗的患者最终进展至终末期肾脏病(ESRD)[3-5]。IgA肾病是一种病理诊断,免疫病理以肾小球系膜区IgA沉积伴补体C3沉积为特征。光镜表现变化较大,从肾小球单纯系膜增生至新月体形成、肾小球球性硬化,伴或不伴肾小管萎缩及间质纤维化。IgA肾病的临床表现也不一致,从孤立性镜检血尿至终末期肾脏病[6]。研究表明血脂异常与IgA肾病的进展及预后相关[7],血脂异常与IgA肾病肾活检病理之间的联系未形成定论。本次研究的目的是评价血脂异常与IgA肾病临床与病理之间的联系。
1 资料与方法
1.1 一般资料 收集从2008年1月至2015年11月在本院诊断为IgA肾病患者178例,其中男98例,女80例,平均年龄36.89岁。参考中国成人血脂异常防治指南,根据血脂情况对178例IgA肾病患者进行分组,分为血脂异常组(82例)和血脂正常组(96例)。排除标准:(1)系统性红斑狼疮、紫癜肾炎、肿瘤、血液病等系统性疾病所致继发性IgA肾病;(2)肾活检时肾小球滤过率(eGFR)<10 mL·min-1·1.73 m-2;(3)患者肾活检光镜下肾小球数目小于10个。IgA肾病诊断依靠组织病理学免疫荧光分析,以IgA和补体C3为主沉积于肾小球系膜区,伴或者不伴血清IgG或补体IgM沉积。所有患者在肾活检时均未长期服用糖皮质激素和或免疫抑制剂。所有参与者获得知情同意。
1.2 方法
1.2.1 临床指标检测 收集临床观察指标包括肾活检时年龄、性别、血压。实验室指标:高密度脂蛋白(HDL)、血清胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、血肌酐、24 h尿蛋白定量、血清清蛋白(Alb)、血尿素氮(BUN)、尿酸。估计的eGFR使用适合中国人的MDRD公式计算,eGFR=[175×(Scr)-1.234×(年龄)-0.179×(女性×0.79)][8]。
1.2.2 病理分级 所有肾活检样本均行光镜、免疫荧光和电镜检查。除了对IgA肾病进行Lee氏分级外[9],还对其进行牛津分级[10],具体如下,(1)系膜细胞增生(M):存在系膜细胞增生(M1)和无明显系膜细胞增生(M0);(2)内皮细胞增生(E):存在内皮细胞增生(E1)、无明显内皮细胞增生(E0);(3)节段性肾小球硬化(S):S1或S0;(4)肾小管萎缩和(或)间质纤维化(T),T0:0%~50%,T1:>50%。牛津分级评分(MEST)得分=M+E+S+T,范围从0~4。肾活检的诊断是经两位病理医生独立的诊断,最终的诊断经所有作者参与临床病理讨论后决定。
1.2.3 血脂异常诊断标准 依据中国成人血脂异常防治指南,血脂异常为符合下列4项中任何1项:血脂异常诊断标准:TC≥6.22 mmoL/L,TG≥2.26 mmoL/L,HDL≤1.04 mmol/L,LDL≥4.14 mmol/L和(或)过去2周调脂药物治疗[11]。

2 结 果
2.1 血脂异常组与血脂正常组临床资料及病理资料对比 血脂异常组与血脂正常组相比,有较高的24h尿蛋白、较高的血肌酐、较低的eGFR、较高的血BUN、较高的血尿酸、较高的TC、较高的TG及较高的HDL。两组在年龄、性别、收缩压、舒张压、Alb、LDL-C之间差异无统计学意义(P>0.05),见表1。IgA肾病血脂异常组与正常组对比,有更多患者处于LeeⅣ~Ⅴ级、肾小管萎缩和(或)间质纤维化及系膜细胞增生、内皮细胞增生、节段性肾小球硬化评分中3分及以上者比例较高。两组在系膜细胞增生、内皮细胞增生、节段性肾小球硬化评分中差异无统计学意义(P>0.05),见表2。
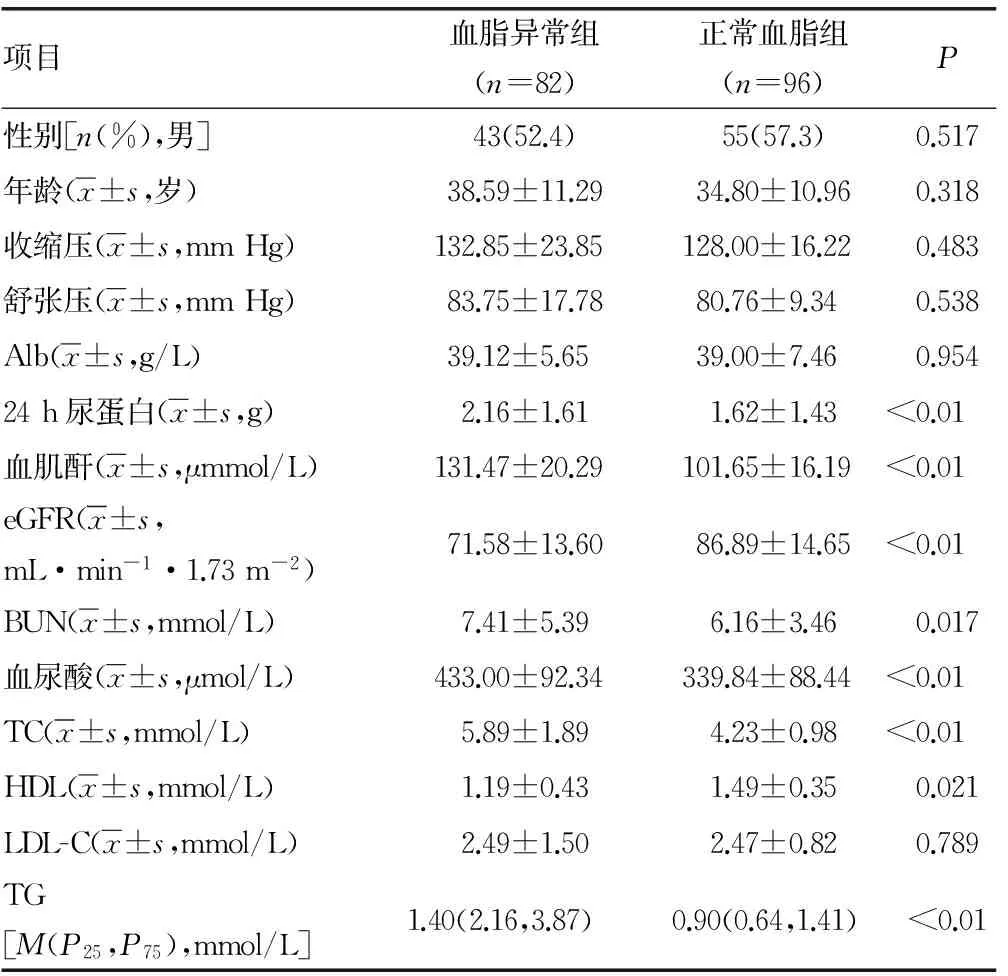
表1 血脂异常、血脂正常组与IgA肾病患者临床资料对比
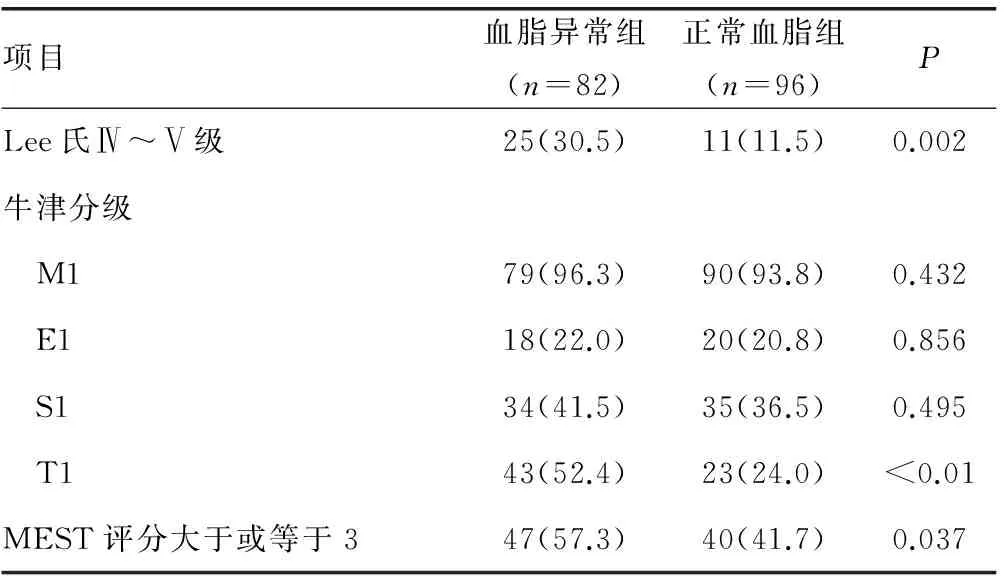
表2 血脂异常、血脂正常组与IgA肾病患者 病理资料对比[n(%)]
2.2 高TG血症与TG正常组临床资料及病理资料对比 高TG血症与TG正常组相比,有较高的24h尿蛋白、较高的血肌酐、较低的eGFR、较高的血尿酸、较高的TC、较高的TG。两组在年龄、性别、收缩压、舒张压、BUN、Alb、LDL-C及HDL之间差异无统计学意义,见表3。IgA肾病高TG血症与TG正常组对比,有更多患者处于LeeⅣ~Ⅴ级、肾小管萎缩和(或)间质纤维化评分及MEST3分及以上者比例较高。两组在系膜细胞增生、内皮细胞增生、节段性肾小球硬化评分中评分中差异无统计学意义(P>0.05),见表4。
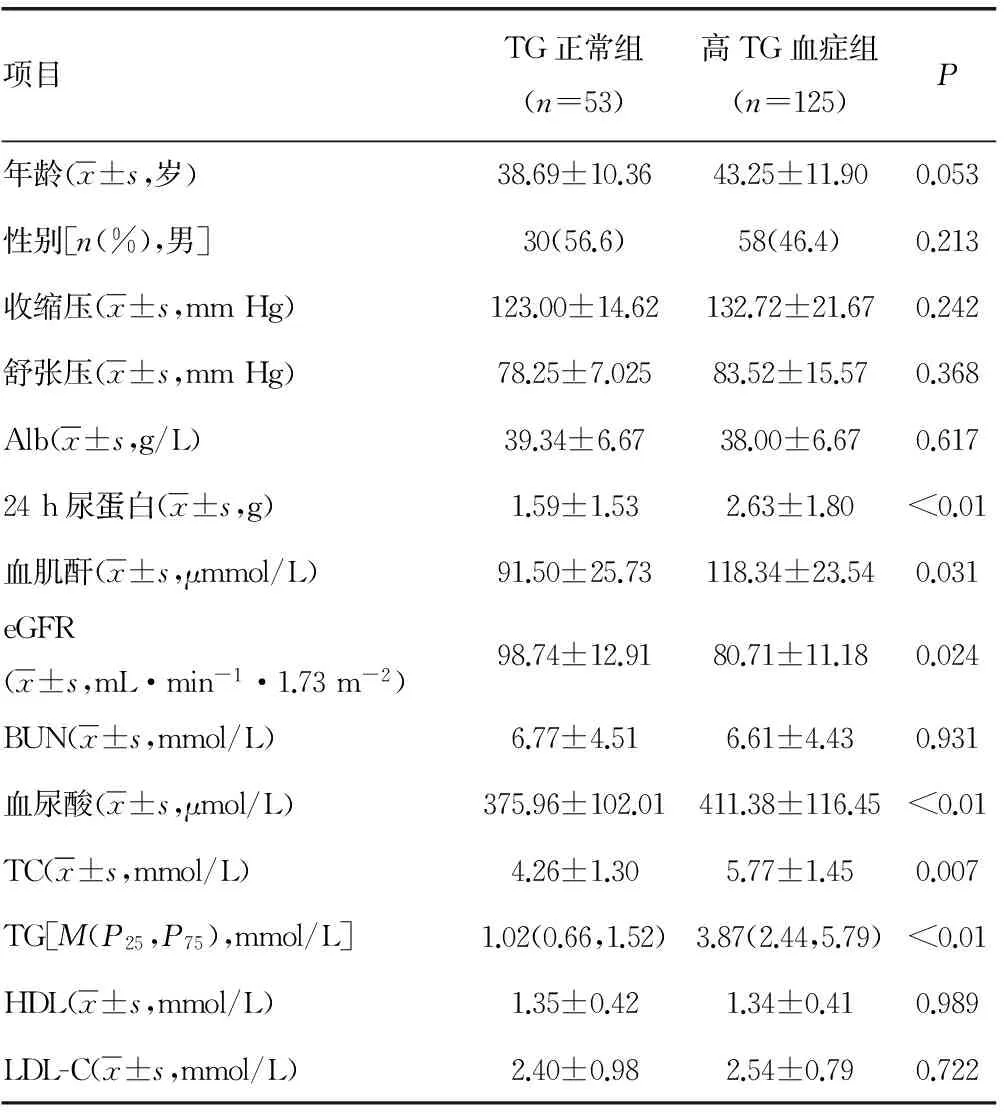
表3 TG正常组、高TG血症组与IgA肾病临床的关系
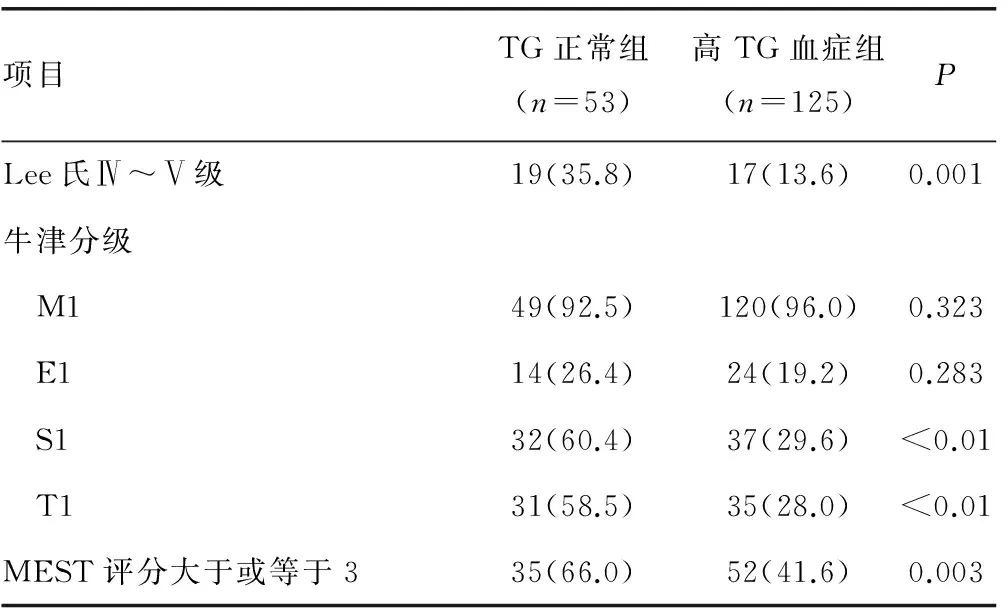
表4 TG正常组高TG血症组与IgA肾病患者病理 资料对比[n(%)]
2.3 高TC血症与TC正常组临床资料及病理资料对比 高TC血症与TC正常组相比,有较高的血尿酸、较高的血TC、较高的血TG、较高的血清LDL-C及较高的血HDL。两组在年龄、性别、收缩压、舒张压、BUN、血清清蛋白、24h尿蛋白定量、血肌酐及eGFR之间差别无显著意义,见表5。IgA肾病高TC血症与TC正常组对比,有更多患者处于LeeⅣ~Ⅴ级。两组在肾小管萎缩和(或)间质纤维化、系膜细胞增生、内皮细胞增生、节段性肾小球硬化评分中及MEST之和3分及以上比例差异无统计学意义,见表6。
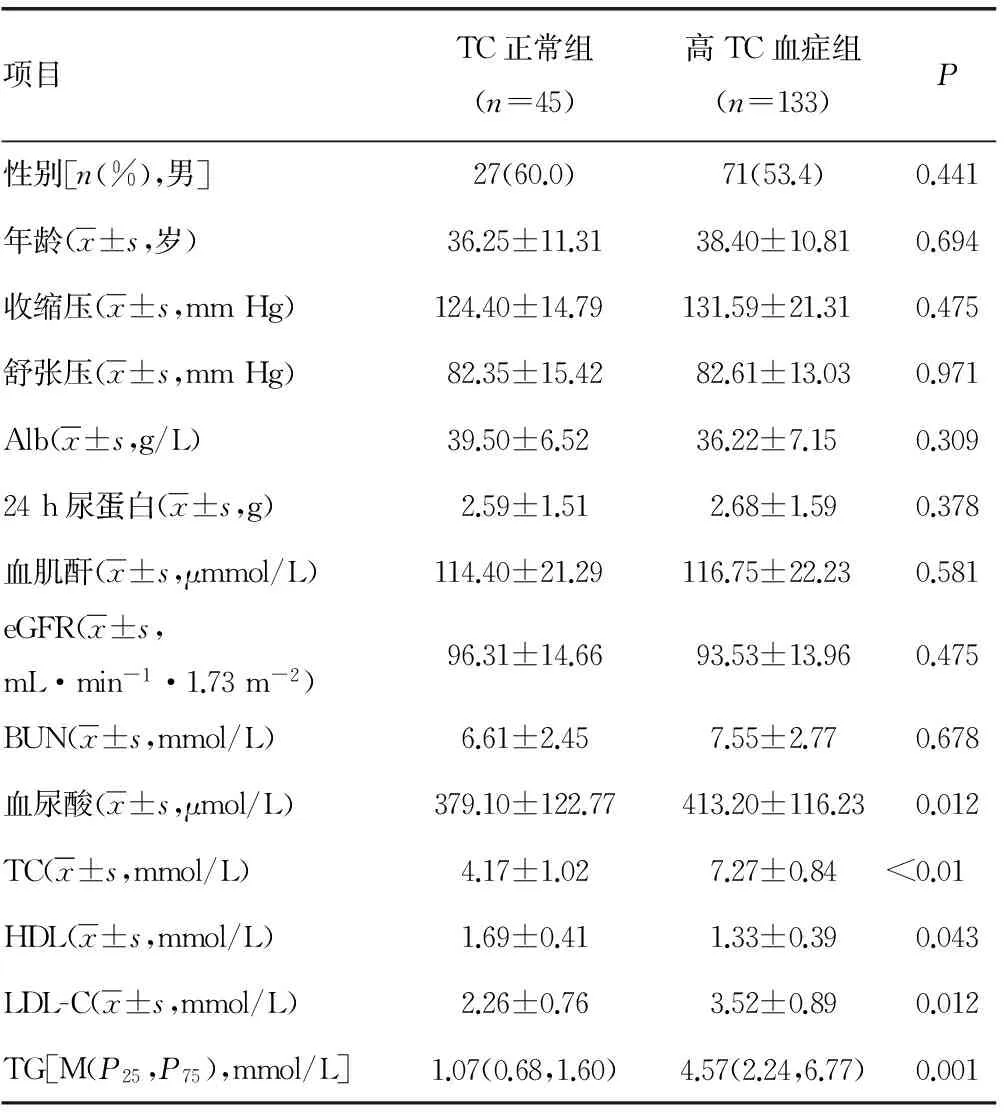
表5 TC正常组、高TC血症组与IgA肾病临床的关系
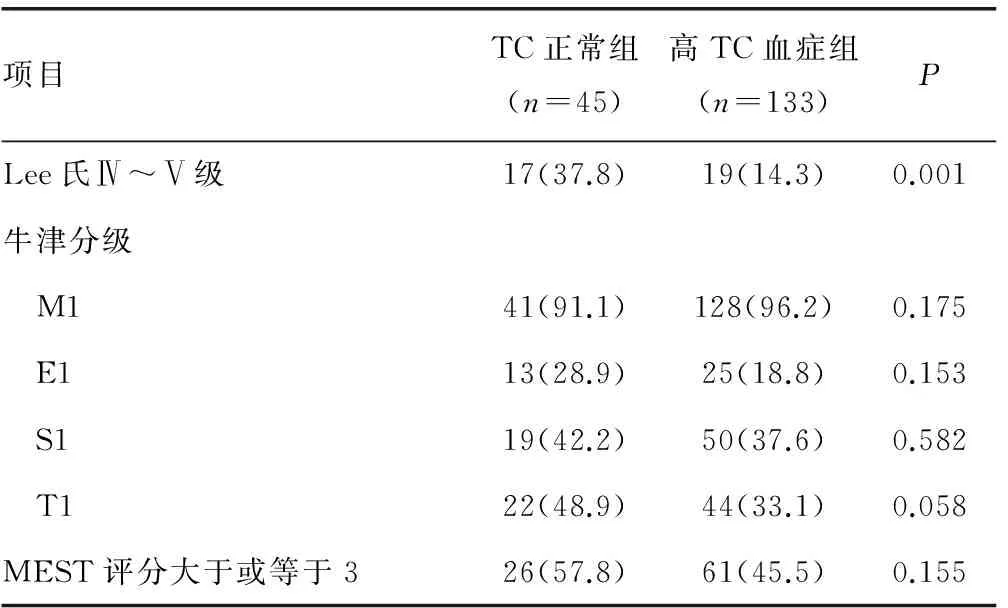
表6 TC正常组、高TC血症组与IgA肾病患者病理 资料对比[n(%)]
3 讨 论
本研究回顾分析了经肾活检确诊的178例IgAN患者的临床资料和肾脏病理资料,探讨血脂异常与IgA肾病临床及病理联系。结果显示血脂异常组有更高的24h尿蛋白、较高的血肌酐、较低的eGFR、有更多处于LeeⅣ~Ⅴ级患者、肾小管萎缩或(和)间质纤维化及MEST3分及以上者比例较高。本文进一步按照高TC血症及高TG血症分组,并分别比较患者临床及病理资料。结果显示,高TG血症者有较高的24h尿蛋白、较高的血肌酐、较低的eGFR、病理有更多患者处于LeeⅣ~Ⅴ级、肾小管萎缩和(或)间质纤维化评分及MEST3分及以上者比例较高。然而在高TC血症患者血清Alb、24h尿蛋白定量、血肌酐、eGFR、肾小管萎缩和(或)间质纤维化之间差异无统计学意义。24h尿蛋白定量及肾小管萎缩或/和间质纤维化是IgA肾病预后相关的指标。上述结果表明高TG血症与IgA肾病预后密切相关。
血脂异常在动物模型可以导致肾小球损伤及肾小球率过滤下降[12]。研究表明高脂血症与IgA肾病预后相关。本研究发现,血脂异常组患者24h尿蛋白定量明显升高,eGFR下降,这均是IgA肾病预后不良的因素。Syrjänen等[13]对IgA肾病患者随访研究,结果表明肾活检时高TG血症是IgA肾病预后不良的因素。刘擘等[14]研究提示高TC血症与高TG血症加重IgA肾病的临床指标。高TG血症是IgA肾病发生肾间质纤维化的危险因素。本研究在高TC血症组中未见血肌酐升高、eGFR下降,结果与刘擘等[14]有差异,但与Syrjänen等[13]一致。血脂异常组24h尿蛋白定量升高原因可能是由于足细胞吞噬脂质导致滤过屏障结构及功能改变。
血脂异常组及高TG血脂组均可见肾小管萎缩和(或)间质纤维化者比例高。提示高TG血症可能通过对肾小管及肾间质来影响肾脏。在2型糖尿病大鼠模型中,脂肪氧合酶应激与肾小管间质病变相关[15]。他汀类降脂药物能延缓实验动物肾间质纤维化[16]。
本研究亦发现血脂异常组、高TG血症及高TC血症组患者血尿酸均升高。Syrjänen等[13]研究表明高TG血症及高尿酸血症均是IgA肾病预后不良的因素。其可能原因,高TG血症合并高尿酸血症增加了高胰岛素血症,这些将导致代谢综合征,最终导致肾脏损害。
研究表明与其他IgA肾病病理分级相比,牛津分级及MEST评分可以早期预测IgA肾病预后[17]。既往关于IgA肾病血脂异常与肾脏病理的研究多数使用Hass分级[7,14],本研究使用Lee氏及牛津分级两种病理分级,分别探讨血脂异常与IgA肾病的关系。该病理分型对肾小球、肾小管均有评分,可克服Hass分级着重强调肾小球病变的不足。
综上所述,血脂异常尤其是高TG血症IgA肾病者24h尿蛋白量升高、有较高的血肌酐、较低的eGFR。血脂异常尤其是高TG血症的IgA肾病肾小管萎缩和(或)间质纤维化者比例高。因此,应加强对IgA肾病患者血脂的认识,积极地降脂治疗,延缓IgA肾病的进展。
[1]FabianoRC,PinheiroSV,SimoesESA.ImmunoglobulinAnephropathy:apathophysiologyview[J].InflammRes,2016,65(10):757-770.
[2]RobertT,BerthelotL,CambierA,etal.MolecularInsightsintothePathogenesisofIgANephropathy[J].TrendsMolMed,2015,21(12):762-775.
[3]LiPK,HoKK,SzetoCC,etal.PrognosticindicatorsofIgAnephropathyintheChinese——clinicalandpathologicalperspectives[J].NephrolDialTransplant,2002,17(1):64-69.
[4]ZhouFD,ZhaoMH,ZouWZ,etal.Thechangingspectrumofprimaryglomerulardiseaseswithin15years:asurveyof3331patientsinasingleChinesecentre[J].NephrolDialTransplant,2009,24(3):870-876.
[5]LiLS,LiuZH.EpidemiologicdataofrenaldiseasesfromasingleunitinChina:Analysisbasedon13,519renalbiopsies[J].KidneyInt,2004,66(3):920-923.
[6]KoyamaA,IgarashiM,KobayashiM.NaturalhistoryandriskfactorsforimmunoglobulinAnephropathyinJapan.ResearchGrouponProgressiveRenalDiseases[J].Am J Kidney Dis,1997,29(4):526-532.
[7]沈姗,柴华旗.高脂血症与IgA肾病临床病理的相关性分析[J].中国血液流变学杂志,2013(2):268-270.
[8]Ma YC,Zuo L,Chen JH,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J].J Am Soc Nephrol,2006,17(10):2937-2944.
[9]Lee SM,Rao VM,Franklin WA,et al.IgA nephropathy:morphologic predictors of progressive renal disease[J].Hum Pathol,1982,13(4):314-322.
[10]Working Group of the International IgA Nephropathy Network and the Renal Pathology Society,Cattran DC,Coppo R,et al.The Oxford classification of IgA nephropathy:rationale,clinicopathological correlations,and classification[J].Kidney Int,2009,76(5):534-545.
[11]中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南[J].中国实用乡村医生杂志,2012,19(18):5-15.
[12]Keane WF,Kasiske BL,O′donnell MP.Lipids and progressive glomerulosclerosis.A model analogous to atherosclerosis[J].Am J Nephrol,1988,8(4):261-271.
[13]Syrjänen J,Mustonen J,Pasternack A.Hypertriglyceridaemia and hyperuricaemia are risk factors for progression of IgA nephropathy[J].Nephrol Dial Transplant,2000,15(1):34-42.
[14]刘擘,曾玉纯,李劲高,等.伴血脂异常的IgA肾病的临床及病理特征[J/CD].中华临床医师杂志(电子版),2015(14):2669-2672.
[15]Dominguez JH,Tang N,Xu W,et al.Studies of renal injury Ⅲ:lipid-induced nephropathy in type II diabetes[J].Kidney Int,2000,57(1):92-104.
[16]Krämer S,Kron S,Wang-Rosenke Y,et al.Rosuvastatin is additive to high-dose candesartan in slowing progression of experimental mesangioproliferative glomerulosclerosis[J].Am J Physiol Renal Physiol,2008,294(4):801-811.
[17]Barbour SJ,Espino-Hernandez G,Reich HN,et al.The MEST score provides earlier risk prediction in lgA nephropathy[J].Kidney Int,2016,89(1):167-175.
Analysis on clinicopathological features and dyslipidemia in IgA nephropathy*
LaiYuping,ZhangZhou,LiangYanjuan,YouYongsen,LiGe,LiuHongmei
(FifthDepartmentofInternalMedicine,ShundeDistrictGuizhouHospital,Guangdong528000,China)
Objective To explore the relationship between dyslipidemia with clinic and pathological features in IgA nephropathy.Methods A total of 178 IgA nephropathy diagnosed by biopsy from January 2008 to November 2015 were collected.According to Lee′s classification and Oxford classification,these patients were performed the pathological grades of IgA nephropathy.The relationship among dyslipidemia,hypertriglyceridemia,hypercholesterolemia and the clinical and pathological features of IgA nephropathy was respectively investigated.Results The patients with IgA nephropathy complicating dyslipidemia,particularly hypertriglyceridemia,had higher 24-h urine protein,higher serum creatinine and lower eGFR.The patients with IgA nephropathy complicating dyslipidemia,especially hypertriglyceridemia,had the higher proportion of renal tubular atrophy and/or interstitial fibrosis (58.5%).Conclusion The understanding of dyslipidemia in the patients with IgA nephropathy should be strengthened,lipid-lowering treatment should be actively conducted to delay the progress of IgA nephropathy.
IgA nephropathy;dyslipidemia;hypertriglyceridemia;hypercholesterolemia
10.3969/j.issn.1671-8348.2016.32.016
顺德区卫生和计划生育局医学科研立项课题(2015B009)。 作者简介:赖玉萍(1985-),主治医师,本科,主要从事肾小球疾病、急性肾衰竭、血液净化的研究。
R692.3+1
A
1671-8348(2016)32-4511-03
2016-06-22
2016-08-10)

