姜黄素对结肠癌HT-29细胞生长增殖、细胞周期分布及CyclinD1基因表达的影响*
方 丽,周 进,谢 华,姚文秀,周 行,魏 阳,王理扬
(1.成都医学院第一附属医院消化内科 610500;2.四川省肿瘤医院肿瘤内科,成都 610041)
论著·基础研究
姜黄素对结肠癌HT-29细胞生长增殖、细胞周期分布及CyclinD1基因表达的影响*
方 丽1,周 进2△,谢 华2,姚文秀2,周 行2,魏 阳2,王理扬2
(1.成都医学院第一附属医院消化内科 610500;2.四川省肿瘤医院肿瘤内科,成都 610041)
目的 观察姜黄素对人结肠癌HT-29细胞生长增殖、细胞周期分布的影响,并探讨可能的机制。方法 培养对数生长的人结肠癌HT-29细胞,用不同浓度的姜黄素-1640培养基进行培养。选取24、48、72h时间节点,观察细胞生长的形态学差异。四甲基偶氮唑蓝(MTT)法检测姜黄素对HT-29细胞的生存抑制率,流式细胞术检测加入姜黄素前后HT-29细胞的周期分布改变,并对药物处理前后的CyclinD1基因表达进行检测比较。结果 在加入姜黄素稀释液后,HT-29细胞生长明显变慢,形状由饱满变得细长,脱壁增多。MTT提示姜黄素能明显抑制HT-29细胞生长,并呈时间和浓度依赖性。流式细胞术显示姜黄素能诱导明显的G0/G1期阻滞,24、48、72h时G1期比例分别为38.2%、44.6%、49.3%,相对对照组差异有统计学意义(P<0.05)。蛋白免疫印迹(Westernblot)实验发现姜黄素能明显降低HT-29细胞中的CyclinD1基因表达,并随作用时间的延长,抑制作用更强。结论 姜黄素能明显抑制人结肠癌HT-29细胞细胞周期CyclinD1基因表达,并诱导细胞G1期阻滞。
姜黄素;结肠肿瘤;HT-29;CyclinD1
恶性肿瘤的发病率日渐增高,且该病检出率低,治愈率低下,是目前困扰临床的一个重大难题。靶点及驱动基因探寻、新药研发是临床及科研工作者孜孜不倦的工作目标。近年来,天然小分子黄酮类物质由于其毒性低微和强大的抗肿瘤活性受到广泛的关注。姜黄素作为姜黄药用的主要有效成分,通过规范提取,保留其多种生物学作用,经多方研究证实具有抗菌、抗肿瘤,以及抗凝、利胆、收缩子宫、降压、降血脂等作用。我们既往研究也发现姜黄素对人肝癌细胞株具有明显的抑制生长及促凋亡作用。为进一步考察其在消化道恶性肿瘤中的作用,本研究培养人结肠癌HT-29细胞,观察姜黄素对其生长及细胞周期分布的影响,并检测细胞周期关键调控基因,初步探寻可能的机制。
1 材料与方法
1.1 主要试剂及仪器 姜黄素、DMSO购自SIGMA,碘化丙啶(PI)、DMEM培养基、胎牛血清(FBS)购自美国Gibco公司,胰蛋白酶(Tyrisin)购自Promega,HT-29细胞株为本实验室冻存。CyclinD1抗体为Santa Cruz公司产品。Elite型流式细胞仪(flow cytometry,FCM)由美国COUTLER公司生产。
1.2 方法
1.2.1 细胞培养及形态学观察 人结肠癌HT-29细胞贴壁生长于含10%小牛血清RPMI-1640培养基中,于5%CO2培养箱、37 ℃常规培养。2~3 d用胰蛋白酶消化后收集细胞并传代。在细胞进入对数生长期后,加入姜黄素稀释液,Olympus倒置显微镜观察HT-29细胞形态的变化。
1.2.2 四甲基偶氮唑蓝(MTT)法检测细胞增殖 根据相关文献报道及既往研究结果,选取2、5、10、20 μmol/L浓度姜黄素进行实验。MTT实验共分为5组,各组以每孔104个HT-29细胞接种于96孔培养板中,依次加入2、5、10、20 μmol/L的姜黄素-1640稀释液,以含0.1%DMSO的1640培养基为空白对照,分别培养24、48、72 h后加入MTT溶液(5 mg/mL)20 μL,全自动酶标仪(490 nm)测定各孔的吸光度(A)值,按公式:抑制率 = 1-药物组A/空白对照组A×100%进行计算。
1.2.3 流式细胞术检测细胞周期分布 另取对数生长期的HT-29细胞,培养24 h后,去上清液,加入上述浓度的姜黄素-1640稀释液分别培养24、48、72 h后与空白对照组一起胰酶消化,洗涤后弃上清液,70%乙醇4 ℃固定,PI染色30 min,COUTLER流式细胞仪上机检测,Listmode软件分析细胞周期分布。
1.2.4 蛋白免疫印迹法(Western blot)检测姜黄素作用前后HT-29细胞中细胞周期基因CyclinD1的表达差异 细胞裂解液裂解HT-29细胞,提取总蛋白,定量。电泳分离、转膜。50 g/L脱脂奶粉缓冲液4 ℃封闭过夜,加一抗CyclinD1(1∶200)室温振摇孵育2 h,洗膜30 min后加二抗(1∶8 000)室温振摇孵育1 h,洗膜,暗盒显影。内参选用β-actin。

2 结 果
2.1 姜黄素对HT-29细胞生长的影响 正常HT-29细胞贴壁生长,细胞间接触紧密,生长旺盛,胞浆饱满,一般2~3d须分瓶传代。加入姜黄素稀释液后,HT-29细胞生长变慢,贴壁疏松,部分脱壁,细胞接触间隙增大,形态变狭长,周围碎片增多。
2.2 生存抑制实验 姜黄素明显抑制HT-29细胞的生长,且具有浓度和时间依赖性。药物处理24h,2、5、10、20μmol/L组抑制率分别为4%、7%、11%、17%。随着时间和姜黄素浓度的增加,HT-29细胞的生存抑制效应愈加明显。细胞抑制率曲线见图1。
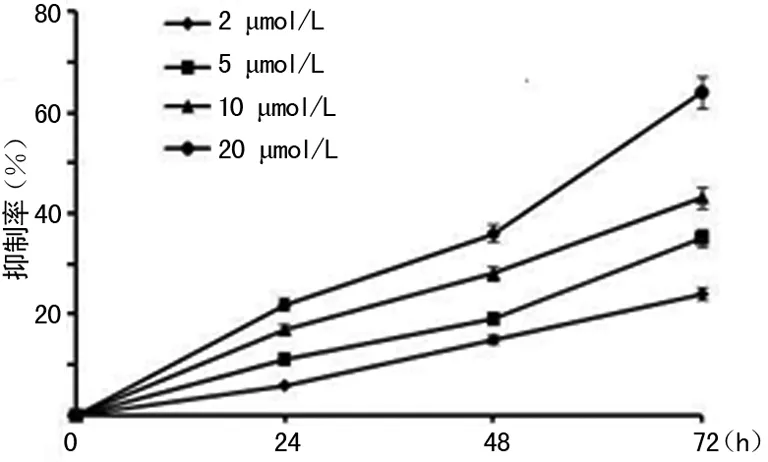
图1 不同浓度姜黄素对HT-29细胞生存抑制曲线图
2.3 姜黄素对HT-29细胞周期的影响 正常生长的HT-29细胞G0/G1期、S期、G2/M期的比例分别为34.1%、55.7%、10.2%。经姜黄素处理24、48和72h后,HT-29细胞在G0/G1期的比例增加,而S期比例下降。10μmol/L姜黄素组的细胞周期分布情况见表1。

表1 10 mol/L姜黄素对HT-29细胞 周期分布的影响
*:P<0.05,与对照组比较。
2.4 姜黄素对HT-29细胞周期基因CyclinD1表达的影响Westernblot结果见图2。从图上可以看出,姜黄素能抑制HT-29细胞周期基因CyclinD1表达,并且这种抑制效果随时间增加越加明显。

图2 姜黄素(10 μmol/L)对HT-29细胞CyclinD1基因的影响
3 讨 论
恶性肿瘤仍是目前困扰人民群众生命健康的重大难题之一。化疗作为传统抗肿瘤治疗手段,在临床中仍然发挥着重要的作用。然而,明显的毒副反应依旧是细胞毒性类药物不可避免的问题。研究者们也在热衷于寻求具有高选择抗肿瘤活性并且低毒的新型药物。姜黄素是中药姜黄的主要有效成分,目前研究发现,姜黄素具有抗炎、抗肿瘤、抗血管硬化等广泛的生物学活性[1-2]。而其在恶性肿瘤生长上发挥的负调控作用更是目前研究热点。体外实验表明,姜黄素可抑制肝癌、肺癌、结直肠癌等多种细胞增殖、诱导凋亡,具有明显的遏制肿瘤发生发展的功效[3-5]。
研究证实,姜黄素发挥抗肿瘤作用主要通过调节抑癌基因和原癌基因表达、诱导细胞凋亡、抗肿瘤血管生成、抗肿瘤转移、逆转肿瘤细胞耐药等机制[6-9]。其过程复杂,涉及的信号通路广泛,也是研究者关注的焦点之一。姜黄素在疾病治疗中的应用前景已被普遍接受,对其剂型及生物利用度的开发也是目前的研究热点。纳米载体材料作为一种新型的药物传递系统,具有改变药物体内分布、药物释放速率、提高生物利用度、延长药物在局部的滞留时间等特点[10]。Gao等[11]以磷脂为稳定剂将姜黄素制备成纳米结晶新制剂,发现姜黄素纳米新剂型较单纯姜黄素水溶性增加了近600倍,并且对肿瘤细胞的抑制作用明显强于单纯姜黄素组。其他的剂型还包括微球药物搭载系统、脂质体/磷脂复合物等,均从一定程度上提高了姜黄素的生物利用度[12-13]。
肿瘤细胞的生长依赖于细胞周期的正常更替。在这过程中,周期蛋白(Cyclins)起着关键调控的作用[14-15]。CyclinD1是Cyclins家族成员中在G1期最先被合成的,于G1中期达峰值。目前研究发现CyclinD1异常高表达于食道、肺、乳腺、肠道恶性肿瘤等[16-17],并与恶性细胞增殖程度相关。而机制研究则表明CyclinD1与细胞周期素依赖激酶CDK4/6形成CyclinD1-CDK复合物,该激酶复合物磷酸化Rb蛋白,释放出E2F而促使细胞进入S期[18-20]。CyclinD1过度表达使细胞周期G1/S期转换时间缩短,促进细胞周期转换速度,从而导致细胞增殖失控。
本实验观察到姜黄素作用前、后HT-29细胞生长,细胞周期的变化,并结合免疫印迹法中CyclinD1基因表达结果,本文推测姜黄素对CyclinD1基因的影响进而导致的G1期阻滞可能是其抑制HT-29细胞生长增殖的途径之一。
[1]刘全未,黄维义.姜黄素诱导HO-1表达对大鼠动脉粥样硬化的影响[J].重庆医学,2011,40(26):2649-2651.
[2]UekiM,UenoM,MorishitaJ,etal.Curcuminamelioratescisplatin-inducednephrotoxicitybyinhibitingrenalinflammationinmice[J].JBiosciBioeng,2013,115(5):547-551.
[3]DuQ,HuB,AnHM,etal.SynergisticanticancereffectsofcurcuminandresveratrolinHepa1-6hepatocellularcarcinomacells[J].OncolRep,2013,29(5):1851-1858.
[4]NagarajuGP,ZhuS,KoJE,etal.Antiangiogeniceffectsofanovelsyntheticcurcuminanalogueinpancreaticcancer[J].CancerLett,2015,357(2):557-65.
[5]LiaoH,WangZ,DengZ,etal.CurcumininhibitslungcancerinvasionandmetastasisbyattenuatingGLUT1/MT1-MMP/MMP2pathway[J].IntJClinExpMed,2015,8(6):8948-8957.
[6]RevaldeJL,LiY,HawkinsBC,etal.HeterocycliccyclohexanonemonocarbonylanalogsofcurcumincaninhibittheactivityofATP-bindingcassettetransportersincancermultidrugresistance[J].BiochemPharmacol,2015,93(3):305-317.
[7]GouQ,LiuL,WangC,etal.Polymericnanoassembliesentrappingcurcuminovercomemultidrugresistanceinovariancancer[J].ColloidsSurfBBiointerfaces,2015,126:26-34.
[8]靳胜,陈书恩,张曼,等.姜黄素逆转HL60/ADR及MCF-7/ADR的多药耐药研究[J].重庆医学,2010,39(1):21-23.
[9]LinSS,LaiKC,HsuSC,etal.CurcumininhibitsthemigrationandinvasionofhumanA549lungcancercellsthroughtheinhibitionofmatrixmetalloproteinase-2and-9andVascularEndothelialGrowthFactor(VEGF)[J].CancerLett,2009,285(2):127-133.
[10]ShinMS,HongJY,ParkS.Gemcitabinereleasebehaviorofpolyurethanematrixesdesignedforlocalanticancerdrugdeliveryviastent[J].JDrugDelivSciTech,2012,22(4):301-306.
[11]GaoY,LiZ,SunM,etal.Preparationandcharacterizationofintravenouslyinjectablecurcuminnanosuspension[J].DrugDeliv,2011,18(2):131-142.
[12]PereiraAG,FajardoAR,NocchiS,etal.Starch-basedmicrospheresforsustained-releaseofcurcumin:preparationandcytotoxiceffectontumorcells[J].CarbohydrPolym,2013,98(1):711-720.
[13]GulcurE,ThaqiM,KhajaF,etal.CurcumininVIP-targetedstericallystabilizedphosholipidnanomicelles:anoveltherapeuticapproachforbreastcancerandbreastcancerstemcells[J].DrugDelivTranslRes,2013,3(6):167-172.
[14]YangP,YinK,ZhongD,etal.InhibitionofosteosarcomacellprogressionbyMacroH2AviathedownregulationofcyclinDandcyclindependentkinasegenes[J].MolMedRep,2015,11(3):1905-1910.
[15]ChoiYJ,LiX,HydbringP,etal.TherequirementforcyclinDfunctionintumormaintenance[J].CancerCell,2012,22(4):438-451.
[16]SainiSS,KleinMA.TargetingcyclinD1innon-smallcelllungcancerandmesotheliomacellsbyantisenseoligonucleotides[J].AnticancerRes,2011,31(11):3683-3690.
[17]El-HafezAA,ShawkyA,HasanB.CyclinD1overexpressionassociateswithfavourableprognosticfactorsininvasivebreastcarcinoma[J].CancerBiomark,2012,12(4):149-154.
[18]XiaB,YangS,LiuT,etal.miR-211suppressesepithelialovariancancerproliferationandcell-cycleprogressionbytargetingCyclinD1andCDK6[J].MolCancer,2015,14(1):1-13.
[19]LeeY,DominyJE,ChoiYJ,etal.CyclinD1-Cdk4controlsglucosemetabolismindependentlyofcellcycleprogression[J].Nature,2014,510(7506):547-551.
[20]崔洁,张超,王攀,等.上调基因-4对结肠癌细胞增殖的影响[J].中华消化外科杂志,2012,11(3):290-293.
Influence of curcumin on proliferation,cell cycle distribution of HT-29 cells and CyclinD1 gene expression*
FangLi1,ZhouJin2△,XieHua2,YaoWenxiu2,ZhouHang2,WeiYang2,WangLiyang2
(1.DepartmentofGastroenterology,FirstAffiliatedHospital,ChengduMedicalCollege,Chengdu,Sichuan610500,China;2DepartmentofMedicalOncology,SichuanProvincialTumorHospital,Chengdu,Sichuan610041,China)
Objective To investigate the effect of curcumin on the proliferation and cell cycle distribution of human colon cancer cells HT-29 and its potential mechanism.Methods HT-29 cells were cultured in logarithmic growth phase with different concentrations of curcumin-1640 medium.The morphologic differences of cellular growth were observed at the time points of 24,48,72 h.The survival inhibition rate of curcumin on HT-29 cells was analyzed by MTT test.Then the changes of cell cycle distribution before and after adding curcumin was tested by flow cytometry.Western blot assay was adopted to detect the expression change of CyclinD1 in HT-29 cells after treating by curcumin.Results After adding curcumin diluent,the HT-29 cells growth obviously turned to slow,the shape was changed from satiation to long and thin,pulling off from wall was increased.MTT indicated that curcumin could significantly inhibit HT-29 cells growth at a time- and dose-dependent manner.As showing by flow cytometry,curcumin could induce G0/G1arrested.The G1phase proportions at 24,48,72 h were 38.2%,44.6% and 49.3% respectively,the difference compared with the control group was statistically significant.Western blot test found that curcumin could significantly decrease the CyclinD1 gene expression in HT-29 cells,moreover the inhibiting effect became stronger with the action time extending.Conclusion Curcumin can significantly inhibit the expression of CyclinD1 gene in human colon cancer cell line HT-29 and induces G1phase arrest subsequently.
curcumin;colon neoplasms;HT-29;CyclinD1
10.3969/j.issn.1671-8348.2016.32.005
四川省科技厅科研基金资助项目(2011JYZ034、2016JY0115)。 作者简介:方丽(1977-),副教授,硕士导师,博士,主要从事胃肠疾病临床及发病机制研究。△
E-mail:zhoujt521@163.com。
R
A
1671-8348(2016)32-4479-03
2016-04-04
2016-05-17)

