源于喉上神经外支的甲状腺神经对甲状腺分泌功能的影响*
张江涛,胡 勇,冉建华,孙善全△
(1.遵义医药高等专科学校人体解剖教研室 563002;2.重庆医科大学神经科学研究所 400016;3.播州区公安局刑侦大队 563100)
论著·基础研究
源于喉上神经外支的甲状腺神经对甲状腺分泌功能的影响*
张江涛1,2,胡 勇3,冉建华2,孙善全2△
(1.遵义医药高等专科学校人体解剖教研室 563002;2.重庆医科大学神经科学研究所 400016;3.播州区公安局刑侦大队 563100)
目的 探讨源于喉上神经外支(ELN)的甲状腺神经对甲状腺分泌功能的影响。方法 随机将21只中华田园犬,抽取3只作为对照组,剩余18只按照手术时间分组,即术后第5、7、9天(分别为A、B、C组),每组各6只,再将其分为假手术组和实验组两个亚组(每亚组各3只)。术前采集各组动物血液样本,麻醉后将假手术组的甲状腺支分离,随即将伤口缝合;于实验组,分离并切断狗的甲状腺支并缝合。在术后的第5、7、9天,分别采集各组狗的血液样本和甲状腺。检测各组血液样本的促甲状腺激素(TSH)和甲状腺素(T4)水平,并将甲状腺作组织学切片检查,然后进行各组比较。结果 正常甲状腺滤泡由单层立方形上皮或单层扁平形上皮细胞组成,滤泡内存在胶状质。实验A组可见甲状腺滤泡大小不等,部分萎缩,腺泡内胶状质减少;B组和C组发现甲状腺滤泡进一步萎缩,排列紊乱,滤泡内胶状质也进一步减少。同时实验A、B、C组生物化学检测发现TSH水平随着时间的延长而增加,但T4水平却随着时间的延长而显著减少。结论ELN支配甲状腺的分支可能通过调节甲状腺血管的舒缩,控制甲状腺素的分泌。
喉上神经外支;甲状腺;胶状质;促甲状腺激素;甲状腺素
喉上神经外支(ELN)是喉上神经(SLN)的一个分支,支配环甲肌、咽下缩肌[1]。然而一系列的研究却表明,ELN还可能支配甲杓肌、环甲关节、声门裂以下喉黏膜等结构[2-5]。另外,众多的研究发现,ELN除支配上述结构外,还支配甲状腺,并将源于ELN的支配甲状腺的神经称之为甲状腺神经[6-10]。迄今为止有关甲状腺神经对甲状腺功能的影响,少见报道。为此,本课题以中华田园犬为研究对象,麻醉并切断实验犬的甲状腺神经,观察急性期犬促甲状腺激素(TSH)和甲状腺素(T4)的分泌变化,以及不同时期甲状腺组织的形态学变化,并对该神经在甲状腺分泌中的作用进行研究,以期对甲状腺的分泌调控机制研究提供实验基础。
1 材料与方法
1.1 材料 21只健康中华田园犬(重庆医科大学动物室提供),HE切片制作工具1套,Olympus生物显微镜1台,Siemens公司Advia Centaur XP系统T4、TSH检测仪器1套, 标记物为吖啶脂,直接化学发光法T4 TSH检测试剂盒1套。
1.2 方法
1.2.1 动物分组 将3只作为对照组,剩余18只按照手术时间分组,即术后第5、7、9天(分别为A、B、C组),每组各6只,再将其分为假手术组和实验组两个亚组(每组各3只)。对所有21只狗均在手术前、后的食物中喂饲足够量的碘盐。
1.2.2 手术步骤 在不同时间点上按照1.2 mL/kg体质量的剂量注射2.5%巴比妥钠麻醉动物,然后从大隐静脉抽取血液5 mL,标记为d1(1 d);在严格无菌条件下暴露甲状腺、喉上神经及其分支、颈上神经节和结状神经节。于手术组,仔细观察颈交感干和SLN之间存在的交通后,见图1 。显露并切断由ELN发出的支配甲状腺上极的分支(甲状腺支);于假手术组,仅作皮肤切口,不作神经的离断。术后,逐层缝合伤口。在术后第5、7、9天,分别采集对照组、实验组(A、B、C组)动物的血液样本和甲状腺。
1.2.3 甲状腺T4和TSH检测 用Siemens公司Advia Centaur XP系统T4 TSH检测仪器, 应用酶联免疫法检测T4水平,放射免疫法检测TSH水平。
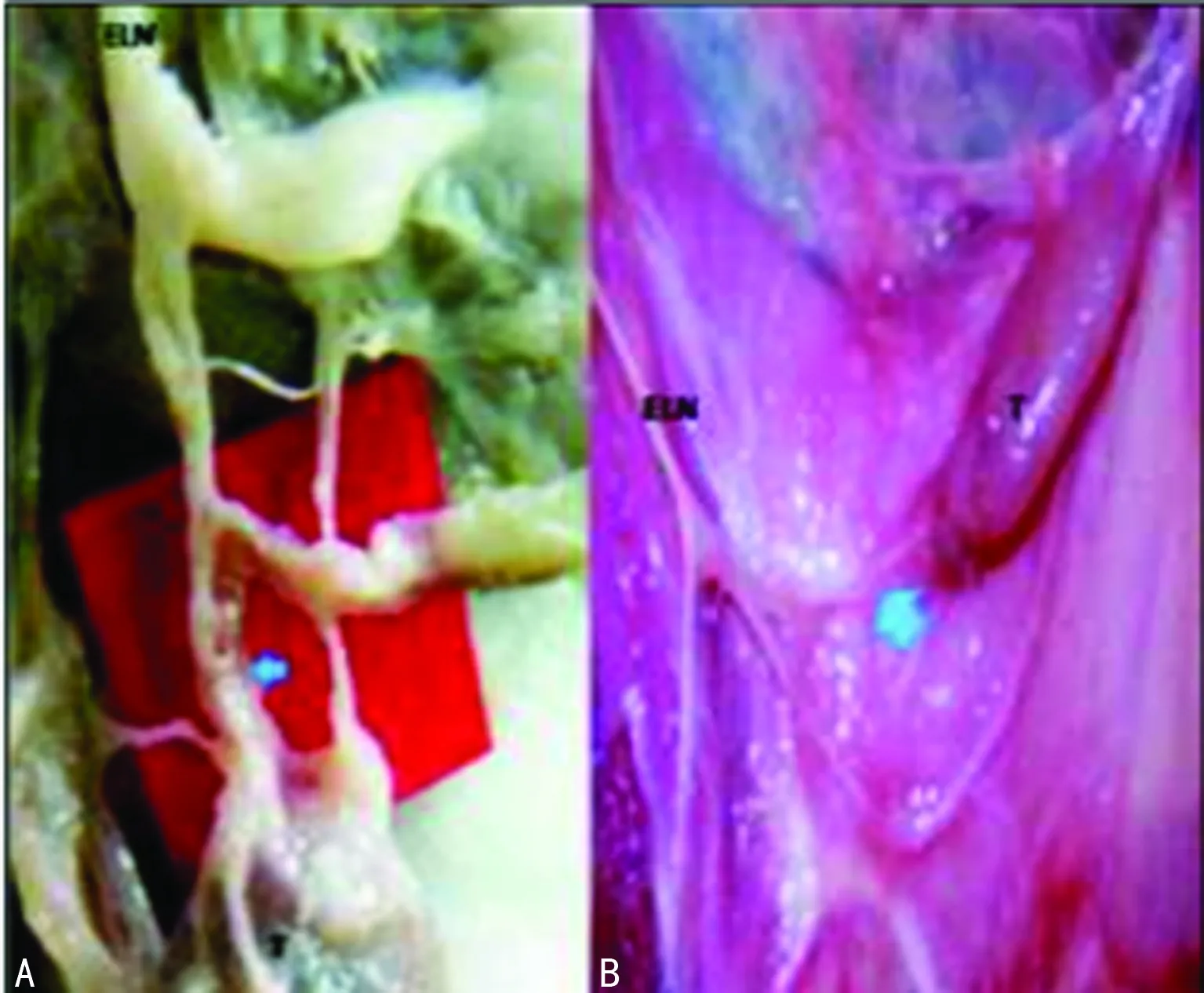
A:ELN分支;B:甲状腺。
图1 ELN发出的支配甲状腺上极的分支
1.2.4 甲状腺组织学观察 用甲状腺制作石蜡切片,HE染色,观察其病理学变化。

2 结 果
2.1 3组狗不同的甲状腺组织学检查显示以下观察结果 对照组和假手术组甲状腺滤泡由单层立方上皮或单层扁平上皮细胞组成,滤泡内存在胶状质,随着时间的延长,实验组甲状腺滤泡依次出现大小不等,形态不规则,排列紊乱,部分萎缩,腺泡内胶状质减少,甚至逐渐消失,见图2。
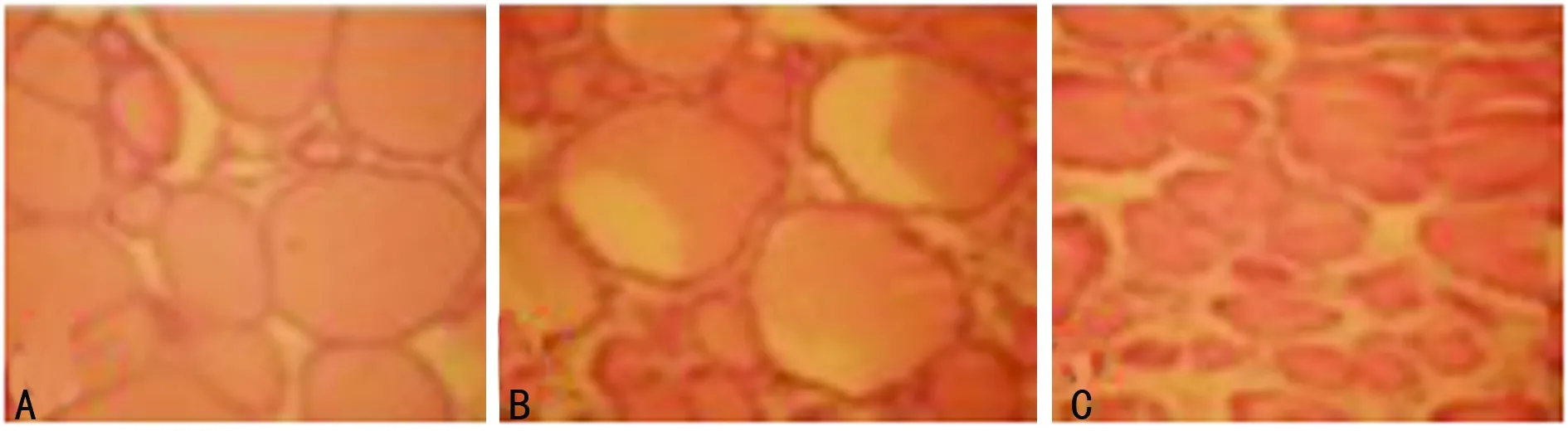
A:对照组;B:假手术B组;C:实验B组。
图2B组甲状腺神经切断后甲状腺的组织学变化(HE,×100)
2.2 3组狗不同时间的TSH和T4检测结果 第1天所有组的TSH和T4 水平假手术组与实验组无明显变化;但是T4 水平在所有组中均为对照组高于实验组;在所有实验组中随着时间的延长,其数值均呈下降趋势。TSH水平所有实验组均高于假手术组;随着时间的延长所有组中的数值均逐渐增高,见表1。
表1 3组狗不同时间的TSH 和T4检测结果比较
*:P<0.05,与对照组和假手术组比较。
2.3T4和TSH水平统计学分析 运用HSD方法进行组间多重比较。甲状腺神经切断1d后,实验A组血液中T4水平与其他各组比较,其差异无统计学意义(P>0.05);术后实验A组与假手术A组和对照组比较T4水平差异无统计学意义(P>0.05);而术后实验B组、C组与假手术B、C组和对照组比较T4水平差异有统计学意义(P=0.400 3、0.033 6)。采用组内配对t检验,假手术各组及对照组之间相比较,其血液中T4水平差异无统计学意义(P>0.05);而在实验A、B、C组与术后第1天比较,其差异均有统计学意义(t=-1.72、-1.02、-3.64 ;P=0.047 3、0.022 1、0.010 5),采用HSD方法组间多重比较。甲状腺神经切断1d后,实验A组与其他各组相比较,TSH水平的差异无统计学意义(P>0.05);而实验B组和C组和对照组之间的差异有统计学意义(P= 0.020 1);实验B组和C组和对照组之间的差异有统计学意义(P=0.009 3)。采用组内配对t检验,假手术A、B、C组TSH水平差异均无统计学意义(P>0.05);实验A、B、C组血液TSH水平与术后第1天比较,差异有统计学意义(t=-6.31、-7.42、-7.97,P=0.003 1、0.002 6、0.001 3)。
3 讨 论
有关甲状腺的神经支配,不同的教科书和不同的文献有着不同的说法。据格氏解剖学记载,交感神经颈上、中、下神经节支配甲状腺。Morris人体解剖学认为,促进甲状腺血管收缩和分泌的神经来源于交感神经颈中、下神经节所发出的无髓神经纤维。1931年Nonidez观察到,支配甲状腺的神经来源于颈上神经节和ELN的分支,并将其称之为甲状腺神经,并认为其大部分神经纤维是交感神经纤维。1968年Shornicki等通过对25只犬和12个人体标本的观察发现,ELN均发出分支支配甲状腺。1968年Moosam观察到ELN发出分支沿甲状腺上动脉的分支,到达甲状腺。直到1991年,有研究观察到:大部分ELN呈袢状,而并非单干形,并将其称之为喉上神经袢;ELN/ELN袢毫无例外地发出分支支配甲状腺,ELN是甲状腺的神经来源之一[9-10]。之后经证实,由ELN/ELN袢发出的甲状腺神经含交感神经节后纤维[9-11]。然而,迄今为止有关该神经对甲状腺分泌功能的影响,少见报道。研究表明,甲状腺的分泌受垂体产生的TSH和下丘脑产生的促甲状腺激素释放激素(TRH)控制,而交感神经支配对其分泌有何影响,尚未见报道。
本实验观察到,在实验组, 切断甲状腺和ELN分支之间的联系后,急性期所有动物均出现了与甲状腺功能减退相一致的病理和生化指标的变化,即甲状腺滤泡萎缩,T4分泌减少。甲状腺的病理组织学变化与Shelke等对水牛甲状腺的观察结果相类似。有研究认为,单纯性甲状腺肿的发生,可能是由于土壤和水中所含碘的浓度过低、怀孕时需求增加、患者的身体条件及摄取硫脲嘧啶、大豆、甘蓝等可以导致甲状腺肿的物质过多所造成[7]。Maxie等[12]也认为,碘量不足是甲状腺有机合成下降的主要原因。在本实验中,动物在接受手术前后均以碘化食物喂养。因此,动物不可能由于碘摄入不足,而影响甲状腺素的合成。因此,在甲状腺神经切断后,T4分泌减少,其原因是:由于交感神经对甲状腺素的分泌具有调控作用,手术将其切断后,引起甲状腺滤泡的萎缩,最终导致甲状腺素分泌的减少。而甲状腺素分泌的下降,可反馈性刺激垂体释放TSH。这就是为什么实验组动物TSH水平升高的原因。Maxie等[12]认为甲状腺激素的合成减少,会刺激垂体释放更多的TSH来增加其产量,这也是导致单纯性甲状腺肿即甲状腺上皮细胞增殖、肥大的原因。由于本实验观察的时间有限,所以尚未观察到实验组甲状腺上皮细胞有否增殖肥大的表现。本实验结果表明,ELN发出的甲状腺神经对甲状腺素的分泌具有调控作用。课题组前期工作发现ELN发出的甲状腺神经含有交感神经节后纤维,而后者可通过调控甲状腺血管的收缩状态,从而影响甲状腺的分泌[10-11]。本实验结果为甲状腺分泌调控的机制研究提供了实验基础。另一方面,众所周知,喉上神经外支损伤是甲状腺手术及颈部其他手术的严重併发症之一。因此,术中如何保护该神经,国内外基础及临床工作者进行了大量的研究。本文结果提示,该神经的甲状腺支切断后,对甲状腺的功能将造成影响。因此,术中如何保护该神经,以及损伤后如何维持甲状腺的正常功能是值得深入研究的课题。
[1]KochilasX,BibasA,XenellisJ,etal.Surgicalanatomyoftheexternalbranchofthesuperiorlaryngealnerveanditsclinicalsignificanceinheadandnecksurgery[J].ClinAnat,2008,21(2):99-105.
[2]LangJ,NachbaurS,FischerK,etal.Thesuperiorlaryngealnerveandthesuperiorlaryngealartery:ananatomicalstudy[J].ClinAnat,2002,15(4):271-275.
[3]RomanchishenAF,LevanovichVV,KarpatskiIV.Surgicalanatomyoftheexternalbranchofthesuperiorlaryngealnerve:clinical-anatomicalinvestigation[J].VestnikKhirurgiiImeniGrekova,2008,167(4):67-70.
[4]FurlanJC.Sympatheticfiberoriginofthesuperiorlaryngealnerveanditsbranches:ananatomicalstudy[J].ClinAnat,2002,15(4):271-275.
[5]HwangSB,LeeHY,KimWY,etal.TheanatomyoftheexternalbranchofthesuperiorlaryngealnerveinKoreans[J].AsianJSurg,2013,36(1):13-19.
[6]YalcinB,DeveliS,TubbsRS,etal.Adetailedstudyoftherelationshipbetweentheexternallaryngealnerveandsuperiorthyroidartery,includingitsglandularbranches.[J]ClinAnat,2013,26(7):814-822.
[7]PatnaikU,NilakantanA,ShrivastavaT.Anatomicalvariationsoftheexternalbranchofthesuperiorlaryngealnerveinrelationtotheinferiorconstrictormuscle:cadavericdissectionstudy[J].LaryngolOtol,2012,126(9):907-912.
[8]许士叶,董剑平,孙善全,等.人与狗迷走/交感干的比较解剖及其喉上神经外支纤维成分[J].中国临床解剖学杂志,2012,30(4):431-434.
[9]HuangHX,SunSQ,RenZH,etal.Superiorlaryngealnerveloop:patternsandsurgicalimplications[J].SurgRadiolAnat,2012,34(10):977-985.
[10]HuangHX,SunSQ,RenZQ,etal.Superiorlaryngealnerveloop:patternsandsurgicalimplications.[J]SurgRadiolAnat,2012,34(10):977-985.
[11]RamnarayanKV,SunSQ,DongJP,etal.Fibercomponentsogtheexternallaryngealnerve.Amorphologicalandhistochemicalanalysis.[J].IndianSciRes,2012,3(1):13-19.
[12]MaxieDV.Jubb,KennedyandPalmer′spathologyofdomesticanimals[M].NewYork,London,AcademicPress:368-396.
Influence of thyroid nerve originated from ELN on thyroid hormone secretion function*
ZhangJiangtao1,2,HuYong3,RanJianhua2,SunShanquan2△
(1.TeachingandResearchingSectionofAnatomy,ZunyiMedicalandPharmaceuticalCollege,Zunyi,Guizhou563002,China;2.InstituteofNeurosciences,ChongqingMedicalUniversity,Chongqing400016,China;3.CriminalInvestigationBrigade,BozhouDistrictPublicSecurityBureau,Zunyi,Guizhou563100,China)
Objective To investigate the influence of the thyroid nerve originated from external laryngeal nerve(ELN) on thyroid hormone secretion function.Methods Three dogs were randomly extracted from 21 Chinese field dogs and the remaining 18 cases were divided into the group A,B and C according to the operation time,i.e.,on postoperative 5,7,9 d,6 cases in each group.Then each group was re-divided into the sham operation subgroup and experimental subgroup.The blood samples were collected before operation.The thyroid nerve branch in the sham operation group was separated after anesthesia and the wound was sutured;whereas the experimental group was performed the thyroid nerve branch separation,cutting off and suture.The blood samples and thyroid in each group were collected on postoperative 5,7,9 d.The levels of thyrotropic hormone(TSH) and T4 were detected.The thyroid was performed the histological section examination.Results The normal thyroid gland follicles consisted of simple cuboidal or simple flattened epithelial cells.The colloid materials existed within the follicles.The group A showed that follicles were unequal in size with partial atrophy and the colloid material in follicles was decreased;the group B and C found that thyroid follicles were further atrophied with arrange in disorder and the colloid material in follicles was further decreased.At the same time,the biochemical detection in the group A,B and C found that the TSH level was increased with time extending,while the T4 level was significantly decreased.Conclusion ELN governing the thyroid nerve branch controls the thyroid hormones secretion possibly by regulating the vasomotion of thyroid artery.
external laryngeal nerve;thyroid gland;gelatinous colloid;thyrotropic hormone;thyroid hormone
10.3969/j.issn.1671-8348.2016.32.007
四川省教委基金项目(川科教1992-51号);重庆市科委中青年科技专家基金(92-3485)。 作者简介:张江涛(1969-),副教授,本科,主要从事人体解剖学与组织胚胎学及法医学研究 。△
E-mail:sunsq2151@sohu.com。
R
A
1671-8348(2016)32-4484-03
2016-06-19
2016-08-07)

