VGX-1027对光滑念珠菌刺激大鼠气道上皮细胞IL-1β和TNF-α表达影响的研究*
王玉春,张 雪,骆雪萍△
(桂林医学医学院第二附属医院:1.检验科;2.重症医学科,广西桂林 541199)
论著·基础研究
VGX-1027对光滑念珠菌刺激大鼠气道上皮细胞IL-1β和TNF-α表达影响的研究*
王玉春1,张 雪2,骆雪萍2△
(桂林医学医学院第二附属医院:1.检验科;2.重症医学科,广西桂林 541199)
目的 探讨未加免疫抑制剂VGX-1027大鼠气道上皮细胞(RTEC)与加入VGX-1027的RTEC分别与光滑念珠菌孵育后炎症因子IL-1β和TNF-α表达及意义。方法 以体外培养未加VGX-1027孵育的RTEC(未加组)和加入VGX-1027孵育的RTEC(加入组),分别与光滑念珠菌孵育3、6、9 h,观察未加和加入组RTEC形态变化;Real time PCR检测未加和加入组IL-1β和TNF-α mRNA表达;ELISA检测未加和加入组IL-1β和TNF-α分泌。未与光滑念珠菌孵育并未加VGX-1027的RTEC为对照组。结果 随孵育时间延长,IL-1β和TNF-α 表达呈进行性增高,未加组与加入组相比,未加组IL-1β和TNF-α 表达更高。相同时间点,未加组与加入组比较IL-1β和TNF-α 表达均差异有统计学意义(P<0.05)。结论 RTEC可识别光滑念珠菌启动天然免疫,并激活下游炎症因子IL-1β和TNF-α的分泌,介导炎症反应,但是过度的炎症反应不能起到保护作用反而加重损伤。
光滑念珠菌;大鼠气道上皮细胞;VGX-1027;肿瘤坏死因子α;白细胞介素1β
近年,由于未能控制的重症感染诱导大量炎症因子的释放,使机体发生失控的自我持续放大和自我破坏的全身性炎症反应。全身炎症反应综合征(SIRS)与代偿性抗炎反应综合征(CARS)的失衡是多器官功能障碍综合征(MODS)的主要发病机制[1]。其中,重症监护病房(ICU)患者由于光滑念珠菌等真菌感染导致菌血症和脓毒败血症从而引起大量炎症因子的释放,使炎症反应失衡而死亡[2]。本研究通过培养未加免疫抑制剂N-乙酰-3,5-二碘-L-酪氨酸(VGX-1027)[3]的大鼠气道上皮细胞(RTEC)和加入VGX-1027的RTEC分别与光滑念珠菌孵育,探讨在免疫调节剂作用下,光滑念珠菌对RTEC刺激下加入组和未加组炎症因子白细胞介素1β(IL-1β)和肿瘤坏死因子α(TNF-α)的表达及影响。
1 材料与方法
1.1 材料 RTEC购于北京协和细胞资源中心。DMEM F12 1∶1混合培养传代,培养条件37 ℃、5%CO2。标准光滑念珠菌,购自上海酶联生物科技有限公司。接种沙堡培养基37 ℃培养48 h,挑菌落在高温高压灭菌磷酸盐缓冲液(PBS)冲洗,配成悬液,显微镜计数,无菌PBS重悬,4 ℃存备用。
1.2 方法
1.2.1 RTEC与光滑念珠菌孵育实验
1.2.1.1 孵育前准备 细胞用胰酶消化、离心、计数,调整密度5×105/mL,每孔1 mL细胞悬液分别加入6孔板,培养24 h。
1.2.1.2 孵育实验及分组 稀释菌液,计数,调整浓度5×106/mL,每孔100 μL菌液,孵育复数(MOI)为1[4]。向六孔板任意一孔加菌液后,每间隔3 h,从其他六孔板任选一孔加菌液,共加3次,分别标记未加(VGX-1027孵育)3、6、9 h组。从剩余孔中选取1孔,未与光滑念珠菌孵育并未加VGX-1027的RTEC标记对照组。
1.2.1.3 加入抑制剂VGX-1027 按照1.2.1.1操作后,调整VGX-1027浓度为1 mg/mL[3]分别加入每1个孔,随机选取3个孔按照1.2.1.2操作加菌液,标记加入3、6、9 h组。
1.2.2 荧光定量PCR 检测IL-1β和TNF-α 终止孵育,收集细胞加入1 mL Trizol,按说明书提取RNA配制逆转录体系,合成cDNA第一链。IL-1β引物序列如下,上游:5′-ACC TGG TAG AAG TGA TGC C-3′,下游:5′-CAA GGA GTT GTT TCC GTT A-3′;TNF-α引物序列如下,上游:5′-CAC CAC GCT CTT CTG TCT ACT-3′,下游:5′-AGA TGA TCT GAG TGT GAG GGT C-3′;β-acting引物序列如下,上游:5′-GGA GAT TAC TGC CCT GGC TCC TA-3′,下游:5′-GAC TCA TCG TAC TCC TGC TTG CTG-3′。Real time PCR 反应条件:94 ℃ 2 min,94 ℃ 20 s,59 ℃ 20 s,72 ℃ 2 s,40循环。
1.2.3 上清液ELISA 检测IL-1β和TNF-α 终止孵育,分别取100 μL上清液,按说明进行,绘制曲线,计算出IL-1β和TNF-α表达水平。

2 结 果
2.1RTEC光镜观察
2.1.1 未加组的RTEC光镜观察 对照组RTEC形状完整、结构清晰(图1A);未加3、6、9h组(图1B、C、D)可见,RTEC形状变异、边缘模糊、结构不完整,未加3h组与对照组比较,未加6h组与未加3h组比较,未加9h组与未加6h组比较,光滑念珠菌菌群数量逐渐增多,细胞碎片、溶解现象更明显。
2.1.2 加入组的RTEC光镜观察 由1图E、F、G可见,加入3h组与未加3h组比较、加入6h组与未加6h组比较、加入9h组与未加9h组比较发现,加入组RTEC形状、结构和完整性均比未加入组损伤减轻,细胞变异减少,随时间延长光滑念珠菌数量逐渐增多,但细胞碎片和细胞溶解现象比未加组明显减少。

A:对照组;B:未加3h组;C:未加6h组;D:未加9h组;E:加入3h组;F:加入6h组;G:加入9h组。
图1RTEC与光滑念珠菌孵育光镜观察(×20)
2.2IL-1β和TNF-αmRNA荧光定量PCR结果
2.2.1 未加3、6、9h组与光滑念珠菌孵育后IL-1β和TNF-αmRNA表达 未加3h组与对照组比较、未加6h组与未加3h组比较、未加9h组与未加6h组比较,IL-1β和TNF-αmRNA表达均明显增高。
2.2.1.1 未加3、6、9h组IL-1βmRNA表达 未加3h组(2.498 5± 0.120 5)与对照组(1.000 0±0.000 0)比较,差异有统计学意义(P<0.05);未加6h组(3.898 1± 0.141 1)与未加3h组比较,差异有统计学意义(P<0.05);未加9h(5.942 1±0.110 7)与未加6h组比较,差异有统计学意义(P<0.01)。
2.2.1.2 未加3、6、9h组TNF-αmRNA表达 未加3h组与对照组(1.000 0± 0.000 0)比较,差异有统计学意义(P<0.05);未加6h组(6.298 9± 0.109 7)与未加3h组比较,差异有统计学意义(P<0.05);未加9h组(8.785 7±0.517 3)与未加6h组比较,差异有统计学意义(P<0.01)。
2.2.2 加入与未加3、6、9h组的RTEC与光滑念珠菌孵育后IL-1β和TNF-αmRNA表达水平 相同时间,加入组IL-1β和TNF-αmRNA的表达降低(P<0.05),尤其是加入9h组与未加9h组相比,差异有统计学意义(P<0.01),见图2、3和表1、2。
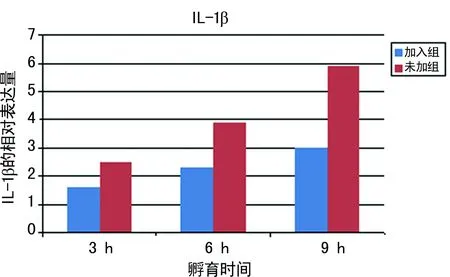
图2 加入VGX-1027组与未加组比较IL-1β mRNA表达
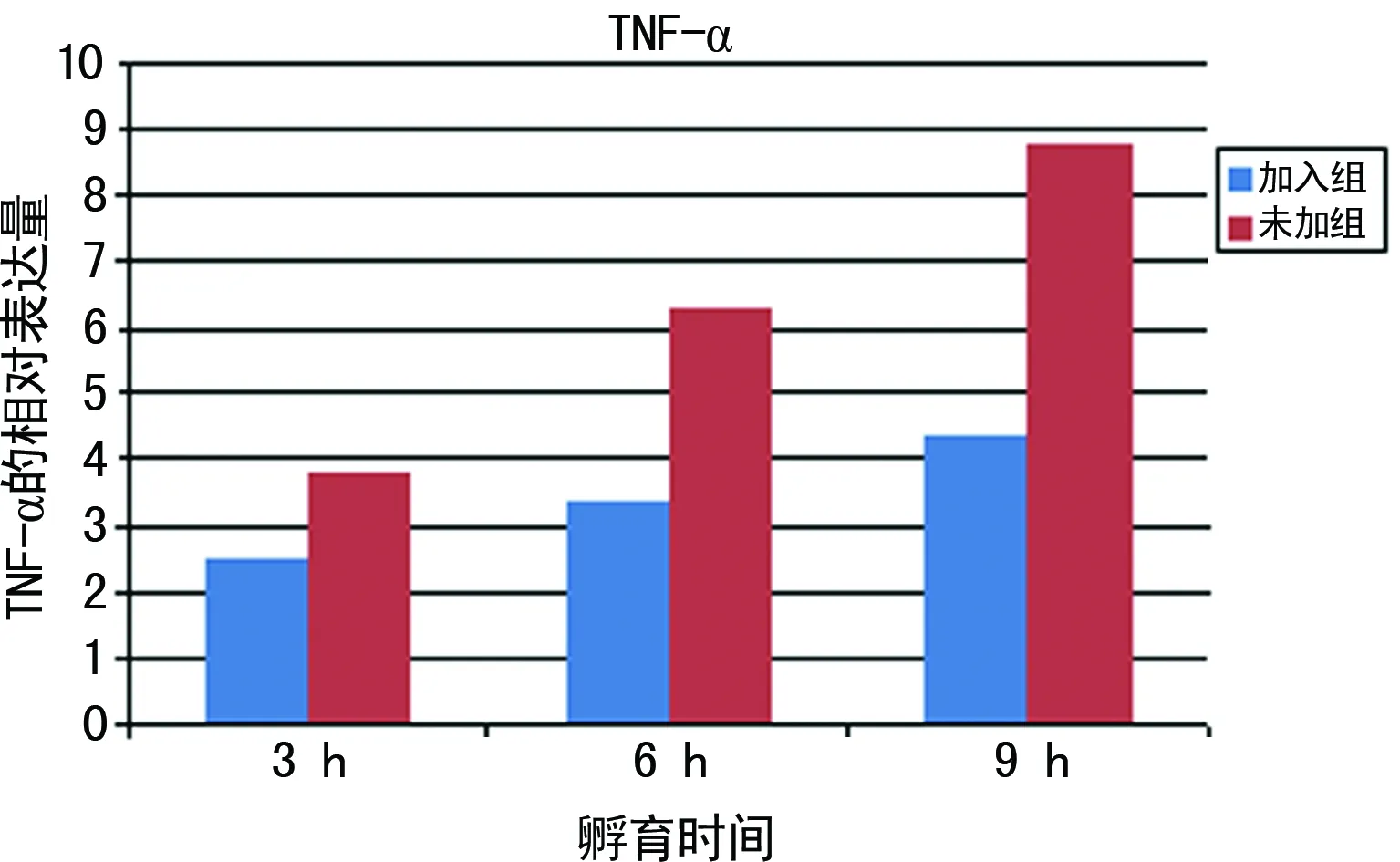
图3 加入VGX-1027孵育组与未加组比较TNF-α mRNA表达
2.3ELISA检测上清液中IL-1β和TNF-α分泌
2.3.1 未加3、6、9h组上清液IL-1β和TNF-α因子的分泌 未加3h组与对照组比较、未加6h组与未加3h组比较,未加9h组与未加6h组比较,IL-1β和TNF-α的表达显著升高。
2.3.1.1 未加3、6、9h组上清液IL-1β因子表达 未加3h组(121.53±15.71)与对照组(64.75±8.03)比较差异有统计学意义(P<0.05);未加6h组(272.94±7.72)与未加3h组比较差异有统计学意义(P<0.05);未加9h组(412.55±19.05)与未加6h组比较差异有统计学意义(P<0.01)。
2.3.1.2 未加3、6、9h组上清液TNF-α表达 未加3h组(80.69±8.57)与对照组(50.97±2.74)比较差异有统计学意义(P<0.05);未加6h组(139.13±15.78)与未加3h组比较差异有统计学意义(P<0.05);未加9h组(307.79±18.81)与未加6h组比较差异有统计学意义(P<0.01)。
2.3.2 加入与未加3、6、9h组上清液中IL-1β和TNF-α分泌比较 相同时间,加入组比未加组IL-1β和TNF-α的分泌均较低,尤其是9h组低表达更显著(表3、4)。

表1 加入VGX-1027孵育组与未加组比较IL-1β mRNA表达
a:P<0.05,与加入3h组比较;b:P<0.05,与加入6h组比较;c:P<0.01,与加入9h组比较.

表2 加入VGX-1027孵育组与未加组比较TNF-α mRNA表达
a:P<0.05,与加入3h组比较;b:P<0.05,与加入6h组比较;c:P<0.01,与加入9h组比较。

表3 加入VGX-1027孵育组与未加组比较IL-1β分泌
a:P<0.05,与加入3h组比较;b:P<0.05,与加入6h组比较;c:P<0.01,与加入9h组比较。

表4 加入VGX-1027组与未加组比较TNF-α分泌
a:P<0.05,与加入3h组比较;b:P<0.05,与加入6h组比较;c:P<0.01,与加入9h组比较。
3 讨 论
VGX-1027是一种异恶唑化合物,有很强的免疫调节特性,能针对体内外不同受体信号通路刺激抑制炎症因子的分泌[5]。有研究表明,VGX-1027是一种有效的免疫调节剂,能降低促炎细胞因子如IL-1β、TNF-α和干扰素γ(INF-γ)等的分泌,并通过抑制细胞因子的炎性作用使细胞存活率显著增加[3],从而避免炎性-抗炎失衡对机体造成的严重损伤。对于ICU患者由于大量激素和免疫抑制剂的应用,真菌侵入机体发生侵袭性肺部真菌感染(IPFI)非常普遍[6]。严重的未能控制的真菌感染引起大量炎性细胞浸润和炎症介质释放,使炎性介质和抗炎介质失衡造成严重的肺脏损伤最终导致死亡。本研究通过RTEC加入免疫抑制剂VGX-1027与光滑念珠菌孵育相同时间发现,信号通路下游炎症因子IL-1β和TNF-α分泌与未加入组相比显著减少。此时在显微镜下发现,加入组与未加入组相比,加入组细胞轮廓、形态、结构和完整性破坏情况比不加入组明显减轻。由此可见,VGX-1027具有很强的免疫抑制性,可降低炎性介质IL-1β和TNF-α的分泌,减轻炎症反应,避免失控的炎症反应带来的严重损伤。
当真菌入侵机体时,首先接触气道上皮细胞,气道上皮细胞是抵抗真菌等病原微生物入侵机体的第一道防线[7],也是抗病原微生物感染产生免疫应答的前哨细胞。以往气道上皮细胞仅被认为是机械物理屏障,随研究深入发现气道上皮细胞表面存在许多特异的病原识别受体(PRRs),如Toll样家族受体[8]和C型凝集素受体(CLR)等,通过对真菌表面病原相关分子模式(PAMPs)识别启动天然免疫,保护机体免受真菌侵袭[9]。PRRs通过特异识别PAMP后,活化信号通路,招募特异接头蛋白如MyD88等,使下游炎症和趋化因子释放,发挥抗真菌感染作用[10-11]。Dubourdeau等[12]发现用分生孢子刺激小鼠能激活信号通路启动天然免疫,诱导下游TNF-α和IL-1等分泌抗感染。又有研究发现,PRRs上调也可以促进炎症因子如TNF-α等的分泌,增加抗感染作用[13]。本实验研究同样发现,光滑念珠菌与RTEC孵育能诱导下游炎症因子IL-1β和TNF-α的表达,未加组炎症因子分泌比加入组多。其中,最明显的现象是虽然未加3h组比加入3h组释放的炎症因子IL-1β和TNF-α明显增多,但此时在显微镜却发现与加入3h组相比未加3h组RTEC细胞形态、结构和完整性的损害相对较轻,细胞溶解和细胞碎片相对较少。由此可见,在真菌感染早期信号通路能启动天然免疫,诱导下游炎症因子如TNF-α和IL-1β的释放,适度的炎症反应能抗真菌感染。
然而随着孵育时间的延长,下游的炎症因子IL-1β和TNF-α的表达逐渐增多,尤其在9h组。未加9h组比加入9h组IL-1β和TNF-α的分泌几乎升高了一倍,但此时显微镜下发现,未加组与加入组相比未加组RTEC受到的损害不但没有减轻反而加重。细胞形态结构的完整性均被严重破坏,细胞溶解、被吞噬现象越来越明显,细胞碎片逐渐增多。张青等[14]研究也发现,IL-1β和TNF-α是SIRS主要的前炎症细胞因子,当一个损害性刺激作用机体会诱导前炎症因子的产生和释放,“瀑布样”效应开始启动。患者血浆中前炎症因子IL-1β和TNF-α等水平显著升高,使机体的炎症反应逐渐扩大,甚至失控。对于重症患者在器官损害期,前炎症细胞因子会显著升高,导致组织损伤和器官功能障碍[15]。此时,重症患者将加重病情甚至死亡。由此证明,过度失控的炎性因子释放会产生瀑布级联,引起机体失控的自我持续放大和自我破坏的全身性炎症反应加重损伤。
综上所述,RTEC能识别光滑念珠菌,通过信号转导诱导下游炎性因子IL-1β和TNF-α的表达,从而启动天然免疫抗真菌感染。适度的炎症反应对机体起到保护作用,但失控的持续放大的炎症反应对机体的损伤更为严重。因此,充分认识炎症避免“二次打击”可能为ICU重症患者在治疗方面提供了一个新的靶点。
[1]TsukamotoT,ChanthaphavongRS,PapeHC.Currenttheoriesonthepathophysiologyofmultipleorganfailureaftertrauma[J].Injury,2010,41(1):21-26.
[2]GrollAH,LumbJ.Newdevelopmentsininvasivefungaldisease[J].FutureMicrobiol,2012,7(2):179-184.
[3]ManganoK,SardesaiN,D′AlcamoM,etal.Invitroinhibitionofenterobacteria-reactiveCD4+CD25-TcellsandsuppressionofimmunoinflammatorycolitisinmicebythenovelimmunomodulatoryagentVGX-1027[J].EurJPharmacol,2008,586(1/2/3):313-321.
[4]SeiderK,GerwienF,KasperL,etal.Immuneevasion,stressresistance,andefficientnutrientacquisitionarecrucialforintracellularsurvivalofCandidaglabratawithinmacrophages[J].EukaryotCell,2014,13(1):170-183.
[5]Stosic-GrujicicS,CvetkovicI,ManganoK,etal.Apotentimmunomodulatorycompound,(S,R)-3-Phenyl-4,5-dihydro-5-isoxazoleaceticacid,preventsspontaneousandacceleratedformsofautoimmunediabetesinNODmiceandinhibitstheimmunoinflammatorydiabetesinducedbymultiplelowdosesofstreptozotocininCBA/Hmice[J].JPharmacolExpTher,2007,320(3):1038-1049.
[6]CheCY,JiaWY,XuQ,etal.TherolesofsurfactantproteinDduringAspergillusfumigatusinfectioninhumancornealepithelialcells[J].IntJOphthalmol,2012,5(1):13-17.
[7]EvansSE,XuY,TuvimMJ,etal.Inducibleinnateresistanceoflungepitheliumtoinfection[J].AnnuRevPhysiol,2010,72(1):413-435.
[8]RomaniL.Immunitytofungalinfections[J].NatRevImmunol,2011,11(4):275-288.
[9]DrummondRA,BrownGD.TheroleofDectin-1inthehostdefenceagainstfungalinfections[J].CurrOpinMicrobiol,2011,14(4):392-399.
[10]吴呈霖,骆雪萍,吴晔,等.大鼠侵袭性肺部热处理光滑念珠菌感染肺组织Dectin-1和IL-10的表达[J].广东医学,2014,35(22):3468-3470.
[11]NeteaMG,MarodiL.InnateimmunemechanismsforrecognitionanduptakeofCandidaspecies[J].TrendsImmunol,2010,31(9):346-353.
[12]DubourdeauM,AthmanR,BalloyV,etal.AspergillusfumigatusinducesinnateimmuneresponsesinalveolarmacrophagesthroughtheMAPKpathwayindependentlyofTLR2andTLR4[J].JImmunol,2006,177(6):3994-4001.
[13]BainJM,LouwJ,LewisLE,etal.Candidaalbicanshyphaformationandmannanmaskingofbeta-glucaninhibitmacrophagephagosomematuration[J].mBio,2014,5(6):1874.
[14]张青,李琦,毛宝龄,等.ARDS和SIRS患者血浆TNF-α、IL-1β、IL-6及IL-10水平的变化[J].感染、炎症、修复,2004,5(3):92-94.
[15]HollowayTL,RaniM,CapAP,etal.TheassociationbetweentheTh-17immuneresponseandpulmonarycomplicationsinatraumaICUpopulation[J].Cytokine,2015,76(2):328-333.
Study of effect of VGX-1027 on expression of IL-1β and TNF-α in rat tracheal epithelial cells stimulated by Candida glabrata*
WangYuchun1,ZhangXue2,LuoXueping2△
(1.DepartmentofClinicalLaboratory;2.DepartmentofICU,SecondAffiliatedHospitalofGuilinMedicalUniversity,Guilin,Guangxi541199,China)
Objective To explore the expression and significance of IL-1β and TNF-α in rat tracheal epithelial cells(RTEC)without adding immunosuppressant VGX-1027 and RTEC with adding VGX-1027 after co-culturing with Candida glabrata.Methods RTEC without and with VGX-1027 were respectively co-cultured with Candida glabrata bacteria liquid for 3,6,9 h.Then the morphological changes of RTEC were observed in the adding VGX-1027 group and non-adding VGX-1027 group;the mRNA expressions of IL-1β and TNF-α were detected by real-time PCR and secretion of IL-1β and TNF-α was determined by ELISA.Results With the culture time extending,the expression of IL-1β and TNF-α showed the progressive increase;the expressions of IL-1β and TNF-α in the non-adding VGX-1027 group were higher than those in the adding VGX-1027 group.At the same time point,the expressions of IL-1β and TNF-α had statistically significant difference between the non-adding VGX-1027 group and adding VGX-1027 group(P<0.05).Conclusion RTEC can recognize Candida glabrata to activate natural immunity and secretion of downstream inflammatory factors IL-1β and TNF-α,and mediates inflammatory reaction,but excessive inflammation can not play a protective effect,on the contrary aggravates damage.
Candida glabrata;rat tracheal epithelial cells;VGX-1027;tumor necrosis factor-α;interleukin-1beta
10.3969/j.issn.1671-8348.2016.32.004
广西医疗卫生重点科研课题(重2012007);广西自然科学基金项目(2013GXNSFAA019209)。 作者简介:王玉春(1965-),副主任技师,本科,主要从事重症感染方面研究。△
R519.3
A
1671-8348(2016)32-4475-04
2016-04-03
2016-05-16)

