脱氢表雄酮对人脐静脉内皮细胞血管舒张功能的影响*
夏尊恩 周 泉 李 艳
脱氢表雄酮对人脐静脉内皮细胞血管舒张功能的影响*
夏尊恩 周 泉 李 艳#
目的:分析脱氢表雄酮(DHEA)对CD40L刺激的人脐静脉内皮细胞(HUVECs)的一氧化氮(NO)、内皮素-1(ET-1)水平及ET-1 mRNA和内皮源性NO合酶(eNOS)mRNA表达水平的影响,探讨DHEA对血管舒张的作用。方法:原代培养HUVECs,给予CD40L(1μg/m1)刺激(CD40L刺激组)和不同浓度DHEA(10-8mol/L、10-7mol/L、10-6mol/L,分别为低、中、高浓度DHEA组)干预,以不作干预的培养细胞为空白对照组。采用反转录聚合酶链反应(RT-PCR)检测HUVECs的ET-1、eNOS mRNA表达,采用ELISA和硝酸还原酶法分别检测细胞培养液中NO和ET-1浓度。结果:与空白对照组比较,CD40L刺激组ET-1 mRNA和ET-1浓度明显增加,eNOS mRNA和NO水平明显降低(P<0.05或P<0.01)。与CD40L组比较,不同浓度DHEA组ET-1 mRNA和ET-1水平降低,eNOS mRNA和NO水平增加,以高浓度DHEA组变化最明显(P<0.05或P<0.01)。结论:DHEA能通过抑制ET-1表达和促进NO生成来保护内皮细胞的舒张血管功能。
脱氢表雄酮;人脐静脉内皮细胞;一氧化氮;内皮素-1;舒张功能
动脉粥样硬化(Atherosclerosis,AS)是严重危害人类健康的一种常见血管病,目前已经认识到内皮细胞功能失调是导致AS形成的重要因素[1]。血管内皮不仅具有屏障功能,更重要的是它还具有内分泌、信息传递、血小板调节和抗黏附等功能。正常状态下,血管内皮会分泌一氧化氮(NO)、内皮素-1(ET-1)、内皮源性NO合酶(Endothelial Nitric Oxide
Synthase,eNOS)、前列环素、白细胞介素6(IL-6)等血管活性因子,调节血管舒张、收缩、炎症反应、血管平滑肌细胞增殖、血小板聚集、白细胞黏附等[2]。流行病学及动物实验资料显示脱氢表雄酮(Dehydroepiandrosterone,DHEA)作为一种雄激素,对心血管系统有保护作用[3-5]。目前有研究发现,雄激素可使男性冠心病患者肱动脉扩张,而这些血管扩张作用主要依赖于血管内皮舒张功能[6]。因此,本文通过体外培养人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cells,HUVECs),观察DHEA对其表达NO、ET-1、eNOS的作用,探讨DHEA对血管内皮舒张/收缩功能的作用机制。
1 材料与方法
1.1 试剂和材料
内皮细胞ECM培养基购自美国Sciencell公司;DHEA、1型胶原酶购自美国Sigma公司;Trizol 购自美国Invitrogen公司(批号15596-028);反转录聚合酶链反应(RT-PCR)试剂购自立陶宛Fermentas公司(批号1175936),引物由上海生工生物技术有限公司合成;NO检测试剂盒购自南京建成生物医学工程研究所(批号20120430);ET-1检测试剂盒购自美国Assay Designs Inc公司(批号K863502)。实验所用脐带采自本院产科健康新生儿,产妇及家属知情同意,并经医院伦理委员会批准。
1.2 实验方法
1.2.1 细胞培养:无菌条件下取健康新生儿脐带,采用胶原酶消化法从脐静脉血管内皮将内皮细胞洗脱下来后进行原代培养,待细胞融合长满形成单层细胞后,用0.25%胰蛋白酶消化及传代培养,内皮细胞鉴定采用Ⅷ因子相关抗原免疫组化染色,呈典型铺路石样排列。实验前24h将培养基改为无血清培养基,实验选用生长状态良好的对数生长期细胞。实验共分为5组:(1)空白对照组(无干预);(2) CD40L刺激组[7](1μg/m1 CD40L与内皮细胞共同培养24h);(3)低浓度DHEA(10-8mol/L)组;(4)中浓度DHEA(10-7mol/L)组;(5)高浓度DHEA(10-6mol/L)组。每组设3个复孔。3-5组先给予不同浓度的DHEA 干预1h,再加入1μg/ml CD40L与内皮细胞共同培养24h。
1.2.2 RT-PCR检测mRNA表达:用TRIzol试剂提取HUVECs总RNA,将总RNA逆转录成cDNA,然后进行 PCR扩增。ET-1上游引物:5’-TAC TTC CCA CAA AGA CCA CA-3’,下游引物:5’-CGG ACA GAT GTT CTT GCT AA-3’,扩增产物长度为356bp。eNOS上游引物:5’-GAG TCC TCA CCG CCT TCT C-3’,下游引物:5’-AGG AAG CGC GTG GCA GTA-3’,扩增产物长度为664bp。GAPDH上游引物:5’-ACG GAT TTG GTC GTA TTG GG-3’,下游引物:5’-TCC TGG AAG ATG GTG ATG GG-3’,扩增产物长度为211bp。PCR条件为:94℃预变性2min,进入循环,94℃变性60s,ET-1:54℃,GAPDH:56℃,eNOS:54℃,退火60s,72℃延伸60s的条件下循环扩增。扩增产物进行琼脂糖凝胶电泳,经凝胶成像分析系统进行图像分析,测定PCR产物条带的光密度(A)值。以GAPDH作内参照,ET-1和eNOS条带的A值分别与GAPDH的A值的比值表示其相对表达水平。
1.2.3 ET-1浓度测定:采用ELISA双抗体夹心法。严格按照试剂盒说明书方法操作,在酶标仪450nm处,以空白对照孔调零后测各孔A值,根据标准曲线计算各组样品ET-1浓度。
1.2.4 NO浓度测定:采用硝酸还原酶法。分别取双蒸水、标准品和各组培养细胞上清液各100μl,按照NO检测试剂盒方法操作,在酶标仪上测定550nm处A值,根据标准品A值计算各组样品NO含量。
1.3 统计学处理

2 结 果
2.1 DHEA对ET-1 mRNA表达的影响
相对定量分析显示,各组ET-1 mRNA表达差异有统计学意义(F=13.18,P<0.01)。CD40L刺激组ET-1 mRNA表达较空白对照组明显增加(1.16±0.21 vs 0.23±0.05,t=10.63,P<0.01);不同浓度DHEA组ET-1 mRNA表达均较CD40L刺激组下降,高浓度DHEA组下降最多(0.46±0.12,t=8.49,P<0.05)。见图1。
2.2 DHEA对ET-1浓度的影响
各组ET-1浓度差异有统计学意义(F=15.56,P<0.01)。与空白对照组比较,CD40L刺激组ET-1水平明显上升(46.15±5.07μg/L vs 75.39±6.51μg/L,t=4.96,P<0.05),不同浓度DHEA 组ET-1浓度均较CD40L刺激组下降,高浓度DHEA组下降最多(46.68±5.24μg/L,t=6.71,P<0.05)。见图2。
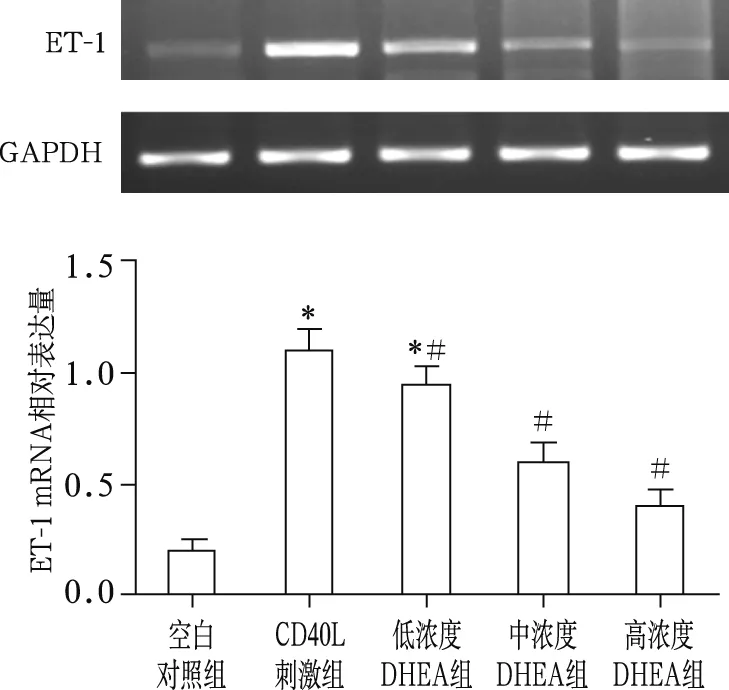
注:与空白对照组比较,* P<0.01;与CD40L刺激组比较,
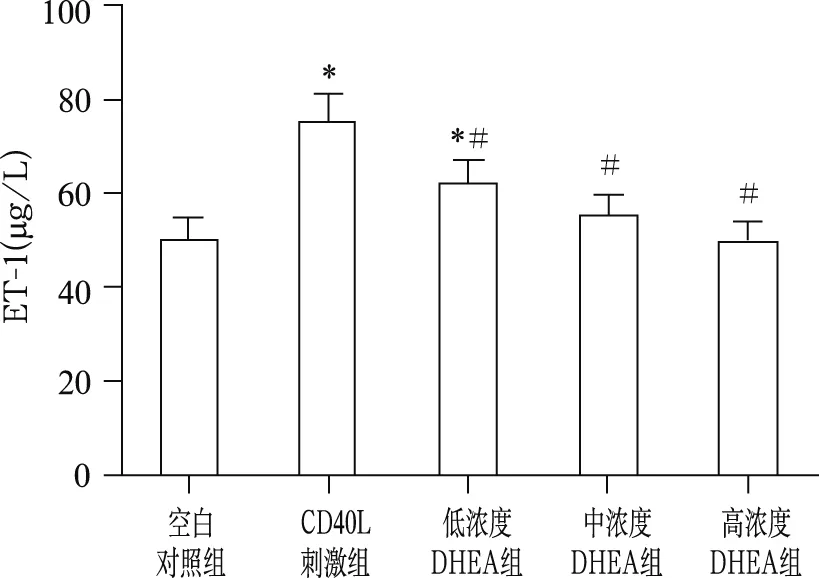
注:与空白对照组比较,* P<0.05;与CD40L刺激组比较,
2.3 DHEA对eNOS mRNA表达的影响
各组间eNOS mRNA表达差异有统计学意义(F=21.39,P<0.01)。与空白对照组比较,CD40L刺激组eNOS mRNA表达降低(0.20±0.05 vs 0.11±0.03,t=6.38,P<0.01)。与CD40L刺激组比较,不同浓度DHEA组eNOS mRNA表达显著增加,相对定量值分别为0.21±0.06、0.33±0.09、0.52±0.11(t=7.02、8.54、10.36,P<0.05或P<0.01)。见图3。
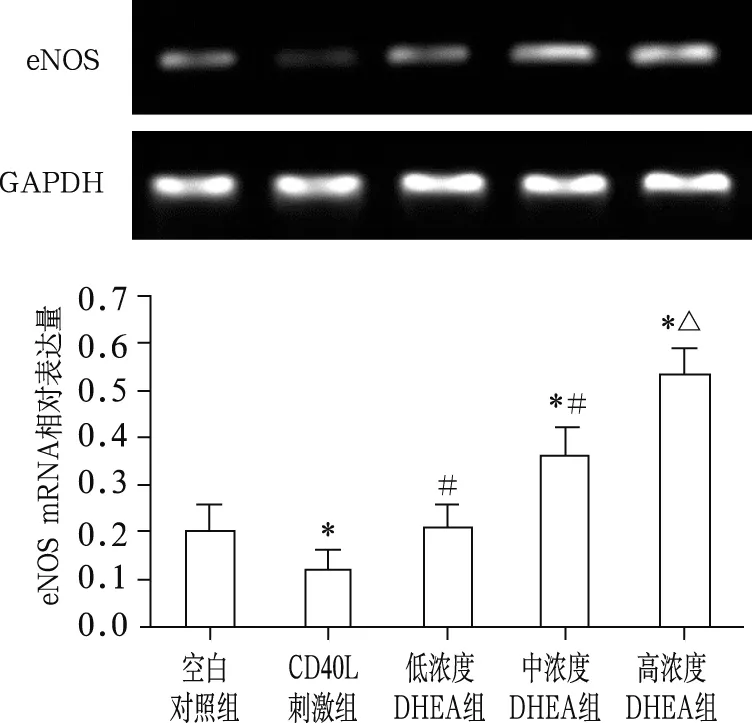
注:与空白对照组比较,* P<0.01;与CD40L刺激组比较,
2.4 DHEA对NO浓度的影响
各组NO浓度差异有统计学意义(F=12.47,P<0.01)。与空白对照组比较,CD40L刺激组NO浓度明显降低(18.22±3.43μmol/L vs 12.38±2.11μmol/L,t=7.12,P<0.05)。中、高浓度DHEA组NO较CD40L组明显增加,浓度分别为15.21±2.38μmol/L和18.45±2.76μmol/L(t=5.23、6.87,P<0.05)。见图4。
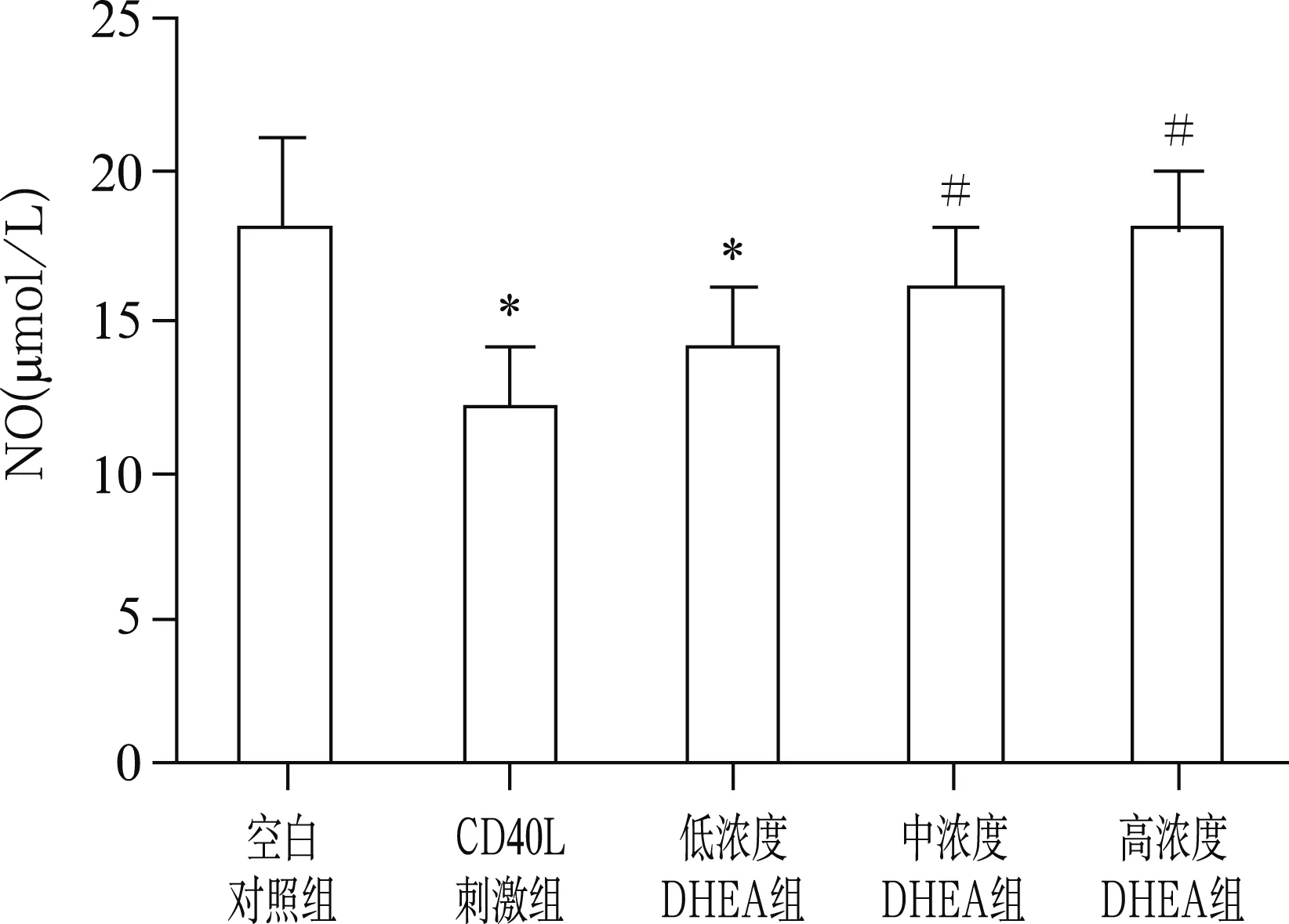
注:与空白对照组比较,* P<0.05;与CD40L刺激组比较,
3 讨 论
在AS发生发展的早期阶段,血管内皮功能障碍发挥着重要作用,损伤的血管内皮可能失去原有的生理功能,极易发生炎症反应、脂质沉积、血栓形成,从而加速AS[8]。因此血管内皮不仅是重要的血管屏障,而且是调节血管舒张功能和血管结构的内分泌器官。生理条件下,内皮细胞在各种刺激下由eNOS催化左旋精氨酸的氧化反应,生成并不断释放NO到周围组织和细胞中,调节血管张力和血管扩张;同时NO还具有抗凝、抗氧化、抗细胞黏附等作用,可阻止血小板聚集和白细胞对血管内皮的黏附,抑制平滑肌细胞的增殖,介导平滑肌细胞舒张,从而发挥心血管保护作用[9]。病理状态时,内皮细胞功能紊乱,其主要表现为NO减少。在炎性细胞因子作用下,eNOS活性减弱,NO合成量减少,会加重血管内皮舒张/收缩障碍。
ET具有很强的促血管收缩作用,其3个亚型中ET-1对心血管系统起着重要的作用。ET-1主要由内皮细胞在血管壁剪切力、压力等物理因素以及肾上腺素、血管紧张素、血栓素等刺激下合成和分泌,用以调节局部血管张力,促进血管收缩和炎症反应的形成,并能促进平滑肌细胞增殖、氧化应激和激活血小板。而NO能抑制ET-1的合成,拮抗ET-1功能,维护血管内皮的正常舒张活性。Alvarez等[10]研究证实ET-1可使冠状动脉强烈痉挛,具有心肌细胞毒性作用和致心律失常作用,ET-1活性的异常升高对于心肌缺血和心肌梗死的发生有重要意义。ET-1和NO的比例失调会导致冠脉管腔狭窄,加重心肌缺血缺氧,使冠心病更加恶化。因此,改善血管内皮细胞功能,抑制冠脉收缩,增加冠脉血流量,已经成为冠心病治疗研究中的重要靶点。
DHEA是人体含量最高的一种内源性雄激素,其对心血管系统的保护机制与其调节内皮细胞功能密切相关。有报道[11]DHEA可以使离体兔主动脉和冠状动脉显著扩张,能通过抑制平滑肌细胞的增殖调节内皮损伤后的血管重塑;并且DHEA还能通过G蛋白藕联受体促进血管内皮NO的合成。Hayashi等[12]通过高脂饮食兔来研究DHEA对AS影响的作用机制,结果表明DHEA可通过转化为雌激素并促进NO生成而发挥抗AS作用。
炎性细胞因子CD40/CD40L是介导内皮细胞损伤的重要介质,其相互作用可诱导内皮细胞内信号转导,激活炎性因子、黏附分子和趋化因子表达,促进白细胞黏附和血小板聚集,形成AS早期炎症反应并加速斑块形成和不稳定。我们之前的研究表明,DHEA能显著抑制CD40和CD40L的表达[13],本实验进一步探讨了DHEA对CD40L诱导的内皮细胞舒张功能的影响,结果显示,DHEA不仅能抑制CD40L诱导的ET-1分泌及ET-1 mRNA的表达,还能促进eNOS mRNA表达和来自于eNOS的NO含量的增加,因而能减少CD40L的促内皮损伤作用,并激活eNOS促内皮细胞释放较多NO,减轻内皮细胞功能障碍,修复内皮细胞功能,对冠脉的损伤修复起到积极地保护作用。
综上所述,DHEA能通过抑制ET-1表达,促进eNOS和NO生成来保护血管内皮细胞的舒张功能。该结果为临床应用DHEA治疗AS提供了部分实验依据。
◀
本文第一作者简介:
夏尊恩(1981-),男,汉族,医学博士,主管技师,主要从事动脉粥样硬化与炎症机制研究
1 Barbato JE, Tzeng E. Nitric oxide and arterial disease[J]. J Vasc Surg, 2004, 40(1):187-193.
2 Omar SA,Webb AJ,Lundberg JO, et al. Therapeutic effects of inorganic nitrate and nitrite in cardiovascular and metabolic diseases[J]. J Intern Med, 2016, 279(4):315-336.
3 Savineau JP, Marthan R, Dumas de la Roque E. Role of DHEA in cardiovascular diseases[J]. Biochem Pharmacol, 2013, 85(6):718-726.
4 Tchernof A, Labrie F. Dehydroepiandrosterone, obesity and cardiovascular disease risk: a review of human studies[J]. Eur J Endocrinol, 2004, 151(1):1-14.
5 Alexandersen P, Haarbo J, Byrjalsen I, et al. Natural androgens inhibit male atherosclerosis: a study in castrated, cholesterol-fed rabbits[J]. Circ Res, 1999, 84(7): 813-819.
6 Wynne FL, Khalil RA. Testosterone and coronary vascular tone: implications in coronary artery disease[J]. J Endocrinol Invest, 2003, 26(2):181-186.
7 Marzio PD, Sherry B, Thomas EK, et al. beta-Chemokine production in CD40L-stimulated monocyte-derived macrophages requires activation of MAPK signaling pathways[J]. Cytokine, 2003, 23(2):53-63.
8 Gimbrone MA Jr, Garc a-Carde a G. Endothelial cell dysfunction and the pathobiology of atherosclerosis[J]. Circ Res, 2016, 118(4):620-636.
9 Llorens S, Jordan J, Nava E. The nitric oxide pathway in the cardiovascular system[J]. J Physiol Biochem, 2002, 58(3):179-188.
10 Alvarez D, Briassouli P, Clancy RM, et al. A novel role of endothelin-1 in linking Toll-like receptor 7-mediated inflammation to fibrosis in congenital heart block [J]. J Biol Chem, 2011, 286(35):30 444-30 454.
11 Liu PY, Death AK, Handelsman DJ. Androgens and cardiovascular disease[J]. Endocr Rev, 2003, 24(3):313-340.
12 Hayashi T, Esaki T, Muto E, et al. Dehydroepiandrosterone retards atherosclerosis formation through its conversion to estrogen: the possible role of nitric oxide[J]. Arterioscler Thromb Vasc Biol, 2000, 20(3):782-792.
13 夏尊恩,李 艳,汪 明,等. 脱氢表雄酮对人脐静脉内皮细胞CD40 /CD40L表达的影响[J]. 微循环学杂志, 2008, 18(1):39-41.
Influence of Dehydroepiandrosterone on Diastolic Function in Human Umbilical Vein Endothelial Cells
XIA Zun-en,ZHOU Quan,LI Yan#
Department of Clinical Laboratory, Renmin Hospital of Wuhan University, Wuhan 430060, China;#Corresponding author
Objective: To investigate effect of dehydroepiandrosterone (DHEA) on expression of NO, ET-1 and eNOS in human umbilical vein endothelial cells(HUVECs) and influence of DHEA on diastolic function in HUVECs.Method: HUVECs were incubated with 1μg/m1 CD40L for 24 hours with or without pretreated by different concentration of DHEA(10-8mol/L,10-7mol/L,10-6mol/L). ET-1 and eNOS mRNA expression were detected by RT-PCR. The levels of NO and ET-1 were measured by nitrate reduction test and ELISA. Results: Compared with control group, CD40L increased the mRNA expression of ET-1 and level of ET-1 in HUVECs(allP<0.01). Meanwhile, the eNOS mRNA expression and NO content in HUVECs in CD40L group were decreased(allP<0.01). DHEA with different concertration could down-regulate the ET-1 mRNA and ET-1 expression and promote the eNOS mRNA expression and NO content in HUVECs,espically the most obvious change was in 10-6mol/L DHEA group(P<0.05,P<0.01). Conclusion: DHEA could regulate vascular endothelial cells diastolic function by promoting NO generation and inhibiting ET-1 expression.
Dehydroepiandrosterone; Human umbilical vein endothelial cells; NO; ET-1; Diastolic function
国家自然科学基金(81101319)
武汉大学人民医院检验科,武汉 430060;#
本文2016-09-02收到,2016-10-10修回
R392.11
A
1005-1740(2016)04-0007-05