SH-SY5Y 神经细胞中α7神经型尼古丁受体基因沉默对CaM、CaMKⅡ蛋白水平的影响
张淑丽, 官志忠,2, 肖 雁, 吴昌学, 齐晓岚
SH-SY5Y 神经细胞中α7神经型尼古丁受体基因沉默对CaM、CaMKⅡ蛋白水平的影响
张淑丽1, 官志忠1,2, 肖 雁1, 吴昌学1, 齐晓岚1
目的 构建稳定的α7 nAChR沉默的神经母细胞瘤细胞(SH-SY5Y)细胞,研究α7 神经型尼古丁受体(nAChR)基因沉默对钙调蛋白(CaM)、钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ)水平的影响,了解α7 nAChR神经保护作用及其与阿尔茨海默病(AD)发病机制的关系。方法 将α7 nAChR shRNA重组质转染到SH-SY5Y,用含嘌呤霉素的培养液筛选,挑选阳性克隆后采用实时荧光定量PCR和蛋白质印迹方法(Western-blot)检测细胞中α7 nAChR mRNA 及蛋白表达水平的变化;Western-blot方法测定CaM、CaMKⅡ蛋白表达水平。结果 获得稳定转染α7 nAChR shRNA重组质粒的细胞克隆株,与对照组相比,α7 nAChR mRNA 及蛋白表达量分别减少了95%和80%。CaM、CaMKⅡ蛋白表达量分别减少了48.5%和35%。结论 成功构建了α7 nAChR mRNA沉默的SH-SY5Y细胞细胞株,α7 nAChR沉默降低了CaM、CaMKⅡ的蛋白水平,可能影响信号通路转导,这可能与阿尔茨海默病 (AD) 的发病有一定的关系。
RNA干扰; α7神经型尼古丁受体; CaM; CaMKⅡ; SH-SY5Y 细胞
阿尔茨海默病(AD) 是一种老年人最常见的中枢神经系统退行性疾病,从中年期到晚年期缓慢发生的记忆损伤和认知功能障碍[1,2]。胆碱能系统功能障碍是早期AD较突出的基本特征,在AD发生中具有显著作用[3]。神经型尼古丁受体又称烟碱乙酰胆碱受体(Neuronal acetylcholine receptors,nAChR)对大脑智力发育、学习记忆和识别能力等功能有重要作用,并参与其他受体许多功能的调节,具有明显神经保护作用[4]。报道指出在AD患者中观察到胆碱能损伤与 α7 nAChR水平下降有关[5]。α7nAChR属于离子通道受体,对Ca2+具有良好通透性,与α7nAChR有关的很多病理及生理机制都涉及到Ca2+内流[6]。大量神经系统疾病患者尸检中都有关于Ca2+沉积的报告[7],这引起了人们关注Ca2+在这些疾病中的调节作用。Gu[7]报道在阿尔茨海默病中钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ)含量减少,且CaMKⅡ是钙调蛋白(CaM)的作用底物。本研究用体外合成的shRNA抑制细胞 α7 nAChR的表达,研究其受抑制后CaM、CaMKⅡ表达水平,从而探讨 α7 nAChR对CaM、CaMKⅡ 表达水平的影响及研究 α7 nAChR神经保护作用机制及其在AD发病机制中的作用。
1 材料与方法
1.1 材料 本实验保存的人脑神经母细胞瘤(SH-SY5Y)细胞株;DMEM 高糖培养基、胰酶、双抗购于 HyClone 公司;OPTI-MEM培养基、血清购于Gbico;由上海生工生物工程技术服务有限公司合成各模板引物序列;Genopure Plasmid Midi Kit、X-tremeGENE HP DNA Transfection Reagent 购于 Roche 公司(德国);Trizol 试剂、逆转录试剂盒购于 invitrogen 公司(美国);兔抗CaM(FL-149):sc-5537多克隆抗体、鼠抗CaMKⅡα(A-1):sc-13141单克隆抗体、鼠抗 -actin单克隆抗体:sc-81178及HRP标记的抗鼠二抗:sc-2005、Control shRNA Plasmid-B、AChR 7 shRNA Plasmid(h)、GFP shRNA Plasmid购自 Santa Cruz Biotechnology Inc (美国);兔抗 7多克隆抗体购自Genetex(美国);辣根过氧化物酶 (HRP) 标记的抗兔二抗#7074购自CST(美国);聚乙烯二氟膜、ECL-Plus 发光液、胶片购自 Amersham 公司;Real time RT-PCR 所用试剂均购于Roche公司;二甲亚砜(DMSO)购自 Gibco 公司;普通化学试剂均购自 Sigma 公司。
1.2 方法
1.2.1 细胞培养和转染 用含10%胎牛血清、1%双抗(青霉素100 U/ml,链霉素100 U/ml)的高糖DMEM培养基于5% CO2、37 ℃恒温中培养SH-SY5Y贴壁细胞。生长良好的细胞用0.25%胰酶蛋白酶消化接种至六孔板,待其汇合度达到70%~80%时,在试剂说明书指导下进行shGFP荧光质控摸索最佳沉默效率,再分别将不同重组质粒转入培养的SH-SY5Y细胞中。于OPTI-MEM培养基中转染6 h换10%血清的DMEM培养基,培养24 h之后,加0.004 g/L嘌呤霉素培养液筛选,直至出现单克隆细胞。96孔板有限稀释,挑取阳性单克隆并扩增培养。收集其细胞,测定α7nAChR mRNA及蛋白表达水平。
1.2.2 细胞α7 nAChR 基因沉默效果测定 采用一步法提取总 RNA,以PCR 循环逆转录合成的cDNA为模板进行Real- time PCR。所用试剂为Firststart Universal SYBR Green Master(Rox)。引物序列参照王凡等[8](见表1)。
1.2.3 蛋白表达水平测定 收集细胞,提取细胞蛋白(冰上裂解2 h,14000 r/min离心5 min)并进行BCA方法定量,Western blot方法检测α7 nAChR、CaM、CaMKⅡ蛋白表达水平,以β-actin为内对照。ImageJ软件分析结果,计算α7 nAChR、CaM、CaMKⅡ蛋白条带与β-actin蛋白像素灰度的比值作为蛋白表达相对水平。实验重复3次,每次3个复孔。
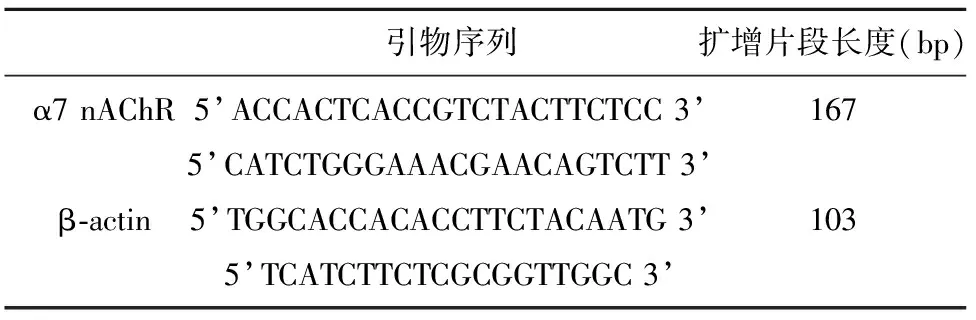
表1 荧光定量PCR引物序列及产物片段
在ABI Step One Plus型实时荧光定量PCR仪,采集α7 nAChR及β-actin基因扩增各循环的荧光信号,以SDS2.1软件收集荧光和分析数据。分析结果时以β-actin为内对照,计算α7 nAChR基因在实验组与对照组的相对水平(RQ=2-△△Ct)。实验重复3次,每次3个复孔。
2 结 果
2.1 免疫荧光方法测沉默效率优化转染条件 转染GFP shRNA Plasmid 24 h之后用免疫荧光方法,紫光激发红光进行倒置荧光显微镜观察GFP荧光标记率。根据荧光值得到在转染试剂:质粒=3∶1,复合物的最适体积为200 μl(六孔板),其最适孵育条件为常温、15 min(见图1)。
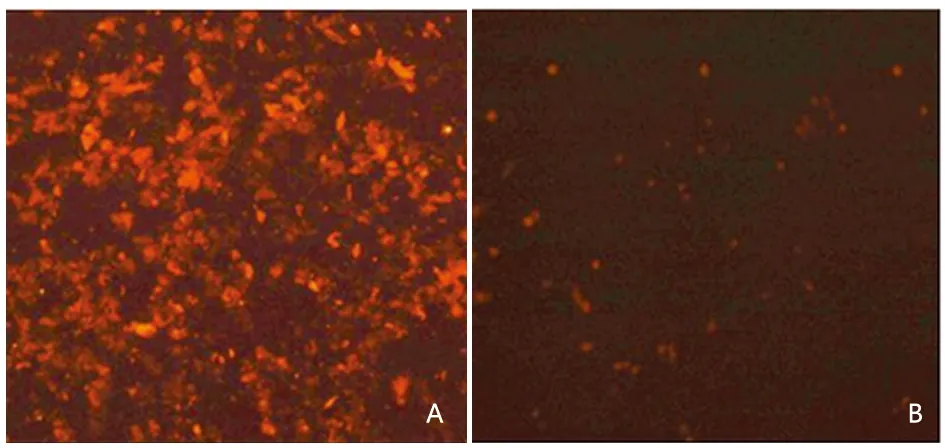
图1 未转染shGFP免疫荧光图(A);转染shGFP的最优条件免疫荧光图(B)×100
2.2 转染7尼古丁受体基因后7尼古丁受体 mRNA 及蛋白表达水平 本实验表明,用Real-time PCR和Western blot方法检测到SH-SY5Y细胞转染nAChRα7 shRNA质粒后mRNA 及蛋白表达水平分别减少了95%(见图2A)及80%(见图2B),与对照组相比差异具有统计学意义(P<0.01)。而转染阴性对照与对照组相比不具有差异性。说明已将shα7nAChR成功转入SH-SY5Y细胞,且抑制了α7 nAChR mRNA和蛋白表达水平。
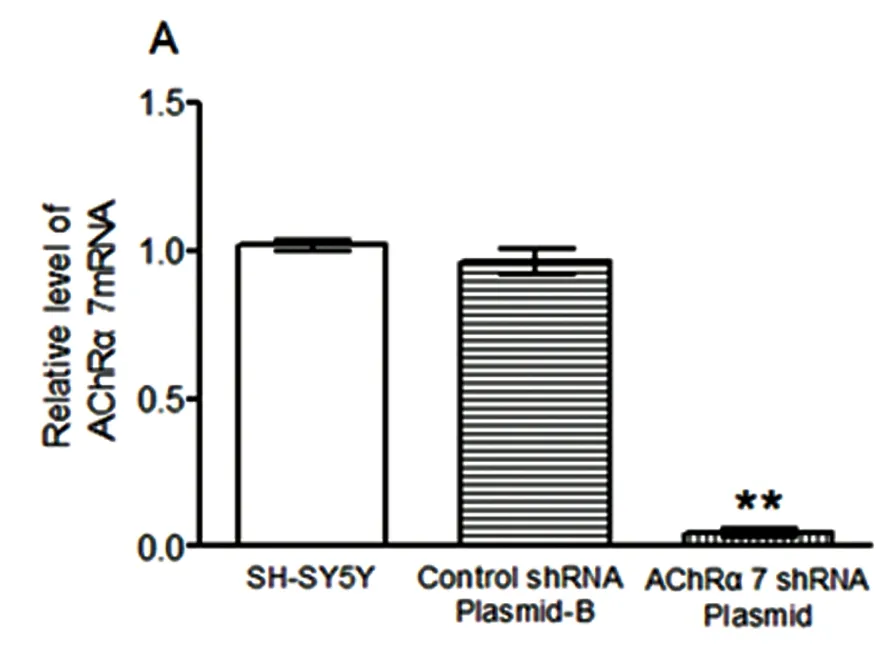
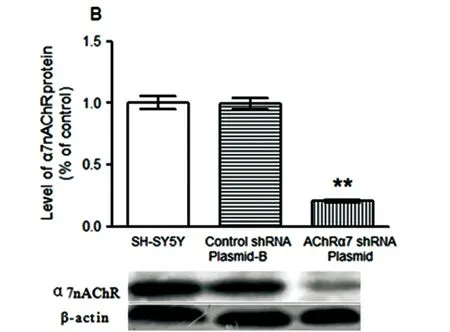
与对照组相比差异有高度统计学意义**P<0.01
图2 转染α7 nAChR shRNA质粒后α7 nAChR mRNA(A)及蛋白表达水平(B)
2.3 转染7尼古丁受体基因后CaM、CaMKⅡ蛋白表达水平 转染α7 nAChR shRNA质粒后CaM、CaMKⅡ蛋白表达水平分别减少了48.5%(见图3)和35%(见图4),与对照组相比差异具有统计学意义(P<0.01)。而转染阴性对照与对照组相比不具有差异性。说明降低α7 nAChR水平能减少CaM、CaMKⅡ蛋白表达水平。
3 讨 论
nAChR是神经系统中一类非第2信使介导性神经递质结合的离子通道,由2种亚单位α和β构成。不同的亚单位以不同的组合构成不同的尼古丁受体亚型(五聚体),主要调控细胞内外Na+、K+和Ca2+等离子的流动[9],其含量减少与AD的发病有关[10]。α7nAChR是其中较为特殊的亚型,其在海马和皮质神经元中高表达[11],激活的α7nAChR可以调节神经元兴奋性和神经递质释放[12,13]、改变突触可塑性[14]、帮助神经元抵御内外因素的损伤,维持正常的生理功能,对维持记忆及认知功能的十分重要。且最近有研究表明在老化过程中α7nAChRs对维持认知功能、学习和记忆具有重要性及α7nAChRs对海马突触可塑性的重要性[15]。研究表明,α7nAChR对改善阿尔茨海默病和精神分裂症患者的认知障碍有显著作用[16,17]。本研究将针对α7nAChR的shRNA片段转染到SH-SY5Y细胞中,mRNA和蛋白表达水平明显下降了。表明α7nAChR shRNA能有效地抑制内源性α7nAChR的表达。
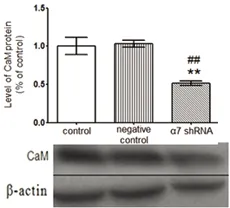
与对照组相比差异有统计学意义**P<0.01;与阴性对照组相比差异有统计学意义##P<0.01
图3 转染α7 nAChR shRNA质粒后CaM蛋白表达水平
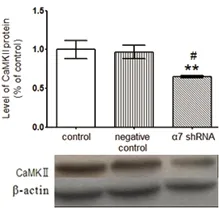
与对照组相比差异有统计学意义**P<0.01;与阴性对照组相比差异有统计学意义#P<0.05
图4 转染α7 nAChR shRNA质粒后CaMKⅡ蛋白表达水平
配体门控型离子通道的α7nAChR对Ca2+通透性极强,对维持细胞内钙稳态具有重要的作用[18]。Ca2+流入神经细胞内与CaM相结合,进一步激活下游的涉及长时程增强 (LTP) 维持的级联反应[19]。钙调蛋白CaM在细胞中是重要的多功能蛋白,激活40多种酶或通道。它不仅参与了神经元和星形胶质细胞的信号级联放大系统,及参与突触可塑性、细胞分化与增生,而且还在LTP和学习记忆中起着非常重要的作用[20]。CaMKⅡ是由α、β、γ、δ4种亚基单位组成的异质多聚体,并分别有四种不同的基因编码[21],是一种多功能的蛋白激酶,通过磷酸化许多底物蛋白来传导Ca2+信号,在神经递质的合成和释放、LTP以及突触的可塑性、学习记忆中起着重要作用。CaMKIIa基因敲除小鼠LTP及空间记忆能力均受损[22]。因此,CaMKⅡ可能是学习和记忆的分子基础,CaMKⅡ活性异常可能是阿尔茨海默病的发病机制之一。
本研究旨在构建重组α7 nAChR shRNA沉默质粒并表达在SH-SY5Y细胞内,观察其对神经细胞的影响。本研究成功构建的α7 nAChR shRNA真核表达载体有效地抑制了 SH-SY5Y 细胞中 α7 nAChR 的表达,为进一步的研究是否通过α7 nAChR表达减少而影响CaM、CaMKⅡ蛋白表达水平。α7 nAChR表达水平下降这可能是配体门控型离子通道的α7nAChR数目减少进而使进入细胞的Ca2+减少,导致CaM蛋白表达也减少,进而导致Ca2+/CaM复合体减少,进一步导致下游级联反应,CaMKⅡ表达也减少,阻断LTP的产生,最终可能导致学习记忆能力障碍,促使AD的发生与发展。我们前期研究表明,抑制了 SH-SY5Y 细胞中 α7 nAChR 的表达能使Aβ生成增多,但AD中CaM、CaMKII变化与Aβ相互联系还有待于进一步的研究。这提示α7 nAChR对AD可能具有重要的神经保护作用。
[1]Walsh DM,Selkoe DJ. Deciphering the molecular basis of memory failure in Alzheimer’s disease[J]. Neuron,2004,44:181-193.
[2]Osborn GG. Current treatments for patients with Alzheimer disease[J].Am Osteopath Assoc,2010,110(Suppl 8):S16-26.
[3]Medeiros R,Castello NA,Cheng D,et al. α7 Nicotinic Receptor Agonist Enhances Cognition in Aged 3xTg-AD Mice with Robust Plaques and Tangles[J]. Am J Pathol,2014,184:520-529.
[4]Guan ZZ,Yu WF,Shan KR,et al. Loss of Nicotinic Receptors Induced by Beta-Amyloid Peptides in PC12 Cells:Possible Mechanism Involving Lipid Peroxidation[J]. Journal of Neuroscience Research,2003,71:397-406.
[5]D’Andrea MR,Nagele RG. Targeting the alpha 7 nicotinic acetylcholine receptor to reduce amyloid accumulation in Alzheimer’s disease pyramidal neurons[J]. Curr Pharm Des,2006,12(6):677-684.
[6]Kaur A,Gill KD. Disruption of neuronal calcium homeostasis after chronic aluminium toxicity inrats [J]. Toxicol,2005,95:118-122.
[7]Gu Z,Liu W,Yan Z. beta - amyloid Impairs AMPA receptor traffic-kingand function by reducing CaMKII synaptic distribution [J]. J BiolChem,2009,284( 16):10639.
[8]王 凡,任家谋,齐晓岚,等. SH-SY5Y细胞 7尼古丁受体基因抑制对APP代谢的影响[J]. 中风与神经疾病杂志,2012,32(23):5177-5179.
[9]Taly A,Omorringer PJ,Uedin D,et al. Icotinic receptors:llosteric transitions and therapeutic targets in the Ilervous system [J]. Nat Rev Drug Discov,2009,8(9):733-750.
[10]Cao Y,Xiao Y,Ravid R,et al. Changed Clathrin Regulatory Proteins in the Brains of Alzheimer’s Disease Patients and Animal Models [J]. Journal of Alzheimer’s Disease,2010,22:329-342.
[11]Conejero-Goldberg C,Davies P,Ulloa L. Alpha7 nicotinic acetylcholine receptor:A link between inflammation and neurodegeneration [J]. Neuroscience and Biobehavioral Reviews,2008,32 (4):693-706.
[12]Cheng Q,Yakel JL. Presynaptic α7 nicotinic acetylcholine receptors enhance hippocampal mossy fiber glutamatergic transmission via PKA activation [J] . The Journal of Neuroscience,2014,34(1):124-133.
[13]Komal P,Gudavicius G,Nelson C,et al. T-cell receptor activation decreases excitability of c;ortic;al interneurons by inhibiting α7 nicotinic receptors [J]. The Journal of Neuroscience,2014,34(1):22-35.
[14]Nordman JC,Philips WS,Kodama N,et al. Axon targeting of the alpha 7 nicotinic receptor in developing hippocampal neurons by Gprinl regulates growth [J]. Journal of Neurochemistry,2014,129 (4):649-662.
[15]Ma LY,Turner D,Zhang JF,et al. Deficits of synaptic functions in hippocampal slices prepared fromaged mice null α7 nicotinic acetylcholine receptors [J]. Neuroscience Letters,2014,570:97-101.
[16]Russo P,Del Bufalo A,Frustaci A,et al. Beyond acetylcholinesterase inhibitors for treating Alzheimer’s disease:α7-nAChR agonists in human clinical trials[J]. Current Pharmaorutioal Design,2014,20 (38):6014-6021.
[17]Beinat C,Reekie T,Banister SD,et al. Structure-activity relationship studies of SEN12333 analogues:Determination of the optimal requirements for binding affinities at α7 nAChRs through incorporation of known structural motifs [J]. European Journal of Medicinal Chemistry,2015,95:277-301.
[18]Haass C,Selkoe DJ. Soluble protein oligomers in neur odegeneration less ons from the Alzheimer’s amyloid β2 peptide [J]. Nat Rev Mol Cell Biol,2007,8 (2 ):101-112.
[19]Shytle RD,Mori T,Townsend K,et al. Cholinergic modulation of microglial activation by alpha 7 nicotinic receptors [J]. J Neurochem,2004,89:337-343.
[20]Breese CR,Adams C,Logel J,et al. Comparison of the regional expression of nicotinic acetylcholine receptor alpha7 mRNA and [125I]-alpha-bungarotoxin binding in human postmortem brain [J]. J Comp Neurol,1997,387:385-398.
[21]Hook SS,Means AR. Ca2+/CaM-dependent kinases:from activation function[J]. Anna Rev Pharmacol Toxieol,2001,41:471-505.
[22]Irvine EE,Vemon J,Giese KP. Alpha CaMK Ⅱ autophosphorylation contributes torapid learning but is not necessary for memory [J]. Nature Neuroscience,2005,8:411-412.
Influence of α7 neural nicotinic receptor gene silencing on the protein levels of CaM and CaMK Ⅱin SH-SY5Y cells
ZHANG Shuli,GUAN Zhizhong,XIAO Yan,et al.
(The Key Laboratory of Molecular Biology,Guizhou Medical University,Guiyang 550004,China)
Objective Investigating that the influence of inhibited gene expression of α7 nicotinic acetylcholine receptor (nAChR) induced by RNA interference on the protein levels of calmodulin (CaM) and calmodulin dependent protein kinase Ⅱ(CaMK Ⅱ),and to understand the neuroprotective mechanism of α7 nAChR and its function in the pathogenesis of Alzheimer’s disease (AD). Method The recombinant α7 nAChR shRNA were transfected into SH-SY5Ycells,the stable clones were screened with puromycin,and used Real-time PCR and Western blot monitoring the levels of α7 nAChR mRNA and protein,respectively. The protein levels of the CaM and CaMK Ⅱ were also determined by Western blot. Results We got the cell clone strains with stable transfection of α7 nAChR shRNA recombinant plasmid,and as compared with controls,the expression levels of α7 nAChR mRNA and protein in such cells were decreased by the inhibitory efficiency with 95% and 80%,respectively. The protein levels of CaM and CaMK Ⅱ were decreased by 48.5% and 35% respectively. Conclusion The results indicated that the inhibited gene expression of α7 nAChR could decrease the level of CaM,CaMK Ⅱ,which may affect the signal transduction pathway,suggesting that α7 nAChR may play a crucial neuroprotective role in Alzheimer disease’s pathogenesis.
RNA interference; α7 nAChR; CaM; CaMKⅡ; SH-SY5Y Cell
1003-2754(2016)03-0207-04
2015-11-10;
2016- 01-20
国家自然科学基金资助项目(81360178),教育部“长江学者和创新团队发展计划资助”(IRT13058),贵州省科技厅重大专项(黔科合重大专项字2014[6008]),贵州省科技厅项目(201344,黔科合SY字[2013]3020)
(1.贵州医科大学分子生物学重点实验室,贵州 贵阳 550004;2.贵州医科大学病理学教研室,贵州 贵阳 550004)
齐晓岚,E-mail:xiaolan76@163.com
Q51;R749.1*6
A

