帕金森病患者经颅脑实质超声所见与临床评价
乔亚男, 薛 爽, 顾卫红, 金 淼, 王 康, 魏 坤
帕金森病患者经颅脑实质超声所见与临床评价
乔亚男, 薛 爽, 顾卫红, 金 淼, 王 康, 魏 坤
目的 探讨经颅脑实质超声中发现的中脑黑质高回声与帕金森病(PD)的关系。方法 连续入选2010~2013年中日友好医院门诊和住院诊断的123例PD患者及78例健康对照者,行经颅脑实质超声检查,测量黑质区域强度Ⅲ级的信号面积、第三脑室宽度及基底节区有无异常信号。并对123例PD患者进行统一帕金森病评定量表(UPDRS)评分、Hoehn & Yahr分级。最后分析黑质高回声面积与UPDRS评分、Hoehn & Yahr分级的相关性。结果 最后入组89例PD患者及60例健康对照者。89例PD患者中,81例患者黑质高回声面积≥0.2 cm2;60例健康志愿者中,5例黑质高回声面积≥0.2 cm2。PD患者组的黑质高回声面积与健康对照组有明显差异。Pearson相关性分析发现黑质高回声面积的大小与患者发病年龄及病程长短无关系;较大侧黑质高回声与UPDRS评分的总分、第Ⅲ部分及Hoehn & Yahr分级有明显相关性。黑质高回声面积在临床症状(UPDRS Ⅲ)较重的对侧较大。结论 我国PD患者中脑黑质高回声是PD的一个特征性标记,其面积大小与PD患者运动症状的严重程度呈正相关,临床上可将经颅脑实质超声作为PD患者诊断的工具之一。
PD; 经颅脑实质超声; 黑质
自从在帕金森氏病(PD)患者的中脑黑质发现异常扩大的高回声区域后,经颅脑实质超声(TCS)就逐渐成为了一个诊断PD比较可靠的工具。经研究,约90%的PD患者[1~5]及9%的健康正常人群[6]中可发现黑质回声异常增高,而CT或MRI却不能显示相应的结构变化,因此,黑质(SN)高回声是诊断PD的一个特征性标记,尤其是在疾病的早期。然而,SN高回声究竟仅仅是PD患者的一个特征性的标记,还是与疾病的严重程度相关目前还存在争议[3,4]。而且,关于PD患者的SN高回声研究大多集中在欧洲、美洲和亚洲的韩国、台湾、日本等地[7~9]。对中国人群的TCS研究较少[10]。本研究旨在对我国PD患者的中脑黑质进行TCS检查,明确经颅脑实质超声对国人PD诊断的特异性,并探索SN高回声与PD其他特征的关系,尤其是SN高回声面积及PD严重程度之间的关系。
1 资料与方法
1.1 一般资料及统一帕金森病评定量表(UPDRS)评分、Hoehn & Yahr分级 连续入选2010~2013年中日友好医院门诊和住院所诊断的123例PD患者,以上患者的诊断均由神经内科医生根据英国帕金森病协会脑库临床诊断标准提出的帕金森病诊断标准作出诊断。并对诊断为PD的患者进行UPDRS评分及Hoehn & Yahr分级,上述评分均在患者停用帕金森治疗药物12 h之后进行。所有入组患者排除有脑血管病、中毒、颅脑外伤史者。同时招募78例性别、年龄相匹配的从未诊断过PD或其他类型运动障碍类疾病的健康志愿者进行TCS检查。
1.2 经颅脑实质超声 使用LOGIQ9(USA)彩色多普勒超声诊断仪,低频相控阵1~3 MHz 3S探头,探测深度14~16 cm,动态范围57~60 dB。由1名超声检查者进行TCS检查,患者仰卧位,经耳前颞窗轴位扫描,在轴位上可发现被高回声信号的基底池所包围的低或无回声信号的蝴蝶状的中脑结构(见图1a)。从轴位的中脑平面开始,将探头向上旋转10~20°可见高回声的松果体钙化(第三脑室层面一个重要的标志)、及第三脑室、侧脑室前角、丘脑、壳核、尾状核等。双侧均无颞窗者排除入组,有单侧或双侧颞窗者将检查图像保存。由另外一名有超声检查资质的神经内科大夫进行测量并分析:(1)测量第三脑室宽度(见图1b)。(2)检查基底节区(如豆状核、尾状核)有无异常信号(见图1c)。(3)检查中脑黑质:对黑质区域强度≥Ⅲ级的信号测量面积[11],面积≥0.20 cm2视为SN高回声,面积位于0.20~0.25 cm2者为中度SN高回声,面积≥0.25 cm2视为异常SN高回声[2,4](见图1d、图1e)。
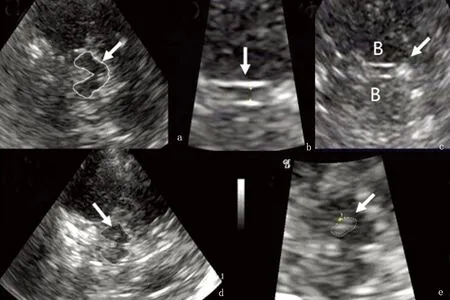
图1 a:经左侧耳前颞窗轴位扫描轴位上可发现被高回声信号的基底池所包围的低或无回声信号的蝴蝶状的中脑结构(白线勾勒所示);b:量第3脑室宽度,宽度为0.30 cm;c:观察第3脑室两旁的基底节是否有异常高回声信号,图中所示基底节无异常高回声信号;d:发现右侧中脑黑质部分异常高回声信号,信号强度≥Ⅲ级。e:为d图放大5倍后进行SN高回声面积的测量,面积为0.25cm2
1.3 统计学分析 用SPSS 18的统计学软件,应用t检验分析PD组和对照组是否有差异,应用Pearson 相关性分析,分析中脑高回声面积大小与患者年龄、UPDRS评分的总分、UPDRS评分第Ⅲ部分及Hoehn&Yahr分级的相关性。依据既往的相关研究[2,4,12,13],我们以SN回声面积≥0.2 cm2作为SN高回声。
2 结 果
2.1 临床资料和SN高回声面积 见表1。由于25例PD患者和15例健康对照者双侧颞窗均透声不良及9例PD患者和3例健康对照者的SN高回声级别小于III级,我们最终入组89例PD患者及60例健康对照者。PD组和对照组的平均年龄为61.1±17.2岁和60.3±16.8岁,两组年龄无显著性差异,P值=0.587。PD组的平均发病年龄和病程为57.2±14.9岁和9.21±6.34 y。其中有4例患者为早发型PD,发病年龄≤45岁。
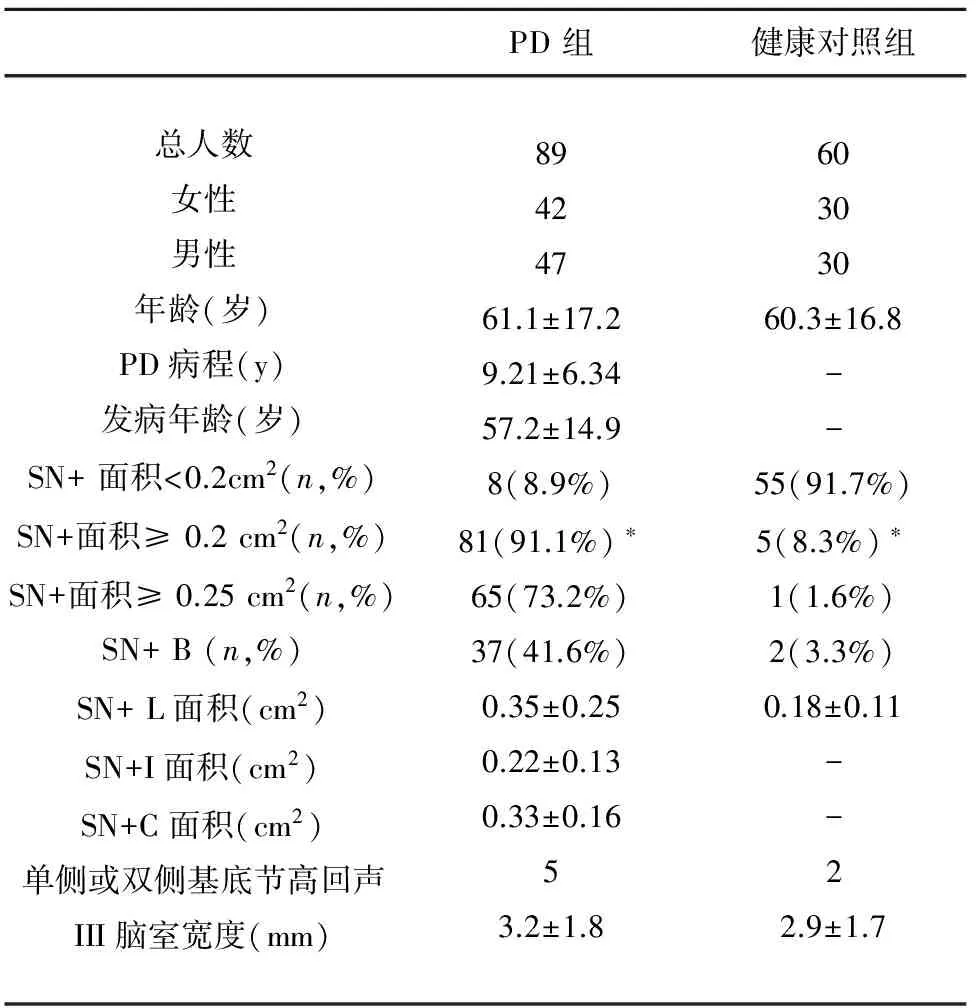
表1 临床特征和SN高回声面积的相关数据
PD:帕金森病;SN+ :SN高回声;SN+ B:双侧SN高回声的患者;SN+ L:较大侧SN高回声面积;SN+I:症状较重肢体同侧的SN高回声面积;SN+C:症状较重肢体对侧的SN高回声面积;*:PD组SN高回声与对照组有明显差异,P=0.025
在本研究中,我们发现8例患者的SN高回声面积<0.2 cm2(8.9%),81例患者SN高回声面积≥0.2 cm2(91.1%),65例患者的SN高回声面积≥0.25 cm2(73.2%)为SN异常高回声,16例患者的SN高回声面积位于0.2~0.25 cm2(17.9%);双侧SN高回声者37例(41.6%),单侧SN高回声者44例(49.5%);89例患者其较大侧SN高回声面积平均为0.35±0.25 cm2,症状较重侧肢体的同侧SN高回声面积平均为 0.22±0.13 cm2,对侧SN高回声面积平均为 0.33±0.16 cm2。60例对照组中,其中5例SN高回声面积≥0.2cm2(8.3%),1例其SN高回声面积>0.25 cm2(1.6%)。双侧SN高回声者2例,单侧SN高回声者3例。较大侧SN高回声面积平均为0.18±0.11 cm2。经t检验分析,以SN回声面积PD≥0.2 cm2为高回声标准,PD组SN高回声面积与健康对照组有明显差异,P=0.025。
此外,PD组患者中有5例发现有单侧或双侧基底节高回声,对照组中有2例,两者无显著性差异,P=0.776。PD组患者III脑室宽度为 3.2±1.8 mm,对照组为 2.9±1.7 mm,两者之间无显著性差异,P值=0.128。
2.2 临床评价(UPDRS和Hoehn & Yahr分级)和PD组SN高回声 89例患者的UPDRS评分的总分平均为 61±49分,UPDRS评分的Ⅰ部分平均为7±5分,Ⅱ部分平均为18±9,Ⅲ部分平均为40±27。Hoehn & Yahr分级:1级有30例,2级有44例,3级有9例,4级有6例(见表2)。
经Pearson相关性分析发现SN高回声的大小与患者的发病年龄和病程长短无关系(P=0.528和0.135);较大侧SN高回声与UPDRS评分的总分、UPDRS评分第Ⅲ部分及Hoehn&Yahr分级有明显相关性(P=0.012、P=0.005、P=0.009)。SN高回声在临床症状(UPDRSⅢ)较重的对侧较大,而在临床症状较重的同侧较小(P=0.001)(见表3)。

表2 PD组患者UPDRS评分及Hoehn & Yahr分级
PD:帕金森病;UPDRSt:UPDRS总分;UPDRSⅠ、Ⅱ、Ⅲ:UPDRS的第Ⅰ、Ⅱ、Ⅲ部分评分;H-Y:Hoehn & Yahr分级
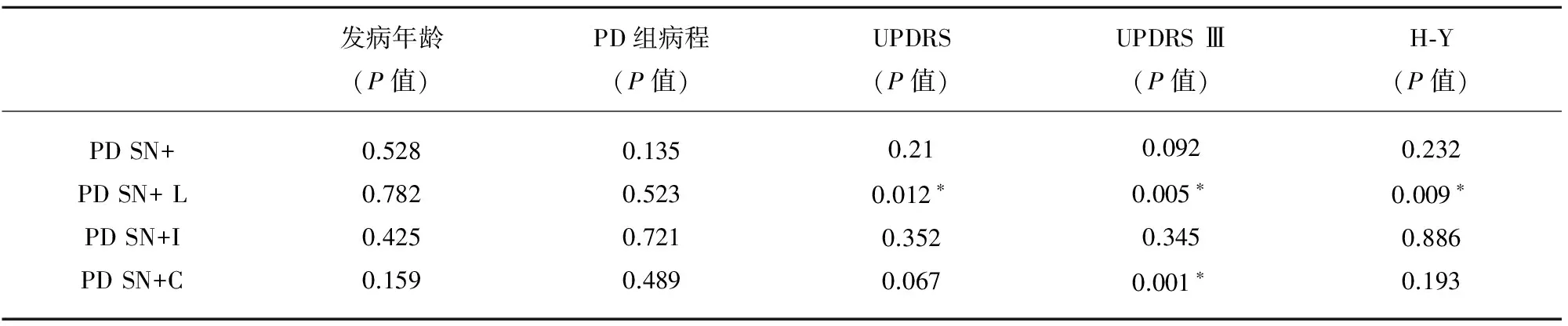
表3 SN高回声面积和PD临床评价之间的Pearson相关分析数据
PD:帕金森病;SN+ :SN高回声;SN+ B:双侧SN高回声的患者;SN+ L:较大侧SN高回声;SN+I: 症状同侧的SN高回声;SN+C:症状对侧的SN高回声;*:两组之间有明显差异
3 讨 论
1995 年,Becker 等[1]首先描述了PD患者TCS上的SN高回声表现。随着超声及影像学技术的不断进展,越来越多的研究证实SN高回声可作为诊断PD的一项重要工具。2013年欧洲神经科学联盟及运动障碍疾病协会(EFNS-MDS)推荐TCS为鉴别原发性PD和PD综合征、早期诊断PD及筛查PD高危患者的A级证据[14]。Luo等在中国人群中发现SN高回声面积≥0.20 cm2和S/M比值(黑质面积/中脑面积)≥0.07可以作为诊断PD的两个特异性很高的参数[10]. 本研究中89例PD患者中有91.1%发现SN回声面积≥0.20 cm2,60例健康对照组中8.3%的SN回声面积≥0.2cm2,与既往的研究结果一致,即81%~100%的PD患者和<9%健康人群可发现SN高回声[1~6,10]。以SN回声面积≥0.2 cm2为SN高回声标准时,PD患者组的SN高回声面积与健康对照组有明显差异(P=0.025)。因此,本研究也可进一步确认SN高回声在我国的PD患者中同样是一个特征性的标记。
UPDRS评分,尤其是第Ⅲ部分运动检查的评判主要取决于临床医生的查体,客观可靠性较高,因此被认为是判定PD患者症状轻重的一个可靠量表。本研究将PD患者的SN高回声面积与UPDRS-III评分作Pearson相关性分析,发现SN高回声面积较大的一侧与UPDRS~Ⅲ评分成正相关关系,P=0.005,即SN高回声面积越大,UPDRS-Ⅲ评分越高,表明SN高回声的面积大小与PD患者症状严重程度呈正相关。但是SN高回声面积是否会随着PD患者症状的逐渐加重而增大还有待于进一步随访检查。既往的多个5~10 y的随访研究[15,16]发现,随着PD患者病情的进展UPDRS-Ⅲ评分进行性增高,但SN高回声的面积大小保持不变。这个发现否定了之前有研究[17]认为的TCS上扩大的SN高回声是黑质结构区域细胞进行性凋亡或毒性物质持续蓄积所致,而支持重金属在黑质部分的蓄积仅仅是导致PD患者SN高回声的部分原因。需要进一步的研究来发现SN高回声的分子及神经生化机制。但上述研究结果仍存在争议,有部分PET研究[18,19]及TCS研究[7]认为SN高回声面积与PD患者病情的进展或病程长短是呈正相关的:(1)认为SN高回声面积的大小与突触前纹状体多巴胺能再摄取运载体活性的下降呈负相关;(2)发现16例PD患者的FU-18标记的PET上的缓慢进展同时伴随着SN高回声面积的扩大;(3)发现43例PD患者的病程越长,TCS上SN高回声面积越大。鉴于多项研究存在以上争议,且本组研究也得出了与之前研究相反地结论。因此,目前认为利用TCS还不能完全判定SN高回声面积的进展是否与PD患者运动迟缓症状加重的临床过程相符合,应进一步完善随访工作、扩大样本量及与其他研究手段相结合。
台湾地区的一项研究[8]认为通过TCS测量SN高回声的面积大小可以区分早发型PD和晚发型PD,他们认为晚发型PD较早发型PD更易出现SN高回声的扩大,且S/M比值更易>0.07,考虑原因为早发型PD的黑质细胞变性与铁离子沉积关系不大。但本研究未发现患者发病年龄与SN高回声面积大小的相关性(P=0.528),考虑可能早发型PD病例数较少有关,应进一步收集早发型PD病例数。
本研究也发现SN高回声面积在临床症状较重(UPDRS-Ⅲ评分较高)的对侧较大,而在临床症状较重的同侧较小,P=0.001。这与既往的研究一致[12,20],进一步表明黑质细胞的变性导致对侧肢体的运动迟缓。
综上所述,中国PD患者中脑SN高回声同样是PD的一个特征性标记,;SN高回声的面积大小与PD患者运动症状的严重程度呈正相关,但是否会随着病情的进一步加重而变化还有待以后的随访研究;此外,在临床症状较重的对侧中脑其SN高回声面积明显扩大。临床上可将用经颅脑实质超声测量SN高回声面积作为诊断帕金森病的工具之一。
本研究还存在如下不足:(1)尚未完成患者的随访。(2)需要进一步扩大样本量。(3)还需要与帕金森综合征、帕金森叠加及其他运动障碍疾病做对照研究。
[1]Becker G,Seufert J,Bogdahn U,et al. Degeneration of substantia nigra in chronic Parkinson’s disease visualized by transcranial color-coded real-time sonography[J]. Neurology,1995,45:182-184.
[2]Walter U,Wittstock M,Benecke R,et al. Substantia nigra echogenicity is normal in non-extrapyramidal cerebral disorders but increased in Parkinson’s disease[J]. J Neural Transm,2002,109:191-196.
[3]Berg D,Behnke S,Seppi K,et al. Enlarged hyperechogenic substantia nigra as a risk marker for Parkinson’s disease[J]. Mov Disord,2013,28:216-219.
[4]Walter U,Behnke S,Eyding J,et al. Transcranial brain parenchyma sonography in movement disorders:state of the art[J]. Ultrasound Med Biol,2007,33:15-25.
[5]Walter U,Skoloudik D. Transcranial sonography(TCS) of brain parenchyma in movement disorders:quality standards,diagnostic applications and novel technologies[J]. Ultraschall Med,2014,35:322-331.
[6]Berg D,Becker G,Zeiler B,et al. Vulnerability of the nigrostriatal system as detected by transcranial ultrasound[J]. Neurology,2001,53:1026-1031.
[7]Kim JY,Kim ST,Jeon SH,et al. Midbrain transcranial sonography in Korean Patients with Parkinson’s Disease[J]. Mov Disord,2007,22:1922-1926.
[8]Huang YW,Jeng JS,Tsai CF,et al. Transcranial imaging of substanitia nigra hyperechogenicity in a Taiwanese cohort of Parkinson’s disease[J]. Mov Disord,2007,22:550-555.
[9]Okawa M,Miwa H,Kajimoto Y,et al. Transcranial sonography of the substantia nigrain Japanese patients with Parkinson’s disease or atypical parkinsonism:clinical potential and limitations[J]. Intern Med,2007,46:1527-1531.
[10]Luo WF,Zhang YC,Sheng YJ,et al. Transcranial sonography on Parkinson’s disease and essential tremor in a Chinese population[J]. Neurol Sci,2012,33:1005-1009.
[11]Skoloudik D,Fandrna T,Bartova P,et al. Reproducibility of sonographic measurement of the substantia nigra[J]. Ultrasound Med Biol,2007,33:1347-1352.
[12]Berg D,Siefker C,Becker G. Echogenicity of the substantia nigra in Parkinson’s disease and its relation to clinical findings[J]. J Neurol,2001,248:684-689.
[13]Walter U,Niehaus L,Probst T,et al. Brain parenchyma sonography discriminates Parkinson’s disease and atypical parkinsonian syndromes[J]. Neurology,2003,60:74-77.
[14]Berardelli A,Wenning GK,Antonini A,et al. EFNS/MDS-ES/ENS[corrected] recommendations for the diagnosis of Parkinson’s disease[J]. Eur J Neurol,2013,20:16-34.
[15]Berg D,Merz B,Rerners K,et al. Five-year follow-up study of hyperechogenicity of the substantia nigra in Parkinson’s disease[J]. Mov Disord,2005,20:383-385.
[16]Behnke S,Runkel A,Kassar HA,et al. Long-term course of substania nigra hyperechogenicity in Parkinson’s disease[J]. Mov Disord,2013,28:455-459.
[17]Niehaus L,Boelmans K. Diagnosis of Parkinson’s disease-transcranial sonography in relation to MRI[J]. Int Rev Neurobiol,2010,90:63-79.
[18]Weise D,Lorenz R,Schliesser M,et al. Substantia nigra echogenicity:a structural correlate of functional impairment of the dopaminergic striatal projection in Parkinson’s disease[J]. Mov Disord,2009,24:1669-1675.
[19]Schweitzer KJ,Hilker R,Walter U,et al. SN+ as a marker of predisposition and slower progression in Parkinson’s disease[J]. Mov Disord,2006,21:94-98.
[20]Walter U,Dressler D,Wolters A,et al. Transcranial brain sonography findings in clinical subgroups of idiopathic Parkinson’s disease[J]. Mov Disord,2007,22:48-54.
Findings and clinical evaluation in patients of Parkinson’s disease by Transcranial sonography
QIAO Yanan,XUE Shuang,Gu Weihong,et al.
(Department of Neurology,China-Japan Friendship Hospital,Beijing,100029,China)
Objective To investigate the correlation between SN+ and Parkinson’s disease by transcranial sonography. Method All 123 patients with Parkinson’s disease who were admitted to Departement of Neurology,China-Japan Friendship Hospital,Beijing,during 2010-2013 and 78 normal controls were studied. All of them were given transcranial sonography test,the assessment of Unified Parkinson’s Disease Rating Scale(UPDRS) and Hoehn & Yahr grading. Results Finally,89 PD patients and 60 healthy controls were included in the study. In all 89 PD patients,81 cases were found the sizes of substantia nigra hyperechogenicity ≥0.2cm2,while 5 cases were found ≥0.2 cm2in all 60 normal controls. The size of substantia nigra hyperechogenicity had significant difference between PD patients and normal controls. By Pearson correlation analysis,we found the size of substantia nigra hyperechogenicity had no correlation with the onset age and the duration of PD,but the size of hyperechogenicity on the larger side had visible correlations with the total score of UPDRS,the score of Part Ⅲ of UPDRS and Hoehn & Yahr grading. The size of hyperechogenicity was much bigger in the contralateral side in which side patients had much higher scores of part III of UPDRS. Conclusions Substantia Nigra hyperechogenicity is also an important mark of PD patients in China,whose size was related with the severity of clinical symptoms of PD patients. We can use transcranial sonography as a tool to help making the diagnosis of PD in clinical work.
Parkinson’s disease; Transcranial sonography; Substantia Nigra
1003-2754(2016)03-0226-04
2015-11-20;
2015-12-13
首都医学发展科研基金资助课题(No. 2009-3020)
(中日友好医院神经内科,北京 100029)
薛 爽,E-mail:xueshuang8420@126.com
R742.5
A

