CRMP2衍生的ST2-104多肽对阿尔茨海默病大鼠皮质神经元的保护作用
孟盼盼, 张雨晴, 高媛媛, 孙 莉, 李 琦
CRMP2衍生的ST2-104多肽对阿尔茨海默病大鼠皮质神经元的保护作用
孟盼盼1, 张雨晴1, 高媛媛1, 孙 莉2, 李 琦1
目的 研究ST2-104肽对阿尔茨海默病(AD)大鼠脑皮质内NMDAR1、NMDAR2B、CRMP2、P-CRMP2的表达影响,进而改善大鼠的认知功能,对神经元发挥保护作用。方法 采用单次单侧脑室微量注射Aβ25-35片段制备AD大鼠模型,具有相同遗传背景的Wistar大鼠作为假手术对照组,分别给予不同剂量的ST2-104多肽和盐酸美金刚治疗。Aβ注射2 d后给药10 d,HE染色法观察脑皮质部分形态变化,甲醇刚果红染色法观察淀粉样物质沉积情况,WB及免疫组化法检测大鼠脑皮质组织NMDAR1、NMDAR2B、CRMP2、P-CRMP2的表达。结果 与假手术组相比,模型组淀粉样物质沉积明显增多,脑皮质部分NMDAR2B表达显著增多(P<0.01),NMDAR1表达相对减少,P-CRMP2与CRMP2表达量均无明显差异;ST2-104多肽可以逆转上述现象,降低NMDAR2B表达(与模型组相比,高剂量组P<0.05),增加NMDAR1表达(与模型组相比,高、低剂量均为P<0.05)。结论 (1)ST2-104可能通过减少NMDAR2B表达降低其活性来发挥对AD大鼠皮质神经元的保护作用。
阿尔茨海默病; ST2-104; Aβ25-35; NMDAR; CRMP2
阿尔茨海默病(AD)是一种与年龄相关的起病隐匿的渐进性神经退行性疾病,早期神经损伤症状是学习和记忆空间认知能力的缺陷[1]。其主要病理学改变是中枢大脑皮质神经元及其突触减少,Aβ淀粉样蛋白沉积和神经原纤维缠结形成[2]。目前的治疗仍不能有效改善和阻滞AD疾病进展,其发病机制尚不明确。ST2-104多肽是带有穿膜结构的脑衰蛋白反应调节蛋白2(CRMP2)衍生肽,可通过血脑屏障到达脑组织拮抗CRMP2与相关蛋白结合而发挥作用,在脑创伤及脑缺血相关疾病中发挥积极保护作用[3,4]。本实验探讨ST2-104对Aβ25-35肽致AD大鼠神经元的保护作用机制。
1 材料和方法
1.1 实验动物 SPF级雄性Wistar大鼠50只,体重180~250 g,吉林大学实验动物中心提供。
1.2 试剂与仪器 ST2-104纯度98%,由耀强生物科技有限公司合成;Aβ25-35(A4559-1MG)购于SIGMA;盐酸美金刚购于丹麦灵北药厂;NMDAR1(ab52177)、NMDAR2B(ab28373)、CRMP2(ab129082)、P-CRMP2(Ser522)(ab193226)抗体购于abcam;辣根过氧化物酶标记的羊抗兔二抗IgG(111-035-003)购于Jackson ImmunoResearch;甲醇刚果红染色试剂盒购于南京森贝咖生物科技有限公司,大鼠脑立体定位仪购于深圳瑞沃德生命科技有限公司;显微镜为蔡司1×71。
1.3 实验分组 50只大鼠适应性喂养1 w后,随机分为假手术组、AD模型组、ST2-104高剂量组、ST2-104低剂量组、盐酸美金刚阳性对照组,每组10只。
1.4 动物模型制备及给药 采用单次单侧脑室微量注射Aβ25-35肽法制备阿尔茨海默病大鼠模型。大鼠术前12 h禁食不禁水。腹腔注射10%水合氯醛麻醉大鼠,俯卧位固定于大鼠脑立体定位仪上,头局部去毛,消毒,正中矢状位切口,剥离骨膜及周边结蹄组织,定位使前囟点、后囟点、人中缝处在同一水平线上,根据《大鼠脑立体定位图谱》定位,以前囟点为原点,旁开1.8 mm,后开1.08 mm,牙科钻颅骨钻孔,深3.8mm处注射Aβ25-35老化液8 μl(16 μg),20 min注完,留针10 min,出针5 min,消毒,缝合切口。假手术组注射等体积的生理盐水。
造模术后2~12 d ST2-104高剂量组(15 mg/kg·d)、ST2-104低剂量组(3 mg/kg·d)大鼠尾静脉给药,盐酸美金刚阳性对照组(3 mg/kg·d)灌胃给药,模型组与假手术组分别给予等体积的生理盐水。每2 d称量大鼠体重调整给药。
1.5 脑组织病理学及分子生物学检测
1.5.1 取材 给药结束后,禁食不禁水12 h处死实验大鼠。10%水合氯醛麻醉,迅速暴露胸腔,自心尖插入灌流针至主动脉,剪除右心耳,灌注生理盐水至肺部和肝脏发白,留出液体澄清,4%多聚甲醛灌注至大鼠躯体僵硬。断头取脑,固定于4%多聚甲醛溶液24 h以上,石蜡包埋切片。冠状位连续切片,每片约4 μm。麻醉后的大鼠迅速处死断头取脑,剥离海马、皮质,锡纸包裹冻存于液氮中。
1.5.2 HE染色 石蜡切片常规脱蜡:二甲苯(Ⅰ)、二甲苯(Ⅱ)各15 min,100%乙醇(Ⅰ)、100%乙醇(Ⅱ)、95%乙醇各10min,90%乙醇、80%乙醇、70%乙醇各5min,蒸馏水2 min。苏木精染色10 min,自来水反蓝10 min,伊红10 s,上行脱水,中性树胶封片,镜下观察。
1.5.3 甲醇刚果红染色 石蜡切片常规脱蜡,入改良Highman染色液浸染10 min,弃余液;Highman分化夜分化2~5 s,立即入水终止分化,水洗2次;自来水冲洗5 min;入苏木精1~2 min,自来水洗10 min;上行脱水,二甲苯透明,中性树胶封片,镜下观察。
1.5.4 免疫组织化学染色 石蜡切片常规脱蜡。PBS洗3次,5 min/次;室温,3%过氧化氢灭活内源性过氧化物酶10 min,PBS洗3次,5 min/次;1%胰酶修复抗原,湿盒37 ℃孵育25~30 min,PBS洗3次,5 min/次;5%牛血清白蛋白封闭非特异性抗体,湿盒37 ℃孵育25 min;滴加PBS稀释的一抗,分别为NMDAR2B(1∶500)、P-CRMP2(1∶200),4 ℃过夜;回收一抗,PBS洗3次,5 min/次;滴加对应二抗(1∶1000),湿盒37 ℃孵育45 min,PBS洗3次,5 min/次;DAB避光显色10~30 min,蒸馏水终止显色并冲洗;苏木精复染数秒,上行脱水,二甲苯透明,中性树胶封片,镜下观察。PBS代替一抗为对照组,其余均相同。
1.5.5 Western Blot 匀浆皮质部分,RIPA裂解液裂解组织提取蛋白,BCA试剂盒蛋白定量,各组处理后蛋白加入Loading buffer,100 ℃煮沸10 min。配胶,WB上样、电泳、转膜、封闭、孵一抗(NMDAR1 1∶1000,CRMP2 1∶10000)、孵二抗(1∶1000)、ECL显影。
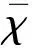
2 结 果
2.1 ST2-104肽对AD大鼠脑皮质区神经元的影响 与假手术组相比,模型组皮质锥体细胞出现坏死脱落,细胞结构不清晰,核固缩碎裂现象。ST2-104肽给药组及盐酸美金刚组大鼠皮质区细胞形态、核染色等与模型组相比均有明显改善(见图1)。
2.2 ST2-104肽对AD大鼠皮质区淀粉样物质的影响 甲醇刚果红染色法可以特异性的将淀粉样物质染成深橘红色。与假手术组相比,模型组大鼠皮质区橘红色明显增多且颜色比较深,而ST2-104肽给药组及盐酸美金刚组较模型组均有明显改善且3组间无明显差别(见图2)。
2.3 免疫组化结果
2.3.1 ST2-104肽对AD大鼠脑皮质区NMDAR2B表达的影响 结果显示,与假手术组相比,模型组NMDAR2B表达明显增加(P<0.01),ST2-104高低剂量组表达NMDAR2B量也明显增加(分别为P<0.05,P<0.01)。与模型组相比,低剂量组没有改善NMDAR2B的表达,ST2-104高剂量组NMDAR2B表达量明显下降(P<0.05),阳性组表达也存在明显差异(P<0.01),高剂量组与阳性组间比较没有统计学意义(见图3,见表1)。
2.3.2 ST2-104肽对AD大鼠脑皮质区P-CRMP2表达的影响 结果显示,假手术组、模型组、高低剂量组和阳性对照组五组间P-CRMP2表达量均没有明显差异(见图4,见表1)。
2.4 Western Blot结果
2.4.1 ST2-104肽对AD大鼠脑皮质区NMDAR1表达的影响 结果显示,与假手术组相比,模型组NMDAR1的表达量有所下降,ST2-104肽给药组逆转上述结果,表达NMDAR1明显增加,并与模型组比较具有统计学意义(P<0.05)(见图5)。
2.4.2 ST2-104肽对AD大鼠脑皮质区CRMP2表达的影响 结果显示,假手术组、模型组、高低剂量组和阳性对照组五组间CRMP2表达量均没有明显差异(见图5)。

图1 ST2-104肽对AD大鼠皮质区病理形态的影响(HE染色 200×)

图2 ST2-104肽对AD大鼠皮质区淀粉样物质沉积的影响(甲醇刚果红染色 200×)

图3 ST2-104肽对AD大鼠脑皮质区NMDAR2B表达的影响

图4 ST2-104肽对AD大鼠脑皮质区P-CRMP2表达的影响

图5 ST2-104肽对AD大鼠皮质区NMDAR1、CRMP2表达的影响

组别剂量(mg/kg)nNMDAR2B(OD×10-6)P⁃CRMP2(OD×10-6)假手术组模型组ST2⁃104低剂量组ST2⁃104高剂量组盐酸美金刚阳性对照组00315310101010104.17±1.009.47±0.57##16.29±1.75##∗∗7.30±1.13#∗5.22±0.97∗∗7.07±2.027.21±1.236.66±3.088.00±1.826.41±0.78
与模型组相比*P<0.05,**P<0.01;与假手术组相比#P<0.05,##P<0.01
3 讨 论
阿尔茨海默病是一个与年龄有关的渐进性神经变性疾病。早期神经损伤症状是学习和记忆认知能力的缺陷,并逐渐进展[2]。以神经元死亡和突触联系减少,Aβ蛋白沉积和神经原纤维缠结为主要病理改变[5]。不同形式的Aβ多肽已经被广泛用于体内外研究,应用Aβ1-40,1-42或25-35多肽于体外培养的神经元或动物侧脑室注射都能模仿出AD模型,结果的可靠性得到公认[6]。Aβ沉积在脑神经元周围形成AD特有的老年斑,继而引起兴奋性突触传递的轴突和树突棘密度减少和突触可塑性降低,LTP(学习与记忆的物质基础)损害,神经元细胞死亡。本实验采用单次单侧脑室微量注射Aβ25-35多肽制备大鼠阿尔茨海默病模型。术后所有组别大鼠均出现精神不振、行动迟钝、食量减少等现象,随着时间延长,假手术组及给药组大鼠逐渐恢复,无1例死亡;模型组大鼠呆滞萎靡,食欲不振,出现伤亡。HE染色及甲醇刚果红染色结果表明,ST2-104对AD大鼠皮质区神经结构破坏具有保护作用,可减少淀粉样物质沉积。
谷氨酸几乎涉及所有的中枢神经系统功能,是一种快速性兴奋性神经递质;中枢神经系统中70%的兴奋性突触利用谷氨酸作为神经递质[1,7]。脑组织具有丰富的谷氨酸受体,特别是NMDAR受体,对学习和记忆功能和突触的可塑性极为重要,通过该受体本身、其共轭离子通道及调节部位形成的复合体而发挥功能,对Ca2+高度通透。文献报道,Aβ的沉积可直接作用于NMDAR,导致缓慢持续地NMDAR激活,Ca2+通过NMDAR内流进入突触后神经元,造成细胞内Ca2+过载,引起突触功能抑制和LTP异常,造成细胞慢性兴奋毒性[8,9]和突触毒性,最终导致细胞死亡,神经功能障碍[10,11]。本实验中发现,模型组大鼠脑组织中NMDAR2B表达量增加,ST2-104肽给药后可以逆转NMDAR2B的增加,高剂量组与模型组具有显著差异(P<0.05),可被激活的受体量减少,活性降低,从本质基础上降低Aβ对神经元的损害。ST2-104可能通过减少皮质区NMDAR2B的表达发挥对皮质神经元的保护作用。实验中还出现模型组大鼠皮质区NMDAR1表达量稍微减少,而给药组的表达明显抬高现象,相关情况报道并不多见,其相关机制需要进一步探索。
CRMP2即塌陷反应介导蛋白,在中枢神经系统特别是海马区广泛表达。对于神经的生长发育十分重要,具有促进神经元纤维生长,指导轴突延长,调节生长锥生长和微管的集装,细胞膜受体内质化等广泛的生物学调节作用[12]。研究显示磷酸化的CRMP2可与NMDAR2B结合,最终导致细胞死亡[13,14]。ST2-104肽为CRMP2的衍生肽,可通过血脑屏障,Tatiana等研究表明ST2-104促进CRMP2与NMDAR2B解离使CRMP2内质化降低NMDAR2B的活性而不改变其分布[15]。本实验结果证实AD脑皮质区CRMP2表达量各组间无明显变化,ST2-104作用机制可能与上述途径相似,有待进一步探究。ST2-104肽对AD大鼠皮质神经元具有保护作用,可能通过减少NMDAR2B表达,降低其活性来发挥作用的。
[1]卢 贞,万莉红,金少举,等. 复方丹参片对Aβ25-35所致老年痴呆小鼠的行为学改善作用及对RACK1的影响[J]. 中国药理与临床,2012,28(6):105-108.
[2]Hort J,Laczo J,Vyhnalek M,et al. Spatial navigation defecit in amnestic mild cognitive impairment[J]. PNAS,2007,104(10):4042-4047.
[3]Brittain JM,Pan R,You R,et al. Disruption of NMDAR-CRMP2 signalling protects against focal cerebral ischemic damage in the rat middle cerebral artery occlusion model[J]. Channels,2012,6(1):53-59.
[4]Brittain JM,Chen L,Wilson SM,et al. Neuroprotction against traumatic brain injury by a peptide derived from the collapsin response mediator protein2(CRMP2)[J]. The Journal of Biological Chemistry,2011,286(43):37778-37792.
[5]Dennis J. Selkoe . Azheimer’s disease is a synaptic failure[J]. Science,2002,298(25):789-791.
[6]李令文,陈明苍,季宇彬. 老年痴呆症模型研究进展[J]. 亚太传统医药,2014,10(5):43-45.
[7]Danysz W,Parsons C G. Alzheimer’s disease,β-amyloid,glutamate,NMDA receptors,and memantine-searching for the connections[J]. British J Pharmacology,2012,167:324-352.
[8]Wenk GL,Persons CG,Parsons P,et al. Potential role of N-methyl-D-aspartate receptor as executors of neurodegeneation resulting from diverse insults:focus on memantine[J]. Behavioural Pharmacology,2006,17:411-424.
[9]牟静静,孟 星,孟盼盼,等. 脑脉泰对慢性脑缺血大鼠认知功能的保护作用及其机制研究[J]. 中风与神经疾病杂志,2015,32(1):21-24.
[10]Butterfield DA,Pocernich CB. The glutamatergic system and Alzheimer’s disease:Therapeutic implication[J]. CNS Drug,2003,17:641-652.
[11]Berridge MJ. Calcium signalling and Alzheimer’s disease[J]. Neurochem Res,2011,36:1149-1156.
[12]Khanna R,Wilson SM,Brittain JM,et al. Opening Pandora’s jar:a primer on the putative roles of CRMP2 in a panoply of neurodegenerative,sensory and motor neuron,and central disorders[J]. Future Neurol,2012,7(6):749-771.
[13]Mileusnie R and Rose SPR. The memory enhancing effect of the APP-derived tripeptide Ac-rER is mediated through CRMP2[J]. Journal of Neurochemistry,2011,118:616-625.
[14]Cole AR,Noble W,van Aalten L,et al. Collapsin response mediator protein 2 hyperphosphorylation is an early event in alzheimer’s disease progression[J]. Journal of Neurochemistry,2007,103:1132-1144.
[15]Brustovetsky T,Pellman JJ,Yang XF,et al. Collapsin Response Mediator Protein2(CRMP2) Interacts with N-Methyl-D-aspartate(NMDA)Receptor and Na+/Ca+Exchanger and Regulates Their Functional Activity[J]. The Journal of Biological Chemistry,2014,289(11):7470-7482.
The protective effects of ST2-104 peptide derived from CRMP2 on cortical neurons in Alzheimer rats
MENG Panpan,ZHANG Yuqing,GAO Yuanyuan,et al.
(Department of Pharmacology,Basic Medical College of Jinlin University,Changchun 130021,China)
Objective To explore the effect of ST2-104 peptide on the expression of NMDAR1,NMDAR2B,CRMP2 and P-CRMP2 in pallium,to elucidate mechanism of ST2-104 on improving the cognitive function following Alzheimer rats. Methods Single single intracerebroventricular microinjection of Aβ25-35 was used to establish the model of Alzheimer and Wistar rats were used as the sham group. Then they were given different dose of ST2-104 or memantine. Administration for 10 days after 2 days injection. The change of pallium cells in cortex region was observed by HE staining. Amyloid deposition was observed by ameliorated Highman Congo red staining. Relative NMDAR1,NMDAR2B,CRMP2,P-CRMP2’s expression were performed by immunohistochemistry and western blot. Results TThere were more amyloid deposition,more NMDAR2B expression(P<0.01),less NMDAR1 expression in the model group compared with sham group,but there was no markedly differences between P-CRMP2 and CRMP2’s expression. ST2-104 peptide could reverse this phenomenon by decreasing the expression of NMDAR2B(high-dose group,P<0.05)and increasing the expression of NMDAR1 expression(low-dose group and high-dose group,P<0.05)compared with the model group. Conclusion ST2-104 peptide might protect neurons from A-beta toxicity by inhibiting the expression of NMDAR2B and decreasing its activity.
AD; ST2-104; Aβ25-35; NMDAR; CRMP2
1003-2754(2016)03-0203-04
2016-01-05;
2016-03-06
吉林省人才开发资金资助项目(No. 802150021426),国家自然科学基金(No. 81571231)
(1.吉林大学基础医学院,吉林 长春 130021;2.吉林大学白求恩第一医院神经内科,吉林 长春 130021)
李 琦,E-mail:youjun08@hotmail.com
R749.1+6
A

