外周血凝血指标与胃癌临床病理特征及化疗的相关性研究
贺爱军, 任 羽
(延安大学附属医院, 1. 普通外科; 2. 血液科, 陕西 延安, 716000)
外周血凝血指标与胃癌临床病理特征及化疗的相关性研究
贺爱军1, 任 羽2
(延安大学附属医院, 1. 普通外科; 2. 血液科, 陕西 延安, 716000)
目的 探讨外周血凝血指标与胃癌临床病理特征及化疗的相关性。方法 120例胃癌患者作为观察组,100例健康人作为对照组,对比2组患者凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、血浆纤维蛋白原(FIB)、血小板计数(PLT)、D-二聚体(D-D)等外周血凝血指标,并对比不同临床病理特征胃癌患者的外周血凝血指标。结果 2组APTT、PT比较无显著差异(P>0.05), 观察组TT显著低于对照组(P<0.05), FIB、D-D、PLT均显著高于对照组(P<0.01); 胃癌患者中,男性TT及PLT均显著低于女性(P<0.05), 年轻患者FIB、D-D显著低于年老患者(P<0.05), 肿瘤侵犯较浅者FIB及PLT显著低于侵犯较深者(P<0.01), 分期较低者PT、FIB、D-D、PLT显著低于分期较高者(P<0.01), 分化较低者TT显著低于分化较高者(P<0.05), PLT显著高于分化较高者(P<0.05), 无转移者D-D与PLT均显著低于有转移者(P<0.05); 化疗后胃癌患者FIB及PLT均显著降低(P<0.01)。结论 胃癌患者血液呈高凝状态,且女性、老年、肿瘤侵犯较深、分期较高、分化较低、存在转移的患者更为严重。
凝血指标; 胃癌; 化疗; 病理特征
随着人们生活水平的提高与生活环境的变化,肿瘤发生率越来越高,胃癌已成为中国消化道肿瘤中最重要的一种,死亡率位居恶性肿瘤的第3位,严重威胁患者的生命健康[1]。血液的高凝状态是引发新生肿瘤血管及加快肿瘤生长、促进肿瘤转移的重要原因,如凝血纤溶系统、血管内皮系统、血小板计数及血流动力学改变等[2]。罹患恶性肿瘤后,可破坏机体的凝血与抗凝纤溶系统平衡,同时机体的高凝状态在一定程度上可促进肿瘤的生长、浸润及转移,进入恶性循环,导致血栓的形成。此外肿瘤的治疗可影响患者的凝血状态,其中化疗作用最大,化疗药物可损伤肿瘤细胞、血管内皮,使凝血因子释放,促进血栓形成,同时可通过持续降低肿瘤负荷改善患者凝血状态[3-4]。本研究分析胃癌患者凝血指标与其临床病理特征的关系,并对比胃癌患者化疗前后凝血指标的变化,现报告如下。
1 资料与方法
1.1 一般资料
选择本院2013年2月—2015年12月收治的胃癌患者120例,男62例,女58例,年龄41~79岁,平均年龄(61.2±16.7)岁。所有患者均为初治患者,经手术或胃镜检测获得病理诊断确诊,临床分期明确,既往无手术、化疗、放疗治疗,可获得完整病历资料。排除合并其他肿瘤疾病、有出血性疾病或血栓性疾病、近2月内曾接受过影响凝血及止血药物患者、恶性肿瘤侵犯造血系统并出现造血功能障碍患者、合并心肝肾等重大脏器疾病患者、近2个月内有输血使患者、既往有脾切除患者、伴糖尿病患者。侵犯部位:侵犯黏膜64例,侵犯肌层56例;肿瘤发生部位:胃窦66例、胃体32例,胃底22例;临床分期: Ⅰ期35例, Ⅱ期22例, Ⅲ期19例, Ⅳ期44例;手术患者69例,未手术患者51例;分化程度:低分化65例,中分化32例,高分化23例;病理类型:黏液性42例,腺型30例,印戒型48例;发生转移组61例,无转移组59例。选择同期住院患者100例为对照组,男52例,女48例,年龄22~76岁,平均年龄(41.2±2.8)岁。主要住院原因为慢性胃炎、胃息肉、胃溃疡等。2组患者在年龄、性别、病情等方面比较,差异无统计学意义(P>0.05), 具有可比性。
1.2 研究方法
采集2组患者凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、血浆纤维蛋白原(FIB)、血小板计数(PLT)、D-二聚体(D-D), 并观察2组患者年龄、性别、肿瘤侵犯深度、部位、分化程度、临床分期、病理类型、转移情况。
患者抽清除空腹静脉血5 mL, 化疗患者化疗治疗后72 h重新采集1次,放置含枸橼酸钠浅蓝色真空采血管、Na2EDTA紫色真空采血管中。采用日本希森美康提供的血球分析仪XE-2100型、血凝生化分析仪CA-530型,并使用配套试剂。TT、PT、APTT采用生物活性法, D-D采用免疫比浊法, FIB采用PT-der法。参照标准: APTT: 23~40 s; TT: 11~17.8 s; PT: 10~15 s; FIB: 2.0~4.0 g/L; PLT: 100~300×109/L; D-D: 0~550 μg/L。
1.3 统计学方法
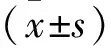
2 结 果
2.1 2组患者凝血指标比较
2组患者APTT、PT比较无显著差异(P>0.05), 观察组TT显著低于对照组(P<0.05), FIB、D-D、PLT均显著高于对照组(P<0.01)。见表1。
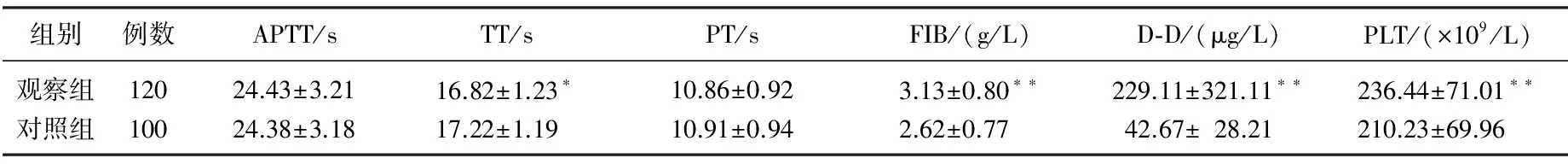
表1 2组患者凝血指标比较
与对照组比较, *P<0.05, **P<0.01。
2.2 胃癌患者临床病理特征与凝血指标的关系分析
① 性别:胃癌患者中,男性TT及PLT均显著低于女性(P<0.05)。② 年龄:年轻患者FIB、D-D显著低于年老患者(P<0.05)。③ 肿瘤侵犯深度:肿瘤侵犯黏膜者FIB及PLT均显著低于侵犯基层患者(P<0.01)。④ 肿瘤侵犯部位:本研究所观察凝血指标在不同肿瘤侵犯部位肿比较无显著差异(P>0.05)。⑤ 肿瘤分期:分期较低者PT、FIB、D-D、PLT显著高于分期较高者(P<0.01)。⑥ 肿瘤分化程度:分化较低者TT显著低于分化较高者(P<0.05),PLT显著高于分化较高者(P<0.05)。⑦ 病理类型:不同病理类型患者凝血指标无显著差异(P>0.05)。⑧ 转移情况:无转移者D-D与PLT均显著低于有转移者(P<0.05)。见表2。

表2 胃癌患者临床病理特征与凝血指标的关系分析
与同一指标另一亚项比较, *P<0.05, **P<0.01。
2.3 胃癌患者化疗前后凝血指标比较
化疗后胃癌患者FIB及PLT均显著降低(P<0.01), 而其他凝血指标无显著变化(P>0.05)。见表3。

表3 观察组化疗前后凝血指标比较
与化疗后比较, **P<0.01。
3 讨 论
恶性肿瘤与机体的凝血功能有密切的关系,肿瘤细胞可通过影响机体的凝血与抗凝系统使凝血状态发生异常[5]。机体正常情况下凝血与抗凝系统处于动态平衡状态,当发生恶性肿瘤时,肿瘤细胞可通过影响血液流变学影响血液的微环境,提高凝血活性,降低抗凝活性,使机体出现高凝血环境[6-7]。临床中胃癌患者发生凝血机制异常时较少见到血栓形成,多处于血栓形成前状态,因此胃癌患者凝血异常通常无法引起足够的重视[8-9]。胃癌导致凝血异常通常表现为肿瘤自身的侵袭性、肿瘤细胞释放癌促凝物质后启动凝血系统、肿瘤细胞释放表明组织因子结合凝血因子后启动内外源性凝血系统、肿瘤细胞产生的炎性因子通过降低凝血酶调节蛋白的表达提高凝血效率、肿瘤细胞表达纤溶酶原激活物抑制物可抑制抗凝与纤溶功能、肿瘤细胞可与内皮细胞、血小板、单核细胞等相互作用加速血管壁的损伤[10-11]。同时血液的高凝状态对肿瘤的生长与转移同样具有重要的影响,肿瘤细胞周围的纤维蛋白为肿瘤细胞提供了有利的生存繁殖环境,对血管有刺激生成作用,进而能够使肿瘤细胞逃避化疗药物的攻击或免疫反应,并附着于血管壁,利于新的转移瘤的生成[12]。
血液高凝状态与恶性肿瘤的发生发展、转移密切相关,肿瘤能够导致机体呈现高凝状态,而高凝状态本身将促进肿瘤的生长或转移。因此,探讨恶性肿瘤患者凝血指标将对肿瘤的诊断、治疗方案的制定以及治疗效果的辅助评估具有重要意义。为了探讨外周血凝血指标与胃癌患者临床病理特征之间的关系,作者选取了120例胃癌患者作为观察组,同时选取100例健康人作为对照组,分别对比2组患者的凝血指标,并针对不同年龄、性别、侵犯部位、侵犯深度、分期、分化程度、病理类型、是否存在转移等方面进行了对比分析,最后又将化疗前后患者的凝血指标进行了对比。结果显示,2组患者APTT、PT比较无显著差异(P>0.05), 观察组TT显著低于对照组(P<0.05), FIB、D-D、PLT均显著高于对照组(P<0.01)。也就是说,胃癌患者TT显著缩短,而FIB、D-D、PLT均显著增高,血液呈现高凝状态。在胃癌患者临床病理特征与凝血指标的关系分析中发现,男性TT及PLT均显著低于女性(P<0.05); 年轻患者FIB、D-D显著低于年老患者(P<0.05); 肿瘤侵犯较浅者FIB及PLT均显著低于侵犯较深者(P<0.01); 分期较低者PT、FIB、D-D、PLT均显著低于分期较高者(P<0.01); 分化较低者TT显著低于分化较高者(P<0.05), PLT显著高于分化较高者(P<0.05); 无转移者D-D与PLT均显著低于有转移者(P<0.05)。APTT为内源性凝血功能指标,PT能够反映外源性凝血系统的功能, TT则用于评价凝血与抗凝、纤维蛋白溶解功能, FIB能够较为客观地反映机体凝血功能, PLT可用于判定机体出血倾向与止血能力,而D-D则属于纤维蛋白降解物,是高凝状态及纤溶亢进的重要客观标志[13]。上述结果说明,胃癌患者中,女性、年龄≥60岁、肿瘤侵犯较深、分期较高、分化较低、存在转移的患者血液高凝状态更为严重。而高凝状态下,肿瘤细胞能够影响凝血与纤维蛋白溶解,进一步促进高凝,而高凝也反向影响肿瘤增殖与转移;纤维蛋白能够为肿瘤的生长繁殖提供良好环境,使之逃避化疗攻击,促使其转移。肿瘤表面的尿激酶杨纤溶酶原激活物能够增加纤维蛋白溶解酶活性,提高肿瘤侵袭能力,因此,高凝状态对患者极其不利。
化疗在杀伤肿瘤细胞时,能够降低肿瘤细胞对凝血系统的过度激活,同时也能够通过杀伤后肿瘤细胞释放的炎性因子、化疗药物直接刺激血管内皮、降低抗凝物质活性等多种途径导致高凝状态的加重。本研究中,化疗后胃癌患者FIB及PLT均显著降低(P<0.01)。FIB的减少是凝血系统被激活, FIB被水解所致。而研究中D-D并未增高,说明机体并未出现纤溶亢进。因此,作者认为化疗后纤溶功能受抑,血液高凝状态加重,这将增加血栓形成风险,但这一作用是相对较为短暂的,将随着化疗药物的停用而缓解[14]。虽然研究中化疗后PLT减少,但相关研究[15]发现,随着化疗的继续进行,PLT将逐渐增高,并恢复至化疗前,甚至更高。
[1] 刘玉辉, 齐馨慧, 刘兆喆, 等. 吉西他滨联合顺铂内科保守方法治疗老年晚期胃癌患者的效果[J]. 湖南师范大学学报: 医学版, 2015, 12(1): 78-80.
[2] 王静, 张侠. 恶性肿瘤患者高凝状态的危险因素、发生机制及实验室检测[J]. 检验医学与临床, 2015, 12(15): 2284-2287.
[3] Abdel Razeq H, Albadainah F, Hijjawi S, et al. Venous thromboembolism(VTE) in hospitalized cancer patients: prophylaxis failure or failure to prophylax[J]. Thromb Thrombolysis, 2011, 31(1): 107-112.
[4] 曲爱忠, 于秀丽, 付永兴. 高凝状态肿瘤患者抗凝联合化疗的临床观察[J]. 医学与哲学, 2013, 34(14): 54-56.
[5] 孙俊红, 李雷花. 肿瘤患者有核红细胞与贫血、凝血功能的相关性研究[J]. 河南预防医学杂志, 2015, 26(3): 177-178.
[6] 胡玲, 杨华, 苏雷, 等. 180例恶性肿瘤病人血液高凝状态的临床研究[J]. 医学研究与教育, 2010, 27: 30-32.
[7] Thorson C M, Van Haren R M. Persistence of Hypercoagulable States after resection of intra-abdominal malignancy[J]. Journal of the American College of Surgeons, 2013, 31(4): 580-589.
[8] Piatek C, Liebman HA. Treating venous thromboembolism in patients with cancer[J]. Expert Rev Hematol, 2012, 5(2): 201-209.
[9] 温志震, 米登海, 任维维, 等. 恶性肿瘤患者凝血功能与临床特征关系的研究[J]. 国际肿瘤学杂志, 2014, 41 (3): 238-240.
[10] 吴红杰, 邹小明. 胃癌与凝血功能的研究进展[J]. 国际外科学杂志, 2016, 43(1): 70-72.
[11] 王丽丽, 于超, 徐成伟. 胃癌患者血浆凝血酶激活的纤溶抑制物水平及临床意义[J]. 山东大学学报: 医学版, 2014, 52(2): 73-77.
[12] 李云鹏, 闫景全. 胃癌患者凝血指标的变化及临床意义[J]. 中国医学工程, 2011, 19(2): 99-101.
[13] 王自明, 张阳德, 何剪太. D-二聚体和C反应蛋白对急性肠系膜缺血患者诊断和预后评估的临床意义[J]. 湖南师范大学学报: 医学版, 2013, 10(3): 48-50.
[14] 潘静玲, 王小娟, 吴萍. 化疗对胃肠道肿瘤患者凝血功能的影响[J]. 中国综合临床, 2012, 28(12): 1245-1249.
[15] 喻晓洁, 胡小青, 张一清. 低分子肝素对卵巢肿瘤化疗诱导凝血功能活化的影响[J]. 中华肿瘤防治杂志, 2011, 18(2): 121-123.
Relationship between peripheral blood coagulation indexes and clinical pathological characteristics and chemotherapy in patients with gastric cancer
HE Aijun1, REN Yu2
(1.DepartmentofGeneralSurgery; 2.DepartmentofHematology,AffiliatedHospitalofYan′anUniversity,Yan′an,Shaanxi, 716000)
Objective To explore the relationship between peripheral blood coagulation indexes and clinical pathological characteristics and chemotherapy in patients with gastric cancer. Methods A total of 120 patients with gastric cancer were selected as observation group, and 100 healthy people were selected as control group. The TT, APTT, PT, FIB, PLT, D-D were compared between the two groups, and peripheral blood coagulation indexes were compared among gastric cancer patients with different clinical pathological characteristics. Results There were no significant differences in APTT, PT between the two groups (P>0.05). TT in the observation group was significantly lower and FIB, D-D, PLT were significantly higher than the control group (P<0.05). In the observation group, TT and PLT in the male patients were significantly lower than the female (P<0.05), FIB and D-D in the younger patients were significantly lower than the elderly patients (P<0.05), FIB and PLT in tumor invasion shallower patients were significantly lower than invasion deeper (P<0.01), PT, FIB, D-D, PLT in the lower stage were significantly lower than the higher stage (P<0.01). TT in lower differentiation was significantly lower, and PLT was higher than those with higher differentiation (P<0.05), D-D and PLT in patients without metastasis were significantly lower than patients with metastasis (P<0.05). FIB and PLT after the chemotherapy were significantly lower than those before treatment (P<0.05). Conclusion The blood of patients with gastric cancer is in a state of high coagulation, and the symptoms are more serious in patients with conditions of female, old age, tumor invasion, higher stage, lower differentiation and metastasis.
blood coagulation indexes ; gastric cancer ; chemotherapy; pathologic features
2016-10-11
陕西省延安市人民政府资助项目(2013-3-46-R3)
R 735.2
A
1672-2353(2016)23-061-04
10.7619/jcmp.201623018

