化学反应与能量考点聚焦
江苏省邗江中学(225009)
张新中 ●
化学反应与能量考点聚焦
江苏省邗江中学(225009)
张新中 ●
考点一 化学键与化学反应中的能量变化
考点解读 化学反应的本质是旧化学键的断裂和新化学键的形成,前者需要吸收能量,后者需要放出能量,两者的差即为反应中的能量变化.
例1 已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( ).
A.X的能量一定低于M的能量,Y的能量一定低于N的能量
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
解析 吸热反应中,反应物的总能量小于生成物的总能量,但不一定X的能量小于M或Y的能量小于N,故A错误、D正确;若从化合价角度分析,吸热反应中旧键断裂时吸收能量多,新键形成时放出能量小,故C错误;吸热反应不一定需要加热,B错误. 答案:D
点评 反应中的能量变化与是否需要条件无关,即放热反应可能需要条件,吸热反应可能不需要条件,故本题易错点是因概念不清而错选B.
练一练 1.下列对化学反应的认识错误的是( ).
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
考点二 吸热反应和放热反应
考点解读 常见放热反应有:①大多数化合反应,②所有的燃烧反应,③酸碱中和反应,④金属与酸的反应,⑤铝热反应.吸热反应有:①大多数分解反应,②晶体Ba(OH)2·8H2O与NH4Cl,③以H2、CO、C为还原剂的氧化还原反应.
2.下列变化中属于吸热反应的是____.
①液态水汽化; ②将胆矾加热变为白色粉末; ③苛性钠固体溶于水;④氯酸钾分解制氧气; ⑤生石灰跟水反应生成熟石灰; ⑥干冰升华.
解析 吸热过程或放热过程与吸热反应或放热反应不同:水汽化、苛性钠固体溶于水、干冰升华都是物理变化,不属于吸热反应;CuSO4·5H2O受热分解生成CuSO4和H2O,氯酸钾分解制氧气,都需要吸收热量,属于吸热反应;生石灰跟水反应是放热反应. 答案:②④
点评 判断时要注意物质的物理变化的热量变化不属于吸热反应和放热反应范畴.
练一练 2.把下列物质分别加入装有水的锥形瓶里,立即塞紧带U形管的塞子.已知U形管内预先装有少量水(为使水容易观察,预先染成红色),如图所示,结果U形管左边液面升高,则加入的物质可能是( ).

A.NaOH固体 B.浓H2SO4
C.NH4NO3晶体 D.Na2O2固体
考点三 原电池的工作原理
考点解读 原电池中,负极材料一般是活泼的金属,反应中负极失去电子,发生氧化反应;正极材料一般是不活泼的金属或导电的非金属,反应中正极得到电子,发生还原反应.
例3 将银片和铜片用导线相连后,一起浸入AgNO3溶液中,则下列说法正确的是( ).
A.铜片质量增大,银片质量减轻
B.形成原电池,铜为正极,银为负极
C.电子是自银片通过外电路导线流向铜片
D.铜极处发生氧还反应,银极表面发生还原反应
点评 解答此题要注意以下两点:①明确原电池的构成条件及判断正、负极的方法;②会书写简单的电极方程式.
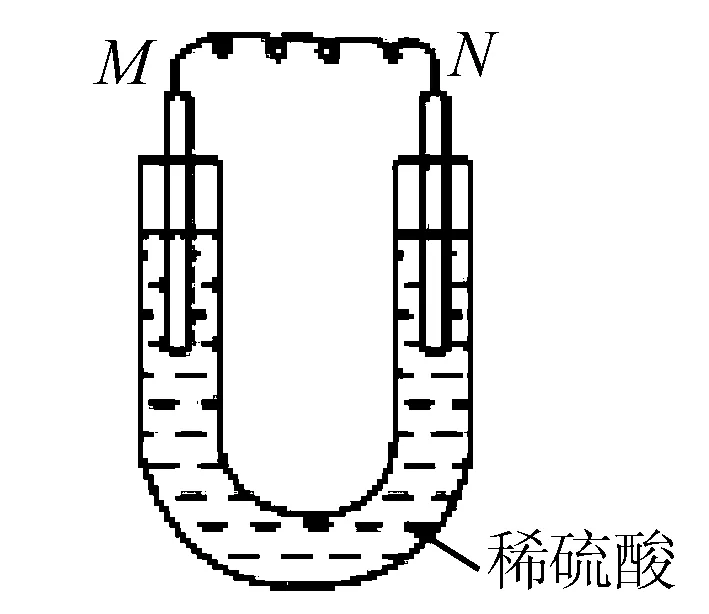
练一练 3.如图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( ) .
A.N上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
考点四 化学电源
考点解读 化学电源有一次电池、二次电池、燃料电池等,其实质是原电池原理的应用.


A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
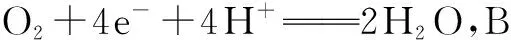
点评 化学电池主要考查电极的判断、电极反应式的书写、电子或电流的流向、离子的流向、溶液的酸碱性的判断等内容,这就要求我们牢固掌握原电池的有关知识.
练一练 4.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源.该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.关于该电池的下列说法不正确的是( ).
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
考点五 化学反应速率及其影响因素
考点解读 化学反应速率是用来衡量化学反应快慢的物理量,通常用单位时间内反应浓度的减少或生成物浓度的增加来表示.计算公式为:υ=Δc/Δt.其它条件不变时,升高温度,增大反应物浓度,增大固体表面积,使用催化剂都会使反应速率增大.
A.υ(O2)=0.001mol·L-1·s-1
B.υ(NO)=0.008mol·L-1·s-1
C.υ(H2O)=0.003mol·L-1·s-1
D.υ(NH3)=0.002 mol·L-1·s-1
解析 由题意得,υ(NO)= =0.002mol·L-1·s-1,再根据各物质表示的速率之比等于它们的化学计量数之比可知,υ(O2)= υ(NO)=0.0025mol·L-1·s-1,υ(H2O)= υ(NO)=0.003mol·L-1·s-1,υ(NH3)=υ(NO)=0.002mol·L-1·s-1.答案:C、D
点评 化学反应速率的计算一般用“三段式”法:①确定反应物或生成物的起始加入量;②确定反应过程中各物质的变化量;③确定反应终了时各物质的量;④计算反应速率. 要注意单位之间的换算及各物质的速率之比等于化学计量数之比.
练一练 5.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( ).
A.加热
B.不用稀硫酸,改用98%的浓硫酸
C.增大稀硫酸的用量
D.不用铁片,改用铁粉考点六 化学平衡状态的判断
考点六 化学平衡状态的判断
考点解读 一定条件下,当可逆反应进行到正反应速率与逆反应速率相等,各物质的浓度不再改变时,该反应即达到平衡状态.故化学反应达到平衡状态的判断方法有:①从反应速率判断:υ正=υ逆;②从混合气体中气体的体积分数或物质的量浓度不变判断.
A.C的生成速率 与C的分解速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1︰3︰2
解析 A、C为“等”和“定”的特征,可以说明反应已达平衡;B中方向一致,不是相反,不能说明反应已达平衡;D中不能确定各物质的百分含量是否一定,也不能说明反应已达平衡.答案:A、C
点评 判断化学反应是否达到平衡主要以“等”和“定”来判断,在应用时,要看反应前后这些量是否由“变化到不变化”,如是,则可判断,如不是,则不能判断.
A.单位时间内生成nmol H2的同时生成nmol I2
B.一个H-H键断裂的同时有2个H-I键断裂
C.2υ(HI)正=υ(H2)逆
D.T、V一定时,某生成物浓度不再变化
参考答案 1.C 2.C 3.D 4.C 5.B、C 6.B
G632
B
1008-0333(2016)22-0075-02

