酶法检测糖化白蛋白的性能验证及其在2型糖尿病患者中的临床应用价值
曹辉彩,赵家慧,陈妹红,靳丽亚,王之秀,陈翼霖
(1.河北省保定市第一中心医院东院检验科, 河北 保定 071000;2.河北大学医学院2014级临床3班,河北 保定 071000;3.河北省保定市第一中心医院总院心电图室,河北 保定 071000)
·论 著·
酶法检测糖化白蛋白的性能验证及其在2型糖尿病患者中的临床应用价值
曹辉彩1,赵家慧2,陈妹红3*,靳丽亚1,王之秀1,陈翼霖1
(1.河北省保定市第一中心医院东院检验科, 河北 保定 071000;2.河北大学医学院2014级临床3班,河北 保定 071000;3.河北省保定市第一中心医院总院心电图室,河北 保定 071000)
目的对宁波瑞源公司酶法检测糖化白蛋白(glycated albumin,GA)定量进行性能验证并评价其临床应用价值。方法收集标本检测酶法测定GA的精密度、准确度、线性范围评价、试剂空白吸光度、参考区间验证,验证其在2型糖尿病患者中的临床性能。结果 低、中和高3个浓度GA 样品的批内精密度分别为1.45%、1.08%、1.06%,批间精密度分别为1.68%、1.13%、1.19%,相对偏倚为1.54%,在参考物质允许的偏倚范围内,准确度符合相关文件的要求。GA线性分析方程式为Y=0.998X +1.170,r=1.000,表明GA在129~925 μmol/L范围内白蛋白与钴结合线性良好。试剂空白吸光度是反映试剂质量的指标之一,本实验测得空白吸光度平均值为0.004 2,显示该试剂对检测结果的干扰非常小。20例无感染的健康体检者中19例在正常参考区间范围内。证明说明书推荐的参考区间适合本实验室检测人群。血清GA对于诊断糖尿病的灵敏度、特异度分别为90.4%、95.8%。GA可用于糖尿病的诊断和疗效评估。结论酶法检测GA的性能指标均符合实验室质量的要求,适用于临床样本的检测及糖尿病患者的疗效评估。
糖尿病,2型;白蛋白类;实验室能力验证
糖尿病(diabetes mellitus,DM)是一组以高血糖为特征的代谢性疾病。DM患者的血糖如果长期升高,会导致眼、肾、心脏、血管、神经的慢性损害和功能障碍。据临床数据表明,将有30%~40% DM患者发病10年后至少发生一种并发症,且并发症一旦产生,药物治疗很难逆转,因此强调尽早预防DM并发症发生。血糖监测在DM患者治疗过程中起着非常重要的作用,控制好血糖能及时延缓DM患者并发症的发生及发展,短期平均血糖控制是血糖长期达标非常重要的手段。DM的短期监控指标有血糖、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、糖化白蛋白(glycosylated albumin,GA)等。HbA1c可以反映近2~3个月的血糖控制水平,而人体中的葡萄糖与血清蛋白的N-末端发生非酶促糖基化反应,其中 90% 以上为 GA,GA 可以反映近2~3周血糖控制的平均水平,可评价短期内血糖变化,具有较高的临床应用价值[1]。本研究采用酶法测定GA的各项性能指标,验证其是否符合实验室质量要求,同时对其在2型DM患者中的临床应用价值进行评价,现报告如下。
1 资料与方法
1.1 样品来源
1.1.1 用于临床性能验证的样品 选取2015年5—12月我院内分泌科收治的明确诊断为DM的患者156例作为病例组,男性97例,女性59例,年龄14~95岁,平均(60.4±19.1)岁。同时选取2015年11—12月在我院参加体检的血糖正常健康体检者216例作为对照组,男性112例,女性104例,年龄20~84岁,平均(51.0±17.1)岁。
1.1.2 用于性能验证的样本 ①低值标本:选择本院内分泌科患者血清,其浓度尽可能接近可报告范围低限。②高值标本:选择本院内分泌科患者的血清,其浓度尽可能接近可报告范围高限。③中值血清:将上述低值血清与高值血清按1∶1的比例混合。
1.2 试剂和仪器 GA试剂、校准品、质控品均由宁波瑞源生物科技有限公司提供,批号分别为2015052301、20150602、20150602。血清白蛋白检测校准品(批号:901UN) 由英国朗道提供。检测仪器为日立7600全自动生化分析仪。
1.3 验证方法 依照美国临床和实验室标准化协会评价方案验证,每天测定低值和高值2个水平的指控,室内质控在控后进行标本检测。
1.3.1 精密度的验证 精密度包括批内和批间精密度,精密度的程度常用标准差和变异系数来表示。按照临床与实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)颁布的EP5-A2文件评价。批内精密度:将3个浓度的样本随患者标本同时检测,连续检测20次;计算其均值、标准差和变异系数;以批内变异系数小于1/4允许总误差为结果可接受。批间精密度:每天测定1次3个浓度的评价样本,共检测20 d,累计20次,计算其均值、标准差和变异系数;以批间变异系数小于1/3允许总误差为结果可接受。
1.3.2 准确度验证 准确度指测得值与真值之间相符合程度,它的高低常以误差的大小衡量。本实验通过检测已知浓度的校准品,计算相对偏倚。相对偏倚=(靶值-测定值)/靶值×100%, 若相对偏倚在允许的偏倚范围内结果为可接受[2]。
1.3.3 线性范围验证 线性范围是指试剂盒按说明书使用可准确测量的范围,是衡量其质量的重要指标。参照CLSI EP6文件,选取一份高浓度样本(H)和份低浓度样本(L),其结果尽可能接近厂家提供的检测上限和下限,分别按5L、4L+1H、3L+2H、2L+3H、1L+4H、5H体积比混合成6个不同浓度的样本,每个浓度重复检测3次,计算其均值。将实测值(Y)和理论值(X)进行比较,计算Y=bX+a验证线性范围。 要求r≥0.975,a值在1±0.05范围内,截距b小于检测上限的5%。
1.3.4 试剂空白吸光度验证 试剂空白是指由于测试试剂本身给检测结果带来的误差。其检测方法是按照正常的检测方法,把样本换成去离子水。
1.3.5 参考区间验证 参考区间在我国通常又称为“参考范围”、“正常范围”、“正常值”等,是指从参考下限到参考上限的区间。通常是中间95%区间,参照CLSI C28-A2文件,从本地参考人群中募集参考个体20例采样并测定,测定值剔除离群值后若不满20例需补足。将这20个测定值与需验证的参考区间比较,若落在参考限外的测定值不超过2个,则该参考区间可直接使用,若大于2个及以上检测结果超出,重新筛选20例,重复上述操作。若仍然有3个或3个以上测定值超出,则实验室应重新检查所用的分析程序,考虑是否有人群差异,考虑是否需要自己建立参考区间。
1.3.6 临床性能验证 临床检验结果的最终目是用于患者的临床治疗,因此检测方法的评价应包括临床性能验证[3],这种性能验证能力可用灵敏度和特异度来衡量[4]。灵敏度指由金标准确诊有病的实验组内所检测出阳性病例数的比率(%),即本实验诊断的真阳性率。灵敏度=[真阳性/(真阳性+假阴性)]×100%;特异度=[真阴性/(假阳性+真阴性)]×100%。
1.4 统计学方法 应用SPSS 16.0统计软件进行数据分析,计算均值、精密度、相对偏倚、参考区间、灵敏度和特异度,进行线性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 精密度结果分析 低、中、高3个浓度的批内精密度和批间精密度均低于CLIA′88分析质量要求规定的1/3允许总误差, 结果均可接受。见表1。

表1 GA精密度结果
2.2 准确度结果分析 检测与当前检测系统校准的校准品应为不同批号配套校准品,重复检测3次,结果分别为487.132 μmol/L、488.321 μmol/L、486.741 μmol/L,其平均值为487.400 μmol/L,理论值为480 μmol/L,相对偏倚为1.54%,低于CLIA′88分析质量要求规定的1/3允许总误差(5%),结果可接受。
2.3 线性范围评价 选择GA低值标本(L)和高值标本(H)各1份,浓度分别为129 μmol/L、925 μmol/L。将6个不同浓度的标本分别编号1、2、3、4、5、6。以实测均值Y为纵坐标,理论值X为横坐标做图并计算其回归方程Y=bX+a,并做散点图进行线性回归分析。经分析GA线性分析方程式为Y=0.998X+1.170,r=1.000,P<0.001。表明GA在129~925 μmol/L范围内白蛋白与钴结合线性良好,结果见表2及图1。

表2 GA线性范围评价结果 (μmol/L)
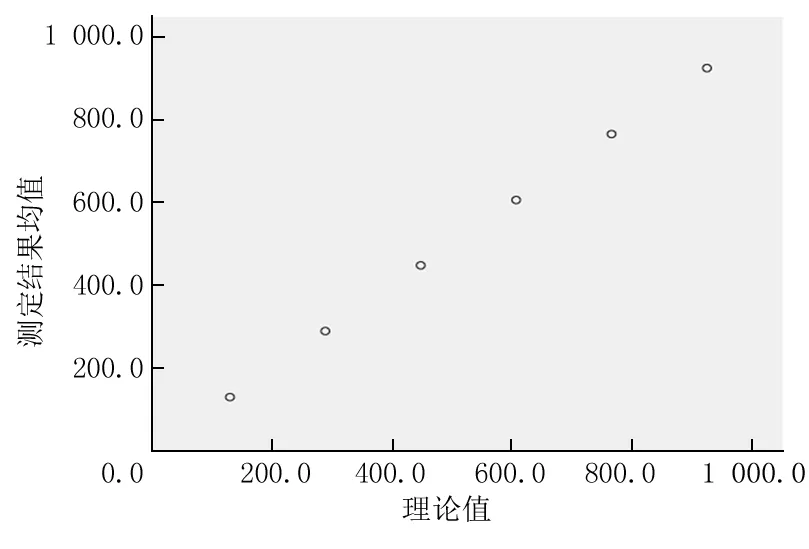
图1 GA线性分析
Y=0.998X+1.170,r=1.000,P<0.001
2.4 试剂空白吸光度 GA的试剂空白吸光度平均值为0.042。
2.5 参考区间验证 参考CLSI C28-A2的要求,将疑似离群点和相邻点的差值(D)与数据全距(R)相除。若D/R≤1/3,即可排除离群点,若>1/3考虑为离群值,将其剔除。本实验D/R≤1/3无离群值。20份检测结果19例在试剂生产厂商提供的11%~16%参考范围内。初步证明说明书推荐的参考区间适合本实验室检测人群。见表3。

表3 GA参考区间验证结果
2.6 临床性能验证 检测病例组和对照组GA水平,以GA>16%判定为阳性。血清GA对于DM患者的灵敏度、特异度分别为90.4%、95.8%,见表4。
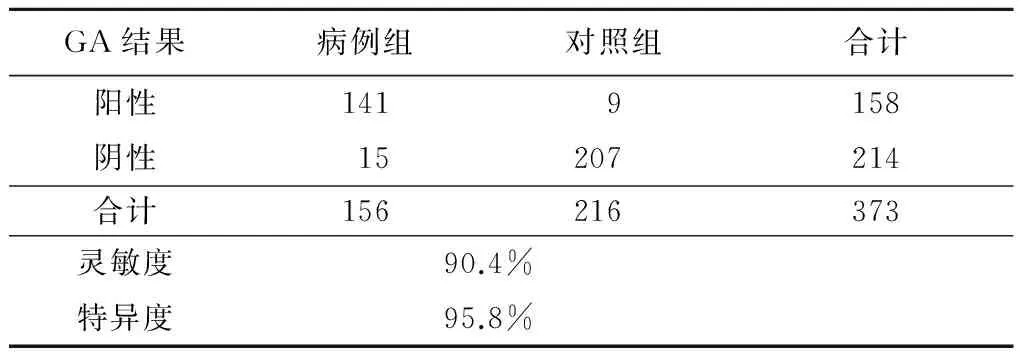
表4 GA的临床性能验证 (例数)
3 讨 论
近年来,DM已成为继肿瘤和心脑血管疾病之后第3位严重危害人类健康的慢性疾病[5-7]。DM患者血糖控制不良可导致DM肾病、心血管疾病等多种并发症,GA与DM大血管、微血管并发症的关系也尤为密切[8]。最新DM流行病学显示目前全球将近4亿DM患者中约1/3存在视网膜病变或不同程度的DM相关眼损伤[9]。另有研究表明GA可以应用于妊娠期DM的筛查[10]。血糖的良好控制可以延缓DM肾病进展、减轻体内脏器损伤、有效降低心血意外事件的发生及尿毒症透析患者的病死率[11]。检测GA水平也可用于监控孕妇孕期血糖水平以及老年无症状性或夜间低血糖诊断。目前GA已作为血糖监测首选指标。GA半衰期较短,测定GA的浓度可有效反映患者过去2~3周内平均血糖的水平,并不受临时血糖浓度波动的影响[12]。由于GA的衰期比HbA1c短,故GA反映血糖变化比HbA1c敏感。GA在治疗效果的确认以及临床用药量的调整方面比HbA1c更有优势。而且在许多血红蛋白代谢异常的情况下HbA1c水平受到影响不能真实反映患者的血糖水平,而GA的结果不受影响,如DM肾病透析患者、贫血患者、妊娠期妇女的血糖检测等。因此,GA能更及时、更确切地反映较短期内DM的控制程度。
本研究GA检测采用的是酶法,其原理是样品中GA在被特异性的蛋白酶裂解释放出糖化氨基酸,经糖化氨基酸氧化酶氧化后产生过氧化氢,过氧化氢经Trinder系统显色后观其颜色深浅与糖化血清蛋白含量成正比,与标准比较后可求得GA的含量。实验室在使用新的检测方法或仪器设备时,应对其性能进行初步评估[13]。本研究参照CLSI系列文件对宁波瑞源生物科技有限公司的GA检测试剂盒和日立7600全自动生化分析仪组成的检测系统进行了性能评价和临床性能验证。结果显示该试剂盒低、中、高3个浓度的批内精密度分别为1.45%、1.08%、1.06%,批间精密度分别为1.68%、1.13%、1.19%,均符合厂商说明书要求小于5%,保证了检测结果的稳定性和重复性。准确度用来表示系统误差的大小,本研究参考相关文献进行了准确度的评价,结果符合相关文件的要求。本研究试剂空白吸光度平均为0.042,提示本试剂对检测结果的干扰非常小。参照CLSI EP6文件的要求对酶法测定GA进行了线性范围评价,GA线性分析方程为Y=0.998X-1.170,r=1.000,表明GA在129~925 μmol/L范围内白蛋白与钴结合线性良好。实验室在使用试剂生产厂商提供的参考区间之前,应按C28-A2文件进行参考区间的验证[14],本研究采用20份体检合格的健康成人样本来验证厂家提供的参考区间,20份检测结果19例在试剂生产厂商提供的11%~16%参考范围内,初步证明说明书推荐的参考区间适合本实验室检测人群。血清GA对于诊断DM的灵敏度、特异度分别为90.4%、95.8%,能为医生对DM的早期诊断及控制情况提供准确的诊断依据,从而改善患者预后和减少并发症。
综上所述,GA检测可准确地反映DM患者短期平均血糖的水平及变化,具有非常重要的临床价值。其检测方法简便、准确和实用。GA与诸多DM慢性并发症如慢性肾病、心血管病变有关。因此,通过GA检测监测DM早期病变,尽早发现和控制DM并发症,是非常有价值的研究方向。
[1] 高倩,王战建.糖化血清白蛋白的临床应用价值[J].临床荟萃,2014,29(1):109-111.
[2] 张葵.定量检测系统方法学性能验证实验的基本方法[J].临床检验杂志,2009,27(5):321-323.
[3] Bossuyt PM,Reitsma JB,Linnet K,et al. Beyond diagnostic accuracy:the clinical utility of diagnostic tests[J]. Clin Chem,2012,58(12):1636-1643.
[4] 康凤凤,王治国.ISO 15189:2012与临床检验定量检测方法确认和性能验证[J].临床检验杂志,2013,31(12):881-884.
[5] Guariguata L,Whiting DR,Hambleton I,et al. Global estimates of diabetes prevalence for 2013 and projections for 2035[J]. Diabetes Res Clin Pract,2014,103(2):137-149.
[6] Xu Y,Wang L,He J,et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA,2013,310(9):948-959.
[7] 张国军,郑丽华,孙锡红.妊娠期糖尿病研究进展[J].河北医科大学学报,2015,36(7):862-866.
[8] 戴静怡,李 青,汪年松. 糖化白蛋白在糖尿病肾病的临床应用及研究进展[J].中国中西医结合肾病杂志,2013,14(2):180-182.
[9] 章莹,熊燕. 糖尿病视网膜病变系统综合性治疗进展[J].实用医学杂志,2016,32(11):1729-1730.
[10] 王欣蓉.糖化白蛋白在妊娠期糖尿病筛查及诊断中的价值探讨[J].中国实验诊断学,2014,18(4):613-614.
[11] Perkovic V,Heerspink HL,Chalmers J,et al. Intensive glucose control improves kidney outcomes in patients with type 2 diabetes[J]. Kidney Int,2013,83(3):517-523.
[12] 连国军,潘利琴,李宝青,等. 糖化白蛋白酶法测定试剂研制与评价[J].温州医科大学学报,2016,46(7):526-529.
[13] 黄维纲,黄盛,沈军,等.酶法测定糖化白蛋白的方法学评价及其与糖尿病诊断的相关性研究[J].检验医学,2014,29(5):513-517.
[14] 刘诗颖,万娜,刘晓波,等.缺血修饰白蛋白检测试剂盒的分析性能评价[J].标记免疫分析与临床,2015,22(10):1042-1046.
(本文编辑:赵丽洁)
2016-03-17;
2016-09-09
曹辉彩(1975-),女,河北赵县人,河北省保定市第一中心医院主任检验师,医学硕士,从事临床检验学研究。
*通讯作者。E-mail:chc1718@163.com
R587.1
B
1007-3205(2016)11-1350-04
10.3969/j.issn.1007-3205.2016.11.029

