慢性乙型肝炎抗病毒治疗与血清HBsAg和HBcrAg水平的变化
李健,陆伟,张占卿,,王雁冰,翁齐铖,张智勇,丁荣蓉,周新兰
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.上海市公共卫生临床中心 肝炎二科,上海201508;3.日本富士瑞必欧株式会社 上海代表处,上海 200336)
慢性乙型肝炎抗病毒治疗与血清HBsAg和HBcrAg水平的变化
李健1,陆伟2,张占卿1,2,王雁冰2,翁齐铖3,张智勇3,丁荣蓉2,周新兰2
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.上海市公共卫生临床中心 肝炎二科,上海201508;3.日本富士瑞必欧株式会社 上海代表处,上海 200336)
目的:探讨核苷(酸)类抗病毒治疗与慢性乙型肝炎(CHB)患者血清HBsAg和HBcrAg水平的变化。方法:108例CHB患者入选本研究,其中HBeAg阳性患者分别进入抗病毒组46例和非抗病毒组20例,HBeAg阴性患者进入抗病毒组31例和非抗病毒组11例。血清HBsAg和HBcrAg分别采用化学发光微粒免疫法和化学发光酶免疫法检测。结果:无论HBeAg阳性或阴性患者,抗病毒组与非抗病毒组随访时间差异均无统计学意义(P>0.05);抗病毒组随访起点与终点血清HBsAg和HBcrAg水平差异均有统计学意义(均P<0.05),非抗病毒组随访起点与终点血清HBsAg和HBcrAg水平差异均无统计学意义(均P>0.05);抗病毒组与非抗病毒组从随访起点到终点血清HBsAg下降幅度和下降比例差异均无统计学意义(均P>0.05),从随访起点到终点血清HBcrAg下降幅度和下降比例差异均有统计学意义(P<0.05)。结论:CHB患者的抗病毒治疗能导致显著的血清HBsAg和HBcrAg下降,但只能获得显著的血清HBcrAg下降幅度和下降比例。
慢性乙型肝炎;核苷(酸)类;抗病毒治疗;乙型肝炎表面抗原;乙型肝炎核心相关抗原
核苷(酸)类抗病毒药物是目前治疗慢性乙型肝炎(chronic hepatitis B,CHB)的主流,能够使CHB及其相关肝硬化患者的肝脏炎症得到改善、纤维化发生回归和肝脏功能趋向正常[1]。抗病毒治疗的一个直接后果是乙型肝炎病毒(hepatitis B virus,HBV)复制水平的下降,同时伴随HBV相关抗原如乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、乙型肝炎核心相关抗原(hepatitis B core-related antigen,HBcrAg)表达水平的下降[2-3]。抗病毒治疗后血清HBV DNA下降幅度与肝脏炎症改善程度和纤维化回归程度呈显著正相关[4-5],但抗病毒治疗后血清HBV相关抗原变化与肝组织病理状态相关性的研究较少。本研究根据接受抗病毒治疗的77例和未接受抗病毒治疗的31例CHB患者血清HBsAg和HBcrAg定量检测的结果,探讨抗病毒治疗与血清HBsAg和HBcrAg水平的变化;并参照血清HBV DNA水平的变化,推断血清HBsAg和HBcrAg水平的变化与肝组织病理学改变的潜在相关性。
1 资料和方法
1.1一般资料 2012年8月至2015年7月上海市(复旦大学附属)公共卫生临床中心住院的CHB患者108例,其中乙型肝炎e抗原(hepatitis B e antigen,HBeAg)阳性和阴性患者分别为66例和42例。诊断符合2010年中华医学会肝病学分会、感染病学分会联合修订的《慢性乙型肝炎防治指南》中的标准。在综合评估病情的基础上,根据病情需要,46例HBeAg阳性和31例HBeAg阴性患者接受了核苷(酸)类抗病毒治疗(抗病毒组),20例HBeAg阳性和11例HBeAg阴性患者未接受抗病毒治疗(非抗病毒组)。HBeAg阳性患者,抗病毒组和非抗病毒组男:女比例分别为35:11和11:9,两者之间的差异无统计学意义(x2=2.935,P=0.087);平均年龄分别为(35.74±10.33)岁和(36.45±12.52)岁,两者之间的差异无统计学意义(t=0.241,P=0.810)。HBeAg阴性患者,抗病毒组和非抗病毒组男:女比例分别为24:7和7:4,两者之间的差异无统计学意义(Fisher精确检验,P=0.437);平均年龄分别为(43.42± 12.31)岁和(39.09±7.34)岁,两者之间的差异无统计学意义(t=1.383,P=0.177)。
1.2实验室检查 血标本留用得到了上海市公共卫生临床中心伦理委员会的批准。血清HBsAg和HBeAg采用化学发光微粒子免疫法(chemiluminescence microparticle immunoassay,CMIA)和Abbott Architect I2000全自动化学发光免疫系统及其配套试剂检测,正常参考值分别为<0.05 IU/mL和<1.0 S/CO;其中HBsAg检测上限为250 IU/mL,如超过检测上限,则血清作500倍稀释后重新检测。血清HBcrAg采用化学发光酶免疫法(chemiluminescence enzyme immunoassay,CLEIA)和Fujirebo Lumipulse G1200全自动化学发光免疫系统检测,试剂由Fujirebo株式会社提供,批准文号:SAX5031(日本),正常参考值为<1 kU/mL;检测上限为10 000 kU/mL,如超过检测上限,则血清作50倍稀释后重新检测。血清HBV DNA采用Bio-Rad Icycler荧光定量PCR仪检测,试剂购自深圳匹基生物工程有限公司,检测范围5×102~5×107IU/mL。
1.3统计学处理方法 数据处理和统计分析采用SPSS16.0统计软件。抗病毒组与非抗病毒组随访时间以及随访起点血清HBsAg和HBcrAg、HBV DNA水平的差异比较采用两独立样本的Mann-Whitney U检验;随访起点与终点血清HBsAg和HBcrAg、HBV DNA水平的差异采用两相关样本的Wilcox-on符号秩检验;抗病毒组与非抗病毒组从随访起点到终点的血清HBsAg和HBcrAg、HBV DNA下降幅度的差异比较采用两独立样本的Mann-Whitney U检验;抗病毒组与非抗病毒组从随访起点到终点的血清HBsAg和HBcrAg、HBV DNA下降比例的差异比较采用pearson x2检验或Fisher精确检验。P<0.05为差异有统计学意义。
2 结果
2.1抗病毒组与非抗病毒组的治疗方案和随访时间 无论HBeAg阳性或阴性患者,抗病毒组从随访起点到终点接受持续的核苷(酸)类药物(拉米夫定、替比夫定、恩替卡韦、阿德福韦酯等)单药或联合治疗;非抗病毒组从随访起点到终点只接受临床观察或胸腺肽治疗。抗病毒组和非抗病毒组在随访期间均未同时接受甾体激素类和甘草酸类药物治疗。HBeAg阳性患者,抗病毒组和非抗病毒组随访起点抗病毒:未抗病毒治疗的比例差异无统计学意义(P>0.05),从随访起点到终点的随访时间差异无统计学意义(P>0.05)。HBeAg阴性患者,抗病毒组和非抗病毒组随访起点抗病毒:未抗病毒治疗的比例差异有统计学意义(P<0.05);从随访起点到终点的随访时间差异无统计学意义(P>0.05)。见表1。HBeAg阳性非抗病毒组随访起点有3例曾接受抗病毒治疗,其终止抗病毒治疗的原因:1例先后使用阿德福韦酯、替比夫定、阿德福韦酯联合替比夫定,均未实现病毒学应答,基因测序法证实发生HBV rs L180M和rs M204I耐药变异;1例先后使用拉米夫定、恩替卡韦联合阿德福韦酯、替诺福韦酯均未实现病毒学应答,基因测序法证实发生HBV rs M204I耐药变异;1例为不符合抗病毒治疗指征短期(5个月)使用恩替卡韦。
2.2抗病毒组与非抗病毒组随访起点血清HBsAg和HBcrAg、HBV DNA水平 HBeAg阳性患者,抗病毒组与非抗病毒组随访起点血清HBsAg和HBV DNA水平差异均无统计学意义(均P>0.05),血清HBcrAg水平差异有统计学意义(P<0.01)。HBeAg阴性患者,抗病毒组与非抗病毒组随访起点血清HBsAg、HBcrAg和HBV DNA水平差异均无统计学意义(均P>0.05)。见表2。
2.3随访起点与终点血清HBsAg和HBcrAg、HBV DNA水平 无论HBeAg阳性或HBeAg阴性患者,抗病毒组随访起点与终点血清HBsAg和HBcrAg、HBV DNA水平差异均有统计学意义(均P<0.05)。无论HBeAg阳性或HBeAg阴性患者,非抗病毒组随访起点与随访终点血清HBsAg和HBcrAg、HBV DNA水平差异均无统计学意义(均P>0.05)。见表3-4和图1-2。
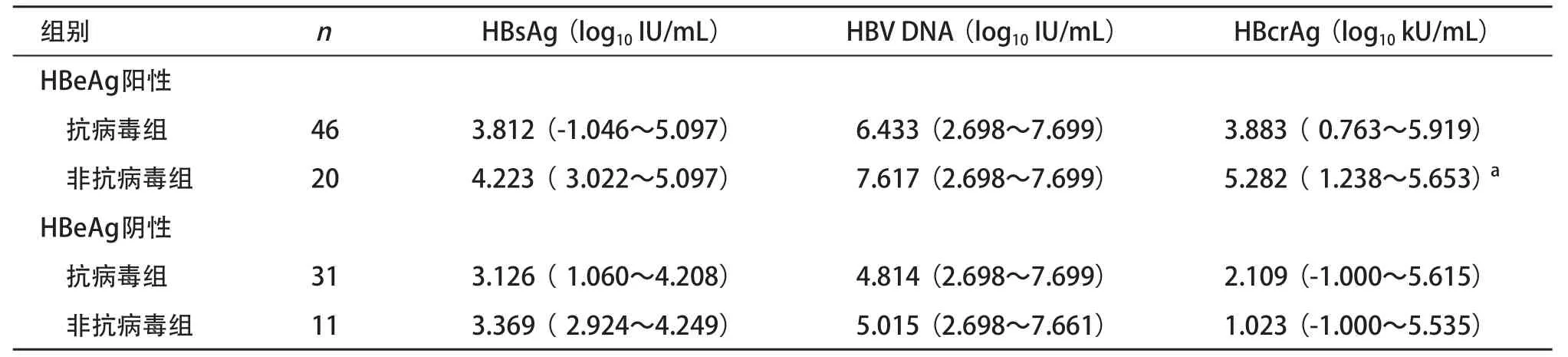
表2 抗病毒组与非抗病毒组随访起点血清HBsAg和HBcrAg、HBV DNA水平比较

表3 HBeAg阳性患者随访起点与随访终点血清HBsAg和HBcrAg、HBV DNA水平比较

表4 HBeAg阴性患者随访起点与随访终点血清HBsAg和HBcrAg、HBV DNA水平比较

图1 HBeAg阳性患者抗病毒组(A~C)与非抗病毒组(D~F)随访起点和随访终点的血清HBsAg、HBV DNA水平(log10IU/mL)以及HBcrAg水平(log10kU/mL)

图2 HBeAg阴性患者抗病毒组(A~C)和非未抗病毒组(D~F)随访起点和随访终点的血清HBsAg、HBV DNA水平(log10IU/mL)以及HBcrAg水平(log10kU/mL)
2.4 抗病毒组与非抗病毒组从随访起点到终点血清HBsAg和HBcrAg、HBV DNA下降幅度 无论HBeAg阳性或HBeAg阴性患者,抗病毒组与非抗病毒组血清HBsAg下降幅度差异均无统计学意义(均P>0.05),血清HBcrAg、HBV DNA下降幅度差异均有统计学意义(均P<0.01)。见表5。

表5 抗病毒组与非抗病毒组血清HBsAg和HBcrAg、HBV DNA下降幅度比较
2.5抗病毒组与非抗病毒组从随访起点到终点血清HBsAg和HBcrAg、HBV DNA下降比例 以血清HBsAg和HBcrAg、HBV DNA的下降分别>1 log10IU/mL、>1 log10kU/mL和>1 log10IU/mL为标准,无论HBeAg阳性或HBeAg阴性患者,抗病毒组与非抗病毒组血清HBsAg下降比例差异均无统计学意义(均P>0.05),血清HBcrAg、HBV DNA下降比例差异均有统计学意义(均P<0.05)。见表6。

表6 抗病毒组与非抗病毒组血清HBsAg和HBcrAg、HBV DNA下降比例比较[n(%)]
3 讨论
慢性HBV感染依次经历免疫耐受、免疫激活、免疫控制和免疫再激活等多个阶段[6]。近年来,血清HBsAg和HBV DNA、HBcrAg水平在慢性HBV感染自然史不同阶段的变化已经被研究。血清HBsAg水平从免疫耐受期经免疫激活期到免疫控制期或免疫再激活期逐步降低,并且在免疫耐受期与免疫激活期、免疫激活期与免疫控制期或免疫再激活期之间的差异均有统计学意义,但在免疫控制期与免疫再激活期之间的差异是否有统计学意义尚无定论[7-13];血清HBV DNA载量从免疫耐受期经免疫激活期到免疫控制期逐步降低,但从免疫控制期到免疫再激活期再度升高,并且在免疫耐受期与免疫激活期、免疫激活期与免疫控制期、免疫控制期与免疫再激活期之间的差异均有统计学意义[7-13]。血清HBcrAg水平在慢性HBV感染不同阶段的变化方向和幅度与血清HBV DNA水平基本一致,但与血清HBsAg水平的变化不完全一致[13-14]。
有研究指出,HBeAg阳性患者,血清HBsAg、HB-crAg、HBV DNA水平与肝组织病理学分级和分期均呈显著负相关,其中血清HBsAg和HBcrAg对病理学分级≥G3和分期≥S4有显著的预测价值,但血清HBV DNA对病理学分级和分期的预测效能尚存争议[15-18];HBeAg阴性患者,血清HBsAg与肝组织病理学分级和分期均无显著相关性,血清HBcrAg、HBV DNA水平与肝组织病理学分级和分期均呈显著正相关,并且血清HBcrAg、HBV DNA对病理学分级≥G2和分期≥S2有显著的预测价值[19-24]。提示HBeAg阳性与阴性患者发病和进展的病毒学和免疫学机制存在差异。
核苷(酸)类抗病毒药物具有延缓、阻止和逆转HBeAg阳性和阴性CHB患者肝组织病理状态的效能已经为临床试验和临床实践所证实。早期有研究认为,抗病毒治疗诱导的血清HBV DNA下降幅度与CHB患者的肝脏炎症改善程度和纤维化回归程度呈显著正相关[4];最近有研究指出,抗病毒治疗诱导的血清HBV DNA下降幅度与HBV相关肝硬化患者的肝脏炎症改善程度和纤维化回归程度呈显著正相关[5]。本组资料显示,无论HBeAg阳性或阴性患者,抗病毒组随访起点与终点血清HBsAg、HBcrAg、HBV DNA水平差异均有统计学意义,而非抗病毒组随访起点与终点血清HBsAg、HBcrAg、HBV DNA水平差异均无统计学意义。提示抗病毒治疗不仅能降低HBV复制而且能减少HBV相关抗原表达;伴随HBV复制水平下降的HBV相关抗原表达减少可能是抗病毒治疗获得肝脏组织学改善的根本原因。
慢性HBV感染的发病和进展机制尚未阐明。除病毒学和免疫学因素外,还受性别、年龄、内分泌环境、病毒-宿主相互作用等的影响[25]。自然条件下,虽然HBV感染诱导肝脏免疫损伤的病毒特异性抗原还不能最终确定,但多数研究认为,无论HBeAg阳性或阴性患者,肝组织HBcrAg的表达形式和表达水平与肝脏炎症的发生和发展有显著相关性,而HBsAg的表达形式和表达水平与肝脏炎症的发生和发展无显著相关性[26-28]。本组资料显示,无论HBeAg阳性或阴性患者,抗病毒组与非抗病毒组从随访起点到终点的血清HBcrAg、HBV DNA下降幅度和下降比例差异均有统计学意义,但抗病毒组与非抗病毒组从随访起点到终点的血清HBsAg下降幅度和下降比例差异均无统计学意义。提示抗病毒治疗导致的肝组织HBcrAg而非HBsAg表达的显著减少可能是获得肝脏组织学改善的关键因素。
概言之,CHB患者的抗病毒治疗能导致显著的血清HBsAg和HBcrAg下降,但只能获得显著的血清HBcrAg下降幅度和下降比例。抗病毒治疗导致的血清HBcrAg显著下降可能有潜在的预测肝脏炎症改善和纤维化回归的效能。本研究的不足之处在于只观察了抗病毒治疗一定时间内血清HBsAg和HBcrAg的变化,而缺乏治疗前后的肝脏组织学变化及其与血清HBsAg和HBcrAg的变化的相关性分析。
[1] RUSSO F P, RODRÍGUEZ-CASTRO K, SCRIBANO L, et al. Role of antiviral therapy in the natural history of hepatitis B virus-related chronic liver disease[J]. World J Hepatol, 2015, 18, 7(8): 1097-1104.
[2] CHEN C H, CHIU Y C, LU S N, et al. Serum hepatitis B surface antigen levels predict treatment response to nucleos (t) ide analogues [J]. World J Gastroenterol, 2014, 20 (24): 7686-7695.
[3] TANAKA E, MATSUMOTO A, YOSHIZAWA K, et al. Hepatitis B core-related antigen assay is useful for monitoring the antiviral effects of nucleoside analogue therapy[J]. Intervirology, 2008, 51(Suppl 1): 3-6.
[4] MOMMEJA-MARIN H, MONDOU E, BLUM M R, et al. Serum HBV DNA as a marker of effi cacy during therapy for chronic HBV infection: Analysis and review of the literature [J]. Hepatology, 2003, 37(6): 1309-1319.
[5] XU Y, ZHANG Y G, WANG X, et al. Long-term antiviral efficacy of entecavir and liver histology improvement in Chinese patients with hepatitis B virus-related cirrhosis[J]. World J Gastroenterol, 2015, 21(25): 7869-7876.
[6] CROAGH C M, LUBEL J S. Natural history of chronic hepatitis B: Phases in a complex relationship[J]. World J Gastroenterol, 2014, 20(30): 10395-10404.
[7] CHAN H L, WONG V W, WONG G L, et al. A longitudinal study on the natural history of serum hepatitis b surface antigen changes in chronic hepatitis B[J]. Hepatology, 2010, 52(4): 1232-1241.
[8] JAROSZEWICZ J, SERRANO B C, WURSTHORN K, et al. Hepatitis B surface antigen (HBsAg) levels in the natural history of hepatitis B virus (HBV)-infection: A European perspective[J]. J Hepatol, 2010, 52(4): 514-522.
[9] NGUYEN T, THOMPSON A J, BOWDEN S, et al. Hepatitis B surface antigen levels during the natural history of chronic hepatitis B: A perspective on Asia[J]. J Hepatol, 2010, 52(4): 508-513.
[10] KIM Y J, CHO H C, CHOI M S, et al. The change of quantitative HBsAg level in the natural course of chronic hapatitia B[J]. Liver Int, 2011, 31(6): 817-823.
[11] BRUNETTO M R, OLIVERI F, COLOMBATTO P, et al. Hepatitis B surface antigen serum levels help to distinguish active from inactive hepatitis B virus genotype D carriers[J]. Gastroenterology, 2010, 139(2): 483-490.
[12] CHUNG K H, KIM W, KIM B G, et al. Hepatitis B surface antigen quantifi cation across different phases of chronic hepatitis b virus infection using an immunoradiometric assay[J]. Gut Liver, 2015, 9(5): 657-664.
[13] SETO W K, WONG D K, FUNG J, et al. Linearized hepatitis B surface antigen and hepatitis B core-related antigen in the natural history of chronic hepatitis B[J]. Clin Microbiol Infect, 2014, 20(11): 1173-1180.
[14] MAASOUMY B, WIEGAND S B, JAROSZEWICZ J, et al. Hepatitis B core-related antigen (HBcrAg) levels in the natural history of hepatitis B virus infection in a large European cohort predominantly infected with genotypes A and D[J]. Clin Microbiol Infect, 2015, 21(6): 606.e1-10.
[15] 张占卿, 陆伟, 王雁冰, 等. 血清 HBsAg和HBV DNA预测慢性乙型肝炎肝组织病理状态的评价[J]. 胃肠病学和肝病学杂志, 2014 , 23(5): 554-558.
[16] 曾达武, 董菁, 陈丽红, 等. 免疫清除期慢性乙型肝炎患者血清HBsAg水平与肝组织炎症分级及纤维化分期的关系[J]. 中华肝脏病杂志, 2012, 20(10): 746-750.
[17] MARTINOT-PEIGNOUX M, CARVALHO-FILHO R, LAPALUS M, et al. Hepatitis B surface antigen serum level is associated with fi brosis severity in treatment-naïve e antigen-positive patients[J]. J Hepatol, 2013, 58(6): 1089-1095.
[18] JIA W, QI X, JI Y Y, et al. Low serum hepatitis B surface antigen level predicts compensated cirrhosis caused by chronic hepatitis B in HBeAg positive patients in East China[J]. Hepat Mon, 2015, 15(8): e29183.
[19] CROAGH C M, BELL S J, SLAVIN J, et al. Increasing hepatitis B viral load is associated with risk of signi¢cant liver fi brosis in HBeAg-negative but not HBeAg-positive chronic hepatitis B[J]. Liver Int, 2010, 30(8): 1115-1122.
[20] ALAM S, AHMAD N, MUSTAFA G, et al. Evaluation of normal or minimally elevated alanine transaminase, age and DNA level in predicting liver histological changes in chronic hepatitis B[J]. Liver Int, 2011, 31(6): 824-830.
[21] MCMAHON B J, BULKOW L, SIMONS B, et al. Relationship between level of HBV DNA and liver disease-a population-based study of hepatitits B e antigen-negative persons with hepatitis B[J]. Clin Gastroenterol Hepatol, 2014, 12(4): 701-706.
[22] SANAI F M, HELMY A, BZEIZI K I, et al. Discriminant value of serum HBV DNA levels as predictors of liver fi brosis in chronic hepatitis B[J]. J Viral Hepat, 2011, 18(7): e217-e225.
[23] 张占卿, 陆伟, 翁齐铖, 等. 血清乙型肝炎核心相关抗原预测慢性乙型肝炎肝组织病理状态的评价[J]. 肝脏, 2015, 20(8): 576-582.
[24] 张占卿, 陆伟, 翁齐铖, 等. 血清病毒学标记物预测慢性乙型肝炎肝组织病理状态的评价[J]. 同济大学学报(医学版), 2015, 36(4): 57-63.
[25] WU J F, CHANG M H. Natural history of chronic hepatitis B virus infection from infancy to adult life-the mechanism of infl ammation triggering and long-term impacts[J]. J Biomed Sci, 2015, 22: 92.
[26] 张占卿, 陆伟, 沈芳, 等. 乙型肝炎病毒复制及其抗原表达水平与慢性乙型肝炎肝组织病理状态的相关性[J]. 胃肠病学和肝病学杂志, 2015, 24(7): 829-836.
[27] 张玉果, 王泰龄. 慢性乙型肝炎肝组织内HBsAg、HBcAg的表达及临床研究进展[J]. 胃肠病学和肝病学杂志, 2010, 19(2): 189-192.
[28] HUANG Y H, HUNG H H, CHAN C C, et al. Core antigen expression is associated with hepatic necroinfl ammation in e antigen-negative chronic hepatitis B patients with low DNA loads [J]. Clin Vaccine Immunol, 2010, 17(6): 1048-1053.
(本文编辑:赵翠翠)
Nucleos(t)ides antiviral therapy and the changes of serum HBsAg and HBcrAg levels in patients with chronic hepatitis B
LI Jian1, LU Wei2, ZHANG Zhanqing1,2, WANG Yanbing2, WENG Qicheng3, ZHANG Zhiyong3, DING Rongrong2, ZHOU Xinlan2. 1.The First Clinical Medical College, Wenzhou Medical University, Wenzhou, 325035; 2.Department of Division II Hepatitis, Shanghai Public Health Clinical Center, Shanghai, 201508; 3.Shanghai Representative Off ce, Fujirebio Incorporation of Japan, Shanghai, 200336
Objective: To investigate the changes of serum hepatitis B surface antigen (HBsAg) and hepatitis B core-related antigen (HBcrAg) levels in patients with chronic hepatitis B treated with nucleos(t)ides antiviral therapy. Methods: One hundred and eight patients of chronic hepatitis B patients were enrolled in this study, 46 patients and 20 patients of HBeAg-positive patients respectively were divided into the antiviral group and the non-antiviral group, 31 patients and 11 patients of HBeAg-negative patients respectively were into the antiviral group and the non-antiviral group. Serum HBsAg and HBcrAg levels were respectively detected by chemiluminescence microparticle immunoassay and chemiluminescence enzyme immunoassay. Results: In both HBeAgpositive and HBeAg-negative patients, the differences of the follow-up time between antiviral and non-antiviral group were no statistically signifi cant (P>0.05); the differences of serum HBsAg and HBcrAg levels between the follow-up start and the follow-up end were statistically signifi cant in antiviral group (P<0.05), and which of serum HBsAg and HBcrAg levels between the follow-up start and the follow-up end were not statistically signifi -cant in non-antiviral group (P>0.05); the differences of serum HBsAg levels decline extent and proportion from follow-up start to the follow-up end between antiviral and non-antiviral group were not statistically signifi cant (P>0.05), and which of HBcrAg decline extent and proportion from follow-up start to the follow-up end between antiviral and non-antiviral group were statistically signifi cant. Conclusion: The antiviral therapy of CHB patients can lead to the signifi cant decrease of serum HBsAg and HBcrAg levels, but can only get the signifi cant decline extent and proportion of serum HBcrAg.
chronic hepatitis B; nucleos(t)ides; antiviral therapy; hepatitis B surface antigen; hepatitis B corerelated antigen
R575.2
A
10.3969/j.issn.2095-9400.2016.11.005
2016-01-12
上海市卫计委重点科研项目(20134032);国家“十二五”传染病防治重大科技专项(2013ZX10002005)。
李健(1991-),男,浙江杭州人,硕士生。
张占卿,主任医师,硕士生导师,Email:doctorzzqsphc@163.com。

