纤维素酶产生菌YZB46的产酶条件研究
罗奉奉,莫亚玲,刘鑫泰,李雪凤,覃玥*
(河池学院化学与生物工程学院,广西宜州546300)
纤维素酶产生菌YZB46的产酶条件研究
罗奉奉,莫亚玲,刘鑫泰,李雪凤,覃玥*
(河池学院化学与生物工程学院,广西宜州546300)
为提高纤维素酶产生菌YZB46的产酶能力,在单因素试验基础上,通过正交试验筛选最佳发酵培养基组成和最佳发酵条件。结果表明,菌株YZB46的最佳发酵培养基碳源为1.5%麸皮,氮源为0.6%黄豆粉,无机盐为0.1%MgSO4和0.4%KH2PO4;最佳发酵条件为接种量8%,发酵液初始pH 5.0,发酵温度30℃,发酵时间72 h,在此优化的发酵条件下,菌株YZB46的产酶活力达37.75 U/mL,是优化前的2.21倍。
纤维素酶;正交试验;酶活;优化
纤维素是自然界中用之不竭的可再生资源,其作为生产第二代生物燃料解决能源和环境问题备受许多国家的重视[1-2]。如今,工、农、林业等对纤维素废物利用率低,简单的处理(如焚烧等)造成资源浪费并污染环境[3]。因此筛选高产纤维素酶菌株是转化利用纤维素资源的关键,目前获得高产纤维素酶的来源主要是自然选育和诱变选育[4],现已有从各种自然环境中筛选得到来自细菌、真菌、放线菌等微生物产纤维素酶的报道[5],放线菌产酶能力较弱,细菌相对于真菌,具有产酶周期短、适应力强、分子操作方便等优势[6],受到越来越多学者的重视。而纤维素酶活性低较为普遍,其易受培养条件等因素的影响,这为规模生产的一大瓶颈[7],因此研究各类影响酶活因素对提高纤维素酶活有重要意义。
本研究前期从桑园土壤环境中筛选得到一株产纤维素酶(carboxymethyl cellulase,CMCase)的蜡样芽孢杆菌(Bacillus cereus)YZB46,该菌株有良好的遗传稳定性,可发挥内切葡聚糖酶活性,在pH6.0、30℃条件下发酵48 h后测得酶活力为17.08 U/mL,拟通过正交试验设计优化发酵培养基和发酵条件,以提高菌株产酶能力,对纤维素酶的进一步研究应用奠定基础。
1 材料与方法
1.1 材料与试剂
蜡样芽孢杆菌(Bacillus cereus)YZB46:本实验室保藏菌株。
羧甲基纤维素钠(carboxymethyl cellulose-Na,CMC-Na)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):国药集团化学试剂有限公司;酒石酸钾钠(分析纯):西陇化工股份有限公司;麸皮、黄豆粉:市售,粉碎过60目筛备用;桑枝、稻草秸秆:采集自宜州桑园及郊区,粉碎过60目筛备用。
种子培养基:蛋白胨5.0 g,酵母膏5.0 g,(NH4)2SO42.0 g,KH2PO42.0 g,MgSO4·7H2O 1.5 g,CaCl2·2H2O 0.4 g,蒸馏水1 000 mL,pH 6.0。
液体发酵培养基:CMC-Na 10.0 g,蛋白胨5.0 g,(NH4)2SO42.0 g,KH2PO42.0 g,MgSO4·7H2O 1.5 g,蒸馏水1 000 mL,pH 6.0。
1.2 仪器与设备
Multiskan MK3酶标仪:美国Bio-Rad公司;Avanti J-E高速冷冻离心机:德国Beckman Coulter公司;AE240S型电子分析天平:梅特勒-托利多仪器有限公司;HH-S4恒温水浴锅:江苏省金坛市医疗仪器厂;PHS-3C pH计:上海智光仪器仪表有限公司;HYG-型培养摇床:上海欣蕊自动化设备有限公司。
1.3 方法
1.3.1 粗酶液的制备
取5%新鲜种子液接种于100 mL液体发酵培养基中,30℃、180 r/min摇床培养48 h,发酵液于4℃、8 000 r/min离心15 min,收集上清液即为粗酶液。
1.3.2 发酵培养基优化
(1)碳源筛选:分别选取1.0%CMC-Na、麸皮、桑枝粉、稻草粉、葡萄糖、蔗糖、淀粉加入液体发酵培养基替代碳源,30℃、180 r/min摇床培养48 h,测定CMCase酶活力,每组试验均设3次重复。
(2)麸皮添加量对产酶影响:分别以0.5%~2.5%的麸皮作为碳源发酵,30℃、180 r/min摇床培养48 h,测定CMCase酶活力,每组试验均设3次重复。
(3)氮源筛选:分别选取0.5%蛋白胨、酵母膏、黄豆粉、(NH4)2SO4、NH4NO3、尿素加入液体发酵培养基替代氮源,30℃、180 r/min摇床培养48 h,测定CMCase酶活力,每组试验均设3次重复。
(4)黄豆粉的添加量对产酶影响:分别以0.2%~1.0%的黄豆粉作氮源发酵,30℃、180 r/min摇床培养48 h,测定CMCase酶活力,每组试验均设3次重复。
(5)MgSO4·7H2O浓度对产酶影响:在培养基中分别添加0.05%~0.30%的MgSO4·7H2O发酵产酶,30℃、180 r/min摇床培养48h,测定CMCase酶活力,每组试验均设3次重复。
(6)KH2PO4浓度对产酶影响:在培养基中分别添加0.2%~1.0%的KH2PO4发酵产酶,30℃、180 r/min摇床培养48 h,测定CMCase酶活力,每组试验均设3次重复。
(7)正交试验优化培养基组分:在单因素试验的基础上,取麸皮、黄豆粉、MgSO4含量、KH2PO4含量设计4因素3水平正交试验,确定最优产酶培养基配方。正交试验因素与水平见表1。
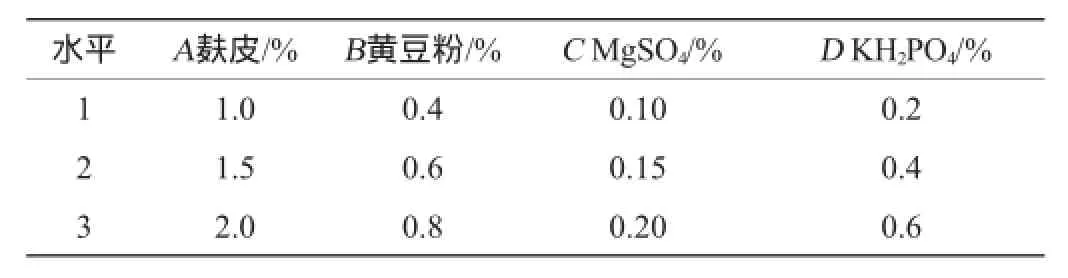
表1 培养基组分优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for medium formula optimization
1.3.3 发酵条件优化
经过发酵培养基组分优化后,在最适的培养基组合条件下进行发酵产酶条件研究,以5%的接种量在初始pH 6.0、30℃条件下发酵48 h为基础条件进行产酶条件单因素试验,设置不同的初始pH(3.0、4.0、5.0、6.0、7.0、8.0、9.0)、发酵温度(20℃、25℃、30℃、35℃、40℃、45℃)、发酵时间(24 h、48 h、72 h、96 h、120 h、144 h)、接种量(2%、5%、8%、11%、14%、17%)进行单因素试验,测定CMCase酶活力,每组试验均设3次重复。根据单因素试验结果,设计以初始pH、发酵温度、发酵时间、接种量为评价因素的4因素3水平正交试验,确定最优发酵条件。正交试验因素与水平见表2。

表2 发酵条件优化正交试验设计Table 2 Design of orthogonal tests for fermentation conditions optimization
1.3.4 纤维素酶活力(CMCase)测定
采用DNS法测定酶反应体系产生的葡萄糖[4]。葡萄糖标准曲线制作:取1 mg/mL的葡萄糖溶液2 mL,加1.5 mL DNS试剂,5 min沸水浴后,迅速冷却至室温,用去离子水定容至20 mL,在波长540 nm处测吸光度值,以葡萄糖含量(mg)和吸光度值(OD540nm值)作标准曲线。
CMCase测定:取粗酶液0.5 mL,加入经40℃预热的含1.5 mL 0.5%CMC-Na的柠檬酸缓冲液(pH5.0,0.05 mol/L)中,混匀,40℃水浴30 min后,立即加1.5 mL DNS试剂,5 min沸水浴后,迅速冷却至室温,用去离子水定容至20 mL,以灭活的粗酶液为对照组,在波长540 nm处测吸光度值,对照标准曲线计算酶活。
酶活定义:在上述条件下,每1 min催化底物CMC-Na产生1 μmol的葡萄糖所需的酶量为1个酶活单位,U/mL。
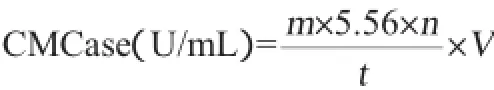
式中:m为葡萄糖标准曲线计算得葡萄糖质量,mg;5.56为1 mg葡萄糖的物质的量,μmol;n为酶液稀释倍数;t为反应时间,min;V为反应酶量,mL。
2 结果与分析
2.1 发酵培养基优化
2.1.1 不同碳源对菌株YZB46产酶影响
由图1可知,当以CMC-Na为碳源时,菌株的酶活力最高[8],以麸皮为碳源时,酶活力仅次于CMC-Na,桑枝粉和稻草粉可能富含较多的木质素,阻碍菌株对纤维素的利用。从经济利用上考虑,选择麸皮作发酵培养基的最佳碳源。

图1 碳源对菌株YZB46产酶的影响Fig.1 Effect of carbon sources on CMCase of strain YZB46
2.1.2 麸皮添加量对菌株YZB46产酶影响
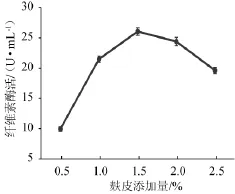
图2 麸皮添加量对菌株YZB46产酶的影响Fig.2 Effect of wheat bran addition on CMCase of strain YZB46
由图2可知,随着麸皮添加量的增加,酶活性呈先上升后下降的趋势,当添加1.5%的麸皮时,酶活达26.07 U/mL,继续增加麸皮量酶活呈现下降趋势。这与陈士成等[9]的报道类似,麸皮可诱导产酶。因此选择麸皮添加量1.0%、1.5%、2.0%进行正交试验。
2.1.3 不同氮源对菌株YZB46产酶影响
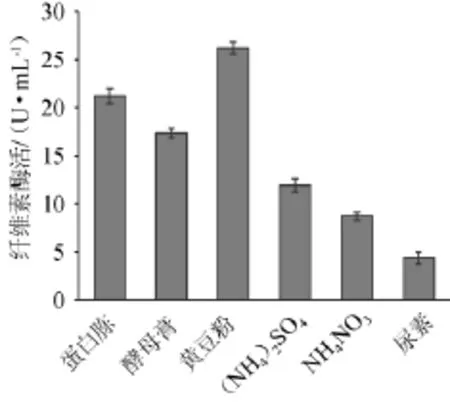
图3 氮源对菌柏油YZB46产酶的影响Fig.3 Effect of nitrogen source on CMCase of strain YZB46
由图3可知,黄豆粉的产酶活力最高,相对于其他氮源,其来源成本低廉,适合作发酵产酶氮源。无机氮源中,(NH4)2SO4比NH4NO3利用效果更好,因NH4+相对于NO3-更易于微生物吸收[10]。但无机氮源的产酶能力较有机氮源的产酶能力低,因此选择黄豆粉作发酵培养基的最佳氮源。
2.1.4 黄豆粉添加量对菌株YZB46产酶影响

图4 黄豆粉添加量对菌株YZB46产酶的影响Fig.4 Effect of soybean meal addition on CMCase of strain YZB46
由图4可知,随着黄豆粉添加量的上升,酶活性呈先上升后下降的趋势。当添加0.6%的黄豆粉时,CMCase活力达最高,为28.51U/mL。因此选择黄豆粉添加量0.4%、0.6%、0.8%进行正交试验。
2.1.5 MgSO4·7H2O添加量对菌株YZB46产酶影响

图5 MgSO4·7H2O添加量对菌株YZB46产酶的影响Fig.5 Effect of MgSO4·7H2O addition on CMCase of strain YZB46
由图5可知,随着MgSO4·7H2O添加量的上升,酶活性呈先上升后下降的趋势。但对产酶影响变化不大,在0.10%~0.20%范围内CMCase活力都较高。因此选择MgSO4·7H2O添加量0.10%、0.15%、0.20%进行正交试验。
2.1.6 KH2PO4添加量对菌株YZB46产酶影响
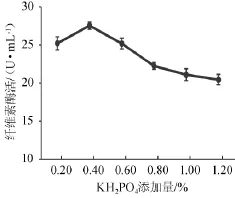
图6 KH2PO4添加量对菌株YZB46产酶的影响Fig.6 Effect of KH2PO4addition on CMCase of strain YZB46
由图6可知,随着KH2PO4添加量的上升,酶活性呈先上升后下降的趋势。KH2PO4在添加量为0.4%的时候酶活力最高,因此选择KH2PO4添加量0.2%、0.4%、0.6%进行正交试验。
2.1.7 培养基组分优化正交试验
在单因素试验基础上,采用正交试验L9(34)对菌株进行产酶测定,试验结果与分析见表3,方差分析见表4。

表3 培养基组分优化正交试验结果与分析Table 3 Results and analysis of orthogonal tests for medium formula optimization
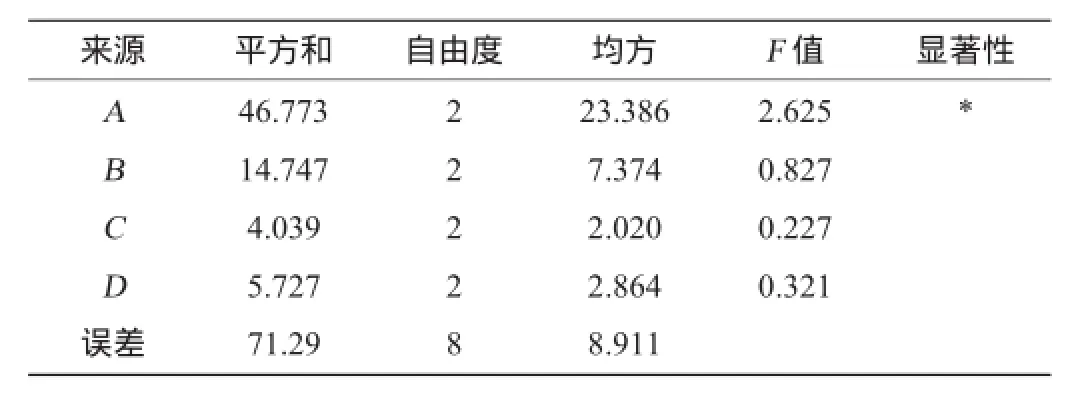
表4 培养基组分优化正交试验结果方差分析Table 4 Variance analysis of orthogonal tests results for medium formula optimization
由表3、表4可知,培养基成分中,各因素对纤维素酶活的影响大小顺序为麸皮>黄豆粉>KH2PO4>MgSO4,麸皮对酶活有显著影响,从极差分析得出,最佳培养基组分组合为A2B2C1D2,即麸皮1.5%,黄豆粉0.6%,MgSO40.1%,KH2PO40.4%,该组合并未在正交表中,因此需将此次组合和试验中最大酶活的组合A2B3C1D2比较,结果见表5。

表5 不同组合发酵结果比较Table 5 Fermentation results comparison of different combinations
由表4可知,通过极差分析得到的组合A2B2C1D2的发酵产纤维素酶活(35.25 U/mL)优于正交试验设计的组合A2B3C1D2(33.64 U/mL)。
2.2 发酵条件优化
2.2.1 不同初始pH对菌株YZB46产酶影响
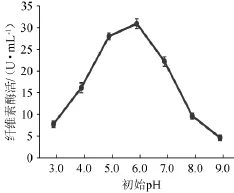
图7 初始pH对菌株YZB46产酶的影响Fig.7 Effects of initial pH on CMCase of YZB46
由图7可知,随着初始pH值的上升,酶活性呈先上升后下降的趋势。在初始pH 6.0酶活达最高,而碱性条件下对产酶有较大的影响,呈急剧下降趋势,说明弱酸性条件下有利于产酶。因此选择初始pH 5.0、6.0、7.0进行正交试验。
2.2.2 不同发酵温度对菌株YZB46产酶影响
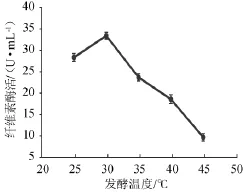
图8 温度对菌株YZB46产酶的影响Fig.8 Effects of temperature on CMCase of strain YZB46
由图8可知,随着发酵温度的升高,酶活力呈先上升后下降趋势,在30℃时达到最高,说明高温不利于菌株产酶。因此选择25℃、30℃、35℃进行正交试验。
2.2.3 不同发酵时间对菌株YZB46产酶影响
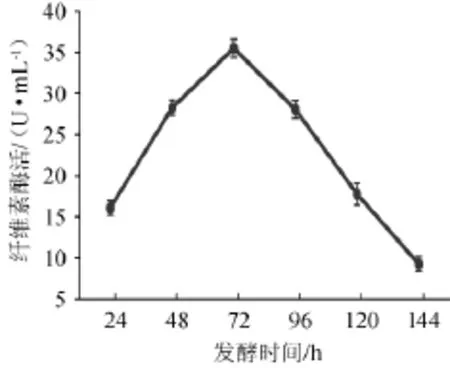
图9 发酵时间对菌株YZB46产酶的影响Fig.9 Effects of fermentation time on CMCase of strain YZB46
由图9可知,在24~144 h内,前期菌体生长,产酶量少,呈逐步升高趋势,在72 h时达到产酶最高,72 h后产酶逐步下降,原因可能是营养物减少,有害代谢物增多,影响菌株的生理活性,因此选择发酵时间48 h、72 h、96 h进行正交试验。
2.2.4 不同接种量对菌株YZB46产酶影响
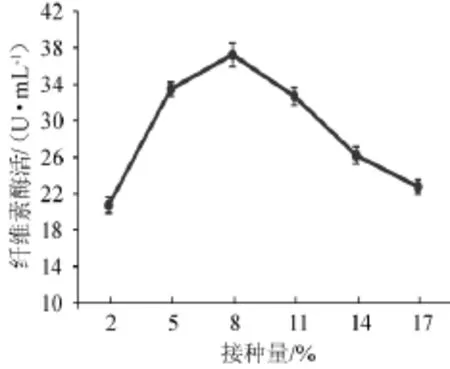
图10 接种量对菌株YZB46产酶的影响Fig.10 Effects of inoculum on CMCase of strain YZB46
由图10可知,随着接种量增加,酶活力逐步升高,接种量为8%时酶活力最高,继续增加接种量,酶活开始下降,接种量过高导致溶氧不足,不利于菌株产酶,因此选择接种量5%、8%、11%进行正交试验。
2.2.8 发酵条件优化正交试验
在单因素试验基础上,设计初始pH、发酵温度、发酵时间、接种量的4因素3水平正交试验,试验结果与分析见表6,方差分析见表7。
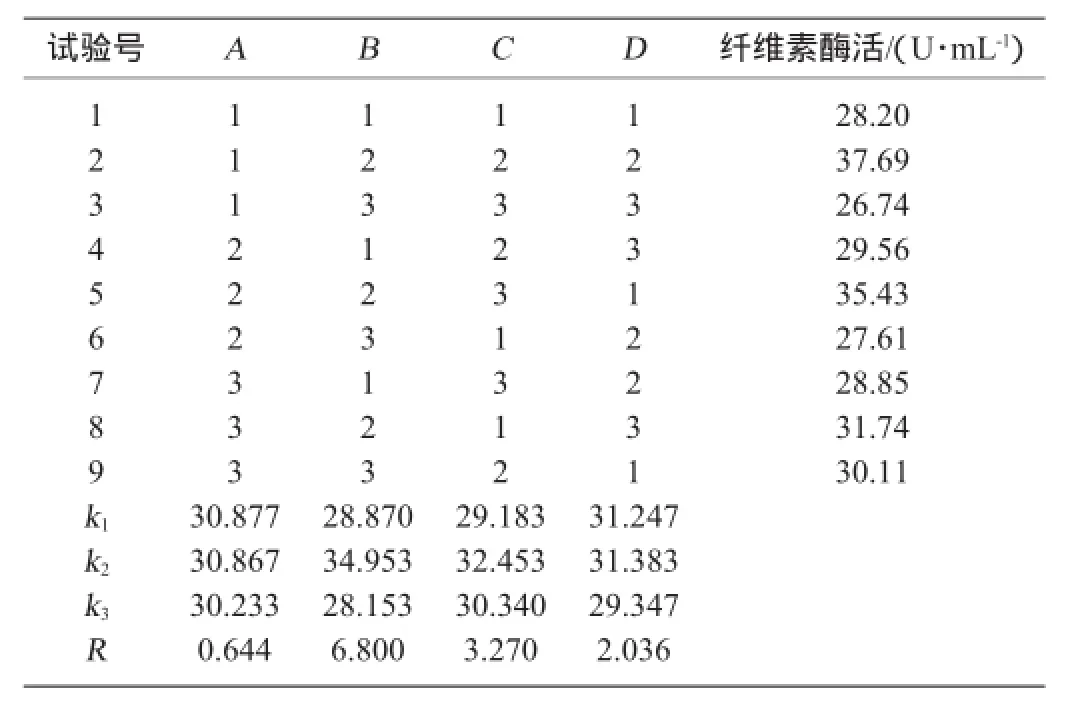
表6 发酵条件优化正交试验结果与分析Table 6 Results and analysis of orthogonal tests for fermentation conditions optimization
由表6、表7可知,发酵条件各因素对YZB46产纤维素酶的影响大小为:发酵温度>发酵时间>接种量>初始pH,其中温度对酶活有显著影响,得到最优组合为A1B2C2D2,即初始pH5.0,温度30℃,发酵72 h,接种量为8%,此组合在正交表中,酶活为37.69 U/mL。
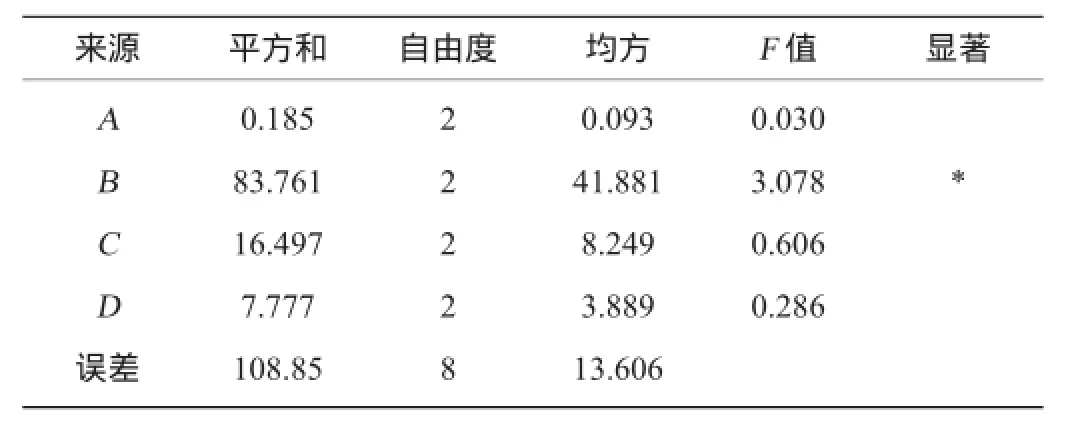
表7 发酵条件优化正交试验结果方差分析Table 7 Variance analysis of orthogonal test results for fermentation conditions optimization
在最佳发酵培养基组分和发酵条件下进行验证试验,重复3次试验,结果见表8。
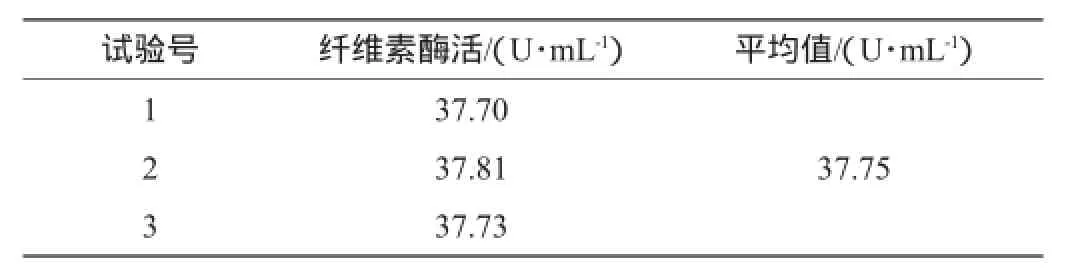
表8 最优组合实验验证结果Table 8 Verification results of the optimal combination
由表8可知,经过发酵培养基组分和发酵条件的优化,菌株YZB46的产酶活力达37.75 U/mL,在发酵优化后产酶有所提升,从原来的17.08 U/mL提升至37.75 U/mL,是优化前的2.21倍。
3 结论
本研究通过单因素和正交试验优化了纤维素酶产生菌YZB46的产酶能力,菌株YZB46的最佳发酵培养基碳源为1.5%麸皮,氮源为0.6%黄豆粉,无机盐为0.1%MgSO4和0.4%KH2PO4;最佳发酵条件为接种量8%,发酵液初始pH 5.0,发酵温度30℃,发酵时间72 h,在此条件下菌株YZB46的产酶活力达37.75 U/mL。菌株YZB46产酶条件属弱酸性、低温产酶[11],发酵时间相对较短,低温短时使酶在工业应用上具有一定优势。关于桑园土壤来源的芽孢杆菌产酶研究鲜见报道,桑园中桑树常因剪枝而产生大量桑枝条,而初步研究菌株YZB46的纤维素酶活力对桑枝粉的降解能力较低,这有待进一步探索[12]。获得高产酶的方法可以通过菌种筛选、培养条件优化、基因改造等途径,自然选育菌种稳定性好,因此,本研究可在发酵条件优化基础上,进一步探究环境因素的影响,通过多菌混合发酵[13]、诱变[14-16]或分子改造等方法开发菌株YZB46的产酶潜能。
[1]LIMAYEM A,RICKE S C.Lignocellulosic biomass for bioethanol production:current perspectives,potential issues and future prospects[J]. Prog Energ Combust,2012,38:449-467.
[2]YANG J K,ZHANG J J,YU H Y,et al.Community composition andcellulase activity of cellulolytic bacteria from forest soils planted with broad-leaved deciduous and evergreen trees[J].Appl Microbiol Biot, 2014,98:1449-1458.
[3]SINGH A,PANT D,KORRES N E,et al.Key issues in life cycle assessment of ethanol production from lignocellulosic biomass:challenges and perspectives[J].Bioresource Technol,2009,101(13):5003-5012.
[4]刘延娟,刘守成,李娟.响应面法优化产纤维素酶菌株的产酶条件研究[J].绿色科技,2016(4):187-190.
[5]KUHAD R C,GUPTA R,SINGH A.Microbial cellulases and their industrial applications[J].Enzyme Res,2011,2:1-10.
[6]MAKI M,LEUNG K T,QIN W S.The prospects of cellulase-producing bacteria for the bioconversion of lignocellulosic biomass[J].Int J Biol Sci,2009,5(5):500-516.
[7]张雪辉,唐蕊,孟春燕.纤维素酶产生菌ZJW-11培养条件的优化[J].江苏农业科学,2014,42(12):399-401.
[8]陆晨.高产纤维素酶菌株的筛选及产酶条件的优化[D].长沙:中南林业科技大学,2012.
[9]陈士成,曲音波,张岩,等.产中性纤维素酶芽孢杆菌Y106产酶条件优化[J].应用与环境生物学报,2000,6(5):457-461.
[10]李争明.纤维素酶产生菌的筛选、发酵产酶条件优化及酶学特性研究[D].武汉:湖北工业大学,2014.
[11]李强,季更生,古绪顶,等.从桑树根际土壤分离的产低温碱性纤维素酶菌株BJ-XH及酶的特性研究[J].蚕业科学,2012,38(6):1086-1092.
[12]王娜,张靖峰,卜杰申.不同预处理对桑树枝条酶解效果的影响研究[J].桑蚕通报,2015,46(1):23-27.
[13]白春燕,魏如腾,侯红萍.多菌混合发酵产纤维素酶及生物法预处理秸秆的研究[J].中国酿造,2016,35(1):57-61.
[14]余祖华,丁轲,候奎,等.产纤维素酶地衣芽孢杆菌的诱变选育及其产酶条件优化[J].中国畜牧兽医,2016,43(4):1006-1011.
[15]刘春芬,贺稚非.纤维素酶高产菌株的诱变选育[J].中国酿造,2008,27(5):29-32.
[16]吕志伟,王瑾,张文会.地衣芽孢杆菌LCB-8的紫外诱变及优良菌株的选育[J].安徽农业科学,2011,39(32):19995-19996.
Fermentation conditions of cellulase-producing strain YZB46
LUO Fengfeng,MO Yaling,LIU Xintai,LI Xuefeng,QIN Yue*
(College of Chemical and Biological Engineering,Hechi University,Yizhou 546300,China)
In order to improve cellulase-producing capacity of strain YZB46,on the basis of single factor experiment,the optimal medium formula and fermentation conditions were optimized through orthogonal tests.The results showed that the optimal medium formula were as follows:carbon source was wheat bran 1.5%,nitrogen source was soybean meal 0.6%,organic salt was MgSO40.1%and KH2PO40.4%,and the optimal fermentation conditions were inoculum 8%,fermentation broth initial pH 5.0,and fermentation temperature 30℃,time 72 h.Under the above conditions,the activity of cellulase reached 37.75 U/ml,which was 2.21 times higher than the control.
cellulase;orthogonal test;enzyme activity;optimization
Q939.9
0254-5071(2016)11-0117-06
10.11882/j.issn.0254-5071.2016.11.024
2016-05-01
广西高校科学技术研究项目(LX2014334);河池学院广西高校微生物及植物资源开发利用重点实验室开放课题(2015HL008);
河池学院重点科研课题(XJ2016ZD002)
罗奉奉(1986-),女,讲师,硕士,研究方向为资源环境微生物。
*通讯作者:覃玥(1970-),女,教授,硕士,研究方向为微生物与植物病害。

