液态发酵生产水溶性红曲黄色素的条件优化
李瑞杰,谢玉梅,何思琴,王磊,陈莎,高梦祥,李利*
(长江大学生命科学学院,湖北荆州430025)
液态发酵生产水溶性红曲黄色素的条件优化
李瑞杰,谢玉梅,何思琴,王磊,陈莎,高梦祥,李利*
(长江大学生命科学学院,湖北荆州430025)
以红色红曲菌(Monascus ruber)M-7为实验菌株,以色价和色调为评价指标,对液态发酵生产水溶性红色红曲黄色素的条件进行了研究。结果表明,培养基pH值为3~4时,红色红曲菌M-7能合成大量的水溶性红曲黄色素,发酵液呈鲜艳的黄色色调;培养基最优碳源为2%蔗糖,最优氮源为0.2%硫酸铵;水溶性红色红曲黄色素的色价和色调值随着培养时间的延长先升后降,在第8天时达到最高,色价为5.56 U/mL,OD400nm/OD510nm为10.29,OD400nm/OD470nm为3.93。
红色红曲菌;水溶性红曲黄色素;液态发酵
随着人们健康意识的提高,天然食用色素越来越受到国内外消费者的青睐。红曲色素(Monascuspigments)是我国近年来增长速度最快的天然食用色素,是红色红曲菌(Monascus ruber)发酵产生的次生代谢产物,包括黄色、橙色和红色三类色素组分,在我国及东南亚地区已有超过1000年的应用历史,目前在欧美等国家的肉制品(如火腿肠)中也得到了很好的应用[1-2]。
黄色素是重要的食用色素,约占市场需求量的60%以上[3]。目前,市售的食用黄色素产品以植物提取为主(如姜黄素、栀子黄等[4]),因而易受季节、气候、产地等因素的影响。相比之下,采用微生物发酵法进行天然食用色素的生产,不受季节限制、原料转化率高、成本低,是目前世界食品色素添加剂的发展趋势。目前,市场上应用广泛的红曲色素以红色素为主,而红曲黄色素的生产起步较晚,目前生产厂家也很少,产品并未大规模上市,而且存在色价和色调都不高等问题[3],因此,红曲黄色素的开发研究具有广阔的前景,可产生显著的经济效益。
有研究表明,红曲菌所产生的红曲色素包括醇溶性组分和水溶性组分[1]。目前的红曲色素产品一般以醇溶性组分为主,水溶性较差,应用范围主要限制于油性食品(如火腿肠、香肠等)中。近年来,通过菌种的选育和发酵培养基的优化来获得高色价和色调值的红曲黄色素已取得一定成果[5-12],但也均以生产醇溶性红曲黄色素为主。为丰富红曲黄色素产品的种类,促进其在饮料等非油性食品中的应用,本研究以红曲色素高产菌株—红色红曲菌M-7为实验材料,通过液体发酵法研究了水溶性红曲黄色素的生产条件,以探索一种安全、高效、低成本的水溶性红曲黄色素的生产方法,为其工业规模化生产提供基础和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
红色红曲菌(Monascus ruber)M-7:由华中农业大学陈福生教授惠赠,该菌株为红曲色素高产菌株。
1.1.2 培养基
红曲菌孢子培养基(查氏酵母琼脂(Czapek yeast exatract agar,CYA)):NaNO33 g,K2HPO41 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,蔗糖30 g,酵母膏5 g,蒸馏水1 L,琼脂20 g,pH 5.5。
液态发酵种子制备培养基:在1 L蒸馏水中加入去皮马铃薯200 g,煮沸30 min,用4层纱布过滤,滤液中加葡萄糖20 g,定容至1 L。
水溶性红曲黄色素液态发酵培养基[13]:谷氨酸钠5.04 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 1 g,ZnSO4·7H2O 0.01 g,MnSO4·H2O 0.003 g,葡萄糖20 g,0.1 mol/L柠檬酸-磷酸盐缓冲液(pH 3、4、5、6、7或8)0.5 L,蒸馏水0.5 L。
以上培养基灭菌条件为:121℃,20 min。其中水溶性红曲黄色素液态发酵培养基中的葡萄糖单独灭菌,灭菌条件为115℃,15 min。
1.2 仪器与设备
TE124S电子分析天平、PB-10 pH计:德国赛多利斯公司;Mini Spin Plus离心机:德国Eppendorf公司;HVE-50高温灭菌锅:日本Hirayama公司;U-1900双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;SPX-100B-Z生化培养箱:上海博讯医疗生物仪器股份有限公司;叠加式IS-RDS3摇床:美国Crystal公司;GZX-6000电热恒温鼓风干燥箱:上海新苗医疗器械制造有限公司。
1.3 实验方法
1.3.1 水溶性红曲黄色素的发酵
(1)孢子悬浮液的制备:将保存在4℃的菌种接种到CYA斜面上,28℃培养10 d,加入5 mL无菌水洗下孢子,用双层擦镜纸过滤除去菌丝,玻璃珠将孢子振荡打散,血球计数板计数。
(2)种子的培养:250 mL三角瓶中装液态发酵种子制备培养基50 mL,接种孢子悬浮液,使孢子的终浓度为103个/mL,28℃、220 r/min振荡培养40~44 h,作为种子液。
(3)液态发酵:250 mL三角瓶装水溶性红曲黄色素液态发酵培养基100 mL,接入上述种子液10 mL,28℃、220 r/min振荡培养2~9 d。
1.3.2 生物量的测定
采取干质量法,即发酵完成后,发酵液用布氏漏斗抽滤得到菌丝体,用3倍体积的蒸馏水洗涤菌丝体,于60℃中干燥至质量恒定,称质量。
1.3.3 色价的测定
发酵液用布氏漏斗抽滤得到滤液,12 000 r/min离心3 min,稀释一定倍数,于200~600 nm进行全波段扫描,分别取波长400 nm、470 nm和510 nm处吸光度值计算黄色素、橙色素和红色素的色价。色价计算公式:

1.3.4 色调的测定
本实验色调定义为黄色素/红色素=OD400nm/OD510nm;黄色素/橙色素=OD400nm/OD470nm。
2 结果与分析
2.1 pH对红色红曲菌产水溶性黄色素的影响
据报道,pH对红曲色素的产生有一定影响[13-15]。一般认为,酸性条件下主要产物为红曲黄色素和红曲橙色素;中性或碱性条件下主要产物为红曲红色素。为了实现红曲黄色素的生产,首先利用柠檬酸-磷酸盐缓冲液制备不同pH的发酵培养基,研究pH对红曲菌液态发酵产色素的影响,结果见图1。

图1 pH对水溶性红曲黄色素色调的影响Fig.1 Effect of pH on color tone of water soluble yellow Monascuspigment
由图1可知,发酵培养基的pH对色素的种类影响很大,在pH3和pH4时,红曲菌M-7产生较多的水溶性黄色素,发酵液呈鲜艳的黄色色调,OD400nm/OD510nm分别为4.50和3.76,OD400nm/OD470nm分别为2.48和2.40,黄色素的色价分别为1.04U/mL和0.95U/mL;而当pH为5、6、7和8时,红曲菌M-7产生较多的水溶性红色素,发酵液呈明显的红色色调,OD400nm/OD510nm依次为1.66、1.07、0.69和0.68,OD400nm/OD470nm依次为1.44、1.00、0.74和0.73。该结果中pH对红曲色素影响的规律与文献报道基本一致[13-15]。因此,将发酵培养基的pH值控制在3~4,可实现水溶性红曲黄色素的发酵生产。在后续实验中,均将发酵培养基的pH值控制在3~4。
2.2 碳源种类对红色红曲菌产水溶性黄色素的影响
分别以2%的可溶性淀粉、玉米粉、大米粉、蔗糖、马铃薯淀粉、葡萄糖为碳源,0.5%谷氨酸钠为氮源,初始pH值为3.0,发酵2 d后,考察碳源种类对发酵液中水溶性红曲黄色素色价和色调的影响,结果见图2。
由图2A可知,以可溶性淀粉、蔗糖和马铃薯淀粉为碳源时水溶性红曲黄色素的产量较高,色价均>80U/g菌体干质量;由图2B可知,蔗糖为碳源时的色调值最高,OD400nm/OD510nm、OD400nm/OD470nm分别是4.75、2.35,表明此时产生的水溶性红曲黄色素所占比例最大,纯度较高。因此,确定蔗糖为发酵培养基的最佳碳源。

图2 碳源种类对水溶性红曲黄色素色价(A)及色调(B)的影响Fig.2 Effect of carbon sources on color value(A)and tone(B)of water soluble yellowMonascuspigment
2.3 碳源含量对红色红曲菌产水溶性黄色素的影响

图3 葡萄糖含量对水溶性红曲黄色素色价(A)及色调(B)的影响Fig.3 Effect of glucose concentration on color value(A)and tone(B)of water soluble yellowMonascuspigment
分别以1%、2%、3%、4%、5%的蔗糖为碳源,0.5%的谷氨酸钠为氮源,初始pH值为3.0,发酵2 d后,考察碳源浓度对发酵液的水溶性红曲黄色素色价和色调的影响,结果见图3。
由图3可知,当蔗糖含量>3%时,对水溶性红曲黄色素的产生有一定抑制作用,类似结果在醇溶性红曲黄色素发酵过程中也有报道[7],可能是过高的渗透压对水溶性红曲黄色素的产生有不利影响。综合色价和色调值来看,产水溶性红曲黄色素最佳的葡萄糖含量为2%,此时色价为90.03U/g菌体干质量,OD400nm/OD470nm为2.35,OD400nm/ OD510nm为4.59。
2.4 氮源种类对红曲菌产水溶性黄色素的影响
分别以0.5%的酵母膏、蛋白胨、谷氨酸钠、硝酸钾、硫酸铵、硝酸铵为氮源,2%的蔗糖为碳源,初始pH值为3.0,发酵时间2 d后,考察氮源种类对发酵液中水溶性黄色素色价和色调的影响,结果见图4。
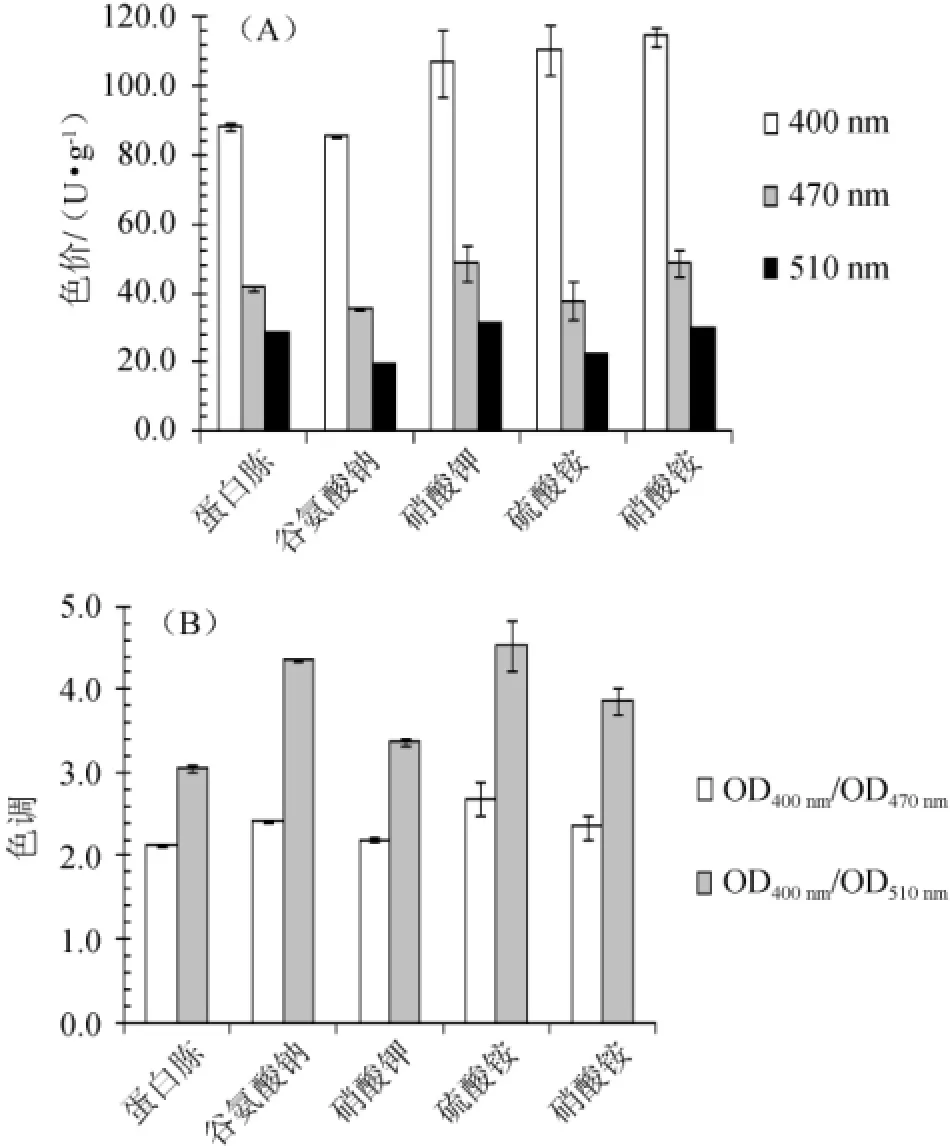
图4 氮源种类对水溶性红曲黄色素色价(A)及色调(B)的影响Fig.4 Effect of nitrogen source on color value(A)and tone(B)of water soluble yellowMonascuspigment
由图4可知,6种氮源中,酵母膏实验组2 d后未观察到明显的水溶性红曲黄色素的产生,而其他氮源实验组均有大量水溶性红曲黄色素产生。与有机氮源酵母膏、蛋白胨、谷氨酸钠相比,无机氮源硝酸钾、硫酸铵、硝酸钾更有利于水溶性黄色素的产生,其中以硫酸铵为氮源时,黄色素的色价(110.69 U/g)和色调(OD400nm/OD470nm为2.69,OD400nm/OD510nm为4.54)均较高,故选择硫酸铵为较优氮源。
2.5 氮源含量对红曲菌产水溶性黄色素的影响
分别以0.2%、0.5%、0.8%、1.1%、1.4%的硫酸铵为氮源,2%的蔗糖为碳源,初始pH值为3.0,发酵时间2 d后,考察氮源浓度对发酵液中水溶性红曲黄色素色价和色调的影响,结果见图5。
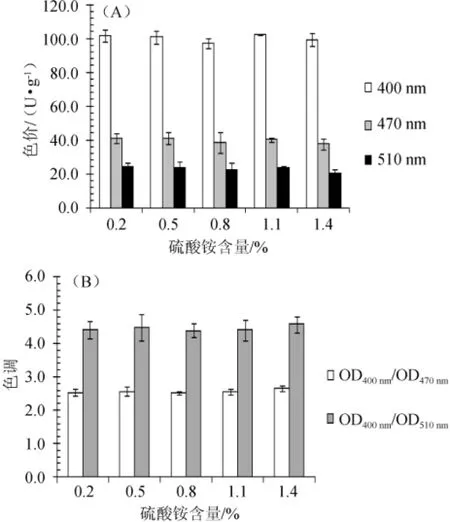
图5 硫酸铵含量对水溶性红曲黄色素色价(A)及色调(B)的影响Fig.5 Effect of ammonium sulphate concentration on color value(A)and tone(B)of water soluble yellow Monascuspigment
由图5可知,在所考察的浓度范围内,硫酸铵对水溶性红曲黄色素的色价和色调影响不明显,从经济节约的角度考虑,较优硫酸铵含量为0.2%。
2.6 发酵时间对红曲菌产水溶性黄色素的影响
由于黄色素是红曲菌的次级代谢产物,主要在生长后期大量产生,因此,在上述最佳碳、氮源种类和浓度的条件下,以培养时间为单因素,从发酵培养的第2天开始,每隔24 h测定发酵液的pH、色价和色调值,实验结果见图6。
由图6可知,发酵过程中,培养基的pH是动态变化的,第2天到第5天缓慢下降,之后又呈上升趋势,pH变化范围在2.85~3.10范围内,满足红色红曲菌M-7产水溶性黄色素的基本要求。在水溶性红曲黄色素的产量方面,前4天色价较低,从第5天开始,色价开始大幅提升,第8天达到最高值,为5.56 U/mL,第9天开始下降,可能是黄色素开始向红色素转化。

图6 发酵时间对水溶性红曲黄色素色价(A)及色调(B)的影响Fig.6 Effect of fermentation time on color value(A)and tone(B)of water soluble yellowMonascuspigment
在水溶性红曲黄色素的纯度方面,其变化趋势基本与黄色素产量相似,从OD400nm/OD470nm和OD400nm/OD510nm的大小来看,5 d后黄色素的比例显著提高,其中OD400nm/OD510nm在第8天达最大,为10.29,之后呈下降趋势,第9天为9.74;而OD400nm/OD470nm一直保持缓慢上升趋势,第8天为3.93,第9天为4.08。综合考虑红曲黄素的产量和纯度,最佳发酵时间为8 d。
3 结论
本实验以红色红曲菌M-7为实验菌株,以色价和色调为评价指标,对液态发酵生产水溶性红曲黄色素的条件进行了研究。
结果表明,将发酵培养基的pH控制在3~4,可实现高纯度的水溶性红曲黄色素的发酵生产,发酵产物呈鲜艳的黄色色调。
碳源对水溶性红曲黄色素的发酵有显著影响,以2%的蔗糖最佳,此时水溶性红曲黄色素的色价和色调值在所考察的碳源中均最高。氮源对水溶性红曲黄色素的发酵有显著影响,以0.2%的硫酸铵最佳,此时水溶性红曲黄色素的色价和色调值在所考察的氮源中均最高。
水溶性红曲黄色素的色价和色调值随着培养时间的延长先升后降,在第8天时达到最高,色价为5.56 U/mL,OD400nm/OD510nm为10.29,OD400nm/OD470nm为3.93。
[1]FENG Y,SHAO Y,CHEN F.Monascuspigments[J].Appl MicrobiolBiotechnol,2012,96:1421-1440.
[2]梁彬霞,白卫东,杨晓暾,等.红曲色素的功能特性研究进展[J].中国酿造,2012,31(3):21-24.
[3]周波,吴吉林,朱明军,等.基于代谢途径提高红曲黄色素生成及控制橘霉素产生的研究[J].食品科技,2011,36(2):242-248.
[4]周波,吴吉林,朱明军,等.微生物黄色素的研究进展[J].微生物学通报,2010,37(9):1362-1368.
[5]周波,杨玲,崔思颖,等.响应面法优化培养基提高红曲黄色素的色调[J].华南理工大学学报:自然科学版,2008,36(11):91-95.
[6]周波,王菊芳,吴振强,等.高产红曲黄色素菌株的选育[J].微生物学通报,2008,35(12):1909-1914.
[7]毛鹏.红曲黄色素液态发酵技术研究[D].无锡:江南大学,2015.
[8]周波,浦跃武,朱明军,等.氮源对红曲霉突变株产黄色素的影响[J].现代食品科技,2008,24(2):123-127.
[9]XIONG X,ZHANG X,WU Z,et al.Accumulation of yellowMonascus pigments by extractive fermentation in nonionic surfactant micelle aqueous solution[J].Appl Microbiol Biotechnol,2015,99(3):1173-1180.
[10]JIRASATID S,NOPHARATANA M,KITSUBUN P,et al.Statistical optimization for Monacolin K and yellow pigment production and citrinin reduction byMonascus purpureusin solid-state fermentation[J].J Microbiol Biotechn,2013,23(3):364-374.
[11]YONGSMITH B,THONGPRADIS P,KLINSUPA W,et al.Fermentation and quality of yellow pigments from golden brown rice solid culture byaselectedMonascusmutant[J].Appl Microbiol Biotechn,2013, 97(20):8895-8902.
[12]KLINAUPA W,PHANSIRI S,THONGPRADIS P,et al.Enhancement of yellow pigment production by intraspecific protoplast fusion of Monascusspp.yellow mutant(ade(-))and white mutant(prototroph)[J]. J Biotechnol,2016,217:62-71.
[13]KANG B,ZHANG X,WU Z,et al.Production of citrinin-freeMonascus pigments bysubmerged culture at low pH[J].Enzyme Microb Technol, 2014,55:50-57.
[14]OROZCO S F B,KILIKIAN B V.Effect of pH on citrinin and red pigments production byMonascus purpureusCCT3802[J].World J Microbiol Biotechnol,2008,24:263-268.
[15]CHEN M H,JOHNS M R.Effect of pH and nitrogen source on pigment production byMonascus purpureus[J].Appl Microbiol Biot,1993,40 (1):132-138.
Optimization of liquid-state fermentation conditions for the production of water soluble yellowMonascuspigment
LI Ruijie,XIE Yumei,HE Siqin,WANG Lei,CHEN Suo,GAO Mengxiang,LI Li*
(College of Life Science,Yangtze University,Jingzhou 430025,China)
UsingMonascus ruberM-7 as experimental strain,color value and color tone as evaluation index,the production of water soluble yellow Monascuspigment by liquid state fermentation was investigated.The results showed that when the fermentation medium pH was 3-4,a large portion of water soluble yellowMonascuspigment was synthesized byM.ruberM-7,and the fermentation broths was bright yellow.The optimal carbon source of the medium was sucrose 2%,and the optimal nitrogen source was ammonium sulfate 0.2%,respectively.The color value and the color tone of water soluble yellowMonascuspigment increased in the early stage,decreased in the late stage,and the maximum points were on the 8thday.After 8 d cultivation,the production of water soluble yellowMonascuspigment was 5.56 U/ml,OD400nm/OD510nmwas 10.29 and OD400nm/OD470nmwas 3.93.
Monascus ruber;water soluble yellowMonascuspigment;liquid-state fermentation
TS264.4
0254-5071(2016)11-0073-05
10.11882/j.issn.0254-5071.2016.11.015
2016-04-19
国家自然科学基金资助项目(31501453;31371829);长江大学大学生创新创业训练计划项目(20150089)
李瑞杰(1994-),女,本科生,研究方向为食品质量与安全。
*通讯作者:李利(1983-),女,讲师,博士,研究方向为食品微生物学。

