高糖腹透液通过神经酰胺经 JNK/SAPK通路介导腹膜间皮细胞凋亡
汤天凤,王斌,蒋春明,张庆燕,孙琤,张苗*
(1南京大学附属鼓楼医院肾内科,2南京大学附属鼓楼医院神经外科,南京 210008)
高糖腹透液通过神经酰胺经JNK/SAPK通路介导腹膜间皮细胞凋亡
汤天凤1,王斌2,蒋春明1,张庆燕1,孙琤1,张苗1*
(1南京大学附属鼓楼医院肾内科,2南京大学附属鼓楼医院神经外科,南京 210008)
目的 观察葡萄糖腹膜透析液(peritoneal dialysis solution,PDS)对人腹膜间皮细胞(peritoneal mesothelium cells,PMCs)凋亡的影响,探讨神经酰胺在高糖PDS诱导的PMCs凋亡中的作用机制。方法 PMCs分别在正常对照、1.5%PDS、4.25%PDS条件下培养,以4.25%甘露醇作为高渗对照。高压液相串联质谱法(LC/MS/MS)检测细胞内神经酰胺的变化,TUNEL检测细胞凋亡,Western blot检测p-JNK、p-c-Jun、Bax、Bcl-2蛋白水平。结果 PDS呈浓度、时间依赖性上调PMCs细胞内神经酰胺,正常对照组、高渗对照组细胞内神经酰胺无明显变化;相比1.5%PDS组,4.25%PDS可诱导PMCs细胞凋亡,促进JNK及其下游c-Jun磷酸化,而酸性鞘磷脂酶抑制剂地昔帕明可显著抑制高糖PDS的此类作用;JNK阻断剂SP600125可明显抑制高糖PDS诱导的JNK和c-Jun活化、进而抑制Bax的上调和Bcl-2的下调。结论 细胞内神经酰胺增加可能经JNK/SAPK通路参与高糖PDS诱导的PMCs凋亡。
葡萄糖腹透液;腹膜间皮细胞;细胞凋亡;神经酰胺;JNK/SAPK
持续性非卧床腹膜透析已作为终末期肾脏疾病的首选治疗方式之一[1],但目前临床上广泛使用的腹膜透析液(peritoneal dialysis solution,PDS)为高渗、高糖、低pH,常造成透析液的生物不相容性,导致腹膜表层间皮细胞损伤,进而引起腹膜纤维化(peritoneal fibrosis,PF)[2],也是最终导致患者腹膜功能衰竭和超滤失败而退出治疗的重要因素之一[3]。腹膜间皮细胞(peritoneal mesothelium cells,PMCs)是构成腹膜最主要的细胞群体,其形态与功能改变亦是发生PF的起始变化。神经酰胺是一种重要的诱导细胞凋亡的脂质第二信使[4,5],我们的前期研究表明,高渗、高糖的PDS诱导的PMCs凋亡也有神经酰胺的参与[6]。c-Jun NH2-末端激酶/应激活化蛋白激酶(C-Jun NH2-terminal kinase/stress activated protein kinase,JNK/SAPK)是有丝分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族成员之一,在转录水平调控凋亡相关基因的差异表达是JNK/SAPK激活后促进细胞凋亡过程中的下游事件。研究表明神经酰胺可以诱导浓度依赖的JNK/SAPK激活,包括 SEK1,SAPK和 c-Jun的顺序激活[7]。在某些细胞应激反应中,细胞因子和应激可通过神经酰胺启动JNK/SAPK信号转导途径从而导致细胞凋亡[8]。本研究旨在进一步探讨神经酰胺经JNK/SAPK通路在高糖PDS诱导腹膜间皮细胞细胞凋亡过程中的具体作用机制,为PF的防治提供新思路。
材料和方法
1 主要试剂
人 PMCs购自美国ATCC公司;DMEM低糖细胞培养液、新生牛血清购自美国GIBCO公司;1.5% PDS、4.25%PDS由广州百特公司赠送;胰蛋白酶购自美国AMRESCO公司;外源性神经酰胺C2-CER购自美国Biomol公司;酸性鞘磷脂酶阻断剂地昔帕明、JNK阻断剂SP600125、甘露醇购自美国Sigma公司;TUNEL试剂盒购自深圳晶美公司;p-JNK、p-c-Jun一抗,辣根过氧化物酶标记的二抗购自美国Santa Cruz公司;GAPDH单克隆抗体购自美国Sigma公司。
2 PMCs的培养及实验分组
PMCs于含10%新生牛血清的 DMEM中,37℃、5%CO2贴壁培养。细胞生长至90%融合时以0.25%胰酶消化,1∶4传代。待细胞60%~70%融合时,无血清培养12h后换成含10%新生牛血清的DMEM,并加入干预药物培养24h。
3 高压液相串联质谱法测定神经酰胺
收集细胞并PBS洗涤3次,220μl PBS重悬,超声破膜,离心,提取上清液(胞质溶胶+细胞器),沉淀物以220μl PBS重悬(细胞膜)。待测样品与1ml氯仿/甲醇(2∶1,v/v)混匀,萃取30 min,加入330μl蒸馏水混匀后离心,收集下层相并干燥,-20°C保存待测。
4 TUNEL法
用含10%胎牛血清的DMEM将PMCs重悬稀释成5×104/ml,接种于6孔板(板内置入经无菌处理的盖玻片),待细胞60%-70%融合时,无血清培养12h后分组干预24h,按说明书操作。光学显微镜下进行观察并拍照,细胞核内呈现棕黄色颗粒的为凋亡细胞。
5 Western blot
收集细胞加入100μl细胞裂解液提取总蛋白。Bradford法检测蛋白浓度。取30μg蛋白样品SDSPAGE电泳2h分离至硝酸纤维素膜上,置5%脱脂奶室温封闭2h,p-JNK、p-c-Jun、Bax、Bcl-2一抗1:1000,4℃过夜,辣根过氧化物酶标记二抗1:2000室温1h,ECL显色成像。凝胶分析系统定量,比较目的条带吸光度值(A值)。
6 统计学分析
结 果
1 高糖腹透液促进腹膜间皮细胞神经酰胺生成
为观察PDS对PMCs内神经酰胺的影响,应用高压液相串联质谱法检测了PDS与PMCs神经酰胺生成的浓度和时间效应关系。结果显示:与1.5% PDS相比,4.25%PDSz在培养PMCs 8h、16h、24h和48h均能引起细胞内神经酰胺升高,以培养24h最明显,而高渗(4.25%甘露醇)对细胞内神经酰胺生成无明显影响(图1)。
2 高糖腹透液通过神经酰胺诱导PMCs凋亡
为进一步证明PDS是否通过神经酰胺引起PMCs凋亡,应用TUNEL法染色检测了酸性鞘磷脂酶阻断剂地昔帕明对PDS诱导PMCs细胞凋亡的影响。结果显示,4.25%PDS培养PMCs 24h后,细胞核内呈现棕黄色颗粒的凋亡细胞明显增多(图2B),2μmol/L地昔帕明可明显抑制4.25%PDS诱导的PMCs细胞凋亡(图2C);高渗对照组对细胞凋亡无明显影响(图2D)
3 高糖腹透液通过神经酰胺激活促进PMCs内JNK和c-Jun磷酸化
为了明确高糖PDS是否通过神经酰胺激活JNK/SAPK通路诱导PMCs凋亡,观察了高糖PDS对PMCs内JNK和c-Jun的影响及酸性鞘磷脂酶阻断剂地昔帕明对这种影响的作用。Western blot检测显示,用4.25%PDS处理PMCs 12h后,PMCs内JNK及其下游信号c-Jun磷酸化水平明显上调,地昔帕明对这种上调具有显著的抑制作用(图3)。

图1 高糖腹透液对腹膜间皮细胞神经酰胺生成影响的浓度/时间效应关系Fig.1 The concentration and time-dependent effect of high glucose PDS on the production of intracellular ceramide in PMCs

图2 神经酰胺生成阻断剂对高糖腹透液诱导 PMCs细胞凋亡的影响。A,空白对照;B,4.25%PDS处理细胞;C,4. 25%PDS+2μmol/L地昔帕明处理细胞;D,4.25%甘露醇处理细胞;标尺,50μmFig.2 The effect of acidic sphingomyelinase inhibitor desipramine on PMC apoptosis induced by high glucose PDS.A,normal PMCs;B,4.25%PDS treatment;C,4.25%PDS+2μmol/L desipramine;D,4.25%mannitol;scale bar,50μm

图3 神经酰胺生成阻断剂对高糖腹透液诱导 PMCs内 JNK和 c-Jun磷酸化的影响。A,Western blot检测;B,Western blot检测的统计学分析;**,与空白对照组比较,P<0.01;#,与4.25%PDS干预组比较,0.01<P<0.05Fig.3 The effect of acidic sphingomyelinase inhibitor desipramine on the phosphorylation of p-JNK and p-c-Jun in PMCs induced by high glucose PDS. A,Western blot detection;B,statistical analysis of Western blot detection results.**,P<0.01,compared with the normal control group;#,0.01<P<0.05,compared with the 4.25%PDS group
4 高糖腹透液通过PMCs内JNK/SAPK通路上调Bax和下调Bcl-2
为进一步明确高糖PDS是否通过JNK/SAPK通路影响PMCs内凋亡调控基因,应用Western blot检测了高糖PDS对PMCs内凋亡调控蛋白的影响及JNK阻断剂SP600125对这种影响的作用。PMCs在4.25%PDS作用24h后,p-JNK和p-c-Jun水平上调的同时,促凋亡蛋白Bax水平上调,而抗凋亡蛋白Bcl-2水平显著下调。25μmol/L SP600125可明显阻断高糖PDS的上述作用(图4)
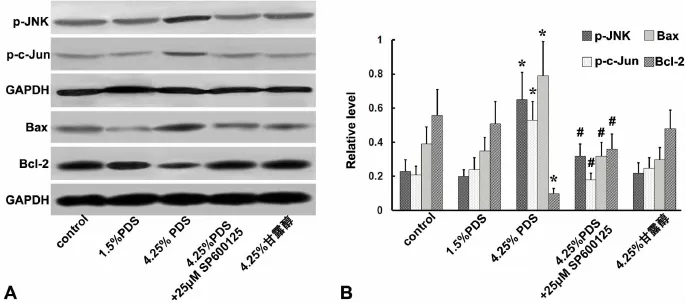
图4 JNK阻断剂对高糖腹透液影响 PMCs内Bax和 Bcl-2的阻断作用。A,Western blot检测;B,Western blot检测的统计学分析;*,与空白对照组比较,0.01<P<0.05;#,与4.25%PDS干预组比较,0.01<P<0.05Fig.4 JNK blocker blocked the effect of high glucose PDS on the expression of Bax and Bcl-2 in PMCs.A,Western blot detection;B,statistical analysis of Western blot detection results;*,0.01<P<0.05,compared with the normal control group;#,0.01<P<0.05,compared with the 4.25% PDS group
讨 论
PMCs是构成腹膜最主要的细胞群体,在保持腹膜结构完整性和功能有效性中起重要作用。我们[9,10]和国外[11]的研究发现:大鼠腹腔内灌注高糖PDS,可导致间皮细胞凋亡,间皮下基质增厚,腹膜新生血管增加、腹膜通透性增高,从而导致腹膜转运功能障碍。我们前期应用流式细胞、末端标化(TUNEL)以及端粒检测技术发现高糖PDS在体外可诱导PMCs的凋亡和衰老[12,13],但高糖PDS诱导PMCs凋亡的具体机制有待进一步研究。神经酰胺是一种重要的脂质第二信使,可通过启动不同的信号转导途径参与细胞生长、增殖、分化、凋亡及应激反应。诱导细胞凋亡是神经酰胺的主要生物学效应,这已在对多种细胞系的研究中得到证实[14,15]。鞘磷脂-神经酰胺循环途径是神经酰胺的主要生化来源之一,增多的神经酰胺通过激活不同蛋白激酶和蛋白磷酸酶(如JNK,PKC,Rac,KSR,Raf,PP2A,PP1)启动级联信号通路,从而引起细胞凋亡[14]。本研究发现,PDS可呈浓度、时间依赖性诱导PMCs细胞内神经酰胺增加,本实验以相同浓度的甘露醇作为高渗对照,不能引起相应的神经酰胺增加,提示高糖PDS对PMCs的作用与渗透压无关。酸性鞘磷脂酶阻断剂地昔帕明对在神经酰胺的代谢中具有相反作用的酸性鞘磷脂酶和酸性神经酰胺酶都有下调作用[16,17]。我们前期研究结果显示,地昔帕明可下调高糖PDS诱导的神经酰胺活化,其净效应表现为细胞内神经酰胺的减少,提示酸性鞘磷脂酶-神经酰胺通路亦参与了高糖PDS诱导的PMCs凋亡[6]。
目前神经酰胺诱导腹膜间皮细胞凋亡的研究尚无直接实验报道,但有研究表明,高血糖状态可通过影响神经酰胺通路参与细胞凋亡。外源性神经酰胺可诱导人脐静脉内皮细胞凋亡,且与葡萄糖浓度呈正相关[18]。我们的研究亦证实了高糖PDS和外源性神经酰胺对PMCs的损伤作用。通过TUNEL法对凋亡细胞进行原位染色,可见对照组和酸性鞘磷脂酶阻断剂地昔帕明组细胞很少着色,而高糖PDS细胞多数呈现典型的凋亡形态,细胞变小、皱缩、染色质凝集,细胞核内呈显棕黄色颗粒。以上提示,神经酰胺可诱导PMCs凋亡增加,与其他研究者报道一致[19,20],高糖PDS作为可能影响腹膜透析患者间皮细胞功能最终导致腹膜纤维化的重要诱因,可能与之密切相关。
实验证明,在鼠肾小球系膜细胞中,神经酰胺的代谢产物鞘氨醇作用于ERK,对JNK/SAPK无作用,导致细胞的增殖和分化;相反,神经酰胺作用于JNK/SAPK,而对ERK无作用,最终导致细胞凋亡[21],说明神经酰胺对JNK/SAPK的作用尚具有结构特异性。本研究显示高糖PDS可诱导JNK及其下游c-Jun磷酸化,提示高糖可激活JNK信号转导途径。为了解高糖PDS是否通过促进神经酰胺生成激活JNK通路,我们应用地昔帕明减少细胞内神经酰胺的产生,发现高糖诱导的JNK和c-Jun磷酸化水平表达上调均可被地昔帕明显著抑制,提示高浓度PDS引起的细胞内神经酰胺增加对JNK信号通路具有启动作用。我们进一步采用JNK阻断剂SP600125抑制高糖诱导的JNK、c-Jun磷酸化,观察到高糖诱导的促凋亡调控基因Bax的上调及抗凋亡调控基因Bcl-2表达下调也得到了进一步抑制,证实JNK/SAPK信号转导途径参与启动了高糖诱导的PMCs凋亡。
综上所述,高糖可作为腹膜透析液的独立因素诱导PMCs凋亡和细胞内神经酰胺增加;酸性鞘磷脂酶抑制剂地昔帕明可通过减少细胞内神经酰胺的产生以抑制JNK信号通路活化;JNK阻断剂SP600125可抑制JNK信号通路磷酸化,进而导致下游凋亡基因发生相应的表达变化。我们的结果提示,高糖PDS诱导的PMCs凋亡中,可能存在“高糖刺激—神经酰胺产生增加—JNK/SAPK激活—细胞凋亡”这一级联反应,这可能作为防治PF的新靶点之一。
[1]杨晓.腹膜透析的解剖基础和原理.临床内科杂志. 2013,30(2):77-79.
[2]De Graaff M,Zegwaard AH,Zweers MM,et al.The effects of a dialysis solution with a combination of glycerol/amino acids/dextrose on the peritoneal membrane in chronic renal failure.Perit Dial Int,2010,30(2):192-200.
[3]Srinivasaiah N,Zia MK,Muralikrishnan V.Peritonitis in myelofibrosis:a cautionary tale.Hepatobiliary Pancreat Dis Int,2010,9(6):651-653.
[4]Kornhuber J,Rhein C,Müller C P,et al.Secretory sphingomyelinase in health and disease.Biol Chem,2015,396 (6/7):707-736.
[5]吕冰洁,杨阳,张建初.鞘磷脂代谢物与肺癌关系的研究进展.华中科技大学学报(医学版),2014,43(5):603-605.
[6]汤天凤,蒋春明,于立杰,等.神经酰胺在高浓度葡萄糖腹透液诱导的腹膜间皮细胞凋亡中的作用.中华肾脏病学杂志,2012,28(7):553-557.
[7]Nogueira TC,Graciano MF,Anhê GF,et al.Short-term modulation of extracellular signal-regulated kinase 1/2 and stress-activated protein kinase/c-Jun NH2-terminal kinase in pancreatic islets by glucose and palmitate:possible involvement of ceramide.Pancreas,2009,38(5):585-592.
[8]Iwayama H,Ueda N.Role of mitochondrial Bax,caspases, and MAPKs for ceramide-induced apoptosis in renal proximal tubular cells.Mol Cell Biochem,2013,379(1-2):37-42.
[9]张苗,蒋春明,孙琤.葡萄糖腹膜透析液诱导间皮细胞凋亡的体外研究.医学临床研究,2007,24(10):1674-1676.
[10]Jiang CM,Tao NN,Sun C,et al.Tanshinone IIA attenuates peritoneal fibrosis through inhibition of fibrogenic growth factors expression in peritoneum in a peritoneal dialysis rat model.Renal Failure,2011,33(3):355-362.
[11]Boccellino M,La Porta R,Coppola M,et al.Peritoneal dialysis fluid activates calcium signaling and apoptosis in mesothelial cells.Apoptosis,2013,18(1):43-56.
[12]张苗,蒋春明,孙琤.黄芪注射液拮抗腹膜透析液诱导腹膜间皮细胞凋亡的研究.医学研究生学报,2006,19(1):15-18.
[13]Cao DW,Zhang M,Jiang CM,et al.Protection of Tanshinone IIA to human peritoneal mesothelial cells(HPMC) through delaying cellular senescence induced by high glucose.Ren Fail,2012,34(1):88-94.
[14]Claus RA,Dorer MJ,Bunck AC,et al.Inhibition of sphingomyelin hydrolysis:targeting the lipid mediator ceramide as a key regulator of cellular fate.Curr Med Chem,2009, 16(16):1978-2000.
[15]Zeidan YH,Hannun YA.The acid sphingomyelinase/ceramide pathway:biomedical significance and mechanisms of regulation.Curr Mol Med,2010,10(5):454-466.
[16]Hurwitz R,Ferlinz K,Sandhoff K,et al.The tricyclic antidepressant desipramine causes proteolytic degradation of lysosomal sphingomyelinase in human fibroblasts.Biol Chem Hoppe Seyler,1994,375(7):447-450.
[17]Elojeimy S,Holman DH,Liu X,et al.New insights on the use of desipramine as an inhibitor for acid ceramidase. FEBS Letters,2006,580(19):4751-4756.
[18]Venable ME,Yin X.Ceramide induces endothelial cell senescence.Cell Biochem Funct.2009,27(8):547-551.
[19]Kharroubi I,Ladrière L,Cardozo AK,et al.Free fatty acids and cytokines induce pancreatic beta-cell apoptosis by different mechanisms:role of nuclear factor-kappaB and endoplasmic reticulum stress.Endocrinology,2004,145 (11):5087-5096.
[20]Bismuth J,Lin P,Yao Q,Ceramide:a common pathway for atherosclerosis?Atherosclerosis,2008,196(2):497-504.
[21]Franzen R,Fabbro D,Aschrafi A,et al.Nitric oxide induces degradation of the neutral ceramidase in rat renal mesangial cells and is counterregulated by protein kinase C.J Biol Chem,2002,277(48):46184-46190.
High glucose peritoneal dialysis solution induces apoptosis of peritoneal mesothelial cells through ceramide-JNK/SAPK pathway
Tang Tianfeng1,Wang Bin2,Jiang Chunming1,Zhang Qingyan1,Sun Cheng1,Zhang Miao1*
(1Department of Nephrology,2Department of Neurosurgery,Drum Tower Hospital,The Affiliated Hospital of Nanjing University Medical School,Nanjing 210008,China)
Objective To observe the effect of peritoneal dialysis solution(PDS)on the apoptosis of peritoneal mesothelium cells(PMCs)and explore the mechanism of ceramide in the apoptosis of PMCs induced by high glucose PDS.Methods PMCs were cultured in DMEM,DMEM with 1.5%PDS and 4.25%PDS,respectively.4.25%mannitol was used as the high osmotic pressure control solution.The change of ceremide level was detected by LC/MS/MS.TUNEL was used for apoptosis analysis.The p-JNK,p-c-Jun,Bax and Bcl-2 proteins were detected by Western blot.Results PDS increased intracellular ceremide level in PMCs in a concentration and time-dependent manner;there was no obvious change in ceremide level in the normal and high osmotic pressure control groups.Compared with 1.5%PDS,4.25%PDS induced PMCs apoptosis and promoted the phosphorylation of JNK and its downstream c-Jun(P<0.05);this effect was obviously inhibited by the acidic sphingomyelinase inhibitor Desipramine.JNK blocker SP600125 significantly suppressed the activation of JNK and c-Jun induced by high glucose PDS,thus inhibiting the up-regulation of Bax and down-regulation of Bcl-2(P<0.05).Conclusion The increase of intracellular ceremide level may play an important role through JNK/SAPK pathway in the apoptosis of PMCs induced by high glucose PDS.
Peritoneal dialysis solution;peritoneal mesothelium cells;apoptosis;ceramide;JNK/SAPK
R329.2+5
A
10.16705/j.cnki.1004-1850.2016.05.003
2016-04-20
2016-10-11
江苏省自然科学基金青年基金项目(BK20160127)
汤天凤,女(1980年),汉族,主治医师
(To whom correspondence should be addressed):zmslp@medmail.com.cn

