果蝇 Hsp83多克隆抗体的制备及鉴定
陈冬生,王双,王剑,周利娟,陶小倩,孙福玲
(安徽师范大学生命科学学院,芜湖 241000)
果蝇Hsp83多克隆抗体的制备及鉴定
陈冬生*,王双,王剑,周利娟,陶小倩,孙福玲
(安徽师范大学生命科学学院,芜湖 241000)
目的 制备和鉴定抗Hsp83蛋白的多克隆抗体。方法 利用PCR技术从果蝇cDNA中获得hsp83基因片段,构建重组质粒;将其转化到BL21(DE3)菌株中诱导蛋白表达,利用Ni-NTA亲和法纯化重组蛋白;再将纯化的蛋白免疫BALB/C小鼠制备多克隆抗体;利用免疫印迹法(Western blot)和免疫荧光染色法检测多克隆抗体的特异性。结果 构建的pET28ahsp83质粒在大肠杆菌中成功表达了Hsp83融合蛋白,蛋白纯化后作为抗原免疫小鼠,获得了抗Hsp83的多克隆抗体。免疫印迹法和免疫荧光染色法检测显示,抗果蝇Hsp83多克隆抗体具有较高的特异性,并能检测出内源性Hsp83蛋白。果蝇卵巢免疫荧光染色显示,Hsp83蛋白定位在卵巢细胞的细胞质中。结论 成功制备了小鼠抗Hsp83蛋白的特异性抗体,此工作为深入研究Hsp83蛋白的功能奠定了基础。
Hsp83蛋白;原核表达,多克隆抗体
热休克蛋白90(Hsp90)是一类在进化上高度保守的、原核和真核生物中普遍存在的分子伴侣蛋白,具有ATPase活性,主要参与蛋白的激活、蛋白质的自稳态调节、细胞周期运转的调控及多种信号传递过程[1-3],在致癌信号转导、应激损伤等过程中也发挥重要作用[4,5]。果蝇Hsp83蛋白由hsp83基因编码,是哺乳动物热休克蛋白Hsp90的同源物。果蝇hsp83基因定位于3号染色体上,是果蝇体内唯一带有一个内含子的热休克蛋白基因[6]。研究表明,果蝇Hsp83蛋白调控众多的生物学过程,如参与果蝇胸、眼、翅膀、刚毛等器官的形态发生[7-9];二聚化的Hsp83蛋白还可促进信号转导分子在活化和非活化状态之间精确转换,调控信号传递[10-12];Hsp83蛋白还可以与翻译抑制因子Cup相互作用,调控Osk、Grk和Nos蛋白质的合成,从而调控果蝇的卵子发生[13]。此外,髙脂性食物会产生氧化应激反应,此反应会诱导果蝇Hsp83蛋白高表达,从而防止氧化性损伤[14]。
本文采用原核表达系统制备并纯化了His-Hsp83融合蛋白,并将蛋白免疫小鼠获得抗Hsp83蛋白的多克隆抗体;通过免疫印迹、免疫组织化学染色技术检测该抗体的特异性。此工作将为更广泛、深入地研究hsp83基因的生物学功能及其分子机制奠定基础。
材料和方法
1 材料
E.coli DH5ɑ、BL21(DE3)菌株与pET28a载体、野生型果蝇oregon、转基因果蝇品系P{hsp83P-hsp83-GFPHA}均由本实验室保存;果蝇hsp8308445突变体(bloomington库,美国);DNA聚合酶、限制性内切酶、T4 DNA连接酶(TaKaRa公司,日本);DNA凝胶回收试剂盒和质粒DNA小提试剂盒购自天根生化科技有限公司;Ni-NTA层析试剂盒、HRP标记的羊抗鼠IgG和Western-blot显影底物购自全式金生物有限公司;DAPI、兔GFP抗体、Alexa FluorⓇ488标记羊抗兔IgG、Alexa FluorⓇ555标记羊抗小鼠IgG(abcam公司,美国);Vasa抗体由中科院动物所陈大华老师惠赠;完全弗氏佐剂、不完全佐剂(Sigma公司,德国);实验用BALB/C小鼠购自扬州大学比较医学中心;其他试剂为国产分析纯或分子生物学专用试剂。
2 重组表达载体的构建
登陆果蝇flybase数据库(http://flybase.org),获取hsp83基因序列,设计一对引物,上游引物(5′-(划线部分为BamH I酶切位点);下游引物(5′-3′)(划线部分为Xho I酶切位点)。以野生型果蝇cDNA为模板,扩增hsp83基因C端序列(582 bp)。PCR产物经BamH I与XhoI双酶切、琼脂糖凝胶电泳、切胶纯化回收目的片段。纯化后的目的片段与载体用T4 DNA连接酶16℃连接过夜,连接产物转化DH5ɑ感受态细胞,在含有卡那霉素的平板上挑取单克隆并扩大培养,PCR鉴定为阳性的菌液提取质粒,送上海生工公司测序。
3 重组蛋白的诱导表达及可溶性分析
将构建好的重组表达质粒pET28a-hsp83转化到大肠杆菌BL21(DE3)感受态细胞中。挑取单克隆接种于5 mL含卡那霉素的LB培养液中培养过夜,然后按1:25比例将过夜培养物接种于20ml培养液中,37℃振荡培养至 OD600为0.6(约 2 h)时,取出 5 ml培养物作为诱导前对照,向剩余的培养物中加入IPTG至终浓度为0.1mmol/L,25℃继续培养4h,诱导His-Hsp83融合蛋白表达。将10ml培养物,4 000 ×g室温离心10min,弃上清,加His Binding buffer(含 PMSF1:100)对细胞进行超声破碎,离心后分别收集上清和沉淀,SDS-PAGE分析蛋白可溶性。
4 重组蛋白的纯化
将重组表达细菌进行大量培养、诱导蛋白表达与超声破碎,离心后上清经0.45孔径滤膜过滤待用。取1.0ml Ni-NTA树脂用binding buffer活化,然后加入过滤后的蛋白上清,经washing buffer漂洗3次,用elution buffer洗脱,获得高纯度目的蛋白。
5 动物免疫及多克隆抗体的制备
选取5~6周健康BALB/C小鼠(体重约20~25g),采用断尾法取血约200μl,用于制备免疫前的正常血清。将纯化后的6×His-Hsp83融合蛋白溶于pH7.4的磷酸盐缓冲液中(浓度约0.2mg/ml),与等体积弗氏完全佐剂采用双推法充分混匀(浓度约0.1mg/ml)。经腹腔注射BALB/C小鼠,每只小鼠注射1ml(约100μg)。其后每2~3周免疫一次,抗原与等量不完全弗氏佐剂同上法混匀后免疫(抗原用量减半),一共免疫4次,最后心脏取血制备抗血清[15]。
6 多克隆抗体的Western blot分析
分别提取野生型果蝇oregon、转基因果蝇P{hsp83P-hsp83-GFPHA}卵巢总蛋白及纯化后蛋白,SDS聚丙烯酰胺凝胶电泳分离,转移至硝酸纤维素(NC)膜上,经50 g/L脱脂牛奶封闭后,用小鼠Hsp83多克隆抗体(1:5000)孵育过夜,HRP标记羊抗鼠单克隆抗体(1:5000)孵育3 h,暗室曝光显色。
7 多克隆抗体的免疫荧光染色检测
分别解剖野生型果蝇oregon、转基因果蝇P{hsp83P-hsp83-GFPHA}及hsp8308445突变体果蝇的卵巢,40g/L甲醛固定30min,2 ml/L Triton-X 100透化处理1.5h,15g/L BSA封闭1h,分别加入免疫前血清(1:500)、小鼠Hsp83多克隆抗体(1:500)、兔Vasa抗体(1:4000)及GFP抗体(1:500)置于4℃孵育过夜;Alexa FluorⓇ488标记的山羊抗兔IgG(1:1000)、Alexa FluorⓇ555标记的山羊抗小鼠IgG(1:1 000)室温孵育3h,DAPI染色30min;进行压片观察[16]。
结 果
1 pET28a-hsp83表达载体
按照图1A所示的目标重组质粒的设计要求,将hsp83开放阅读框序列置于6×His标签的下游,选取BamH I、Xho I作为插入位点。以野生型果蝇卵巢cDNA为模板扩增hsp83编码区C端片段,长度为582 bp,符合理论值(图1B)。将目的片段与 pET28a载体分别用BamH I、Xho I双酶切后16℃连接12 h,转化E.coli DH5ɑ菌株,菌落PCR选出阳性克隆。然后对阳性克隆进行LB液体培养、提取质粒、BamH I与Xho I双酶切,琼脂糖凝胶电泳检测酶切产物。结果如图1C所示,重组质粒切出两条带,一条是582 bp目的条带,另一条是约5300 bp线性化的pET28a载体。此结果表明,目的条带已正确插入到pET28a原核表达载体上。

图1 pET28a-hsp83重组质粒。A,pET28a-hsp83重组质粒图谱。B,PCR扩增 hsp83基因:M,DNA marker;1,hsp83基因 PCR扩增产物。C,pET28a-hsp83质粒双酶切鉴定(BamH I和 Xho I):M,DNA Marker;1,阳性克隆双酶切结果Fig.1 The recombinant plasmid of pET28a-hsp83.A,map of the recombinant plasmid.B,amplification of the hsp83 gene by PCR:M,DNA marker;1,PCR products of hsp83 gene amplification.C,identification of pET28a-hsp83 by double enzyme digestion(BamH I and Xho I):M,DNA marker;1 result of double enzyme digestion of positive clones
2 原核表达与纯化的Hsp83蛋白
用IPTG诱导表达目的蛋白,从IPTG浓度及培养温度两个方面对蛋白表达条件进行优化。最终选用0.1mmol/L IPTG及25℃室温进行诱导培养,4h后,收集细菌,用细胞超声粉碎仪裂解,4℃离心后,上清与沉淀分别用SDS-PAGE电泳分析。如图2A所示,上清中有大量的Hsp83蛋白表达,沉淀中表达较低。用Ni-NTA树脂亲和纯化的方法,纯化上清液中的目标蛋白,纯化效果良好(图2B)。
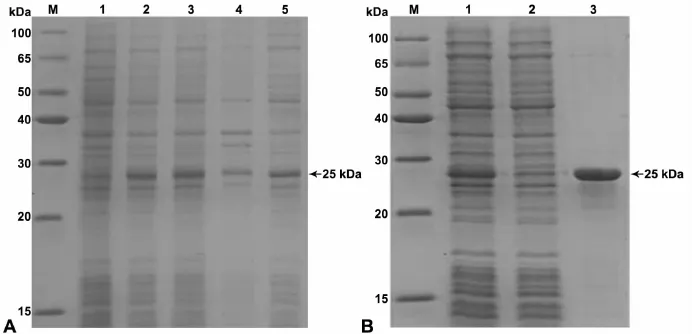
图2 表达与纯化的Hsp83融合蛋白。A,融合蛋白的SDS-PAGE分析:M,蛋白质 marker;1,未诱导菌体总蛋白;2和3,IPTG诱导菌体总蛋白;4,诱导后沉淀;5,诱导后上清。B,融合蛋白的纯化分析:M,蛋白质marker;1,未纯化上清;2,过Ni-NTA树脂流下的上清(未结合的非目标蛋白);3,洗脱液Fig.2 The expression and purification of Hsp83 fusion protein.A.SDS-PAGE analysis of Hsp83 fusion protein:M,protein marker;1,total bacteria protein without IPTG induction;2 and 3,total bacteria protein after IPTG induction;4,the precipitation after induction;5,the supernatant after induction.B,purification of Hsp83 fusion protein:M,protein marker;1,the supernatant before purification;2,the supermatant flowing through the Ni-NTA resin(unbound non-target proteins);3,the eluent
3 Hsp83抗体的特异性
将纯化后的6×His-Hsp83融合蛋白(抗原蛋白)、野生型果蝇oregon及转基因果蝇品系P{hsp83P-hsp83-GFPHA}的卵巢总蛋白电泳、转膜,用制备的抗Hsp83血清进行Western blot分析。结果如图3所示,第1、2泳道都有一条明显的特异性主带,其大小为25kDa,恰好等于6×His标签与Hsp83蛋白C端片段长度的总和,与预期相符。第3泳道为野生型果蝇卵巢的总蛋白,出现了唯一条带,大小约为81kDa,与全长Hsp83大小一致,表明该多抗能很好地识别内源性Hsp83蛋白,且具有很高的特异性。第4~6泳道为转基因果蝇卵巢总蛋白(上样量不同),都出现了两条带,其分子量为81 kDa和108 kDa,较小的为内源性表达蛋白,与野生型大小相同;较大的为转基因Hsp83-GFPHA融合蛋白,与预期符合。Western-blot结果从体外水平充分表明制备的多克隆抗体显示了很高的特异性。
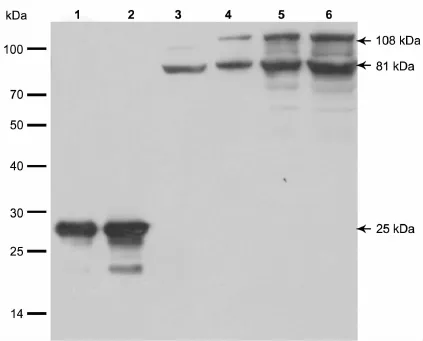
图3 抗体特异性的Western blot分析。1和2,90ng和180ng体外原核表达的纯化后融合蛋白;3,50ng野生型果蝇oregon卵巢总蛋白;4~6,50ng、100ng和200ng转基因果蝇 P{hsp83P-hsp83-GFPHA}卵巢总蛋白Fig.3 Western blot analysis of antibody specificity.1 and 2,90ng and 180ng purified Hsp83 fusion protein;3,50ng total ovarian protein from wild-type Oregon;4 to 6,50ng,100ng and 200ng total ovarian protein from transgenic Drosophila P{hsp83P-hsp83-GFPHA}
为进一步验证制备的多克隆抗体的特异性,我们用抗Hsp83血清对果蝇卵巢进行免疫荧光染色分析,共设计了3组实验。第1组以野生型oregon卵巢为材料,用小鼠免疫前血清为阴性对照。结果如图4A所示,野生型卵巢中Hsp83蛋白可被Hsp83多克隆抗体结合染色,并定位在果蝇卵巢细胞核(DAPI染色)周围的胞质中,而免疫前血清染色检测不到荧光信号。第2组以野生型oregon与hsp83基因突变体(弱突变体)果蝇为材料,用抗 Hsp83血清进行免疫染色,结果显示,野生型卵巢细胞被强烈着色,hsp8308445为弱突变体,卵巢细胞中呈现为相对较弱的荧光染色效果,符合预期结果(图4B)。第3组以野生型oregon和转基因果蝇 P{hsp83P-hsp83-GFPHA}卵巢为实验材料,转基因品系表达Hsp83与GFPHA标签的融合蛋白,用两种抗体(Hsp83抗体与GFP抗体)进行红、绿双重染色。如图4C所示,转基因果蝇卵巢中两种抗体的染色模式完全一致,叠加后为明显的黄色,符合 Hsp83-GFPHA融合蛋白染色的预期目标,而在野生型果蝇oregon卵巢中检测不到GFP信号,也符合预期结果。免疫荧光染色的结果从体内水平显示了Hsp83多克隆抗体的有效性与特异性。

图4 抗体特异性的免疫荧光染色分析。A,内源性Hsp83在野生型果蝇 oregon卵巢中的定位;B,内源性 Hsp83在野生型果蝇 oregon和hsp8308445突变体卵巢中的定位;C,转基因果蝇 P{hsp83P-hsp83-GFPHA}卵巢中 Hsp83与 GFP蛋白的共定位;IgG-B,免疫前血清;比例尺,10μmFig.4 Analysis of antibody specificity by immunofluorescent staining.A,localization of endogenous Hsp83 protein in the ovary of the wild-type(oregon);B,localization of endogenous Hsp83 protein in the ovaries of the wild-type and hsp8308445mutant flies;C,colocalization of Hsp83 and GFP protein in the ovaries of transgenic fly P{hsp83P-hsp83-GFPHA});IgG-B,serum IgG before immunization;scale bar,10μm
讨 论
Hsp83蛋白包含两个功能区域,一个是ATPase结构域,另一个是HSP90结构域。利用DNAStar软件分析Hsp83蛋白质的氨基酸序列,选择C端富含亲水性氨基酸的一段区域,对其相应的基因编码序列进行 PCR扩增。然后,将该片段插入到pET28a原核表达载体6×His标签下游,得到N端标签的融合蛋白,利用IPTG诱导蛋白表达,发现该蛋白主要存在上清中。在用IPTG诱导蛋白表达时,为了提高蛋白的表达量,我们对表达条件进行了优化,IPTG浓度设置了5个梯度:0.01mmol/L、0.03mmol/L、0.1mmol/L、0.3mmol/L、1mmol/L,结果发现 IPTG浓度在0.1mmol/L时,蛋白表达量相对最高。
在用Western-blot检测时,我们先用原核表达纯化的融合蛋白来检测Hsp83抗体的最佳使用浓度,共设置了3个浓度梯度(1:1000、1:5 000和1:10 000),结果发现当Hsp83抗体稀释5000倍时使用效果最佳。虽然直接用纯化的蛋白抗原进行检测,具有很高的特异性,但不能排除6×His标签短肽的影响。所以我们使用了野生型果蝇oregon卵巢总蛋白进行Western blot检测,结果检测出唯一条带,且大小正确,从而证明了该抗体的特异性。同时,我们还使用了转基因果蝇品系P{hsp83P-hsp83-GFPHA}的卵巢总蛋白进行Western blot检测,结果,出现了两条带,一条是内源性目标蛋白,一条是比内源蛋白大的Hsp83-GFPHA转基因融合蛋白,进一步显示了抗体的高效性与特异性。
在用免疫荧光染色检测时,我们首先用野生型oregon卵巢为实验材料,设置了一系列浓度梯度(1:100、1:500和1:1 000)来优化抗体的使用浓度,发现抗体浓度在1:500时染色效果最好。接着我们设置了3组实验检测抗体的特异性。第1组用小鼠免疫前血清作为阴性对照,以排除血清的种源性导致的假阳性;第2组用hsp83基因的突变体作为阴性对照,以排除细胞内非Hsp83蛋白可能导致的假阳性;第3组选用野生型果蝇作为GFP染色的阴性对照,通过融合蛋白Hsp83-GFPHA的双染重叠的有无来检测抗体的特异性,进行进一步的确证。
总之,本研究中制备的小鼠Hsp83抗体,在免疫印迹和免疫组织化学染色两个方面都显示出高效价、高特异性的优点,为未来开展更多的体外(如免疫共沉淀等)及体内(免疫电镜等)研究提供了可能,也为进一步研究Hsp83的功能及作用机制提供便利。
[1]Pearl LH.The HSP90 molecular chaperone-an enigmatic ATPase.Biopolymers,2016,105(8):594-607.
[2]Zhang XY,Zhang MZ,Zheng CJ,et al.Identification of two hsp90 genes from the marine crab,portunus trituberculatus,and their specific expression profiles under different environmental conditions.Comp Biochem Phys C,2009, 150(4):465-473.
[3]Zou BB,Shi QZ,Hematology DO.Advances of HSP90 inhibitors treating acute myelogenous leukemia.Basic Clin Med,2014,34(2):270-273.
[4]Sanchez ER.Chaperoning steroidal physiology:Lessons from mouse genetic models of Hsp90 and its co-chaperones. BBA-Mol Cell Res,2012,1823(3):722-729.
[5]Manchado M,Salas-Leiton E,Infante C,et al.Molecular characterization,gene expression and transcriptional regulation of cytosolic HSP90,genes in the flatfish Senegalese sole (Solea senegalensis,Kaup).Gene,2008,416(1-2):77-84.
[6]Konstantopoulou I,Scouras ZG.The heat-shock gene hsp83 of Drosophila auraria:genomic organization,nucleotide sequence,and long antiparallel coupled ORFs(LAC ORFs). J Mol Evol,1998,46(3):334-343.
[7]Rutherford SL,Lindquist S.Hsp90 as a capacitor for morphological evolution.Nature,1998,396(6709):336-342.
[8]Milton CC,Batterham P,McKenzie J A,et al.Effect of E (sev)and Su(Raf)Hsp83 mutants and trans-heterozygotes on bristle trait means and variation in Drosophila melanogaster.Genetics,2005,171(1):119-130.
[9]Bandura JL,Jiang H,Nickerson DW,et al.The molecular chaperone Hsp90 is required for cell cycle exit in Drosophila melanogaster.Plos Genet,2013,9(9):119-129.
[10]Pearl LH,Prodromou C.Structure and mechanism of the Hsp90 molecular chaperone machinery.Annu Rev Biochem,2006,75:271-294.
[11]Trepel J,Mollapour M,Giaccone G,et al.Targeting the dynamic HSP90 complex in cancer.Nat Rev Cancer, 2010,10(8):537-549.
[12]Heinrichsen ET,Zhang H,Robinson JE,et al.Metabolic and transcriptional response to a high-fat diet in Drosophila melanogaster.Mol Metab,2013,3(1):42-54.
[13]Pisa V,Cozzolino M,Gargiulo S,et al.The molecular chaperone Hsp90 is a component of the cap-binding complex and interacts with the translational repressor Cup during Drosophila oogenesis.Gene,2009,432(1):67-74.
[14]Paula MTD,Silva MRP,Araujo SM,et al.High-Fat diet induces oxidative stress and MPK2 and HSP83 gene expression in Drosophila melanogaster.Oxid Med Cell Longev, 2016,2016(6):1-12.
[15]李哲,柳宗琳,金丽华.果蝇再生蛋白(rgn)多克隆抗体的制备及鉴定.细胞与分子免疫学杂志,2015,31(10):1404-1407.
[16]朱翔翔,王双,王剑,等.三种果蝇精巢生殖干细胞半衰期的研究.激光生物学报,2016,25(2):41-45.
Preparation and characterization of polyclonal antibody against Hsp83 of Drosophila
Chen Dongsheng*,Wang Shuang,Wang Jian,Zhou Lijuan,Tao Xiaoqian,Sun Fuling
(The College of Life Science,Anhui Normal University,Wuhu 241000,China)
Objective To prepare and identify the polyclonal antibody against Drosophila Hsp83 protein.Methods The fragment of gene hsp83 was cloned from Drosophila cDNA library by PCR and then inserted into the expression vector pET28a to construct recombinant plasmids.Hsp83 fusion protein was expressed in BL21(DE3),purified by Ni-NTA affinity chromatography and then used to immunize BALB/C mice.The polyclonal antibody against Drosophila Hsp83 was gained from the mice serum.The specificity of the antibody was analyzed by Western blotting and immunofluorescent staining.Results The Hsp83 fusion protein was successfully expressed in BL21(DE3)from the pET28a-hsp83 plasmids constructed.The purified fusion protein as antigen immunized BALB/C mice and stimulated the generation of polyclonal antibody against Hsp83.The anti-Hsp83 antibody showed relatively high specificity in the western blot and immunofluorescent staining,and was able to detect endogenous Drosophila Hsp83 protein.In addition,Hsp83 was localized in the cytoplasm of ovarian cells by immunofluorescent staining.Conclusion The polyclonal antibody against Hsp83 with high specificity was successfully prepared,and this lays the foundation for further study of the functions of Hsp83 protein.
Hsp83 protein;prokaryotic expression;polyclonal antibody
Q786
A
10.16705/j.cnki.1004-1850.2016.05.014
2016-08-29
2016-10-08
国家自然科学基金面上项目(31071266);安徽省高校自然科学基金重点项目(KJ2015A082);安师大研究生科研创新与实践项目(2015cxsj172);安徽高校科研平台创新团队项目。
陈冬生,男(1973年),汉族,副教授
(To whom correspondence should be addressed):dschgene@163.com

