瘦素及其受体在甲状腺乳头状癌组织中共同高表达
马小开,谢传信,王圣应,郑绪才,黄建康,朱正志,姚廷敬,张晖,冯振中
(1蚌埠医学院第一附属医院肿瘤外一科,蚌埠 233000;2亳州市人民医院肿瘤外科,亳州 236000;3安徽省肿瘤医院颈胸肿瘤外科,合肥 230000;4蚌埠医学院病理学教研室,蚌埠 233000)
瘦素及其受体在甲状腺乳头状癌组织中共同高表达
马小开1*,谢传信2,王圣应3*,郑绪才3,黄建康1,朱正志1,姚廷敬1,张晖1,冯振中4
(1蚌埠医学院第一附属医院肿瘤外一科,蚌埠 233000;2亳州市人民医院肿瘤外科,亳州 236000;3安徽省肿瘤医院颈胸肿瘤外科,合肥 230000;4蚌埠医学院病理学教研室,蚌埠 233000)
目的 探讨瘦素(leptin)和瘦素受体(leptin recptor,LEPR)在甲状腺乳头状癌(papillary thyroid carcinoma,PTC)组织中的表达及其临床意义。方法 采用免疫组织化学Elivision法分别检测60例甲状腺乳头状癌组织和45例甲状腺腺瘤组织中leptin和LEPR的表达,免疫荧光双染检测leptin及LEPR在甲状腺乳头状癌组织和癌旁正常甲状腺组织中的共同表达;Pearson相关性分析法分析PTC组织中leptin和LEPR表达水平之间的相关性,卡方检验法分析leptin和LEPR表达与患者临床病理特征之间的关系。结果 Leptin和LEPR在PTC组织中的阳性表达率均高于甲状腺腺瘤组织;二者在PTC组织中的表达呈正相关,并呈共同高表达;在PTC组织中,肿瘤直径≥1cm者leptin和LEPR阳性表达率均高于肿瘤直径<1cm者;leptin和LEPR在有淋巴结转移者阳性表达率均低于未发生转移者。结论 leptin和LEPR在PTC组织中呈现共同高表达,且两者的表达与肿瘤直径和淋巴结转移等肿瘤进展指标密切相关,提示两者可能在PTC的发生、发展中发挥重要作用,可以作为PTC治疗的潜在靶点。
甲状腺乳头状癌;瘦素;瘦素受体
甲状腺乳头状癌(thyroid papillary carcinoma,PTC)是甲状腺癌中恶性程度较低的一种,占60%~80%,患者多为女性。PTC预后较好,但淋巴结转移机会多,临床触不到淋巴结的患者,经选择性颈清扫术后,病理结果提示46%~72%的病例有淋巴结转移[1]。我们总结前期的临床工作发现PTC的颈部淋巴结转移有一定的规律,通常颈淋巴结转移以Ⅱ、Ⅲ、Ⅳ、Ⅵ区为主,尤以Ⅵ区最常见[2],但对于这种淋巴结转移的机制,目前尚不清楚。
瘦素(leptin)是由肥胖基因(Obesity genes,OB)编码、白色脂肪组织分泌的一种蛋白质类激素,目前已证实leptin可以促进PTC细胞的增殖及抗其凋亡[3,4],但leptin及leptin受体(LEPR)在PTC中的其他功能尚不明确。本文旨在通过观察leptin及LEPR在PTC组织中的表达及其与临床病理特征之间的关系,为分析其在PTC的进展过程中的作用提供线索。
材料和方法
1 病例
收集蚌埠医学院第一附属医院肿瘤外一科2012年6月至2013年6月行甲状腺手术患者病历及病理资料进行统计分析。根据随机原则,选取甲状腺乳头状癌组织蜡块标本60例,男性25例,女性35例(术后病理示17例发生淋巴结转移、43例未发生淋巴结转移)和甲状腺腺瘤组织标本45例,以上病历资料详尽、完整,所有患者术前均未行内分泌、化疗及放疗等治疗,标本结果均经病理证实。所有实验所用甲状腺组织蜡块标本均为手术后2h以内的新鲜标本,先于4℃下用10%甲醛(pH值7.2~7.4)固定6~12h,后充分水洗,石蜡包埋封存。
2 试剂
Elivision法免疫组织化学染色用兔抗人LEP单克隆抗体、兔抗人LEPR单克隆抗体、即用型快捷免疫组织化学试剂盒及DAB显色试剂盒均购自生工生物工程(上海)股份有限公司,免疫荧光用兔多克隆抗体(Anti-leptin抗体ab16227)和小鼠单克隆抗体(Anti-leptin receptor抗体LPR-02 ab2143)为Abcam产品,羊抗小鼠IgG(H+L)488和羊抗兔IgG(H+L)546)为Invitrogene产品。
3 Elivision法免疫组织化学染色与结果判定
Leptin及LEPR检测主要步骤参照ElivisionTMplus试剂盒说明书两步法:切片脱蜡、水化,微波抗原修复及过氧化氢去除内源性过氧化物酶,分别滴加一抗(1:40),4℃孵育过夜,PBS冲洗后滴加二抗孵育30min后,DAB显色,苏木素复染、二甲苯透明、中性树胶封固后显微镜下观察。PBS替代一抗作阴性对照,已知阳性片作阳性对照。由两位有经验的临床病理医师采用双盲法对每例切片染色结果进行判读,根据阳性细胞占视野中所有组织细胞中的比例以及阳性细胞的染色强度来判定实验结果:按显色细胞数(A)记分:阳性细胞数<1/3为1分,阳性细胞数1/3~2/3为2分,阳性细胞数≥2/3为3分。按细胞显色深浅(B)记分:无阳性反应细胞为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。积分数=A×B。A×B=0判断为(-),A×B=1~2判断为(+),A×B=3~4判断为(++),A×B=6~9判断为(+++)。实验结果(-)与(+)视为阴性,(++)与(+++)视为阳性。
4 免疫荧光双重染色
冰冻切片恢复室温,PBS洗3次除去包埋剂,冰甲醇固定10min,BSA、Triton X-100室温封闭破膜60min,滴加一抗(1:100)稀释液约100μl,置湿盒中4℃过夜,荧光二抗(1:500)室温避光孵育1h,PBS洗片、封片,室温放置1h待片干后放入冰箱避光保存,在荧光显微镜下观察。
5 统计学处理
应用SPSS19.0统计软件,对实验数据进行分析,临床特征由相关数据表示,根据数据类型,对结果进行χ2检验、Spearman等级相关分析等进行相关分析。
结 果
1 Leptin和LEPR在甲状腺乳头状癌组织中的阳性表达率高于甲状腺腺瘤组织
Elivision法免疫组织化学染色显示,leptin主要在PTC组织的细胞膜和(或)胞质中呈阳性表达(图1A),而在甲状腺腺瘤中主要呈阴性表达(图1B),在PTC和甲状腺腺瘤中的阳性表达率分别为78.33%和26.67%(表1)。LEPR主要在 PTC组织的细胞膜和(或)胞质中呈阳性表达(图1C),在甲状腺腺瘤中主要呈阴性表达(图1D),在PTC和甲状腺腺瘤中的阳性表达率分别为70.00%和40.00%(表1)。Leptin和LEPR在PTC组织中共同阳性表达率为60.00%;免疫荧光双重染色显示,PTC组织中,几乎所有的leptin强阳性细胞同时强表达LEPR(图2);Spearman相关分析显示,leptin和LEPR表达水平之间呈正相关(表2)。
2 Leptin和LEPR在甲状腺乳头状癌中的表达与肿瘤大小及淋巴结转移相关
将PTC中leptin和LEPR的表达与患者临床病理特征进行相关分析显示,leptin和LEPR在淋巴结转移组阳性表达率均低于未发生转移组,同时发现肿瘤直径≥1cm组患者中leptin和LEPR阳性表达率均高于肿瘤直径<1cm组(表3)。
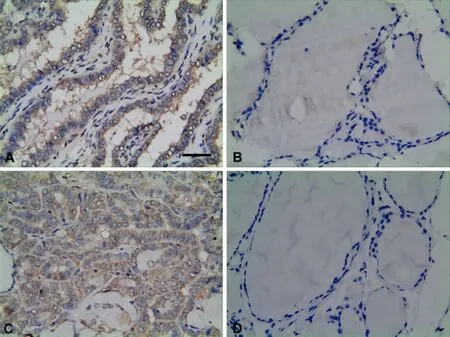
图1 Leptin和 LEPR在甲状腺乳头状癌和甲状腺腺瘤中的免疫组织化学表达。A,甲状腺乳头状癌组织中leptin表达;B,甲状腺腺瘤组织中leptin表达;C,甲状腺乳头状癌组织中LEPR表达;D,甲状腺腺瘤组织中LEPR表达;比例尺,50μmFig.1 Immunohistochemical expression of leptin and LEPR in PTC and thyroid adenoma.A,Expression of leptin in PTC;B,Expression of leptin in thyroid adenoma;C,Expression of LEPR in PTC;D,Expression of LEPR in thyroid adenoma;scale bar,50μm

图2 Leptin和LEPR在甲状腺乳头状癌组织共定位的免疫荧光双标检测。A,leptin;B,LEPR;箭头示双标细胞;比例尺,50μmFig.2 Immunofluorescent double labeling for co-localization of leptin and LEPR in PTC.A,leptin;B,LEPR;arrows indicate the double labelling cells;scale bar,50μm

表1 Leptin及 LEPR在甲状腺乳头状癌和甲状腺腺瘤中的表达Table 1 The expression of leptin and LEPR in PTC and thyroid adenoma
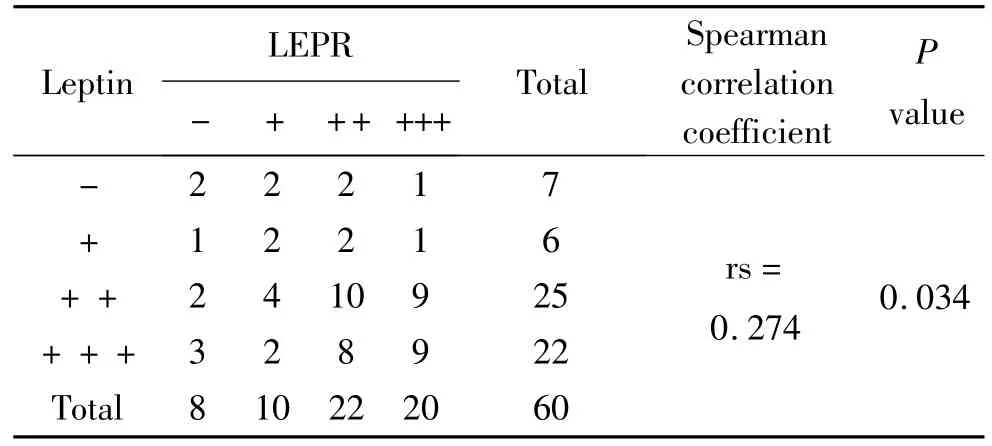
表2 Leptin及 LEPR在甲状腺乳头状癌中表达的关系Table 2 The correlation between the expressions of leptin and LEPR in PTC

表3 甲状腺乳头状癌中 leptin和 LEPR的表达和临床特征的关系Table 3 The relationship between the expression of leptin/LEPR and clinical features in PTC
讨 论
甲状腺癌的检出率逐年提高,医生通过体检发现甲状腺结节的患病率是3%~7%,应用超声检查出甲状腺结节的患病率从20%~76%不等[5,6]。而在甲状腺结节中通过手术切除,术后病理证实为恶性的概率约5%~10%[7],严重影响群众健康及生活水平。
PTC是甲状腺癌最常见的一个类型,占甲状腺恶性肿瘤的60%~70%[8]。甲状腺癌的发病机制尚不明确,目前惟一明确的甲状腺癌危险因素是儿童期电离辐射接触史,其与PTC的发生密切相关[9]。近年来越来越多的学者研究肥胖与甲状腺癌的相关性时认为肥胖可能增加患甲状腺癌的风险,孔娜等对385例良恶性甲状腺结节临床资料比较分析提示体重指数大于正常的患者甲状腺癌的发病风险可能增加[10]。Kitahara等[11]通过研究身体质量指数(Body Mass Index,BMI)和甲状腺癌风险之间的关系,认为肥胖是患甲状腺癌的高危因素。
Leptin是由肥胖基因OB编码、白色脂肪组织分泌的一种蛋白质类激素,需要与其受体LEPR结合才能发挥生物学效应。在生理状态下,leptin可以通过影响下丘脑室旁核中促甲状腺释放激素基因的表达而发挥调节甲状腺激素分泌的作用,甲状腺激素也可通过影响体脂含量及促甲状腺激素等对leptin发挥相应的调节作用[12]。相关研究已经证明leptin及LEPR在正常乳腺上皮组织以及乳癌细胞中均有表达,且在乳腺癌细胞中可检测到瘦素受体mRNA的过表达[13,14],此外,在神经胶质瘤、肝癌、子宫内膜癌等肿瘤中,leptin都可促进肿瘤细胞的侵袭和转移[15-17]。
Leptin和LEPR在PTC中的作用机制尚未明确。有文献报道,leptin可通过PI3K/AKT信号转导通路来刺激肿瘤细胞的增殖,同时促进肿瘤细胞的抗凋亡作用[18]。Melih等[19]应用ELISA来检测PTC患者中血清leptin水平,发现其显著高于正常人群。Rania等[20]发现分化型甲状腺癌患者术前的的血清leptin处于较高水平,术后一月下降明显,提示瘦素与分化型甲状腺癌相关并有助于其诊断。Yaghmaei[4]等的研究显示甲状腺癌患病组的血清leptin明显高于正常对照组,而两组之间的BMI、甲状腺激素和促甲状腺激素水平无显著差异。本研究结果也提示,leptin和LEPR的表达与患者的BMI值无关。Fan等的研究也证实,leptin和LEPR的表达与乳头状甲状腺癌、滤泡状甲状腺癌及甲状腺未分化癌相关,且在甲状腺乳头状癌患者中高水平的leptin和LEPR提示预后较差[21]。
本实验通过检测60例甲状腺乳头状癌组织和45例甲状腺腺瘤组织中leptin和LEPR的表达情况,发现leptin及LEPR在PTC中的阳性表达率均高于甲状腺腺瘤组织,说明leptin及LEPR可能参与甲状腺乳头状癌的发生、发展。此外,leptin和LEPR在PTC组织中共同表达率为60.00%,二者呈显著正相关,且免疫荧光双标也证实二者在甲状腺乳头状癌组织中共同高表达。结合leptin在乳腺癌ZR-75-1细胞系中可以促进其受体的表达[22]的研究,我们推测甲状腺乳头状癌细胞中leptin可能是通过相同的方式诱导其受体LEPR的表达,但其中的具体机制尚待我们进一步探究。
在PTC组织中,leptin和LEPR的表达与肿瘤的大小有关,肿瘤越大二者阳性表达率越高,也进一步说明leptin及LEPR促进肿瘤的发展,这与Cheng等[23]研究结果一致。于霄等[24]研究结果显示,leptin在甲状腺乳头状癌淋巴结转移组的表达要高于未转移组,且PTC组织中新生血管密度随leptin表达强度的增强而增加,说明leptin参与甲状腺乳头状癌组织中血管的生成及肿瘤的进展。本研究结果显示leptin及LEPR在甲状腺乳头状癌淋巴结转移组的表达率均要低于未转移组,其中leptin在未转移组的表达率为86%,与于霄等研究结果接近(89.66%),究其原因可能与淋巴结转移组样本量较小有关,在后续的研究中将会得到进一步验证。
[1]董志伟,谷铣之.临床肿瘤学.北京:人民卫生出版社,2002,618-619.
[2]王圣应,朱正志,彭德峰,等.分化型甲状腺癌颈淋巴结转移规律的研究.中华外科杂志,2008,46(18):1404-1406.
[3]Uddin S,Hussain AR,Siraj AK,et al.Role of leptin and its receptors in the pathogenesis of thyroid cancer.Int J Clin Exp Pathol,2011,4(7):637-643.
[4]Hedayati M,Yaghmaei P,Pooyamanesh Z,et al.Leptin:a correlated Peptide to papillary thyroid carcinoma?J Thyroid Res,2011,2011:832163.
[5]Gharib H,Papini E,Paschke R,et al.American Association of Clinical Endocrinologists,Associazione Medici Endocrinologi,and European Thyroid Association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules.Endocr Pract,2010,16(suppl1):1-43.
[6]熊专,孙晖,万姗等.不同性质甲状腺结节临床特征的分析.华中科技大学学报(医学版),2014,43(4):444-448.
[7]Cooper DS,Doherty GM,Haugen BR,et al,Revised A-merican Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer.Thyroid,2009,19(11):1167-1214.
[8]Burton TR,Henson ES,Baijal P,et al.The pro-cell death Bcl-2 family member,BNIP3,is localized to the nucleus of human glial cells:Implications for glioblastoma multiforme tumor cell survival under hypoxia.Int J Cancer,2006,118 (7):1660-1669.
[9]Boice JD Jr.Radiation and thyroid cancer:what more can be learned?Acta Oncol,1998,37(4):321-324.
[10]孔娜,陈昕彦,张春玉,等.385例良恶性甲状腺结节临床资料比较分析.中华内分泌代谢杂志,2012,28(10):806-810.
[11]Kitahara CM,Platz EA,Freeman LE,et al.Obesity and thyroid cancer risk among US men and women:a pooled analysis of five prospective studies.Cancer Epidemiol Biomarkers Prev,2011,20(3):464-472.
[12]Légrádi G,Emerson CH,Ahima RS,et al.Leptin prevents fasting-Induced suppression of prothyrotropin-releasing hormone messenger ribonucleic acid in neurons of the hypothalamic paraventricular nucleus 1.Endocrinology,1997,138 (6):2569-2576.
[13]Rouet-Benzineb P,Aparicio T,Guilmeau S,et al.Leptin counteracts sodium butyrate-induced apoptosis in human colon cancer HT-29 cells via NF-κB signaling.J Biol Chem, 2004,279(16):16495-16502.
[14]Cascio S,Bartella V,Auriemma A,et al.Mechanism of leptin expression in breast cancer cells:role of hypoxia-inducible factor-1α.Oncogene,2008,27(4):540-547.
[15]Yen WL,Lu DY,Lee MJ,et al.Leptin induces migration and invasion of glioma cells through MMP-13 production. Glia,2009,57(4):454-464.
[16]Saxena NK,Sharma D,Ding X,et al.Concomitant activation of the JAK/STAT,PI3/AKT,and ERK signaling is involved in leptin-mediated promotion of invasion and migration of hepatocellular carcinoma cells.Cancer Res,2007, 67(6):2497-2507.
[17]Sharma D,Saxena NK,Vertino PM,et al.Leptin promotes the proliferative response and invasiveness in human endometrial cancer cells by activating multiple signal-transduction pathways.Endocr Relat Cancer,2006,13(2):629-640.
[18]Uddin S,Bavi P,Sirj A,et al.Leptin-R and its association with PI3K/AKT signaling pathway in papillary thyroid carcinoma.Endocr Relat Cancer,2010,17(1):191-202.
[19]Melih A,Funda K,Bahadir C,et al.Leptin Levels in Thyroid Cancer.Asian J Surg,2009,32(4):216-223.
[20]Rania AR,Waleed AE,Reham AE,et al.Study of Serum Leptin in Well-differentiated Thyroid Carcinoma:Correlation with Patient and Tumor Characteristics.World J Surg, 2014,38(10):2621-2627.
[21]Fan YL,Li XQ.Expression of leptin and its receptor in thyroid carcinoma:distinctive prognostic significance in different subtypes.Clin Endocrinol,2015,83(2):261-267.
[22]Chen C,Chang YC,Liu CL,et al.Leptin-induced growth of human ZR-75-1 breast cancer cells is associated with upregulation of cyclin D1 and c-Myc and down-regulation of tumor suppressor p53 and p21WAF1/CIPI.Breast Cancer Res Treat,2006,98(2):121-132.
[23]Cheng SP,Chi CW,Tzen CY,et al.Clinicopathologic significance of Leptin and Leptin receptor expressions in papillary thyroid carcinoma.Surgery,2010,147(6):847-853.
[24]于霄,赵俊军,王波,等.甲状腺乳头状癌组织中瘦素的表达与血管生成及转移的关系.中国癌症杂志,2011,21(4):283-286.
High level co-expression of leptin and leptin receptor in papillary thyroid carcinoma
Ma Xiaokai1*,Xie Chuanxin2,Wang Shengying3*,Zheng Xucai3,Huang Jiankang1,Zhu Zhengzhi1,Yao Tingjing1,Zhang Hui1,Feng Zhenzhong4
(1Department of surgical oncology,the First Affiliated Hospital of Bengbu Medical College,Bengbu 233000;2Department of surgical oncology,the People's Hospital of Bozhou,Bozhou 236000;3Department of cervical thoracic surgical oncology,Anhui Tumor Hospital,Hefei 230000;4Department of Pathology,Bengbu Medical College,Bengbu 233000,China)
Objective To investigate the expression and clinical significance of leptin and leptin receptor(LEPR)in papillary thyroid carcinoma(PTC).Methods In this study,we detected the expression of leptin and LEPR by immunohistochemistry(Elivison) in 60 cases of papillary thyroid carcinoma(PTC)and 45 cases of thyroid adenoma.The coexpression of Leptin and LEPR in papillary thyroid carcinoma and adjacent normal thyroid tissues was detected by immunofluorescent double staining;Pearson correlation was used to analyze the correlation between the expression levels of leptin and LEPR in PTC tissues;the Chi square test was used to analyze the relationship between the expression of leptin and LEPR and the clinicopathological characteristics of the patients.Results The positive rates of leptin and LEPR were higher in PTC than in thyroid adenoma.Both expressions are high and correlated positively in PTC.The positive rates of leptin and LEPR were higher in the group of tumors with a diameter≥1cm than in the group with a diameter<1cm,while lower in tumors with lymph node metastasis than in those without metastasis.Conclusion Leptin and LEPR were high co-expressed in PTC tissue,and the expression of them was closely related to tumor diameter and lymph node metastasis.These results suggest that both of them may play an important role in the occurrence and development of PTC.They might be potential targets for PTC treatment.
Papillary thyroid carcinoma;leptin;leptin receptor
R739.91
A
10.16705/j.cnki.1004-1850.2016.05.012
2015-12-01
2016-10-09
安徽省高校省级自然科学研究项目资助(KJ2013Z142);蚌埠医学院自然科学基金资助(Byky1371)
马小开,男(1983年),汉族,主治医师
(To whom correspondence should be addressed):mak0707@163.com;wangshengying61@163.com

