普瑞巴林联合吴茱萸碱对神经病理性疼痛大鼠细胞因子和T细胞的影响
章玲宾,潘 晨,张 宁,游敏吉,陈 琴,陈佳琪
实验研究
普瑞巴林联合吴茱萸碱对神经病理性疼痛大鼠细胞因子和T细胞的影响
章玲宾1,潘 晨2,张 宁1,游敏吉1,陈 琴1,陈佳琪3
目的:观察普瑞巴林联合吴茱萸碱对神经病理性疼痛大鼠免疫细胞的影响。方法:SD大鼠30只。随机分为5组(每组6只):假手术组(S组)、对照组(C组)、普瑞巴林组(P组)、吴茱萸碱组(Q组)和普瑞巴林-吴茱萸碱复合物(F组)。大鼠暴露左侧L5脊神经并结扎,建立脊神经结扎(SNL)模型,S组大鼠暴露左侧L5脊神经,但不结扎。建立SNL模型7 d后P组腹腔注射普瑞巴林(5 mg/kg),Q组腹腔注射吴茱萸碱注射液(5 mg/kg),F组腹腔注射普瑞巴林-吴茱萸碱复合物(5 mg/kg),S和C组腹腔注射生理盐水(2 mL/kg),连续给药7 d,观察测量大鼠神经损伤侧的疼痛行为学的变化。给药7 d后取主动脉血3 mL检测大鼠肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、5-羟色胺(5-HT)、去甲肾上腺素(NE)和T淋巴细胞亚群中T细胞分化群4(CD4+)、T细胞分化群8(CD8+)的水平。结果:模型制成后S组大鼠活动如常,其它四组大鼠SNL 1周后,步态及姿势出现不同程度的异常;P组、Q组、F组三组动物SNL第10天开始,上述症状逐渐缓解,尤其F组症状表现轻微。给药7 d后C组TNF-α为(101.75±15.46)μg/L、IL-6为(32.98±6.64)μg/L、NE为(78.14±4.38)pg/mL、5-HT为(6.21±1.87)μmol/L,较S组TNF-α[(55.14±13.28)μg/L]、IL-6[(18.16±5.98)μg/L]、NE[(23.65±2.21)pg/mL]、5-HT[(1.89±0.76)μmol/L]显著升高(P<0.01);F组TNF-α为(68.54±17.65)μg/L、IL-6为(20.21±4.23)μg/L、NE为(33.08±3.85)pg/mL、5-HT为(2.64±1.38)μmol/L较C组明显降低(P<0.05)。给药7 d后C组CD4+为(16.43±1.68)ng/mL、CD8+为(11.26±2.31)ng/mL较S组CD4+[(25.28±1.56)ng/ mL]、CD8+[(14.05±2.45)ng/mL]显著降低(P<0.01);F组CD4+为(32.45±3.45)ng/mL、CD8+(21.47±1.08)ng/mL较C组升高(P<0.01或P<0.05)。结论:普瑞巴林联合吴茱英碱对神经病理性疼痛大鼠具有较好的协同镇痛作用,优于各自单独使用;两者合用能够使神经病理性疼痛家兔炎性细胞因子的表达下调,并能延缓神经病理性疼痛大鼠T淋巴细胞亚群CD4+、CD8+的下降。
神经病理性疼痛;普瑞巴林;吴茱萸碱;疼痛行为学;免疫细胞
神经病理性疼痛是中枢或外周神经损伤或产生病变而引起的疼痛[1],是慢性疼痛中最为难治的一种,可持续数天、数月甚至数年,发病率高,临床治疗效果不理想[2]。新型抗癫痫药物普瑞巴林是抑制性神经递质r-氨基丁酸(GABA)的结构衍生物,具有脂溶性,能通过血脑屏障,对神经病理性疼痛治疗有良好疗效且不良反应少,患者耐受性较好[3]。目前普瑞巴林治疗神经病理性疼痛的作用机制尚未完全明确。吴茱英碱是吴茱萸的主要有效成分之一,具有镇痛、降血压及体温上升等药理作用。本实验提出普瑞巴林联合吴茱萸碱应用于神经病理性疼痛大鼠,并对比联合用药与单独用药,观察大鼠自发疼痛行为学改变、对炎性介质和免疫细胞的影响。评价瑞巴林联合吴茱萸碱应用于神经病理性疼痛大鼠是否有协同镇痛效果。为临床上治疗神经病理性疼痛的用药选择提供理论依据。
1 材料与方法
1.1 研究对象 成年雄性清洁级Sprague-Dawley(SD)大鼠30只(由安徽医科大学动物实验中心提供),体质量250~350 g,饲养于温度为(22±2)℃、相对湿度为(55±15)%的动物房鼠笼里,12 h光照/12 h黑暗周期变化,自由摄食饮水。适应环境1周。
1.2 动物模型建立 采用文献的报道的方法[4]制作脊神经结扎(spinal nerve ligation,SNL)模型。大鼠腹腔注射戊巴比妥钠50 mg/kg麻醉后,常规消毒,俯卧捆绑,沿L4~6脊椎中线切皮,钝性分离脊椎左侧肌肉组织,切断横突,暴露L5脊神经,用3.0丝线结扎并剪断左侧k脊神经。然后逐层缝合肌肉和皮肤,避免术后感染。假手术组大鼠暴露左侧L5脊神经,但不结扎。
1.3 研究方法 按随机数字表法随机分为5组(每组6只):假手术组(S组),对照组(C组),普瑞巴林组(P组),吴茱萸碱组(Q组)和普瑞巴林-吴茱萸碱复合物(F组)。P组腹腔注射普瑞巴林5 mg/kg,Q组腹腔注射吴茱萸碱注射液5 mg/kg,F组腹腔注射普瑞巴林-吴茱萸碱复合物5 mg/kg,S和C组腹腔注射生理盐水2 mL/kg。SNL模型建立7 d后给药,再连续给药7 d。
1.4 指标检测 (1)疼痛行为学的观察:①行为学变化:观察手术前及手术后大鼠步态、姿势、后肢着地协调程度(尤其是左侧),跛行,大鼠后爪变化以及舔、咬或激烈抖动手术侧后爪等现象。②机械缩足痛阈(MWT)测定[5]:在手术前1 d以及手术后1、3、5、9、14 d给药后30 min测量机械刺激缩足痛阈值。机械刺激缩足反射阈值的测量:将有机玻璃箱置于金属筛网上,待大鼠在有机玻璃箱中适应10 min后,用不同内径的Von Frey尼龙丝,选择一根合适的Von Frey尼龙丝垂直刺激大鼠左后肢足底中部,逐渐加压至出现抬足或舔足行为时作为阳性反应,参照up-down法推测阈值。⑵标本的采集与检测:给药7 d后取主动脉血3 mL,置入不抗凝管常温下放置1 h后,1500 r/min离心30 min,抽取血清,标本置于-20℃以下冰箱中保存。待标本收集完成后用ELISA法检测用于大鼠体内肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、5-羟色胺(5-HT)和去甲肾上腺素(NE)和T细胞分化群4(CD4+)、T细胞分化群8(CD8+)的水平变化检测。放免法试剂盒由上海生物制品研究所及解放军总医院科技开发中心放免研究所提供,均按说明书操作。测量仪器为中国科技大学实业总公司中佳光电GC-1200γ免疫计数仪。
2 结果
2.1 一般资料 实验过程中实验大鼠无自噬、死亡、脱落等现象,30只大鼠全部进入结果分析。实验期间各组大鼠体重比较,差异无统计学意义。
2.2 疼痛行为学测定 (1)疼痛行为学实验中,S组大鼠活动如常;C组、P组、Q组、F组四组SNL 1周后,步态及姿势出现不同程度的异常,左侧患肢活动减少,无力,不能触地,爪不能伸展,有时突然舔嗜手术侧后爪或抖动。C组大鼠术后,手术侧后爪有足趾并拢且常处于保护状态(悬与空中)。P组、Q组、F组三组给药后3 d开始,上诉症状逐渐缓解,尤其F组上诉症状表现轻微。(2)各组机械缩足痛阈(MWT)比较:术前各组大鼠的机械刺激缩足反射阈值差异无统计学意义(P>0.05)。S组大鼠手术后各时间点机械刺激缩足反射阈值较对照组均显著降低(P<0.05、0.01)。P组大鼠术后第3 d起MWT值较模型组显著升高(P<0.05),Q组大鼠手术后第5 d起MWT值较模型组显著延长(P<0.05、0.01),F组从手术后第3 d起MWT值较S组显著延长(P<0.05),较P或Q组显著延长(P<0.05)。结果见表1。
表1 各组大鼠MWT的比较(±s,n=6)
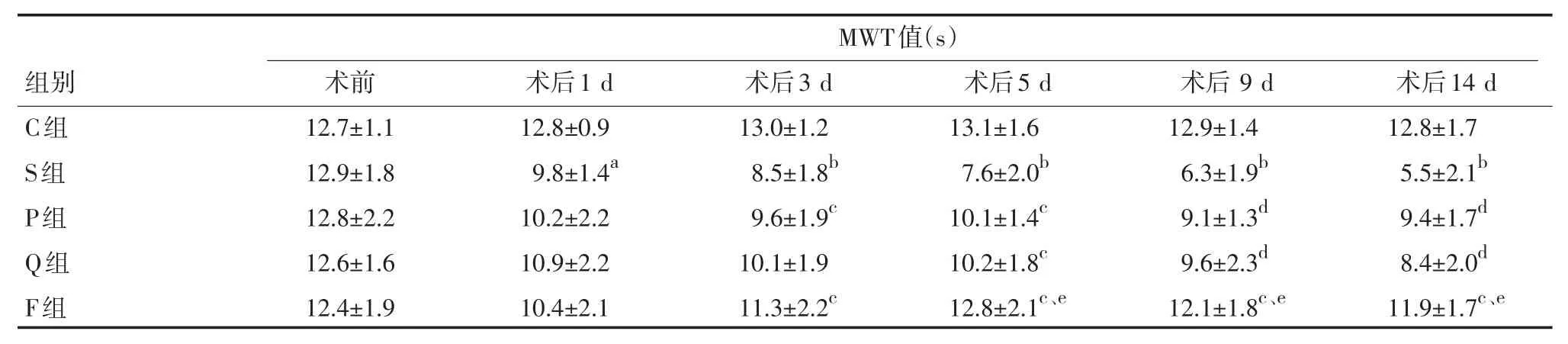
表1 各组大鼠MWT的比较(±s,n=6)
注:与C组比较:aP<0.05,bP<0.01;与S比较:cP<0.05,dP<0.01;与P组或Q组比较:eP<0.05
MWT值(s)组别C组S组P组Q组F组术前12.7±1.1 12.9±1.8 12.8±2.2 12.6±1.6 12.4±1.9术后1 d 12.8±0.9 9.8±1.4a10.2±2.2 10.9±2.2 10.4±2.1术后3 d 13.0±1.2 8.5±1.8b9.6±1.9c10.1±1.9 11.3±2.2c术后5 d 13.1±1.6 7.6±2.0b10.1±1.4c10.2±1.8c12.8±2.1c、e术后9 d 12.9±1.4 6.3±1.9b9.1±1.3d9.6±2.3d12.1±1.8c、e术后14 d 12.8±1.7 5.5±2.1b9.4±1.7d8.4±2.0d11.9±1.7c、e
2.3 血清TNF-a、IL-6水平 给药7 d后C组TNF-a、IL-6较S组显著升高(P<0.01);P、Q、F三组较C组明显降低(P<0.01或P<0.05),见图1。

图1 给药7 d后各组大鼠血清TNF-α、IL-6水平
2.4 5-HT和NE的表达 给药7 d后C组5-HT、NE较S组显著升高(P<0.01);P、Q、F三组较C组明显降低(P<0.01或P<0.05),见图2。
2.5 CD4+、CD8+的表达 给药7 d后C组CD4+、CD8+较S组显著降低(P<0.01);P、Q、F三组较C组升高(P<0.01或P<0.05),见图3。
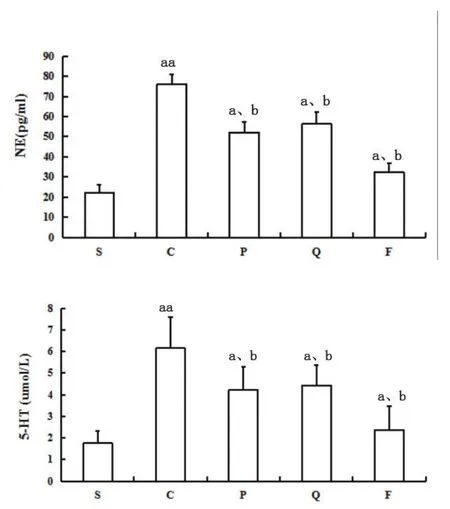
图2 给药7 d各组大鼠血清5-HT、NE水平
3 讨论
神经病理性疼痛的治疗是全球性的难题,其发病机制和治疗也成为医学和生物学中最富挑战的问题之一。即使采用现有最好的治疗方法,仍有半数以上患者因达不到满意的缓解而成为难治性患者。目前药物治疗仍是主要的治疗方法。目前多项国际指南规范了对神经病理性疼痛的处理[6-7]。指南推荐的药物包括抗癫痈药物、抗抑郁药物、阿片类药物、非甾体抗炎剂及局部用药。当单药治疗疗效不够理想时,可联合用药[8]。联合应用对中枢神经有多种作用机制的药物应是一种比较有应用前景的镇痛策略。理论上需要多种具有不同作用模式和作用机制的药物或不同治疗手段进行联合治疗,才能达到良好或满意的效果,同时因所使用药物剂量的较少,从而降低了不良反应的发生率[9]。

图3 给药7 d各组大鼠内CD4+、CD8+的测量值
近年来,随着对神经病理性疼痛机制的研究深入,发现免疫细胞和炎性细胞因子在神经病理性疼痛发生和持续过程中起着重要作用[10-11]。T淋巴细胞可以介导免疫应答反应,T淋巴细胞亚群中CD4+、CD8+细胞对稳定和调节免疫功能起着十分重要的作用。Cui等[11]在几个神经病理性疼痛模型中发现,在受损神经部位明显周围T淋巴细胞和自然杀伤细胞免疫细胞明显增加。Moalem等[12]进一步研究发现,成熟T淋巴细胞缺失的裸鼠坐骨神经损伤后,机械性触痛和热痛过敏明显轻于对照组的野生型大鼠;而将野生型大鼠的T1型淋巴细胞提取出来并注射到T淋巴细胞缺失的裸鼠体内后,裸鼠神经损伤后的痛敏减轻现象消失,提示神经损伤后的炎症反应很有可能为淋巴细胞介导的特异性免疫反应。TNF-α、IL-6是神经-内分泌-免疫功能系统中的重要炎性细胞因子,神经损伤后激活的免疫细胞,神经胶质细胞产生大量炎性因子TNF-α,IL-1β和IL-6等。炎性细胞因子通过结合在胶质细胞和神经元上激活的受体,提高神经元兴奋性,产生中枢敏化,导致痛阈降低。因此炎性细胞因子在疼痛的产生及维持中起着重要作用。5-HT和NE是与疼痛相关的神经递质,在疼痛过程中参与了致痛和镇痛两种过程的调节。在外周它们均是致痛因子,通过第二信使(钙离子、环核苷酸)作用于局部神经细胞或通过旁分泌方式进行调节,刺激感觉神经末梢而产生疼痛,通过检测外周血中的致痛因子浓度,可以在一定程度上反应出疼痛的程度。
普瑞巴林并不通过GABA机制直接发挥作用,其确切机制尚不明确。通过特异性和突触前膜P/Q型电压门控性钙通道α2-δ亚单位结合[13],阻断电压依赖性钙通道,减少Ca2+内流,减少大脑皮层谷氨酸盐、去甲肾上腺素和P物质等兴奋性神经递质的释放,使过度兴奋的神经元恢复常态而发挥抗癫痫、止痛、抗焦虑作用[14-16]。吴茱萸碱通过感觉神经脱敏而发挥镇痛作用[17];另外吴茱萸碱具有抗炎作用,可以通过调节相关炎症因子的表达从而在疼痛中产生一定的镇痛作用。其对炎性脚趾的痛阈值有提高作用,但对非炎性脚趾的痛阈值无影响。对醋酸引起的血管通透性增加有抑制作用[18-20]。
本实验在建立SNL模型后7 d,除S组大鼠活动如常,C组、P组、Q组、F组四组步态及姿势出现不同程度的异常,左侧患肢活动减少,无力,不能触地,爪不能伸展,有时突然舔嗜手术侧后爪或抖动。P组、Q组、F组三组给药3 d后开始,上诉症状逐渐缓解,尤其F组上诉症状表现轻微。C组大鼠术后,手术侧后爪有足趾并拢且常处于保护状态(悬与空中)。表明普瑞巴林联合吴茱英碱对神经病理性疼痛大鼠具有较好的协同镇痛作用,优于各自单独使用。给药7 d后C组TNF-α、IL-6、5-HT、NE较S组显著升高,CD4+、CD8+显著降低,均P<0.01,表明一些神经介质(如5-HT、NE、促炎细胞因子(如TNF-α、IL-6)和T细胞(CD4+、CD8+)的释放可能与疼痛有关。结果还提示给药7 d后P、Q、F三组血中的TNF-α、IL-6、5-HT、NE较C组明显降低,CD4+、CD8+升高,均P<0.05。表明两者合用能够使神经病理性疼痛家兔炎性细胞因子TNF-α、IL-6、5-HT、NE的表达下调;能够延缓神经病理性疼痛大鼠T淋巴细胞亚群CD4+、CD8+的下降。
总之,本研究的创新点在于使用两种药效的作用明确的药物联合用于神经病理性疼痛大鼠疼痛行为学和T细胞的影响研究,研究结果也显示联合用药的效果较单一用药的效果好,给临床治疗神经病理性疼痛提供了药效学的治疗依据。后期还应进一步的进行相关信号转导通路的研究,明确联合用药的作用机制。
[1]Banha N,Nakamura T,Matsumuka M,et al.Possible relation⁃shipof monocyte ehemoattractant protein-1 with diabetic nephropa⁃thy[J].KidIley Int,2003,58(2):684-690.
[2]Fehrenbacher JC,Taylor CP,Vasko MR.Pregabalin and gabapen⁃tin reduce release of substance P and CGRP from rat spinal tis⁃sues only after infla.mmation or activation of protein kinase C[J]. Pain,2003,105(1-2):133-141.
[3]Kumar N,Laferriere A,Yu JS,et al.Evidence that pregabalin re⁃duces neuropathic pain by inhibiting the spinal release of glutamate [J].J Neurochem,2010,113(2):552-561.
[4]Attal N,Lanteri-Minet M,Laurent B,et al.The specific disease burden of neuropathic pain:results of a French nationwide survey [J].Pain,2011,152(12):2836-2843.
[5]武玉清,周成华,张永.维拉帕米增强氯胺酮对神经病理性疼痛的拮抗作用[J].中国药理学通报,2012,28(4):512-517.
[6]Dworkin RH,O'Connor AB,Audette J,et al.Recommendations for the pharmacological management of neuropathic pain:an over⁃view and literature update[J].Mayo Clin Proc,2010,85(3):13-14.
[7]Attal N,Cruccu G,Baron R,et al.EFNS guidelines on the phar⁃ma cological treatment of neuropathic pain:2010 revision[J].Eur J Neurol,2010,17(9):1113-1118.
[8]Portenoy R.Development and testing of a neuropathic pain screen⁃ing questionnaire:ID Pain[J].Current Med Res Opinion,2006,22 (8):1555-1565.
[9]SeottL J,PerryCM,Tredol.A review of its use in perioperative Pain [J].Drugs,2000,60(1):139-176.
[10]Inoue K.The function of microglia through purinergic receptors: neuropathic pain and cytokine release [J].PharmacolTher, 2006,109(122):210-226.
[11]Cui JG,Holmin S,Mathiesen T,et al.Possible role of inflammato⁃ry mediators in tactile hypersensitivity in rat models of mononeu⁃ropathy[J].Pain,2000,88(3):239-248.
[12]Moalem G,Xu K,Yu L.T lymphocytes play a role in neuropathic pain following peripheral nerve injury in rats[J].Neuroscience, 2004,129(3):767-777.
[13]Taylor CP,AngelottiT,Fanman E.Pharmacology and mechanism of action of pregabalin:The calcium channelɑ2-δ(alpha 2-delta) subunit as a target for antiepileptic drug discovery[J].Epilepsy Res,2007,73(2):137-150.
[14]Sills GJ.The michanisms of action of gabapentin and pregabalin[J]. Cuit OpinPharmacol,2006,6(1):108-113.
[15]Kavoussi R.Pregabalin:From molecule to medicine[J].Eur Neuro⁃psychophanmacol,2006,16(SuppL):S128-S133.
[16]Rogawski MA.New Molecular Targets for Antiepileptic Drugs:ɑ 2-δ,SV2A,and Kv7/KCNQ/M Potassium Channels[J].Curr Neurol Neurosci Rep,2008,8(4):345-352.
[17]Kobayashi Y.The nociceptive and anti-nociceptive effects of evo⁃diamine from fruits of Evodia rutaccarpa in mice[J].Planta Med, 2003,69(5):425-428.
[18]Matsuda H,Wu JX,Tanaka T,et al.Antinociceptive activities of 70%metha-nol extract of Evodiae Fructus(Fruit of Evodia rutae⁃carpa,var.Bodinier)and its lkaloidal components[J].Biol Pharm Bull,1997,20(3):243.
[19]Greeshma N,Prasanth KG,Balaji B.Tetrahydrocurcumin exerts protective effect on vincristine induced neuropathy:Behavioral,bio⁃chemical,neurophysiologicaland histologicalevidence[J].Chem Biol Interact,2015,238(5):118-128.
[20]Xu YQ,Jin SJ,Liu N,et al.Aloperine attenuated neuropathic pain induced by chronic constriction injury via anti-oxidation ac⁃tivity and suppression of the nuclear factor kappa B pathway[J]. Biochem Biophys Res Commun,2014,451(4):568-573.
(收稿:2016-01-26 修回:2016-05-20)
(责任编辑 刘洪斌)
文稿所含图表的具体要求
本刊采用三横线表,如遇有合计和统计学处理内容(如t值、P值等),则在此行上面加一条分界横线;表内数据要求同一指标有效位数一致,一般按标准差的1/3确定有效位数。表格中注释用的角码符号采用单个角码的形式,按a、b、c、d、e、f…顺序选用,在表注中依先纵后横的顺序依次标出。单一角码用于表示P<0.05;若用表示P<0.01,则用双角码,如“aP<0.05;aaP<0.01”。线条图的高宽比例以5∶7为宜。
图片要求有良好的清晰度和对比度,建议采用tif格式,按其在正文中出现的先后次序连续编码。组织(病理)学图片应注明染色方法和放大倍数。图片若为人像,应征得本人的书面同意,或遮盖其能被辨认出系何人的部分。
照片的大小以9 cm×6 cm为宜,每幅照片的背面应贴上在正文中出现的序码并注明上下方向。大体标本照片应有尺度标记。照片中需标注的符号(包括箭头)请另用纸标上,不要直接写在照片上,照片不可折损。机上下载的大体和组织、细胞图片应改拍为像片刊出。
Effect of Pregabalin and Evodiamine on Cytokines and T Cells in a Rat Model of Neuropathic Pain
ZHANG Ling-bin,PAN Chen,ZHANG Ning,et al. Department of Anesthesiology,Lishui People's Hospital of Zhejiang Province,Lishui(323000),China
Objective To observe the effect of pregabalin and evodiamine on immune cells in a rat model of neuropathic pain. Methods Adult male Sprague-Dawley(SD)rats were subjected to left L5spinal nerve li⁃gation model(SNL).In a sham operation,the left L5spinal nerve was exposed but not ligated.Total 30 mice were randomly assigned to 5 groups(6 rats in each group):sham operation(Group S),control(Group C),pregaba⁃lin(Group P),evodiamine(Group Q)and pregabalin combined evodiamine(Group F).Seven days after SNL,rats in different groups were treated as follows:intraperitoneal injection of pregabalin(5 mg/kg)(Group P),intraperito⁃neal injection of evodiamine(5 mg/kg)(Group Q),intraperitoneal injection of pregabalin and evodiamine com⁃plexes(Group F),Rats in group C were received intraperitoneal injection of physiological saline(2 mL/kg).All treatment lasted for 7 days.From the beginning of the experiment,the changes of pain behavior in rats were observed every day.In the end,blood(3ml)was sampled from the aorta and examined for serum tu⁃mornecrosis factor-alpha (TNF-alpha),interleu⁃kin-6(IL-6),5-serotonin(5-HT),and norepinephrine(NE)and for CD4+and CD8+T lymphocytes. Results Spinal nerve ligation changed gait and posture in all related groups.However,gait and posture improved in Group P,Group Q,and Group F 10 days after SNL,especially in Group F.In Group F,serum levels of TNF-α, IL-6,NE,and 5-HT were significantly lower than those in the Group C(P<0.05).In Group C,CD4+and CD8+T cells were significantly less than Group S.Group F had more CD4+and CD8+T cells than Group C(P<0.01 or<0.05). Conclusion Joint use of pregabalin and evodiamine in rat model of neuropathic pain had good synergistic analgesic effect.The combination of the two medicines can decrease the expression of TNF-alpha, IL-6,5-HT,NE and delay the decrease in CD4+,CD8+T lymphocyte subsets in rats with pathological pain.
Neuropathic pain;pregabalin;evodiamine;pain behavior;immune cells
Q9-33;R971+.6
A
1007-6948(2016)04-0350-05
10.3969/j.issn.1007-6948.2016.04.011
浙江省中西医结合学会临床药学科研项目(2014LYZD005);浙江省丽水市高层次人才资助项目(2014RC35);浙江省医学会临床科研项目(2010ZYC-A48)
浙江省丽水市人民医院1.麻醉科;2.药学部;3.检验科(丽水 323000)
潘晨,E-mail:pan8chen@qq.com
——以吴茱萸为例

