Ⅰ型神经纤维瘤病合并腹膜后恶性外周神经鞘瘤1例报告并文献复习
刘 茁 田晓军马潞林 陆 敏
(北京大学第三医院泌尿外科,北京 100083)
·病例报告·
Ⅰ型神经纤维瘤病合并腹膜后恶性外周神经鞘瘤1例报告并文献复习
刘 茁 田晓军*马潞林**陆 敏①
(北京大学第三医院泌尿外科,北京 100083)
本文报道2016年6月我科对1例既往有Ⅰ型神经纤维瘤病的25岁男性患者行腹腔镜下腹膜后肿物切除术。术中因肿瘤底部较深且与骶骨、盆壁粘连较紧,中转为开放手术。手术时间185 min。术中出血1500 ml,输注悬浮红细胞400 ml。术后第2天拔除尿管,第7天拔除盆腔引流管,第8天出院。术后病理诊断为腹膜后恶性外周神经鞘瘤。术后随访1个月,左侧足面麻木感,左下肢肌力Ⅲ级,排便、排尿正常,未见肿瘤复发或转移。我们认为手术应尽可能完全切除恶性外周神经鞘瘤,如果肿瘤侵犯神经,常需要把受累神经一并切除,但可能会造成相应的功能障碍。
恶性外周神经鞘瘤; Ⅰ型神经纤维瘤病; 腹膜后
由良性的神经纤维瘤病(neurofibromatosis,NF)恶变而来的腹膜后恶性外周神经鞘瘤(malignant peripheral nerve sheath tumor,MPNST)临床罕见,临床表现和影像学缺乏特异性,诊断存在一定困难。MPNST恶性程度较高,易侵袭周围组织器官,手术难度大。我院2016年6月20日收治1例Ⅰ型神经纤维瘤病(neurofibromatosis type 1,NF1)合并腹膜后MPNST,现报道如下,旨在提高对该病的诊疗水平。
1 临床资料
患者男,25 岁,主因左侧腰痛2个月就诊。患者2个月前无明显诱因出现左侧牵拉样腰部剧痛,行走时加重,伴左下肢及阴囊部放射痛,20天前出现排尿及排便不畅。15年前因右侧腰部皮下肿物行手术切除,术后病理提示NF。家族中祖母、父亲患有神经纤维瘤病。查体:全身多发皮下结节,以胸腹背部为著,较大者直径约2 cm。全身皮肤散在黄褐色色斑,大小不一,无明显凸起。盆腔MRI平扫(图1):左侧腹膜外可见4.9 cm×8.6 cm等T1、混杂T2信号肿块影,拟与左侧骶孔相连,信号不均,病变与盆壁软组织界限不清。考虑左侧腹膜外占位性病变,恶性不除外,盆壁软组织受累可能。泌尿系增强CT示(图2):左侧腹膜外软组织密度团块影,范围7.8 cm×9.6 cm×9.3 cm,内密度不均匀,与盆壁软组织分界不清,累及骶骨、左侧髋关节、左侧坐骨,局部骨质欠规整,部分边缘可见硬化;增强扫描病变呈不均匀强化,可见低密度无强化区,直肠、膀胱及前列腺受压移位。2016年6月20日行腹腔镜下腹膜后肿物切除术。全身麻醉后取平卧位,留置F16尿管。五孔法。第一点位于脐下缘,向下做3 cm纵行切口,将气腹针穿入腹腔,建立CO2气腹,压力14 mm Hg(1 mm Hg=0.133 kPa)。置入直径10 mm trocar,置入腹腔镜;在左右腹直肌旁脐下3 cm分别置入12、10 mm trocar,用于置入超声刀或分离钳;在左右侧髂前上棘内上方3 cm各置入5 mm trocar,用于置入三叶钳协助暴露。分离肿瘤,血运丰富,为减少出血游离左侧髂内动脉及静脉,予结扎切断。肿瘤周边游离后,因底部较深且与骶骨、盆壁粘连较紧,腹腔镜游离肿瘤底部困难,中转为开放手术。取腹部正中切开。逐步游离并切除肿瘤。盆壁及骶骨创面使用双极刀电凝止血。观察无活动性出血后,创面覆盖止血纱布。留置盆腔引流管,逐层缝合伤口。手术时间185 min。术中出血1500 ml,输注悬浮红细胞400 ml。术后患者安返病房。术后第2天拔除尿管,第7天拔除盆腔引流管,第8天出院。盆腔肿物术后标本肉眼所见(图3):大小10 cm×8 cm×7 cm,切面灰白间灰黄灰红,局部可见出血,实性质软,部分囊性变,表面似有包膜,周围附脂肪组织。肿瘤细胞呈梭形(图4),异型性明显,核分裂像易见。免疫组化(图5):CD117(-),CD57(+),Desmin(-),DOG-1(-),GFAP(-),Ki-67(60%+),NeuN(-),NF(-),P53(异质性表达),S-100(+),Syn(+),MyoD1(-),CD34(+),EMA(-)。常规形态结合免疫组化,符合MPNST,呈浸润性生长,核分裂像>30个/10 HPF,可见多灶性凝固性坏死。术后随访1个月,左侧足面麻木感,左下肢肌力Ⅲ级,排便、排尿正常,未见肿瘤复发或转移。
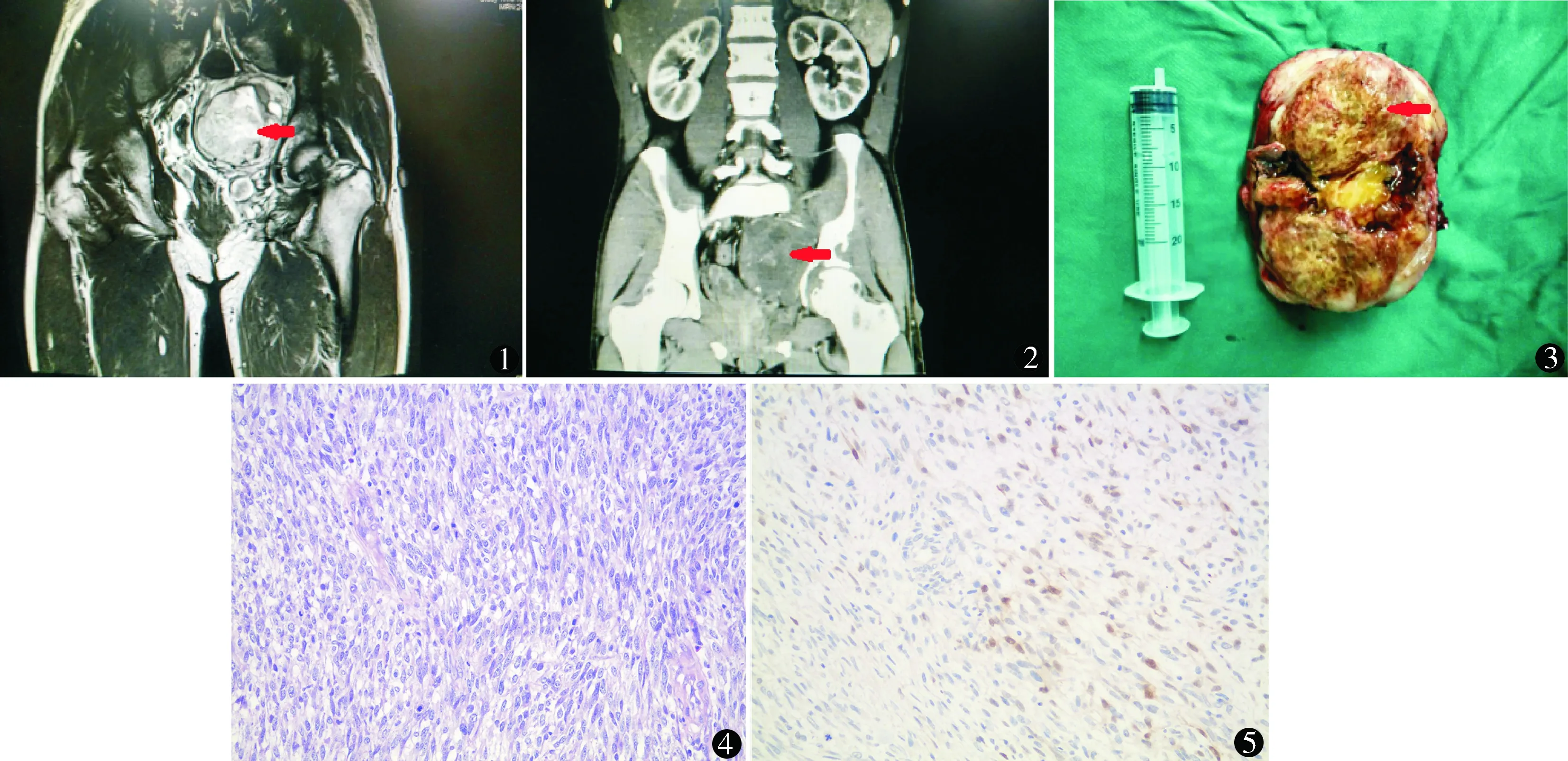
图1 盆腔MRI平扫示:左侧腹膜外可见一大小4.9 cm×8.6 cm占位性病变,盆壁软组织受累可能 图2 泌尿系增强CT示:左侧腹膜外软组织密度团块影,累及左侧髋关节,直肠、膀胱及前列腺受压移位 图3 术后肉眼所见大小10 cm×8 cm×7 cm,切面灰白间灰黄灰红,局部可见出血,实性质软,部分囊性变,表面似有包膜,周围附脂肪组织 图4 MPNST 肿瘤细胞梭形,异型性明显,核分裂像易见 HE染色 ×200 图5 MPNST 免疫组化显示部分细胞S-100阳性 免疫组化 ×200
2 讨论
MPNST是一种神经系统恶性软组织肿瘤。2002年世界卫生组织将原来的神经肉瘤、神经纤维肉瘤、恶性许旺氏细胞瘤及恶性神经鞘瘤统称为MPNST。MPNST占所有软组织肉瘤的3%~10%[1],发病年龄主要集中在40~50岁的成年人,男性多见。MPNST的组织发生方式有3种:即散发型,NF1的恶变,其他肿瘤放疗后或神经鞘瘤、节细胞瘤的恶变[2]。超过50%的MPNST患者曾被诊断为NF1[3]。NF1属常染色体显性遗传综合征,由Virchow 1847年首次报道。按照美国国家卫生研究院(National Institutes of Health,NIH)制定的NF诊断和分型标准,可分为NF1型与NF2型。NF1型发病基因定位于17q11.2,发病率为1/4000~1/3000,占所有NF的85%~90%,NF1型患者恶变的发生率为5%~10%[4]。本例患者属NF1恶变型。
MPNST的临床表现为四肢及躯干部进行性增大的痛性肿物。MPNST起病隐匿,肿物较大时查体可能触及软组织包块。若肿瘤压迫或侵犯神经,患者可表现为相应的神经症状。本例患者左侧腰部牵拉样剧痛伴随左下肢及阴囊部放射痛,考虑肿瘤侵犯相关神经所致,出现排尿及排便不畅,考虑肿块巨大压迫膀胱及直肠可能。对于NF1恶变而来的MPNST,查体可发现全身多处的皮肤牛奶咖啡色斑和弥漫的皮肤NF。
MPNST的CT表现为孤立或弥漫性肿块,大小不一,其内成分丰富,密度不均,增强时肿瘤实质可呈斑块状、岛屿状强化,常压迫、侵犯周围组织。宋曼等[5]报道1例腹膜后MPNST,CT提示肿物呈不规则混杂密度肿块影,其内可见片状低密度区、斑片索条状软组织密度影及钙化影;增强扫描肿块不均匀强化,肿物推挤右肾及右侧肾上腺,与周围组织边界不清;术中见肿物表面欠光滑,质硬,与周围组织器官广泛粘连,并侵犯右侧肾上腺及右侧肾周筋膜。本例CT显示肿物与盆壁软组织分界不清,累及骶骨、左侧髋关节、左侧坐骨。我们认为MPNST恶性程度较高,易侵袭周围组织器官。核磁共振成像(magnetic resonance imaging,MRI)对MPNST具有辅助诊断价值,但MRI在鉴别良性NF与MPNST方面具有重叠性。Wasa等[6]回顾性分析41例MPNST与20例良性NF的MRI表现,认为肿物体积>10 cm、外周强化、存在病灶周围水肿及瘤内囊性变等4个影像学特征中出现2个或2个以上时,应高度怀疑MPNST。本例MRI表现为等T1、混杂T2信号肿块影,信号不均,病变与盆壁软组织界限不清,盆壁软组织受累可能。我们认为NF1患者如果出现如下征象,应警惕恶变可能:①肿瘤体积明显增大;②瘤内信号不均匀;③边界不清、脂肪层受到侵及;④病灶周围水肿。因MPNST在临床表现和影像学上均缺乏特异性,故该病的诊断有一定困难,最终诊断依靠病理学。光学显微镜下常呈纤维肉瘤生长,细胞密集区与疏松区交替排列,偶可见特征性波浪样核,肿瘤以梭形细胞为主,呈圆形、巢团状,伴有异常核分裂象。肿瘤细胞由于软组织肉瘤细胞形态和组织结构具有多样性,常规染色切片难以鉴别[7]。免疫组织化学是重要的辅助诊断和鉴别诊断的手段。Ozdal等[8]认为S-100(+),cytokeratin(-),SMA(-),HMB45(-)对于诊断恶性外周神经鞘瘤具有高度敏感性。
手术是MPNST的首选治疗方法。手术应尽可能完全切除肿瘤,使切缘达到组织学阴性。如果肿瘤侵犯神经,常需把受累神经一并切除,但可能会造成相应的功能障碍,术后辅助放疗可有效降低复发率。Carli 等[9]回顾性分析1975~1998年167例MPNST的临床资料,其中38%患者选择术后放疗,中位随访7年后,术后辅助放疗可以有效降低复发率。Acharya 等[10]和Yone 等[11]也证实术后放疗有助于抑制肿瘤的生长并减少肿瘤的复发。本例因经济原因,术后未行放疗。化疗在MPNST 的应用效果存在争议,主要适用于无法手术切除或已发生广泛转移的患者[12]。目前,较常用的化疗药物是异环磷酰胺、蒽环霉素和阿霉素等[13]。合并NF1的MPNST预后较差。Le Guellec等[14]回顾性分析1990~2013年160例MPNST手术治疗的资料,其中64% MPNST合并NF1,且合并NF1者较不合并NF1者5年总体生存率降低(34.8%与68.5%),并且认为术后切缘阳性和不进行术后放疗是术后生化复发的独立预测因子。
1 Zou C, Smith KD, Liu J, et al. Clinical, pathological, and molecular variables predictive of malignant peripheral nerve sheath tumor outcome. Ann Surg,2009, 249(6):1014-1022.
2 Lafemina J, Qin LX, Moraco NH, et al. Oncologic outcomes of sporadic, neurofibromatosis-associated, and radiation-induced malignant peripheral nerve sheath tumors. Ann Surg Oncol, 2013, 20(1):66-72.
3 Schaefer IM, Fletcher CD. Malignant peripheral nerve sheath tumor (MPNST) arising in diffuse-type neurofibroma: clinicopathologic characterization in a series of 9 cases. Am J Surg Pathol, 2015, 39(9):1234-1241.
4 Widemann BC. Current status of sporadic and neurofibromatosis type 1-associated malignant peripheral nerve sheath tumors. Curr Oncol Rep,2009, 11(4):322-328.
5 宋 曼, 洪 楠. 腹膜后恶性外周神经鞘瘤1例.中国医学影像技术,2011, 27(8):1728.
6 Wasa J, Nishida Y, Tsukushi S, et al. MRI features in the differentiation of malignant peripheral nerve sheath tumors and neurofibromas. AJR Am J Roentgenol,2010,194(6):1568-1574.
7 Thway K, Fisher C. Malignant peripheral nerve sheath tumor: pathology and genetics. Ann Diagn Pathol, 2014,18(2):109-116.
8 Ozdal B, Oz M, Korkmaz E, et al. Malignant peripheral nerve sheath tumor of the vulva, an unusual differential diagnosis for vulvar mass. Int J Surg Case Rep, 2014, 5(11):793-795.
9 Carli M, Ferrari A, Mattke A, et al. Pediatric malignant peripheral nerve sheath tumor: the italian and German soft tissue sarcoma cooperative group. J Clin Oncol, 2005, 23(33):8422-8430.
10 Acharya R, Bhalla S, Sehgal AD. Malignant peripheral nerve sheath tumor of the cauda equina. Neurol Sci, 2001, 22(3):267-270.
11 Yone K, Ijiri K, Hayashi K, et al. Primary malignant peripheral nerve sheath tumor of the cauda equina in a child case report. Spinal Cord, 2004, 42(3):199-203.
12 Moretti VM, Crawford EA, Staddon AP, et al. Early outcomes for malignant peripheral nerve sheath tumor treated with chemotherapy. Am J Clin Oncol, 2011, 34(4):417-421.
13 Zehou O, Fabre E, Zelek L, et al. Chemotherapy for the treatment of malignant peripheral nerve sheath tumors in neurofibromatosis 1: a 10-year institutional review. Orphanet J Rare Dis, 2013, 8(1):1-7.
14 Le Guellec S, Decouvelaere AV, Filleron T, et al. Malignant peripheral nerve sheath tumor is a challenging diagnosis: a systematic pathology review, immunohistochemistry, and molecular analysis in 160 patients from the french sarcoma group database. Am J Surg Pathol, 2016, 40(7):896-908.
(修回日期:2016-08-12)
(责任编辑:李贺琼)
Type ⅠNeurofibromatosis With Retroperitoneal Malignant Peripheral Nerve Sheath Tumor: Case Report and Literature Review
LiuZhuo,TianXiaojun,MaLulin,etal.
DepartmentofUrology,PekingUniversityThirdHospital,Beijing100083,China
Correspondingauthor:MaLulin,E-mail:malulin@medmail.com.cn
【Summary】 This study reported one 25-year-old man with previous history of type Ⅰneurofibromatosis undergoing laparoscopic resection of abdominal mass in June 2016. Due to the tight adhesion between the bottom of tumor and sacral and pelvic wall, laparoscopic surgery was conversed to open surgery. The operation time was 185 min. During the operation, the blood loss was 1500 ml, and 400 ml of suspended red blood cells were infused. The catheter was removed 2 days after operation and the pelvic drainage tube was removed 7 days after operation. After 8 days the patient was discharged from hospital. The pathological results confirmed a retroperitoneal malignant peripheral nerve sheath tumor. Postoperative follow-up for 1 month found that the patient’s left foot surface was numbness, and the left lower extremity muscle strength was grade Ⅲ. The defecation and urination were normal. No tumor recurrence or metastasis was detected. We deem that laparoscopic or open surgery, which should be as complete as possible, is the preferred method of treatment. The nerve often needs to be removed if involved, but this may cause the corresponding dysfunction.
Malignant peripheral nerve sheath tumor; Type Ⅰ neurofibromatosis; Retroperitoneal
D
1009-6604(2016)11-1049-04
10.3969/j.issn.1009-6604.2016.11.025
2016-07-18)
并列第一作者
**通讯作者,E-mail:malulin@medmail.com.cn
①病理科

