直肠腔内超声在直肠癌新辅助放化疗的疗效评估中的应用价值
安县朝 高宗岭
直肠腔内超声在直肠癌新辅助放化疗的疗效评估中的应用价值
安县朝 高宗岭
目的 探讨直肠腔内超声(ERUS)在直肠癌新辅助放化疗的疗效评估中的应用价值。方法 收取175例直肠癌患者的临床资料进行回顾性分析,按照是否进行新辅助放化疗分为A、B组。对新辅助化疗前后患者超声表现及参数进行考察,并对术前2组患者T分期、N分期准确率进行考察与比较。结果 A组患者中43例对新辅助放化疗反应良好,18例反应一般,21例反应较差。新辅助放化疗后患者肿瘤长短径明显缩短,与新辅助化疗前相较差异有统计学意义(P<0.05),而与术中结果无统计学差异(P>0.05)。A组患者术前ERUS诊断T分期准确率为78.04%,诊断N分期准确率为80.49%,与B组患者准确率相较无统计学差异(P>0.05)。结论 直肠腔内超声可反映新辅助化疗前后直肠病灶改变,在直肠癌新辅助放化疗的疗效评估中具有一定价值。
直肠腔内超声;直肠癌;新辅助放化疗;分期
(ThePracticalJournalofCancer,2016,31:1854~1856)
直肠癌是我国常见的消化系统恶性肿瘤,居我国恶性肿瘤发病率第3位,且近年来呈明显升高趋势[1]。针对直肠癌的治疗多以手术治疗为首选方案,然而有些患者身体条件往往无法立即进行手术,需辅以新辅助放化疗对原发肿瘤进行控制,使肿瘤降期,以此提高手术切除率[2]。直肠腔内超声(ERUS)是直肠癌患者常用的辅助诊断手段,被认为是直肠癌较为准确的诊断方法,但是有研究报道,新辅助放化疗可能会影响ERUS诊断准确率[3]。本研究对近年来我院收治的直肠癌患者的影像学资料进行回顾性分析,以期对直肠腔内超声在新辅助放化疗疗效评估中的价值进行探讨,现进行如下报告。
1 资料与方法
1.1 一般资料
收取2012年3月至2015年3月间我院收治的175例直肠癌患者的临床资料进行回顾性分析,纳入及排除标准如下:①所有患者均进行直肠癌根治术,且在手术前后均接受ERUS;②均经术后病理学确诊为直肠癌;③有完整的影像学资料及临床资料;④排除合并其他系统严重疾病的患者。将175例患者按照是否进行新辅助放化疗分为A、B组。A组82例患者在直肠癌根治术前行新辅助放化疗。A组男性52例,女性30例;年龄29~78岁,平均年龄(59.2±8.5)岁;直肠腺癌64例,黏液腺癌13例,鳞状细胞癌5例。B组患者直接进行直肠癌根治术,共有患者93例,其中男性60例,女性33例;年龄34~76岁,平均年龄(58.7±10.6)岁;直肠腺癌75例,黏液腺癌15例,鳞状细胞癌3例。2组患者一般资料方面无显著差异(P>0.05),具有可比性。
1.2 治疗方法
A组患者进行新辅助放化疗,具体方案如下:①放疗方案:照射总剂量40~50 Gy,1.8~2.0 Gy/次,1次/d,每周进行5 d照射,共照射5周;②化疗方案:使用FOLFOX6方案(奥沙利铂200 mg静脉滴注,d1;亚叶酸钙200 mg静脉滴注,d1~d5,5-FU 750 mg静脉滴注,d1~d5),3周为1个疗程,共进行2个疗程。新辅助治疗结束后4周进行手术治疗。
1.3 检查方法
在新辅助放化疗前后,采用彩色多普勒超声诊断仪配置端扫式腔内探头,控制频率5.0~10.0 MHz。进行检查前患者需排空直肠,取左侧屈膝卧位。首先对患者进行直肠指检,以对肿瘤情况进行大致了解,之后置入超声探头,使其前段达到肿瘤水平之上。对肿瘤位置、性状、大小、形态、内部回声、血流情况等进行细致观察,同时需对直肠周围是否有淋巴结进行观察。
1.4 分期标准
参照直肠癌TNM分期标准进行T分期,具体可分为T0(未存在原发肿瘤)、T1(肿瘤浸润至黏膜下层)、T2(肿瘤浸润至肌层)、T3(肿瘤浸润穿透肌层并达浆膜下层,或侵犯至周围组织)以及T4(肿瘤浸润至浆膜层并侵犯其他脏器)。N分期可分为N0(未显示淋巴结,或淋巴结最大直径<5 mm)以及N1(淋巴结最大直径≥5 mm)。
1.5 统计学方法
本研究采用SPSS 18.0统计学软件,组间比较以率的形式表示,检验方法选择卡方检验;超声参数比较以均数±标准差的形式表示,检验方法选择t检验。假设检验标准为α=0.05。
2 结果
2.1 新辅助放化疗后超声表现
对A组患者新辅助化疗结束后进行ERUS,结果显示,43例患者对新辅助放化疗反应良好,占A组患者的52.44%(43/82),超声表现为肿瘤病灶明显缩小,黏膜及黏膜下层中强回声恢复完整,肠壁层次部分恢复;18例患者对新辅助放化疗反应一般,占A组患者的21.95%,超声表现为肿瘤病灶缩小,内部回声增强,但肠壁层次尚未恢复;21例患者对新辅助放化疗反应较差,占A组患者的25.61%,超声表现为肿瘤病灶无明显变化,内部回声仍为均匀低回声,肠壁层次未恢复。
2.2 新辅助放化疗前后超声参数比较
对新辅助放化疗前后超声各项参数进行比较,新辅助放化疗后患者肿瘤长短径明显缩短,与新辅助化疗前相较有统计学意义(P<0.05),而与术中结果无统计学差异(P>0.05)。见表1。

表1 新辅助放化疗前后超声参数比较±s)
注:a表示与新辅助放化疗前相较,P<0.05。
2.3 新辅助放化疗后ERUS与病理T、N分期比较
对新辅助放化疗后ERUS与病理T、N分期进行比较,结果显示,ERUS T分期诊断准确率为78.04%(64/82),ERUS N分期诊断准确率为80.49%(66/82)。见表2、表3。

表2 新辅助放化疗后ERUS与病理T分期比较/例
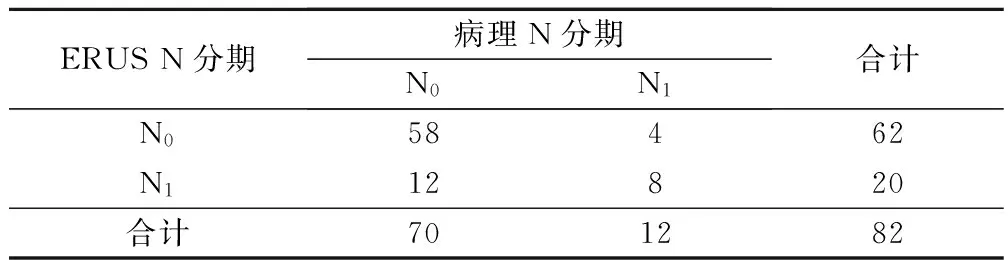
表3 新辅助放化疗后ERUS与病理N分期比较/例
2.4 2组患者术前ERUS诊断准确率比较
对2组患者术前ERUS诊断准确率进行比较,结果显示,2组患者术前ERUS诊断T分期及N分期均无统计学差异(P>0.05)。见表4。

表4 2组患者术前ERUS诊断准确率比较(例,%)
3 讨论
作为消化道常见的恶性肿瘤之一,针对直肠癌的标准治疗方案已逐渐明确,即以手术治疗为主的综合治疗[4]。然而,有些患者身体情况尚无法接受手术治疗,此时常需进行术前新辅助放化疗来进行局部控制。目前,术前新辅助放化疗已被NCCN列入直肠癌临床实践指南T3、T4期患者的常规治疗方案之中,成为其标准治疗方法[5]。将放射治疗与化疗联合使用,可在一定程度上互相补充,增强疗效。研究显示,新辅助放化疗可有效减少肿瘤原发病灶体积,控制肿瘤生长情况,降低肿瘤负荷,提高手术切除率,并且对于复发及转移的控制有一定效果[6]。
ERUS是直肠癌患者常用的辅助诊断方式,由于其操作时需将超声探头置入患者直肠内,因此可更加直观地对肿瘤病灶及周围组织情况进行细致入微的观察,且可将肠壁各层次之间的关系体现得清晰明了,对直肠癌分期具有良好的价值[7]。然而,有研究报道显示,新辅助放化疗可能会引起肠壁水肿或纤维化,对诊断准确率造成一定影响[8]。
本研究结果显示,大多数肿瘤对新辅助放化疗反应良好,新辅助放化疗可有效降低肿瘤长短径,减小肿瘤体积,这对于手术完全切除提供了保障。A组患者T分期准确率较低于B组患者,并且我们发现,对新辅助放化疗反应良好的患者,更易出现ERUS分期错误。究其原因,可能是因为对新辅助放化疗反应良好的患者大多可观察到肿瘤体积明显缩小,病灶可能被纤维组织所取代,并伴有周边炎症的发生。此时周边炎症的低回声可能与固有基层中残留的肿瘤病灶低回声相似,因此引起错误判断[9]。但2组患者T分期及N分期准确率差异并不具有统计学意义,这也证实了ERUS可在直肠癌新辅助放化疗后发挥诊断价值。
然而,不容忽视的是,在术前进行ERUS至进行手术之前的这段时间,肿瘤仍可能不断进展,这也有可能是影响术前ERUS准确性的因素之一。由本文结果可知,仍有部分患者对新辅助放化疗疗效不显著甚至较差,为期6周的治疗可能会导致这类患者病情进展。关于此点,我们建议在术前新辅助放化疗的过程中可多次进行ERUS,对病灶改变情况进行监视,及时调整治疗方案,以免耽误患者病情,最大化提高治疗效果[10]。
综上所述,直肠腔内超声可反映新辅助化疗前后直肠病灶改变,在直肠癌新辅助放化疗的疗效评估中具有一定价值。
[1] De Felice F,Musio D,Izzo L,et al.Neoadjuvant chemoradiotherapy for locally advanced rectal cancer:The debate continues〔J〕.World J Gastrointest Oncol,2014,6(12):438-440.
[2] Clancy C,Burke JP,Coffey JC.KRAS mutation does not predict the efficacy of neo-adjuvant chemoradiotherapy in rectal cancer:a systematic review and meta-analysis〔J〕.Surg Oncol,2013,22(2):105-111.
[3] Glimelius B.Neo-adjuvant radiotherapy in rectal cancer〔J〕.World J Gastroenterol,2013,19(46):8489-8501.
[4] Phang PT,Wang X.Current controversies in neoadjuvant chemoradiation of rectal cancer〔J〕.Surg Oncol Clin N Am,2014,23(1):79-92.
[5] 沈忠磊.T3a期直肠癌患者进行新辅助放化疗的疗效观察〔D〕.浙江大学,2015.
[6] 刘文扬,金 晶.中期和局部晚期老年直肠癌辅助放化疗进展〔J〕.中华结直肠疾病电子杂志,2016,5(1):21-26.
[7] 迟 芳.直肠腔内超声在临床中的应用价值〔J〕.中国实用医药,2016,11(5):75-76.
[8] 郝雅静,邢 军,任基伟.直肠癌新辅助放化疗影像学疗效评价现状及展望〔J〕.医学综述,2014,20(19):3580-3582.
[9] 王钰全.直肠癌术前新辅助放化疗的降期价值〔J〕.中国实用医药,2014,9(1):86-87.
[10] 彭海花,游凯云,王成涛,等.经直肠超声对局部进展期直肠癌新辅助放化疗后再分期的诊断价值〔J〕.中华胃肠外科杂志,2013,16(12):1203-1207.
(编辑:甘 艳)
Application of ERUS in Efficacy Evaluation of Rectal Cancer Treated with Neoadjuvant Chemoradiotherapy
ANXianchao,GAOZongling.
SecondAffiliatedHospitalofShaanxiUniversityofChineseMedicine,Xianyang,712000
Objective To explore the application of ERUS in efficacy evaluation of rectal cancer treated with neoadjuvant chemoradiotherapy.Methods 175 cases of rectal cancer were retrospectively analyzed and divided into group A and group B according to neoadjuvant chemoradiotherapy.Ultrasound appearance and indexes before and after treatment were observed,and accurancy of T stage and N stage were compared.Results 43 patients of group A had good response to neoadjuvant chemoradiotherapy,18 patients had normal response and 21 patients had bad response.Tumor size decreased after neoadjuvant chemoradiotherapy,which had statistically difference compared to before treatment(P<0.05).Accuracy of T stage of group A was 78.04%,of N stage was 80.49%,which had no statistical difference with group B(P>0.05).Conclusion ERUS can show the change of lesions after neoadjuvant chemoradiotherapy,which has some value in efficacy evaluation of rectal cancer treated with neoadjuvant chemoradiotherapy.
ERUS;Rectal cancer;Neoadjuvant chemoradiotherapy;Stage
712000 陕西中医药大学第二附属医院
10.3969/j.issn.1001-5930.2016.11.034
R735.3+7
A
1001-5930(2016)11-1854-03
2016-05-15
2016-10-11)

