成团泛菌(Pantoea agglomerans)对镉胁迫下蒌蒿耐受性的影响
周小梅,赵运林,董萌,库文珍,梁曾恩妮
1. 湖南城市学院建筑与城市规划学院,益阳 413000 2. 中南林业科技大学,长沙 410004 3. 湖南城市学院化学与环境工程学院,益阳 413000 4. 湖南省农产品加工研究所,长沙 410125
成团泛菌(Pantoea agglomerans)对镉胁迫下蒌蒿耐受性的影响
周小梅1,赵运林2,*,董萌3,库文珍3,梁曾恩妮4
1. 湖南城市学院建筑与城市规划学院,益阳 413000 2. 中南林业科技大学,长沙 410004 3. 湖南城市学院化学与环境工程学院,益阳 413000 4. 湖南省农产品加工研究所,长沙 410125
为探讨功能微生物对镉(Cd)胁迫下蒌蒿耐受性的影响,以成团泛菌(Pantoea agglomerans)J2为对象,通过盆栽试验,研究不同Cd处理水平下J2菌对蒌蒿生长、生理、Cd富集转运与根际微生态的影响。结果表明:J2菌可显著促进蒌蒿株高、地上部干重、地下部干重、总生物量及根冠比的增加。在J2菌的作用下,蒌蒿叶绿素a、叶绿素b和总叶绿素含量以及超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性均显著增加,丙二醛(MDA)含量明显减少。J2菌可显著促进蒌蒿对Cd的富集转运,蒌蒿地上部、地下部与总Cd含量均显著增加,地上部生物富集系数(BCF)明显大于地下部,转运系数(TF)相比于对照增加了7.5%~37.4%。J2菌可显著增加蒌蒿根际土壤细菌、放线菌数量及微生物总量,明显减少真菌数量。研究表明成团泛菌J2对蒌蒿生长、生理、Cd富集转运与根际微生态可产生积极影响,在一定程度上可提高蒌蒿植株对Cd的耐受性。
成团泛菌;镉胁迫;蒌蒿;耐受性
Received 25 February 2016 accepted 22 April 2016
镉(Cd)是毒性极强且非人体必需的重金属元素,土壤中的Cd一旦被农作物吸收富集,通过食物链将极大地危害人类健康。蒌蒿(Artemisia selengensis Turcz.)菊科蒿属多年生草本植物,俗称藜蒿、芦蒿、泥蒿、水蒿等,洞庭湖湿地优势植物。蒌蒿对Cd具较强的富集转运能力,对Cd的积累主要表现在地上部,是一种较具潜力的洞庭湖湿地Cd污染土壤修复植物[1],但由于生物量相对较小等原因,影响了其在洞庭湖湿地Cd污染土壤修复中的运用。
功能微生物近年来被广泛运用于促进植物的生长,增强植物对逆境的适应,改善土壤的微生物环境,提高植物对重金属污染土壤的修复效果[2-4]等。因此,研究Cd胁迫下蒌蒿对接种功能微生物的响应机制极其重要。Luo等[5]研究表明,接种内生细菌可促使龙葵(Solanum nigrum)根部与地上部生物量显著增加,并降低重金属Cd对植物的毒害效应。Zhang等[6]研究发现,内生促生细菌可显著增加植株体内过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性,进而可抵御由逆境胁迫所产生的氧化伤害。Sun等[7]研究发现,铜抗性细菌可显著增加铜向油菜(Brassica napus)茎叶部的转运,明显提高油菜茎叶部分铜的含量。韩坤等[8]将具1-氨基环丙烷-1-羧酸(ACC)脱氨酶活性Bacillus sp.菌株接种到盐胁迫下小麦的根系,结果表明,小麦幼苗的干物质重和叶绿素含量明显增加,SOD、POD、CAT活性显著增强,可缓解由盐胁迫所产生的毒害效应。赵青云等[9]研究表明,施用根际促生菌Bacillus subtilis Y-IVI,可促进香草兰地上部干重和根系干重的增加,可改善香草兰的根际微生态。但鲜有在Cd胁迫条件下,功能微生物对蒌蒿生长、生理与根际微生态的影响研究。
据此,本研究欲通过盆栽试验,以具促生功能的Cd抗性成团泛菌(Pantoea agglomerans)J2为对象,探讨功能微生物对不同Cd处理水平下蒌蒿生长、Cd富集转运、抗性生理和根际微生态的影响,以揭示功能微生物对Cd胁迫下蒌蒿耐受性的影响机制,为构建一种有效的洞庭湖湿地Cd污染土壤修复技术提供科学依据。
1 材料与方法(Materials and methods)
1.1 供试材料
菌株J2分离自蒌蒿体中,经鉴定为成团泛菌(Pantoea agglomerans)。能分泌吲哚乙酸(IAA),且对Cd2+的耐受浓度为90 mg·L-1[10]。在超净工作台上,用无菌接种环挑取少量J2菌体,接种于装有液体LB培养基的三角瓶中。于振荡培养箱内,30 ℃、150 r·min-1震荡培养16 h,菌液4 ℃、8 000 r·min-1离心5 min,再用无菌生理盐水润洗2次,然后用无菌生理盐水调节菌悬液浓度为5.2×108cfu·mL-1,制成接种菌剂。
蒌蒿植株取自南洞庭湖管竹山(112°19′33.4″E,28°55′14.9″N)。为保证试验用苗的一致性,从移栽成活后的蒌蒿植株中剪取长势基本一致的带3芽的蒌蒿茎段若干于湖南城市学院的苗圃大棚进行扦插与常规养护管理。
基质是采用由草炭、蛭石和珍珠岩按3:1:1比例混合而成的营养土,经测定有机质含量为395 g·kg-1,全氮含量为11.6 g·kg-1,全磷含量为1.15 g·kg-1,全钾含量为10.2 g·kg-1,pH值为6.85,全Cd含量为0.25 mg·kg-1,经自然风干与灭菌处理后,施入N、P、K复合肥100 mg·kg-1,再添加不同浓度的Cd(以Cd2+计算),使培养基质中Cd2+浓度分别为0、10、20、30 mg·kg-1,拌匀,于实验室平衡备用。
1.2 试验设计
2014年8月18日,将经处理且平衡了45 d的基质进行装盘,孔穴盘的底径为3 cm,上口径为6.2 cm,高为8.5 cm,每穴称装基质100 g。取菌剂50 mL,与基质充分混匀,以等量无菌生理盐水为对照。挑选健壮、长势基本一致的蒌蒿扦插苗(带3片完全展开叶)移栽至孔穴盘,每处理移栽16株。浇透水,置于湖南城市学院苗圃大棚,正常养护管理60 d后,取样进行各指标的测定。
1.3 测定方法
将蒌蒿植株从孔穴盘中取出,自来水下冲冼干净,为去除吸附在根表面的Cd2+,将蒌蒿植株置于浓度为20 mmol·L-1的Na2-EDTA溶液中浸泡20 min,再用去离子水反复冲冼并用滤纸吸干多余水分。用直尺量取蒌蒿植株的株高,并将蒌蒿植株分为地上部和地下部,置于烘箱中,105 ℃杀青15 min,再于75 ℃下烘干至恒重,称取地上部、地下部及总干重并计算根冠比,根冠比=地下部干重/地上部干重。
取蒌蒿植株地上部和地下部干样,研磨粉碎,分别称取0.2 g样品,参照梁泰帅等[11]方法进行消解,采用岛津AA-6300型石墨炉原子吸收分光光度计(标准曲线线性关系系数为99.8%以上、回收率范围为97.2%~104.3%)进行地上部和地下部Cd含量的测定,并计算总Cd含量,生物富集系数(BCF)=植株组织中Cd含量/土壤中Cd含量,以及转运系数(TF)=植株地上部Cd含量/植株地下部Cd含量。
选取蒌蒿植株的第4叶进行叶绿素含量,丙二醛(MDA)含量,SOD、POD和CAT活性的测定。叶绿素含量,SOD、POD和CAT活性的测定参照李合生[12]的方法,MDA含量的测定参照Cakmak和Marschner[13]的方法。
将蒌蒿植株从孔穴盘中取出,轻轻抖动,将附着在根系上的土视为根际土壤。取根际土壤进行细菌、真菌和放线菌数量的测定,细菌、真菌和放线菌数量采用稀释平板计数法进行测定[14]。
1.4 统计分析
所有数据均为3次独立试验的平均值,以平均值±标准差来进行表示,SPSS19.0进行统计分析,LSD做差异显著性分析。
2 结果与讨论(Results and discussion)
2.1 成团泛菌对镉胁迫下蒌蒿生长特性的影响
生物量与株高的变化是植物对Cd胁迫反应的综合体现[15],从表1可知,随Cd胁迫浓度的增加蒌蒿株高、地上部干重、地下部干重以及总干重均呈先升后降的趋势,在CK 20处理水平下均达最大值。相比于单一Cd胁迫,蒌蒿株高在J2 20和J2 30处理水平下显著增加5.1%和5.6%,地上部干重、地下部干重、总干重在所有的处理水平下均显著增加,地上部干重增幅为11.6%~16.7%,地下部干重增幅为41.7%~66.7%,总干重增加了14.3%~18.8%。这说明成团泛菌J2对蒌蒿的生长产生积极影响。推测原因可能是由于菌株能分泌IAA,可增加蒌蒿植物对土壤中水分和养分的吸收,并从形态等方面来调控植株的生长发育[16]。
根冠比是反映植物根部和地上部生长的重要指标,也是评估在Cd胁迫下植物耐受能力强弱的可靠标准[15]。从表1可知,随Cd胁迫浓度的增加蒌蒿根冠比呈先升后降的趋势,在CK 20处理水平下达最大值。相比于单一Cd胁迫,蒌蒿根冠比在成团泛菌J2作用下显著增加了22.1%~48.3%。根冠比的增加说明光合产物向根系供给的比例增加[15]。蒌蒿植株生物量、株高以及根冠比的增加,可进一步说明成团泛菌J2可增强植株对Cd胁迫的适应性反应。
2.2 成团泛菌对镉胁迫下蒌蒿叶绿素含量的影响
叶绿素含量的高低通常可作为植物抗性生理与光合能力强弱的评价指标[17]。逆境胁迫会破坏叶绿体的结构,从而影响叶绿素的生物合成[18]。接种功能微生物可提高植物的抗逆性,从而可保障叶绿素酶的催化能力[19-20]。从表2可以看出,随Cd胁迫浓度的增加蒌蒿叶绿素a、叶绿素b和总叶绿素含量均呈先升后降的趋势,在CK10处理水平下均达最大值。相比于单一Cd胁迫,蒌蒿叶绿素a含量在J2 20处理水平下显著增加6.6%,叶绿素b和总叶绿素含量在所有的处理水平下均显著增加,叶绿素b含量的增幅为11.3%~20%,总叶绿素含量的增幅为7.7%~9.6%。叶绿素含量的增加表明成团泛菌J2在一定程度上可增加蒌蒿植株的光合积累和抗逆性。

表1 成团泛菌(J2)对镉胁迫下蒌蒿生长特性的影响
注:同列不同小写字母表示5%水平上的差异显著,下同。
Note: The different small letters in the same column mean significant difference at the level of 5%. The same as followed.

表2 成团泛菌对镉胁迫下蒌蒿叶绿素含量的影响

表3 成团泛菌对镉胁迫下蒌蒿MDA含量与抗氧化酶活性的影响
2.3 成团泛菌对镉胁迫下蒌蒿MDA含量和抗氧化酶活性的影响
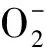
2.4 成团泛菌对镉胁迫下蒌蒿Cd富集转运的影响
从表4可知,相比于CK 0,蒌蒿地下部、地上部与总Cd含量均显著增加,且随Cd胁迫浓度的增加呈上升趋势。与单一Cd胁迫相比,成团泛菌促进了蒌蒿对Cd的吸收,蒌蒿地下部Cd含量在J2 20和J2 30处理水平下显著增加9.4%和9.8%,地上部Cd含量在J2 10、J2 20和J2 30处理水平下显著增加12.7%、49.6%和38.8%,总Cd含量在J2 10、J2 20和J2 30处理水平下明显增加9.1%、30.9%和25.5%。
BCF是评价植物从土壤中富集重金属能力强弱的指标[11,24],从表4可以看出,蒌蒿地上部BCF要明显大于地下部,表明地上部是蒌蒿Cd的主要富集部位,在CK 10处理水平下蒌蒿地上部与地下部的BCF均达最大值,且随Cd胁迫浓度的进一步增加,BCF呈下降趋势。与单一Cd胁迫相比,蒌蒿地上部BCF在J2 10、J2 20和J2 30处理水平下显著增加12.5%、50.0%和38.9%,地下部BCF在J2 10、J2 20和J2 30处理水平下显著增加4.4%、8.8%和9.4%。
转运系数(TF)可用来评价植物将重金属由地下部转运至地上部的能力[11,24],从表4可知,随Cd胁迫浓度的增加,蒌蒿转运系数基本呈下降趋势。相比于单一Cd胁迫,蒌蒿转运系数在成团泛菌J2作用下增加了7.5%~37.4%。
相关研究表明,内生细菌可通过分泌低分子有机酸和合成铁载体等途径来活化土壤中的重金属元素,从而促进植物的吸收[25];可通过分泌有机配位体与重金属螯合,改变植物体内重金属的分布与存在形态,从而促进重金属向植物茎叶部的转运[26]。在本研究中,蒌蒿植株地下部Cd含量、地上部Cd含量和总Cd含量均显著增加,说明成团泛菌J2可促进蒌蒿对Cd的吸收。蒌蒿植株地下部BCF、地上部BCF和TF均明显增加,并且地上部BCF的增幅明显大于地下部BCF,表明成团泛菌J2有利于蒌蒿对Cd的富集与转运。

表4 成团泛菌对镉胁迫下蒌蒿Cd富集转运特征的影响
2.5 成团泛菌对镉胁迫下蒌蒿根际土壤微生态的影响
土壤微生物数量的变化可作为土壤环境质量评价的生物指标[27]。接种功能微生物可增强土壤微生物的活性,减少有害菌株的数量和比例,促使土壤生态系统向更健康的方向发展[28]。研究表明,随Cd胁迫浓度的增加,蒌蒿根际土壤细菌、真菌、放线菌数量以及微生物总数均呈先升后降的趋势,在CK 10处理水平下真菌数量达最大值,在CK 20处理水平下细菌、放线菌数量以及微生物总数均达到最大值。相比于单一Cd胁迫,蒌蒿根际土壤细菌数量在J2 10、J2 20和J2 30处理水平下显著增加23.6%、59.1%和35.9%,微生物总数在J2 10、J2 20和J2 30处理水平下显著增加25.3%、51.2%和33.2%,放线菌数量在J2 0、J2 10和J2 20处理水平下明显增加13.0%、36.8%和9.0%,而真菌数量在J2 10处理水平下显著减少了11.7%。分析原因可能是由于接种成团泛菌J2促进了蒌蒿植株的生长,增强了蒌蒿根系并增加了其脱落物,可为特定微生物的繁殖提供营养,从而导致微生物数量,尤其是细菌和放线菌数量的大幅增加,并对真菌的繁殖产生抑制作用[29]。这也表明成团泛菌J2在一定程度上可改善受损的土壤生态系统,能为蒌蒿植株的生长提供一个较好的土壤环境。

表5 成团泛菌对镉胁迫下蒌蒿根际土壤微生物数量的影响
[1] 董萌, 赵运林, 雷存喜, 等. 洞庭湖湿地Cd富集植物蒌蒿(Artemisia selengensis)的耐性生理机制研究[J]. 生态毒理学报, 2013, 8(1): 111-120
Dong M, Zhao Y L, Lei C X, et al. Physiological mechanism of Cd-tolerance of Artemisia selengensis grown in Dongting Lake Wetland [J]. Asian Journal of Ecotoxicology, 2013, 8(1): 111-120 (in Chinese)
[2] Zhang X X, Li C J, Nan Z B. Effects of cadmium stress on growth and anti-oxidative systems in Achnatherum inebrians symbiotic with Neotyphodium gansuense [J]. Journal of Hazardous Materials, 2010, 175: 703-709
[3] Sheng X F, Sun L N, Huang Z, et al. Promotion of growth and Cu accumulation of bio-energy crop (Zea mays) by bacteria: Implications for energy plant biomass production and phytoremediation [J]. Journal of Environmental Management, 2012, 103: 58-64
[4] Ma Y, Rajkumar M, Freitas H. Improvement of plant growth and nickel uptake by nickel resistant-plant growth promoting bacteria [J]. Journal of Hazardous Materials, 2009, 166: 1154-1161
[5] Luo S L, Chen L, Chen J L, et al. Analysis and characterization of cultivable heavy metal-resistant bacterial endophytes isolated from Cd-hyperaccumulator Solanum nigrum L. and their potential use for phytoremediation [J]. Chemosphere, 2011, 85: 1130-1138
[6] Zhang B L, Shang S H, Zhang H T, et al. Sodium chloride enhances cadmium tolerance through reducing cadmium accumulation and increasing anti-oxidative enzyme activity in tobacco [J]. Environmental Toxicology and Chemistry, 2013, 32(6): 1420-1425
[7] Sun L N, Zhang Y F, He L Y, et al. Genetic diversity and characterization of heavy metal-resistant-endophytic bacteria from two copper-tolerant plant species on copper mine wasteland [J]. Bioresource Technology, 2010, 101: 501-509
[8] 韩坤, 田曾元, 刘珂, 等. 具有ACC脱氨酶活性的海滨锦葵(Kosteletzkya pentacarpos)内生细菌对小麦耐盐性的影响[J]. 植物生理学报, 2015, 51(2): 212-220
Han K, Tian Z Y, Liu K, et al. Effect of endophytic bacteria with ACC deaminase activity in Kostel etzkya pentacarpos on wheat salt tolerance [J]. Plant Physiology Journal, 2015, 51(2): 212-220 (in Chinese)
[9] 赵青云, 赵秋芳, 王辉, 等. 根际促生菌Bacillus subtilis Y-IVI在香草兰上的应用效果研究[J]. 植物营养与肥料学报, 2015, 21(2): 535-540
Zhao Q Y, Zhao Q F, Wang H, et al. Beneficial effects of plant growth promoter rhizobacteria on vanilla (Vanilla planifolia Ames.) growth [J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(2): 535-540 (in Chinese)
[10] 周小梅, 赵运林, 胥正钢, 等. 分泌吲哚乙酸的蒌蒿内生耐镉细菌的筛选与鉴定[J]. 生态环境学报, 2014, 23(12): 1980-1985
Zhou X M, Zhao Y L, Xu Z G, et al. Screening and identification of indole acetic acid-producing cadmium-resistant endophytic bacteria from Artemisia selengensis [J]. Ecology and Environmental Sciences, 2014, 23(12): 1980-1985 (in Chinese)
[11] 梁泰帅, 刘昌欣, 康靖全, 等. 硫对镉胁迫下小白菜镉富集、光合速率等生理特性的影响[J]. 农业环境科学学报, 2015, 34(8): 1455-1463
Liang T S, Liu C X, Kang J Q, et al. Effects of sulfur on cadmium accumulation, photosynthesis and some other physiological characteristics of pakchoi (Brassica chinensis L.) under cadmium stress [J]. Journal of Agro-Environment Science, 2015, 34(8): 1455-1463 (in Chinese)
[12] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 165-170
[13] Cakmak I, Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase and glutathione reductase in bean leaves [J]. Journal of Plant Physiology, 1992, 98: 1222-1227
[14] 李振高, 骆永明, 滕应. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008: 90-92
[15] 金香琴, 杨萌尧, 何春光, 等. 菲胁迫下湿生植物美人蕉(Canna indica)对斜生栅藻(Scenedesmus obliquus)生长的影响[J]. 生态毒理学报, 2015, 10(2): 290-296
Jin X Q, Yang M Y, He C G, et al. Effect of wetland plants Canna indica on the growth of Scenedesmus obliquus under phenanthrene stress [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 290-296 (in Chinese)
[16] Gao Y G, Liu Q, Zang P, et al. An endophytic bacterium isolated from Panax ginseng C.A. Meyer enhances growth, reduces morbidity, and stimulates ginsenoside biosynthesis [J]. Phytochemistry Letters, 2015, 11: 132-138
[17] 刘俊祥, 孙振元, 勾萍, 等. 镉胁迫下多年生黑麦草的光合生理响应[J]. 草业学报, 2012, 21(3): 191-197
Liu J X, Sun Z Y, Gou P, et al. Response of photosynthetic physiology of perennial ryegrass (Lolium perenne) to Cd2+stress [J]. Acta Prataculturae Sinica, 2012, 21(3): 191-197 (in Chinese)
[18] Baryla A, Carrier P, Franck F, et al. Leaf chlorosis in oil seed rape plant (Brassica napus) grown on cadmium polluted soil: Caused and consequences for photosynthesis and growth [J]. Planta, 2001, 212: 696-709
[19] 张晖, 宋圆圆, 吕顺, 等. 香蕉根际促生菌的抑菌活性及对作物生长的促进作用[J]. 华南农业大学学报, 2015, 36(3): 65-70
Zhang H, Song Y Y, Lv S, et al. The antifungal activity and crop growth stimulation of growth-promoting rhizobacteria from banana rhizosphere soil [J]. Journal of South China Agricultural University, 2015, 36(3): 65-70 (in Chinese)
[20] 冯世鑫, 莫长明, 唐其, 等. 枯草芽孢杆菌肥在罗汉果上应用的效应分析[J]. 广西植物, 2015, 35(6): 807-811
Feng S X, Mo C M, Tang Q, et al. Effects of the bio-fertilizer of Bacillus subtilis on the application of Siraitia grosvenorii [J]. Guihaia, 2015, 35(6): 807-811 (in Chinese)
[21] 贾新平, 邓衍明, 孙晓波, 等. 盐胁迫对海滨雀稗生长和生理特性的影响[J]. 草业学报, 2015, 24(12): 204-212
Jia X P, Deng Y M, Sun X B, et al. Impacts of salt stress on the growth and physiological characteristics of Paspalum vaginatum [J]. Acta Prataculturae Sinica, 2015, 24(12): 204-212 (in Chinese)
[22] 张银秋, 台培东, 李培军, 等. 镉胁迫对万寿菊生长及生理生态特征的影响[J]. 环境工程学报, 2011, 5(1): 195-200
Zhang Y Q, Tai P D, Li P J, et al. Effects of cadmium stress on the growth and physiological characteristics of Tagetes erecta L. [J]. Chinese Journal of Environmental Engineering, 2011, 5(1): 195-200 (in Chinese)
[23] 张怀山, 赵桂琴, 栗孟飞, 等. 中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答[J]. 草业学报, 2014, 23(2): 180-188
Zhang H S, Zhao G Q, Li M F, et al. Physiological responses of Pennisetum longissimum var. intermedium seedlings to PEG, low temperature and salt stress treatments [J]. Acta Prataculturae Sinica, 2014, 23(2): 180-188 (in Chinese)
[24] 詹淑威, 潘伟斌, 赖彩秀, 等. 外源有机酸对小飞扬草(Euphorbia thymifolia L.)修复镉污染土壤的影响[J]. 环境工程学报, 2015, 9(10): 5096-5102
Zhan S W, Fan W B, Lai C X, et al. Effects of exogenous organic acids on phytoremediation of Cd-contaminated soil by Euphorbia thymifolia L. [J]. Chinese Journal of Environmental Engineering, 2015, 9(10): 5096-5102 (in Chinese)
[25] Sheng X F, He L Y, Wang Q Y, et al. Effects of inoculation of biosurfactant-producing Bacillus sp. J119 on plant growth and cadmium uptake in a cadmium-amended soil [J]. Journal of Hazardous Materials, 2008, 155: 17-22
[26] Ma Y, Rajkumar M, Freitas H. Isolation and characterization of Ni mobilizing PGPB from serpentine soils and their potential in promoting plant growth and Ni accumulation by Brassica sp. [J]. Chemosphere, 2009, 75: 719-725
[27] Yuan B C,Yue D X. Soil microbial and enzymatic activities across a chronosequence of Chinese pine plantation development on the Loess Plateau of China [J]. Pedosphere, 2012, 22(1): 1-12
[28] Ma Y H, Yin S L, Zhang L P, et al. Effects of complex microbial agent on microorganism population and soil enzyme activity in the cucumber rhizosphere soil [J]. Plant Protection, 2012, 38(2): 46-50
[29] Caravaca F, Maboreke H, Kurth F, et al. Synergists and antagonists in the rhizosphere modulate microbial communities and growth of Quercus robur L. [J]. Soil Biology & Biochemistry, 2015, 82: 65-73
Effects of Pantoea agglomerans on Tolerance of Artemisia selengensis under Cadmium Stress
Zhou Xiaomei1, Zhao Yunlin2,*, Dong Meng3, Ku Wenzhen3, Liang Zengenni4
1. College of Architecture and Urban Planning, Hunan City University, Yiyang 413000, China 2. Central South University of Forestry Science and Technology, Changsha 410004, China 3. College of Chemistry and Environment Engineering, Hunan City University, Yiyang 413000, China 4. Hunan Agricultural Product Processing Institute, Changsha 410125, China
To explore the effects of functional microorganism on Artemisia selengensis tolerance under cadmium stress, this study examined the effects of strain J2 on growth, physiology, cadmium concentration and translocation, rhizosphere micro-ecology of Artemisia selengensis under different concentrations of cadmium by pot experiment. The results indicated that Pantoea agglomerans J2 distinctly enhanced the plant height, shoot dry weight, root dry weight, the total dry weight and root-shoot ratio of Artemisia selengensis under cadmium stress. Strain J2 distinctly increased the contents of chlorophyll a, chlorophyll b and the total chlorophyll as well as the activities of superoxide dismutase (SOD), peroxidase (POD)and catalase (CAT), whereas significantly reduced the malondialdehyde (MDA) contents of Artemisia selengensis under cadmium stress. Pantoea agglomerans J2 distinctly promoted Artemisia selengensis to concentrate and translocate cadmium, and shoot cadmium contents, root cadmium contents and the total cadmium contents were significantly increased by Pantoea agglomerans J2 treatment. Bioconcentration factors (BCF) of cadmium in shoot were significant greater than in root. Moreover, translocation factors (TF) of Artemisia selengensis increased by 7.5%-37.4% under cadmium stress compared with the control. Pantoea agglomerans J2 significantly improved the number of bacteria and actinomyces and the total number of microorganisms along with distinctly reducing the number of fungi of Artemisia selengensis rhizosphere soil under cadmium stress. The study suggested that Pantoea agglomerans J2 was conducive to improve not only growth, physiology, cadmium concentration and translocation as well as rhizosphere micro-ecology of Artemisia selengensis under cadmium stress, but also to some extent, Artemisia selengensis tolerance to cadmium.
Pantoea agglomerans; cadmium stress; Artemisia selengensis; tolerance
湖南省自然科学基金(2015JJ4012,2016JJ4015);湖南省教育厅优秀青年项目(15B045)
周小梅(1977-),女,副教授,博士,研究方向为环境污染生态修复,E-mail: 864759100@qq.com;
*通讯作者(Corresponding author), E-mail: zyl8291290@163.com
10.7524/AJE.1673-5897.20160225002
2016-02-25 录用日期:2016-04-22
1673-5897(2016)4-176-08
X171.5
A
简介:赵运林(1959-),男,博士,教授,主要研究方向为湿地生态修复。
周小梅, 赵运林, 董萌, 等. 成团泛菌(Pantoea agglomerans)对镉胁迫下蒌蒿耐受性的影响[J]. 生态毒理学报,2016, 11(4): 176-183
Zhou X M, Zhao Y L, Dong M, et al. Effects of Pantoea agglomerans on tolerance of Artemisia selengensis under cadmium stress [J]. Asian Journal of Ecotoxicology, 2016, 11(4): 176-183 (in Chinese)

