镉胁迫对苎麻(Boehmeria nivea)根系及叶片抗氧化系统的影响
杨叶萍,简敏菲,,*,余厚平,龚秋林,陈勇玲
1. 江西师范大学生命科学学院 江西省亚热带植物资源保护与利用重点实验室,南昌 330022 2. 江西师范大学 鄱阳湖湿地与流域研究教育部重点实验室,南昌 330022 3. 江西省宜春市农业科学研究所,宜春 336000
镉胁迫对苎麻(Boehmeria nivea)根系及叶片抗氧化系统的影响
杨叶萍1,简敏菲1,2,*,余厚平2,龚秋林3,陈勇玲3
1. 江西师范大学生命科学学院 江西省亚热带植物资源保护与利用重点实验室,南昌 330022 2. 江西师范大学 鄱阳湖湿地与流域研究教育部重点实验室,南昌 330022 3. 江西省宜春市农业科学研究所,宜春 336000
镉(Cd)是非必需和毒性最强的重金属元素之一,不合理的开发利用可导致土壤受到Cd的严重污染,严重危及土壤环境或水环境。以苎麻为材料,采用模拟镉(Cd)污染盆栽培养法,选择21 d和49 d等2个不同胁迫期,测定不同浓度Cd2+胁迫下苎麻根系与叶片中渗透调节物质含量、超氧化物岐化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)含量及根系活力的变化。结果表明,高浓度胁迫49 d后,苎麻根系中的渗透调节物质含量明显高于叶片含量,且极显著高于对照,并在240 mg·L-1Cd处理下出现最高值;胁迫49 d时,根系与叶片的渗透调节物质含量与Cd2+浓度极显著正相关。在2个不同胁迫周期,苎麻根系的SOD与POD活性均明显高于叶片;在胁迫21 d时,根系的CAT活性低于叶片,而胁迫49 d后,则明显高于叶片;胁迫21 d时,苎麻根系与叶片的抗氧化酶活性均较胁迫49 d要高;胁迫49 d时,根系POD活性与Cd2+浓度呈极显著正相关,表明根系POD酶在抗氧化酶中占主导地位。不同胁迫时长下苎麻根系或叶片的MDA含量变化趋势不明显,但根系或叶片受胁迫21 d后的MDA含量随Cd2+浓度增加的波动相对受胁迫49 d后的更明显,表明植物早期生理功能出现暂时性的修复。2个不同胁迫周期内,不同浓度镉胁迫下苎麻的根系活力均比对照组下降。研究显示,苎麻根系与叶片对镉胁迫的应答机制不同,且在不同胁迫时间下的响应机理差异较大,根系表现出更强的耐受能力。
镉胁迫;苎麻;叶;抗氧化酶;根系活力
Received 13 March 2016 accepted 22 April 2016
镉(Cd)是非必需和毒性最强的重金属元素之一,不合理的开发利用可导致土壤受Cd的严重污染,危及土壤环境或水环境,并可能经种植业由食物链进入人体,造成生态安全问题[1-3]。国内外专家对植物富集重金属的耐受机理做了相关研究,Cd对植物生理指标的影响仍是当前研究的热点[4-5]。研究表明,过量Cd严重影响植物体内SOD、POD、CAT等酶的活性,并引起MDA含量升高,光合作用降低、营养代谢失调,严重时导致植株死亡[6-8]。目前,Cd对植物抗氧化系统的影响研究主要集中在水稻、大豆、玉米、小麦等经济作物的研究,但对于不同生长时期植物根系生理生态的研究报道仍较鲜见[9-12]。由于根系能直接吸收土壤中的重金属,因此研究Cd对植物根系生理功能的影响具有重要意义。
苎麻(Boehmeria nivea (L.) Gaudich.)作为非食用的经济作物,不存在食物链间的生态安全问题,具有生物量大、根系发达等特点,且对镉具有较强的耐受性和累积能力[13]。为进一步探讨Cd对植物根系不同生长时期的毒害机理,本研究以苎麻为试验材料,研究不同浓度Cd胁迫对植物根系与叶片不同生长期可溶性糖含量、可溶性蛋白含量、游离脯氨酸含量(Pro)、抗氧化酶活性、丙二醛(MDA)含量和根系活力的影响,旨在探讨苎麻根系与叶片不同生长时期对Cd胁迫的生理效应,为进一步明确苎麻对Cd的耐受性机制及其解毒机理提供理论依据。
1 材料与方法(Materials and methods)
1.1 材料
供试材料为苎麻,品种为江西省宜春市苎麻研究所提供的‘赣苎5号’幼苗。胁迫实验于2015年7月至9月期间在室内采用盆栽培养方法,培养基质为膨胀珍珠岩,珍珠岩经自来水冲洗后装入口径25 cm、底内径20 cm、深30 cm的塑料盆中,供试药剂为CdCl2·2.5H2O配制而成的不同浓度Cd2+溶液[14]。移栽长势一致的‘赣苎5号’幼苗(高约30 cm),洗净根部所带土壤,每盆移栽2株。采用1/2 Hoagland营养液进行适应性培养7 d,随后进行不同浓度的Cd2+胁迫实验。设定6个处理组,Cd2+浓度分别为0(对照)、20、60、120、180和240 mg·L-1等,分别记为CK、Cd20、Cd60、Cd120、Cd180、Cd240。根据苎麻的生长旺盛期和生长成熟期,分别选择21 d和49 d作为苎麻的研究周期。每个处理组重复14盆(7盆用于21 d的指标观测,另7盆用于49 d的指标观测),共84盆。实验期间,每周更换新鲜含Cd2+营养液500 mL,营养液pH控制在6.5左右(采用NaOH或HCl溶液调节)。
1.2 方法
根据苎麻的3个生长季,头麻约80~90 d,二麻50~60 d,三麻70~80 d,选择苎麻幼苗在Cd2+胁迫处理第21天和49天作为2个观测周期,分别称取0.2 g苎麻根和顶端倒数第6片叶进行相应指标的测定,每处理分别平行测定3株,取平均值Mean±SD。参照植物生理学实验技术教程[15],其中SOD、POD、CAT活性及可溶性蛋白含量测定所需的提取液用预冷的磷酸缓冲液,于冰浴上快速研磨并在7 000 r·min-1下低温离心,上清液用于指标测定。采用考马斯亮蓝G-250染色法测定可溶性蛋白含量;采用酸性茚三酮比色法测定游离脯氨酸含量;采用氮蓝四唑(NBT)光化还原法测定超氧化物岐化酶(super oxide dismutase,简称SOD)活性,以抑制NBT光化还原的50%为一个酶活性单位U;采用愈创木酚比色法测定过氧化物酶(peroxidase,简称POD)活性;采用紫外吸收法测定过氧化氢酶(catalase,简称CAT)活性;采用硫代巴比妥酸(TBA)法测定可溶性糖含量和丙二醛(malondialdehyde,简称MDA)含量;采用氯化三苯基四氯唑(TTC)法测定根系活力。
1.3 数据处理
采用统计软件SPSS 20.0进行单因素方差分析(One-way,ANOVA)和最小显著差异法(LSD),对苎麻在不同镉浓度水平下的指标测定数据进行差异性比较,Origin8.0进行制图。
2 结果与分析(Results and analysis)
2.1 不同浓度Cd2+胁迫对苎麻根或叶片渗透调节物质的影响
可溶性糖是植物生长发育的主要调节物质,是植物胁迫诱导的小分子溶质之一,具有保持植物渗透势的作用,能缓解胁迫造成的植物生理代谢不平衡问题[16]。表1所示为不同浓度Cd2+胁迫对苎麻根、叶中不同渗透调节物质的影响变化。
可溶性糖含量变化显示:镉胁迫21 d时,除Cd60处理组外,其他处理组根系的可溶性糖含量均低于叶片;胁迫49 d时,除Cd20与Cd60处理外,其他处理下根系的可溶性糖含量均明显高于叶片。一方面,不同胁迫下根系的可溶性糖含量变化特性为:胁迫21 d时,在Cd60处理下达最大,极显著高于CK组26.4%(P<0.01),Cd120处理下的含量值最低,极显著低于CK组15.2%(P<0.01);胁迫49 d时,Cd180处理下达最大,极显著高于CK组158.8 %(P<0.01),Cd60处理下最小,显著低于对照组10.3%(P<0.05),其余各处理间的差异性极显著(P<0.01)。另一方面,不同胁迫下叶片的可溶性糖含量变化特性为:受Cd胁迫21 d时,各胁迫处理组与CK组相比均呈下降趋势,且在Cd180处理下最小,极显著低于CK组13.8%(P<0.01);胁迫49 d后均呈极显著升高,在Cd240处理下最大,极显著高于CK组94.5%(P<0.01)。短时间Cd处理苎麻生长状态极好,根系与叶片的生长较CK组均受到促进作用,可溶性糖含量变化上升不明显;长时间Cd处理根系与叶片的生长较对照受到抑制作用,但其存活率几乎没有受到影响,可溶性糖含量明显上升以抵御不良环境。

表1 不同浓度Cd2+胁迫下苎麻根与叶片渗透调节物质含量的差异
注:不同小写字母表示不同处理组间的显著差异性(P<0.05),不同大写字母表示极显著差异性(P<0.01)。
Note: Different lowercase letters represent the significant differences (P<0.05) in different treatment groups, and different capital letters represent the very significant differences (P<0.01).
可溶性蛋白含量变化结果表明:胁迫21 d时,除Cd120和Cd180两个处理组外,其他各浓度胁迫下根系的可溶性蛋白含量均高于叶片;胁迫49 d时,除Cd20处理外,其他各浓度胁迫下根系的可溶性蛋白含量均明显高于叶片。一方面,不同胁迫下根系可溶性蛋白含量变化特性为:在胁迫21 d时,与CK组相比,各浓度胁迫处理下根系的可溶性蛋白含量均呈极显著下降,且在Cd180胁迫下达最小,极显著低于对照28.1%(P<0.01);胁迫49 d时,随着胁迫浓度增加,根系可溶性蛋白含量呈极显著升高,在Cd240处理下达最大,极显著高于CK组2 278.4%(P<0.01)。另一方面,不同胁迫下叶片可溶性蛋白含量变化特性为:在胁迫21 d时,各处理组的叶片可溶性糖含量均呈极显著升高,且在Cd120处理下最大,极显著高于CK组156.9%(P<0.01);胁迫49 d时,除Cd60处理外,其余胁迫组叶片可溶性糖含量均有所升高,Cd240处理下达最高,极显著高于CK组88.1%(P<0.01)。
游离脯氨酸含量变化显示:胁迫21d时,各处理根系的游离脯氨酸含量均显著低于叶片;胁迫49 d时,除Cd240处理外,其余处理下根系的游离脯氨酸含量均明显低于叶片。一方面,不同胁迫下根系的游离脯氨酸含量变化特性表现为:胁迫21 d时,Cd60处理下最高,极显著高于对照70.9%(P<0.01),Cd120处理下最低,显著低于对照13.7%(P<0.05);胁迫49 d时,各处理均高于对照,Cd240处理下最高,极显著高于对照257.5%(P<0.01)。另一方面,不同胁迫下叶片的游离脯氨酸含量变化特性表现为:胁迫21 d时,各处理下含量均低于对照,且在Cd240处理下最低,极显著低于对照67.3%(P<0.01);胁迫49 d时,各处理均高于对照,且在Cd180处理下最高,极显著高于对照112.6%(P<0.01)。短时间Cd胁迫下苎麻叶片没有受到毒害作用,因此游离脯氨酸含量均低于对照;反映出长时间胁迫下,苎麻叶片受到毒害作用,叶片游离脯氨酸发挥作用以抵抗不良环境。
2.2 不同浓度Cd2+胁迫对苎麻根或叶片SOD活性的影响
SOD是生物体内重要的抗氧化酶,广泛分布于各种生物体内。在不同浓度的Cd2+胁迫下,受不同胁迫周期影响,苎麻的根或叶片中的SOD活性均产生一定差异性,结果分别如图1A及图1B所示。
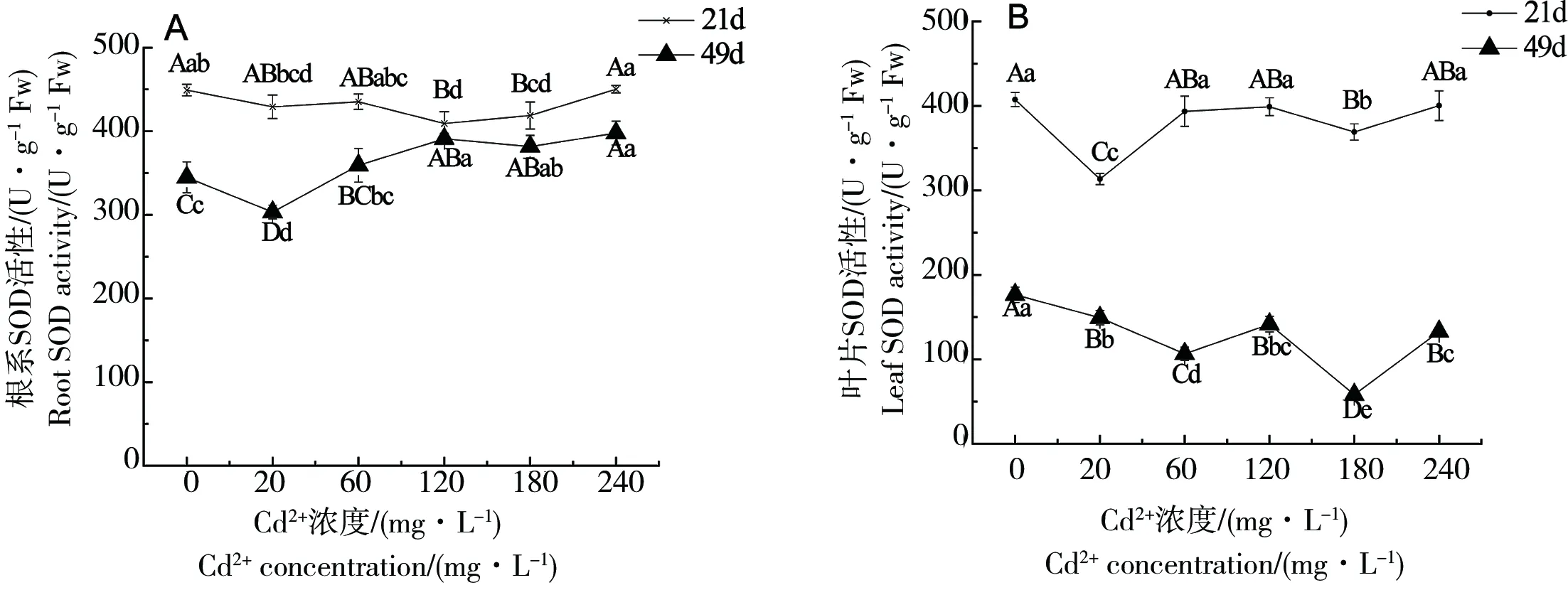
图1 不同浓度Cd2+胁迫下苎麻根与叶SOD活性的比较注:不同小写字母表示不同组间的显著差异性(P<0.05),不同大写字母表示极显著差异性(P<0.01),下同。Fig. 1 Comparison of SOD activities in roots and leaves of B. nivea under different concentration of cadmiumNote: Different lowercase letters represent the significant differences (P<0.05) in different treatment groups, and different capital letters represent the very significant differences (P<0.01), the same below.
图1根系与叶片比较,结果表明,在21 d和49 d两个不同胁迫周期下,不同浓度Cd2+处理后,苎麻根系的SOD活性均明显高于叶片的SOD活性。一方面,各胁迫组与CK组相比较,根系的SOD活性差异性为:在胁迫21 d时,除Cd240胁迫组略微高于CK组外,其余各胁迫组均低于CK组,且Cd120胁迫下最低,极显著低于CK组8.9%(P<0.01);胁迫49 d时,除Cd20处理下极显著低于CK组12.0%(P<0.01)外,其余各胁迫组均高于CK组,Cd240处理下最高,极显著高于CK组15.3%(P<0.01)。另一方面,各胁迫组与CK组相比较,叶片的SOD活性差异表现为:在21 d和49 d两个不同胁迫周期下,各浓度胁迫条件下叶片的SOD活性均低于CK组,21 d时在Cd60胁迫下最低,极显著低于CK组23.1%(P<0.01);49 d时在Cd180胁迫下最低,极显著低于CK组67.1%(P<0.01)。
2.3 不同浓度Cd2+胁迫对苎麻根或叶片POD活性的影响
过氧化物酶(POD)主要存在于细胞的过氧化物酶体中,以铁卟啉为辅基,可催化过氧化氢氧化酚类和胺类化合物,具有消除过氧化氢和酚类、胺类毒性的双重作用。Cd2+不同浓度胁迫后,苎麻根或叶片中的POD活性随胁迫周期的不同存在一定差异,结果分别如图2A及图2B所示。
图2中根系与叶片比较结果显示:在21 d和49 d两个不同胁迫周期下,不同浓度Cd处理下根系的过氧化物酶(POD)活性均明显高于叶片,且根系POD活性达1 000 U·g-1Fw以上,而叶片POD活性均低于100 U·g-1Fw。一方面,胁迫21 d时,各浓度Cd处理下的根系POD活性均低于CK组,Cd60处理下根系POD活性最低,极显著低于对照40.7%(P<0.01);胁迫49 d时,除Cd60胁迫组根系的POD活性极显著低于CK组58.8%外(P<0.01),其余各胁迫组均高于CK组,Cd240胁迫下根系的POD活性最高,极显著高于CK组1 031.2%(P<0.01)。另一方面,在胁迫21 d和49 d两个不同胁迫周期下,各胁迫处理组叶片的POD活性均随胁迫浓度的升高呈逐渐升高趋势,且均在Cd240胁迫下最大,分别极显著高于CK组477.4%和1 075.4%(P<0.01)。
2.4 不同浓度Cd2+胁迫对苎麻根与叶片CAT活性的影响
过氧化氢酶(CAT)是催化过氧化氢分解成氧和水的酶,存在于细胞的过氧化物体内。受不同浓度Cd2+的胁迫,苎麻的根或叶片中的CAT活性随胁迫周期的影响而产生差异,结果分别如图3A和图3B所示。
图3中根系与叶片比较显示:胁迫21 d时,各处理组根系的CAT活性均明显低于叶片;胁迫49 d时,各处理组根系则均明显高于叶片。不同浓度Cd处理后根系的CAT活性差异性表现为:在胁迫21 d时,根系的CAT活性均极显著低于CK组,且在Cd240处理下最低,极显著低于对照70.3%(P<0.01);胁迫49 d时,Cd20处理下最高,极显著高于对照37.3%(P<0.01),Cd60胁迫下最低,略低于对照5.4%。不同处理浓度下叶片CAT活性的差异性为:胁迫21 d时,除Cd20处理和Cd240处理后苎麻叶片的CAT活性略低于CK组外,其余胁迫处理后叶片的CAT活性均高于CK组,且在Cd120处理下最高,极显著高于对照12.2%(P<0.01);胁迫49 d时,各胁迫组均低于对照,且在Cd180处理下最低,极显著低于CK组54.0%(P<0.01)。

图2 不同浓度Cd2+胁迫下苎麻根与叶POD活性的比较Fig. 2 Comparison of POD activities in roots and leaves of B. nivea under different concentration of cadmium
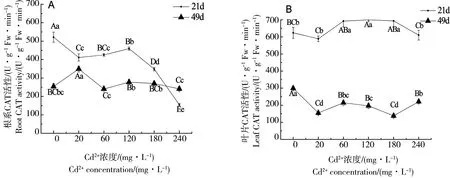
图3 不同浓度Cd2+胁迫下苎麻根与叶CAT活性的比较Fig. 3 Comparison of CAT activities in roots and leaves of B. Nivea under different concentration of cadmium

图4 不同浓度Cd2+胁迫下苎麻根与叶MDA含量的比较Fig. 4 Comparison of MDA contents in roots and leaves of B. Nivea under different concentration of cadmium
2.5 不同浓度Cd2+胁迫对苎麻根或叶片MDA含量的影响
丙二醛(MDA)是膜脂过氧化最重要的产物之一,其在体外影响线粒体呼吸链复合物及线粒体内关键酶活性。它的产生还能加剧膜的损伤,因此在植物衰老生理和抗性生理研究中MDA含量是一个常用指标,可通过MDA了解膜脂过氧化的程度,以间接测定膜系统受损程度以及植物的抗逆性。苎麻受Cd2+不同浓度胁迫后,其根或叶片中的MDA含量随胁迫周期的影响而存在差异,结果分别如图4A和4B所示。
根系与叶片相比,胁迫21 d时,低浓度(Cd20与Cd60)处理下根系的MDA含量高于叶片,其他各高浓度(120~240 mg·L-1)处理下根系的MDA含量低于叶片;胁迫49 d时,除Cd20与Cd180处理组外,其余胁迫下均略微低于叶片对应含量。不同胁迫处理后根系的MDA差异性表现为:在胁迫21 d时,Cd60处理下根系的MDA含量最高,极显著高于CK组45.7%(P<0.01),Cd120处理下最低,极显著低于CK组23.9%(P<0.01);胁迫49 d时,Cd20处理下最大,极显著高于CK组23.3%(P<0.01),Cd60处理下最小,略微低于CK组3.3%。不同胁迫处理后叶片的MDA差异性为:胁迫21 d时,在各胁迫组叶片的MDA含量均高于CK组,Cd120处理下最高,极显著高于CK组136.4%(P<0.01);在胁迫49 d时,Cd120处理下最大,极显著高于CK组94.5%(P<0.01),Cd60处理下最小,显著低于CK组8.9% (P<0.05)。
2.6 不同浓度Cd2+胁迫对苎麻根系活力的影响
植物根系是活跃的吸收器官和合成器官,根的生长情况和活力水平直接影响地上部的营养状况及产量水平,而根系活力是表征植物根系的重要指标。

图5 不同浓度Cd2+胁迫下苎麻根系活力的变化Fig. 5 Changes of root activities of B. nivea under different concentration of cadmium
苎麻受Cd2+胁迫后,其根系活力随胁迫浓度及胁迫周期的不同而产生差异,结果如图5所示。
图5结果显示,在胁迫21 d和49 d两个不同胁迫周期,各浓度胁迫下的根系活力均低于CK组。胁迫21 d时,Cd240处理下的根系活力最高,略微低于对照1.4%,Cd180处理下根系活力最低,极显著低于对照30.6%(P<0.01);胁迫49 d时,依然是Cd240处理下的根系活力最高,略微低于对照16.4%,而Cd120处理下的根系活力则最低,且极显著低于CK组92.5%(P<0.01)。
2.7 Cd2+胁迫浓度与苎麻根或叶片抗氧系统各指标间的相关性
不同Cd2+胁迫浓度对苎麻根或叶片的胁迫及其抗氧系统各项生理指标的影响程度均不相同,Cd2+胁迫浓度与苎麻根或叶片各项生理指标间的相关性如表2所示。
结果显示,不同浓度Cd2+胁迫与根系抗氧系统各项指标的相关性表现为,在胁迫21 d时,根系的可溶性蛋白含量和CAT活性与Cd2+浓度呈极显著负相关关系,相关系数r分别为-0.737和-0.848;MDA含量与Cd2+浓度呈显著负相关关系,相关系数为-0.564(P<0.05)。胁迫49 d时,可溶性糖含量、可溶性蛋白含量、游离脯氨酸含量、SOD活性、POD活性均与Cd2+浓度呈极显著正相关关系,相关系数r分别为0.896、0.937、0.834、0.771、0.976(P<0.01)。
Cd2+胁迫浓度与叶片各项指标间的响应关系表现为,在胁迫21 d时,叶片游离脯氨酸含量与Cd2+浓度呈极显著负相关关系,相关系数r为-0.628(P<0.01);POD活性与Cd2+浓度呈极显著正相关关系,相关系数r为0.960(P<0.01)。叶片在胁迫49 d时,可溶性糖含量、游离脯氨酸含量、POD活性与Cd2+浓度呈极显著正相关关系,相关系数r分别为0.631、0.652、0.912(P<0.01);可溶性蛋白含量与Cd2+浓度呈显著正相关关系,相关系数r为0.489(P<0.05);SOD活性与与Cd2+浓度呈显著负相关关系,相关系数r分别为-0.528(P<0.05)。
3 讨论(Discussion)
综合以上分析,苎麻受不同浓度Cd2+胁迫并经历不同胁迫时间后,根系与叶片的抗氧化系统各项生理指标值存在显著差异,表现出Cd2+胁迫对苎麻植株的生理生态等方面产生综合的效应及影响。
可溶性糖、可溶性蛋白、游离脯氨酸是植物体内的主要渗透调节物质,三者可通过降低细胞原生质的渗透势,使植物保持一定的含水量和膨压[17]。已有研究表明,竹叶眼子菜的可溶性糖含量随Cd2+浓度增加而增加[18]。地中海荚蒾的可溶性蛋白含量随Cd2+浓度增加先升高再下降[19]。苎麻的脯氨酸在低浓度时升高,高浓度胁迫时下降[20]。本研究表明,短时间Cd2+处理促进苎麻根系及叶片生长,增强光合速率,长时间处理抑制苎麻生长,但生长状况依然良好。苎麻受高浓度Cd胁迫经历较长时间(如49 d)后,根系的可溶性糖含量、可溶性蛋白含量、与游离脯氨酸含量均远高于叶片中对应的含量,且均在最高浓度(Cd240)处理下达到最高。根系对Cd2+的敏感度远大于叶片,这与郭艳丽等[21]的结果不一致,可能原因是由于苎麻属根系发达物种,遇不良环境时,为保证生存,根系的调节系统迅速适应环境以防止叶片受不良环境影响而停止光合作用或导致植株死亡。长时间Cd2+胁迫可诱导苎麻体内大量形成可溶性糖、可溶性蛋白、游离脯氨酸等,以提高植物的抗逆性,保护生物大分子的结构与稳定性,这与郭艳丽等[21]结果较一致,说明苎麻通过增加这3种调节物质含量共同提高其渗透调节能力。另一方面,较短时间(如21 d)胁迫下,渗透调节物质与Cd2+浓度相关性不明显,较长时间(49 d)胁迫下渗透调节物质与Cd2+浓度显著正相关,表明短时间胁迫下苎麻体内的生理指标有一个适应调整过程,长时间胁迫才能更有效地激发苎麻对Cd2+的防御机制。

表2 不同Cd2+胁迫浓度与苎麻根或叶片各生理指标间的相关性
注:* 为在P<0.05水平(双侧)上显著相关,**在P<0.01水平(双侧)上极显著相关。
Note: * represent significant correlation on level (bilateral) (P<0.05); ** represent very significant correlation on level (bilateral) (P<0.01).

MDA是植物膜脂氧化的主要产物,植物根系和叶片的MDA含量变化可在一定程度上反映其受重金属毒害的水平[27-28]。本研究表明,苎麻根系与叶片的MDA含量在不同胁迫时间下变化趋势完全不同,在胁迫21 d时,低浓度(20与60 mg·L-1)胁迫下根系的MDA含量高于叶片,而高浓度(120~240 mg·L-1)胁迫下则低于叶片;胁迫49 d时,除20与180 mg·L-1处理组外,其余处理组均略微低于叶片。这说明短时间低浓度胁迫下引起了苎麻根系自由基反应和脂质过氧化,但长时间高浓度胁迫根系受到过氧化伤害,这与王兴明等[23]研究油菜的结果并不一致,可能是由于苎麻与油菜的防御机制不同,苎麻的生理生态适应性主要由叶与根共同发挥作用,其内在关系有待进一步研究。较短时间胁迫下苎麻根系与叶片的MDA含量相对较长时间胁迫下的波动较大,可能是因为植物组织通过保护酶等的调节作用对植物体生理功能的暂时性修复[16]。
当作物遭受Cd2+胁迫时,最先感受胁迫的是根系,通过调整根系生长和代谢适应逆境,导致根系活力降低[6]。本研究表明,Cd2+胁迫下的苎麻根系活力比对照组较低,且长时间胁迫下苎麻根系活力随Cd2+浓度增加先降低后升高,除最高胁迫浓度处理组外,较长时间胁迫下的根系活力均比较短时间胁迫下的低,可能是由于高浓度Cd胁迫下苎麻根系的抗氧化指标相对低浓度下的协同作用保护更显著,以保证根系正常生长。因此,镉胁迫下保护酶系统和渗透调节物质是苎麻根系与叶片耐镉的主要生理机制之一。
致谢:感谢江西师范大学鄱阳湖湿地与流域研究教育部重点实验室廖金宝博士在英文摘要及文章修改中给予的帮助。
[1] 崔玉静, 赵中秋, 刘文菊, 等. 镉在土壤-植物-人体系统中迁移积累及其影响因子[J]. 生态学报, 2003, 23(10): 2133-2143
Cui Y J, Zhao Z Q, Liu W J, et al. Transfer of cadmium through soil-plant-human continuum and its affecting factors [J]. Acta Ecologica Sinica, 2003, 23(10): 2133-2143 (in Chinese)
[2] Agrawal S B, Shweta M. Effects of supplemental ultraviolet-B and cadmium on growth, antioxidants and yield ofPisum sativum L. [J]. Ecotoxicology & Environmental Safety, 2009, 72(2): 610-618
[3] He J, Zhu C, Ren Y, et al. Genotypic variation in grain cadmium concentration of lowland rice [J]. Journal of Plant Nutrition & Soil Science, 2006, 169(5): 711-716
[4] 廖柏寒, 刘俊, 周航, 等. Cd胁迫对大豆各发育阶段生长及生理指标的影响[J]. 中国环境科学, 2010, 30(11): 1516-1521
Liao B H, Liu J, Zhou H, et al. Effects of Cd stress on physiological and ecological indicators and their differences of soybean plants at different growth stages [J]. China Environmental Science, 2010, 30(11): 1516-1521 (in Chinese)
[5] Yang J, Li K, Wei Z, et al. Characterization of early transcriptional responses to cadmium in the root and leaf of Cd-resistant Salix matsudana Koidz [J]. BMC Genomics, 2015, 16(1): 1-15
[6] 何俊瑜, 任艳芳, 王阳阳, 等. 不同耐性水稻幼苗根系对镉胁迫的形态及生理响应[J]. 生态学报, 2011, 31(2): 522-528
He J Y, Ren Y F, Wang Y Y, et al. Root morphological and physiological responses of rice seedlings with different tolerance to cadmium stress [J]. Acta Ecologica Sinica, 2011, 31(2): 522-528 (in Chinese)
[7] Hall J L. Cellular mechanisms for heavy metal detoxification and tolerance [J]. Journal of Experimental Botany, 2002, 53(366): 1-11
[8] 董萌, 赵运林, 雷存喜, 等. 洞庭湖湿地Cd富集植物蒌蒿(Artemisia selengensis)的耐性生理机制研究[J]. 生态毒理学报, 2013, 8(1): 111-120
Dong M, Zhao Y L, Lei C X, et al. Physiological mechanism of Cd-tolerance of Artemisia selengensis grown in Dongting Lake wetland [J]. Asian Journal of Ecotoxicology, 2013, 8(1): 111-120 (in Chinese)
[9] Cheng W D, Zhang G P, Yao H G, et al. Genotypic difference of germination and early seedling growth in response to Cd stress and its relation to Cd accumulation [J]. Journal of Plant Nutrition, 2008, 31(31): 702-715
[10] Robert S, Katarzyna R, Renata R, et al. Cadmium-induced changes in antioxidant enzymes in suspension culture of soybean cells [J]. Acta Biochimica Polonica, 2004, 51(1): 219-222
[11] 崔宏莉, 解静芳, 杨彪, 等. 污灌与镉胁迫对菠菜几种抗氧化酶活性的影响[J]. 生态毒理学报, 2010, 5(2): 274-279
Cui H L, Xie J F, Yang B, et al. Effects of sewage irragation and cadmium stresses on the activities of several antioxidant enzymes of spinich [J]. Asian Journal of Ecotoxicology, 2010, 5(2): 274-279 (in Chinese)
[12] Singh H P, Batish D R, Kaur G, et al. Nitric oxide (as sodium nitroprusside) supplementation ameliorates Cd toxicity in hydroponically grown wheat roots [J]. Environmental & Experimental Botany, 2008, 63(s1-3): 158-167
[13] 佘玮. 苎麻对重金属吸收和积累特征及镉胁迫响应基因表达研究[D]. 长沙: 湖南农业大学, 2010: 35-45
She W. The uptake and accumulation characteristics of heavy metals and expression of Cd stress response genes in ramie (Boehmeria nivea) [D]. Changsha: Hunan Agricultural University, 2010: 35-45 (in Chinese)
[14] 简敏菲, 杨叶萍, 余厚平, 等. 不同浓度Cd2+胁迫对苎麻叶绿素及其光合荧光特性的影响[J]. 植物生理学报, 2015, 51: 1331-1338
Jian M F, Yang Y P, Yu H P, et al. Influences of different cadmium concentration stress on chlorophyll and its photosynthetic fluorescence characteristics of ramie (Boehmeria nivea) [J]. Plant Physiology Journal, 2015, 51: 1331-1338 (in Chinese )
[15] 张蜀秋. 植物生理学实验技术教程[M]. 北京: 科学出版社, 2011: 50-201
Zhang S Q. Plant Physiology Experiment Technology Course [M]. Beijing: Science Press, 2011: 50-201 (in Chinese)
[16] Rafael C, Joaquín M, Julio S. Integration of low temperature and light signaling during cold acclimation response in Arabidopsis [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(39): 16475-16480
[17] Sairam R K, Kumutha D, Ezhilmathi K, et al. Physiology and biochemistry of waterlogging tolerance in plants [J]. Biologia Plantarum, 2008, 52(3): 401-412
[18] 杨海燕, 施国新, 徐勤松, 等. Cd2+胁迫对竹叶眼子菜的毒理学效应分析[J]. 应用与环境生物学报, 2008, 14(3): 366-370
Yang H Y, Shi G X, Xu Q S, et al. Phytotoxicity of Cd2+on leaf cells of Potamogeton malaianus [J]. Chinese Journal of Applied and Environmental Biology, 2008, 14(3): 366-370 (in Chinese)
[19] 杜晓, 申晓辉. 镉胁迫对珊瑚树和地中海荚蒾生理生化指标的影响[J]. 生态学杂志, 2010, 29(5): 899-904
Du X, Shen X H. Effects of cadmium stress on physiological and biochemical indices of Viburnum odoratissimum and V. tinus seedlings [J]. Chinese Journal of Ecology, 2010, 29(5): 899-904 (in Chinese)
[20] 许英, 代剑平, 揭雨成, 等. 镉胁迫下苎麻的生理生化变化与耐镉性的关系[J]. 中国麻业科学, 2006, 28(6): 301-305
Xu Y, Dai J P, Jie Y C, et al. The relationship between physiological and biochemical changes in ramie under cadmium stress and the resistance to cadmium [J]. Plant Fiber Sciences in China, 2006, 28(6): 301-305 (in Chinese)
[21] 郭艳丽, 台培东, 韩艳萍, 等. 镉胁迫对向日葵幼苗生长和生理特性的影响[J]. 环境工程学报, 2009, 3(12): 2291-2296
Guo Y L, Tai P D, Han Y P, et al. Effects of cadmium on the growth and physiological characteristics of sunflower seedlings [J]. Chinese Journal of Environmental Engineering, 2009, 3(12): 2291-2296 (in Chinese)
[22] Sreenivasulu N B, Wobus U, Weschke W. Differential response of antioxidant compounds to salinity stress in salt-tolerant and salt-sensitive seedlings of foxtail millet (Setaria italica) [J]. Physiologia Plantarum, 2000, 109(4): 435-442
[23] 王兴明, 涂俊芳, 李晶, 等. 镉处理对油菜生长和抗氧化酶系统的影响[J]. 应用生态学报, 2006, 17(1): 102-106
Wang X M, Tu J F, Li J, et al. Effects of Cd on rape growth and antioxidant anzyme system [J]. Chinese Journal of Applied Ecology, 2006, 17(1): 102-106 (in Chinese)
[24] 汤叶涛, 关丽捷, 仇荣亮, 等. 镉对超富集植物滇苦菜抗氧化系统的影响[J]. 生态学报, 2010, 20(2): 324-332
Tang Y T, Guan L J, Chou R L, et al. Antioxidative defense to cadmium in hyperaccumulator Picris divaricata V. [J]. Acta Ecologica Sinica, 2010, 20(2): 324-332 (in Chinese)
[25] Malar S, Sahi S V, Favas P J C, et al. Mercury heavy-metal-induced physiochemical changes and genotoxic alterations in water hyacinths [Eichhornia crassipes (Mart.)] [J]. Environmental Science & Pollution Research, 2014, 22(6): 4597-4608
[26] Shah K, Kumar R G, Verma S, et al. Effect of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings [J]. Plant Science, 2001, 161(6): 1135-1144
[27] Dixit V, Pandey V, Shyam R. Differential antioxidative responses to cadmium in roots and leaves of pea (Pisum sativum L. cv. Azad) [J]. Journal of Experimental Botany, 2001, 52(358): 1101-1109
[28] Cosio C, Desantis L, Frey B, et al. Distribution of cadmium in leaves of Thlaspi caerulescens [J]. Journal of Experimental Botany, 2005, 56(412): 765-775
Influence on the Antioxidant System in Roots and Leaves of Boehmeria nivea under Different Cadmium Stress
Yang Yeping1, Jian Minfei1,2,*, Yu Houping2, Gong Qiulin3, Chen Yongling3
1. College of Life Science, Jiangxi Provincial Key Lab of Protection and Utilization of Subtropical Plant Resources, Jiangxi Normal University, Nanchang 330022, China 2. Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, Jiangxi Normal University, Nanchang 330022, China 3. Yichun Agricultural Science Research Institute of Jiangxi Province, Yichun 336000, China
Cadmium (Cd) is one of the most toxic heavy metal elements and the non-essential,unreasonable exploitation and utilization may lead to the serious pollution of soil by Cd, which endanger the soil environment or water environment. Our objective was to reveal the differences in the contents of osmoregulation substances, superoxide dismutase (SOD) activities, peroxidase (POD) activities, catalase (CAT) activities, malondialdehyde (MDA) contents in roots and leaves and root activities in ramie (Boehmeria nivea) under different cadmium stress in different stress duration. Under long stress duration of 49 days, the content of osmoregulation substances in roots was significantly higher than those in leaves at high cadmium concentration, simultaneously being significantly higher than those of the control group without any heavy metal stress. The concentration of each osmoregulation substance in roots peaked at the cadmium stress of 240 mg·L-1. The contents of osmoregulation substance in roots and leaves were both positively correlated to cadmium concentrations under the stress duration of 49 days. The SOD and POD activities in roots were both significantly higher than those in leaves under the two different stress duration (21 d and 49 d). Furthermore, the contents of CAT activities in roots were lower than those in leaves under the stress duration of 21 days, but were higher than those in leaves under the stress duration of 49 days. The antioxidant enzyme activities in roots and leaves under the stress duration of 21 days were higher than those with duration of 49 days. We also found that the POD activity in roots at the stress duration of 49 days were positively correlated to cadmium concentrations, indicating that the POD activity in roots dominated in antioxidant enzymes. The changes of MDA contents in roots or leaves were not significant under the stress of two different duration, but the fluctuation of the MDA content in roots or leaves under the stress duration of 21 days showed more obvious than those of 49 days with increasing cadmium concentrations, suggesting that plant physiological function exhibited a temporary repair in the early stress period. Compared to the control group, the root activities decreased both under different cadmium stress and different stress durations. We concluded that the mechanism of physiological response to cadmium in roots and leaves under different stress durations is very different, but the roots show stronger resistance to stress.
cadmium stress; Boehmeria nivea; leaf; antioxidant enzyme; root activity
国家自然科学基金项目(41161035,41461042);国家科技部“十二五”科技支撑计划资助项目(2011BAC13B02);江西省自然科学基金项目(20142BAB204007);江西省重大生态安全问题监控协同创新中心资助项目(NO.JXS-EW-03)
杨叶萍(1991-),女,硕士研究生,研究方向为湿地生态学,E-mail: yeping0326@qq.com;
*通讯作者(Corresponding author), E-mail: jianminfei0914@163.com
10.7524/AJE.1673-5897.20160313003
2016-03-13 录用日期:2016-04-22
1673-5897(2016)4-184-10
X171.5
A
简介:简敏菲(1969-),女,环境工程工学博士,教授,主要研究方向湿地生态学、环境生态学与生态毒理学,发表学术论文70余篇。
杨叶萍, 简敏菲, 余厚平, 等. 镉胁迫对苎麻(Boehmeria nivea)根系及叶片抗氧化系统的影响[J]. 生态毒理学报,2016, 11(4): 184-193
Yang Y P, Jiang M F, Yu H P, et al. Influence on the antioxidant system in roots and leaves of Boehmeria nivea under different cadmium stress [J]. Asian Journal of Ecotoxicology, 2016, 11(4): 184-193 (in Chinese)

