根表铁膜对水稻吸收转运稀土元素Ce的影响
潘华华,金姝兰,黄益宗,胡莹,王斐,李季,向猛,张地生
1. 上饶师范学院,上饶 334000 2. 农业部环境保护科研监测所,天津 300191 3. 中国科学院生态环境研究中心,北京 100085
根表铁膜对水稻吸收转运稀土元素Ce的影响
潘华华1,金姝兰1,黄益宗2,*,胡莹3,王斐3,李季3,向猛3,张地生1
1. 上饶师范学院,上饶 334000 2. 农业部环境保护科研监测所,天津 300191 3. 中国科学院生态环境研究中心,北京 100085
采用溶液培养的方法探讨根表铁膜形成对水稻吸收积累和转运稀土元素Ce的影响。结果表明,Ce污染胁迫可抑制水稻根表铁膜的形成,根表铁膜吸附的Ce量随着溶液中Ce浓度的提高而增加。根表铁膜形成可降低水稻根系但提高水稻茎叶对Ce的吸收积累。当溶液中Ce浓度为0.1、0.5和1.0 mmol·L-1时,铁膜诱导组水稻根系Ce含量分别比非诱导组水稻根系Ce含量降低38.60%、45.94%和32.75%,诱导组水稻茎叶Ce含量分别比非诱导组水稻茎叶Ce含量提高42.37%、28.87%和22.62%。根表铁膜形成可影响Ce在水稻植株中的富集和转运能力。非诱导组水稻根系富集Ce的能力远大于茎叶。诱导组水稻根系对Ce的富集能力最强,其次是根表铁膜,最后是水稻茎叶。诱导组水稻根系Ce转运系数显著大于非诱导组的根系,说明根表铁膜形成可促进水稻根部Ce向茎叶中转运。可见,根表铁膜对水稻吸收转运稀土元素的影响机理比较复杂。
Ce;水稻;根表铁膜;转运;富集系数
Received 11 January 2016 accepted 25 February 2016
稀土元素因其独特的磁、光、电等优越性能,成为传统产业及高新技术、国防尖端技术等产业生产不可或缺的元素。根据稀土元素原子电子层结构和物理化学性质,以及它们在矿物中共生情况和不同的离子半径可产生不同性质的特征,17种稀土元素通常分为2组:轻稀土(镧、铈、镨、钕、钷、钐、铕、钆)和重稀土(铽、镝、钬、铒、铥、镱、镥、钪)。其中,在地壳中含量最高的是稀土元素铈(Ce)。由于不合理的开采导致矿区周边水体和土壤Ce含量显著提高。有研究报道,包头主污水渠滨岸漫水地、四道沙河河底沉积物、工厂污水渠底部沉积物及其剖面样、农田土壤Ce含量分别为4 524.00、581.20、382.00、185.52和91.08 mg·kg-1,分别是背景值58.29 mg·kg-1的77.61、9.97、6.55、3.18和1.56倍[1-2]。温小军等[3]研究了赣南信丰某稀土矿区耕作层的土壤环境,发现研究区耕作层所有土壤样品的稀土元素地累积指数均较大,Ce超标率为97.3%。Jiang等[4]调查了16种稀土元素在北京、广东、上海等省市主要食物中的积累情况,发现食物中Ce等稀土元素含量高于国家限制标准。
由于土壤样品中铈以Ce4+形式存在,95%以上的Ce4+滞留于表层4 cm之内。而Ce4+的地球化学性质明显不同于其他3价稀土元素,Ce4+的水解能力大于其他3价稀土元素[5]。虽然稀土Ce可以农用,但并不是农作物需要的丰量元素。少量的Ce可提高农作物的数量和质量,大量应用则会影响农作物的生长,甚至产生毒害作用。Lin等[6]研究表明,高浓度的Ce显著影响水稻根和茎的生长,且毒性大于重金属锌。Ce的化合物对蚕豆根尖细胞具有一定的遗传毒性和细胞毒性,Ce3+浓度在50 μmol·L-1以上对杂色云芝酶活性有抑制作用[7]。Wang等[8]研究发现,较高浓度的Ce可破坏拟南芥细胞的超微结构,影响拟南芥的生长。Ce4+能诱导花生悬浮细胞发生程序性死亡[9]。Ce对动物体有很大的损伤力。动物体对Ce表现出明显的选择性蓄积,Ce在眼球的蓄积性明显高于其他脏器组织,其次是骨骼、睾丸、大脑和心脏[10]。Ce蓄积在大脑对高级神经系统造成一定的损伤[11]。Ce对大鼠具有较强的毒害作用, 主要靶器官为肝脏和肺, 使肝、肾抗氧化能力降低。ICR (Institute of Cancer Researcch)在小鼠腹腔注射20 mg·kg-1剂量的CeCl3,可导致脑组织细胞抗氧化酶活性和细胞总抗氧化力下降、脂质过氧化增加,并诱导部分神经细胞转化成炎症细胞[12]。梁青青等[13]调查发现,白云鄂博矿区小学生尿中稀土元素Ce是对照的300多倍,铈、钕等的污染可能对该地区儿童健康造成影响。矿区居民日均Ce等稀土元素摄入量达6.0~6.7 mg时,将影响人体的神经系统、血液系统、消化系统、生殖系统及骨骼[14]。
以江西为中心的中国南方地区是世界最大的离子型稀土分布区,也是中国重要的水稻种植区。稀土矿产开采形成的尾矿、废渣、废水中含有较多的铜、锌、镉、镍、砷及大量的稀土元素。离子型稀土矿的提炼,使用了大量的硫酸铵、碳酸氢铵等浸矿化学药剂。大量的浸矿剂,一方面使土壤酸化,另一方面使这些元素随水体的流动进入矿区土壤和水系中,导致重金属与稀土元素对农田的复合污染,稻田产出粮食减少。因此研究Ce污染物的消减及调控,减少其生物有效性具有十分重要的意义。研究表明,存在于水稻根表的铁膜对重金属元素在土壤中的化学行为和生物有效性及根系吸收养分和污染物起着重要作用。稀土具有重金属的属性,水田中稀土元素易于转移到水稻根系、茎叶中,且水稻根系Ce含量远高于茎叶,说明水稻根系吸收积累Ce的能力更强。随着土壤稀土元素浓度的增加, 稀土元素在水稻根系、茎叶中的积累也迅速提高,水稻根系中稀土元素含量与土壤稀土元素含量呈显著正相关关系[15]。当稀土元素含量超过400 mg·kg-1时, 将显著影响水稻植株的生长,并通过食物链途径危害人体健康[15]。近年来国内外许多科学家研究水稻根表铁膜形成对重金属吸收积累的影响[16-17],但是根表铁膜形成对稀土元素吸收和转运的影响还未见报道。本文通过溶液培养法探讨水稻根表铁膜形成对稀土元素Ce吸收积累和转运的影响,为农田稀土元素Ce的污染防治提供科学依据。
1 材料与方法 (Materials and methods)
1.1 供试水稻
供试的水稻(Oryza sativa L.)品种为嘉花1号,由浙江嘉兴市农业科学院提供,是一种广泛种植的南方晚稻品种,选择颗粒饱满、大小均匀的水稻种子用浓度30%的H2O2消毒10 min,用去离子水清洗2~3遍后,播种到湿润的珍珠岩中培养3周。选择生长一致的水稻苗移栽至直径7.5 cm,高14 cm的PVC盆中。盆内装有1/3强度的营养液。营养液pH为5.5,其配方见表1,每周换2次营养液。
1.2 试验设计
设置4个Ce浓度处理:0.0(CK)、0.1、0.5和1.0 mmol·L-1,以Ce(NO3)3形式加入。分别采用诱导铁膜水稻和未诱导铁膜水稻作为诱导组和非诱导组。每个处理4次重复,共32盆。水稻诱导铁膜的步骤:当水稻根长至10 cm左右时,将盆内的营养液弃去,用蒸馏水浸泡12 h,然后用40 mg·L-1的硫酸亚铁(Fe2SO4)溶液处理36 h,弃去盆内溶液,再用1/3强度的营养液培养水稻48 h。水稻在可控光温的生长室中培养。生长条件:光照强度为260~350 μmol·m-2·s-1,相对湿度为60%~70%左右,光照温度为30 ℃ (14 h·d-1),黑暗温度为20 ℃ (10 h·d-1)。诱导组和非诱导组水稻经过不同浓度的Ce处理1周后,分地上部和地下部收获。
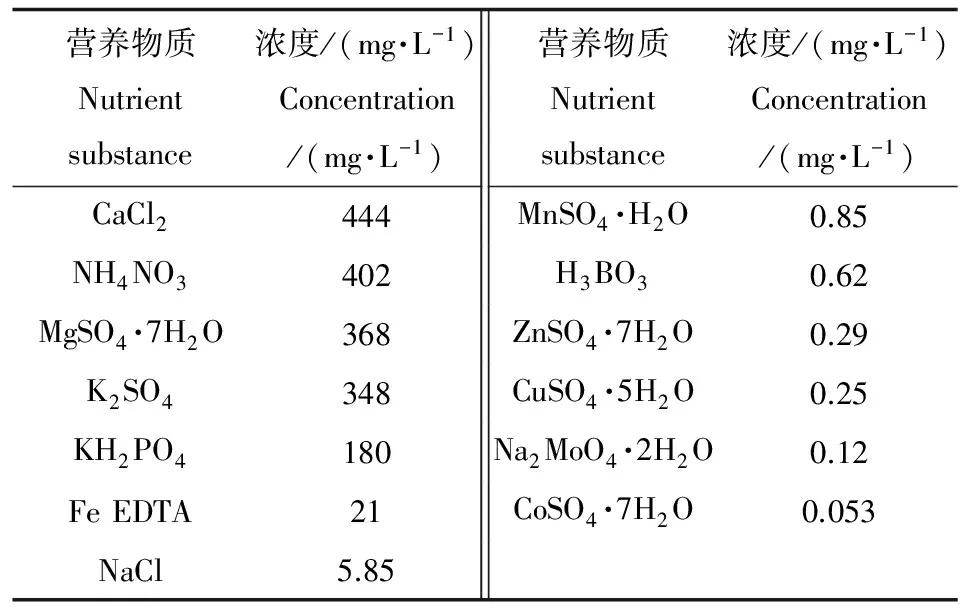
表1 水稻营养液配方
1.3 样品处理与分析
水稻植株根部铁膜用DCB(dithionite-citrate-bicarbonate)法浸提。操作方法[14]:从植株体基部剪下稻根,将稻根用纯净水洗净,吸干水分后放入100 mL的烧杯中,用30 mL的0.125 mol·L-1碳酸氢钠(NaHCO3)和0.03 mol·L-1柠檬酸三钠(Na3C6H5O7·2H2O)混合溶液浸泡10~15 min,放入1 g保险粉(Na2S2O4)混合均匀后,在室温下(20~25 ℃)继续浸泡直至稻根完全变白,将浸提液转入50 mL容量瓶中,用纯净水冲洗稻根3次后,将清洗液全部转入容量瓶并定容至50 mL。采用电感耦合等离子体光谱法ICP-OES(Optima 2000 DV,Perkin Elmer,USA)测定其中的Fe和Ce浓度。将水稻茎叶和浸提后的稻根分别用纯净水清洗3次,用吸水纸将其水分吸干后放入70 ℃的烘箱烘干至恒重,然后将其分别磨碎,称取0.2000±0.0001左右的水稻茎叶、0.1000±0.0001的稻根样品分别放入50 mL的聚四氟乙烯消解罐中,每个样品3个平行,加5 mL优级纯HNO3浸泡过夜,放入微波加速反应系统中进行消解。消解结束后将消解罐中的溶液全部转移到20 mL的容量瓶中,分别用超纯水定容到20 mL,摇匀,过滤后收集上清液,用ICP-OES测定Ce的浓度,运用国家标准样品(茶叶GBW10016)对实验的分析测试过程进行质量控制。
1.4 数据分析
水稻根表铁膜(DCB)、根系(root)向茎叶(shoot)转移Ce的能力用转运系数(translocation factor,简称TF)表示。
TFx=Cshoot-Ce/Cx-Ce
式中:x分别代表水稻根表铁膜和根系,TFx分别表示铁膜、根系向茎叶转移Ce的系数,Cshoot-Ce表示茎叶中Ce的浓度,Cx-Ce分别表示铁膜、根系中Ce的浓度。
水稻对Ce的富集能力用富集系数(BAF)表示。
BAFy=Cy-Ce/Csolution-Ce式中:y分别代表根表铁膜、稻根、茎叶,BAFy分别表示根表铁膜、稻根、茎叶Ce的富集系数,Cy-Ce分别表示根表铁膜、稻根、茎叶Ce的浓度,Csolution-Ce表示培养液中Ce的浓度。使用统计软件Origin9.0、SPSS19.0和Excel2007对试验数据进行统计分析。
2 结果与分析 (Results and analysis)
2.1 水稻根表铁膜形成及其吸附的Ce量
水稻根表铁膜形成量以DCB-Fe含量表示(表2),Ce处理对水稻根表铁膜形成影响较大,0.1~1.0 mmol·L-1Ce处理均显著降低于CK水稻根表铁膜的形成量(P<0.05),说明Ce胁迫不利于水稻根表铁膜形成。水稻根表铁膜吸附的Ce随着Ce浓度的增加而增加,由0.1 mmol·L-1Ce处理时的218.05 mg·kg-1提高到1.0 mmol·L-1Ce处理时的644.84 mg·kg-1。
2.2 水稻茎叶和根系中的Ce含量
图1为诱导组和非诱导组水稻茎叶和根系中的Ce含量,从图中可知,水稻根系Ce含量远高于茎叶,说明水稻根系吸收积累Ce的能力较强。对水稻根系来说,诱导组相对于非诱导组显著地降低水稻根系对Ce的吸收积累。当溶液中Ce浓度为0.1、0.5和1.0 mmol·L-1时,诱导组水稻根系Ce含量分别比非诱导组水稻根系Ce含量降低38.60%、45.94%和32.75%。但是对水稻茎叶来说,诱导组却比非诱导组显著提高了水稻茎叶对Ce的吸收积累。当溶液中Ce浓度为0.1、0.5和1.0 mmol·L-1时,诱导组水稻茎叶Ce含量分别比非诱导组水稻茎叶Ce含量提高42.37%、28.87%和22.62%。

表2 水稻根表铁膜形成及其吸附的Ce量
注:同一列不同字母表示差异性显著(P<0.05),ND表示未检出。
Note: Different letters in the same column means significant difference (P<0.05), ND indicates not detected.
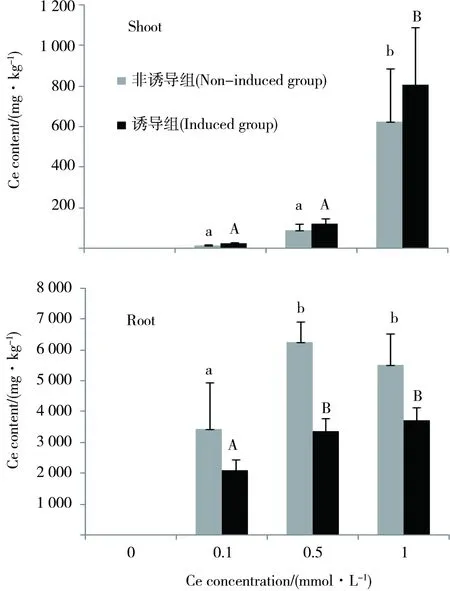
图1 根表铁膜对水稻茎叶和根系Ce含量的影响注:n=4,a、b和A、B分别表示非诱导组和诱导组不同处理间的差异性显著,P<0.05;*表示非诱导组和诱导组之间的P<0.05显著性差异。Fig. 1 Effect of iron plaque on Ce content in shoot and root of rice Note: n= 4. a, b and A, B mean significant difference among different treatments of induced or non-induced group, P<0.05; * means significant difference between induced and non-induced group (P<0.05).
2.3 Ce从水稻根表铁膜、根系向茎叶中的转运
3种浓度Ce处理的水稻无论是根表有无铁膜,其根系向茎叶转运Ce的系数均随处理液Ce浓度的增加而显著增大,根表铁膜向茎叶转运Ce的系数也随着Ce浓度的增加而增大(表3),非诱导组在0.10~1.0 mmol·L-1Ce浓度处理下,水稻根系向茎叶转运Ce的系数由0.004提高到0.113(提高27.3倍)。诱导组在0.10~1.0 mmol·L-1Ce浓度处理下,水稻根表铁膜向茎叶转运Ce的系数由0.012提高到0.216(提高17.0倍),根表铁膜向茎叶转运Ce的系数由0.112提高到1.247(提高10.1倍),说明根表铁膜、根系向茎叶转运Ce的能力主要受处理液中Ce浓度的影响。诱导组水稻根系Ce转运系数显著大于非诱导组的根系,当溶液中Ce浓度为0.1、0.5和1.0 mmol·L-1时,诱导组水稻根系向茎叶转运Ce的系数分别比非诱导组水稻根系向茎叶转运Ce的系数提高200.0%、157.1%和91.2%,说明根表铁膜促进水稻根部Ce向茎叶转移。水稻根表铁膜向茎叶转运Ce的系数大于水稻根系向茎叶转运Ce的系数,这是因为铁膜吸附Ce的数量显著小于根系。
2.4 Ce在水稻不同部位的富集
从表4可知,3种不同浓度Ce处理下,无论是诱导组还是非诱导组水稻根系Ce富集系数均显著大于水稻茎叶Ce富集系数。非诱导组在0.10、0.5和1.0 mmol·L-1Ce浓度处理下,水稻根系Ce富集系数分别为244.74、89.12和39.46,而水稻茎叶Ce富集系数仅分别为1.00、1.25和4.44。诱导组在0.10、0.5和1.0 mmol·L-1Ce浓度处理下,水稻根系Ce富集系数分别为150.28、48.18和26.54,而水稻茎叶Ce富集系数仅分别为1.74、1.76和5.74。诱导组在0.10、0.5和1.0 mmol·L-1Ce浓度处理下,水稻根表铁膜Ce富集系数分别为15.56、4.93和4.60,分别小于同等Ce浓度处理下的根系Ce富集系数,但是大于同等Ce浓度处理下的茎叶Ce富集系数(除1.0 mmol·L-1Ce浓度处理外),说明水稻根系对Ce的富集能力最强,其次是根表铁膜,最后是水稻茎叶。当溶液中Ce浓度为0.1、0.5和1.0 mmol·L-1时,诱导组水稻根系Ce富集系数分别比非诱导组水稻根系Ce富集系数降低38.6%、45.9%和32.7%,诱导组水稻茎叶Ce富集系数分别比非诱导组水稻茎叶Ce富集系数提高74.0%、40.8%和29.3%,说明根表铁膜有效地阻隔水稻根系对Ce的吸收和富集,而稍微促进Ce向水稻茎叶转运。
3 讨论 (Discussion)
水稻是世界重要的粮食作物,全球60%的人以米饭为主食。中国是世界最大的水稻生产国,稻谷年平均产量占世界的35%[17]。水稻作为湿地植物具有大量的通气组织,该组织把叶片的氧气输送到根系,使淹水条件下的Fe2+发生氧化,生成Fe(OH)3,并在水稻根表沉积,形成棕色的根表铁膜[18]。本研究中用Fe2SO4溶液处理的水稻也形成了棕色的根表铁膜。水稻根表铁膜的形成与水稻的品种类型与生育期、Fe2+浓度及其有效性和溶解性、根系的氧化能力、土壤的粘粒含量、生长介质中的有机质和无机碳酸盐、P或S的供应状况显著相关。有研究报道,加S处理能增加水稻根表铁膜数量,加硅处理却明显降低其数量。磷酸根会阻碍铁膜在根表的结晶过程[19]。徐星凯等[20]报道高浓度的稀土元素能有效地减少水稻对P的吸收,培养液中的Ce在水稻根表可形成磷酸铈沉淀。此外,介质中还会形成氢氧化铈、硫酸铈沉淀并附着于水稻根表,从而影响根表铁膜的形成。本研究发现,Ce处理的水稻其根表铁膜的数量均显著低于CK,说明Ce胁迫不利于水稻根表铁膜的形成。
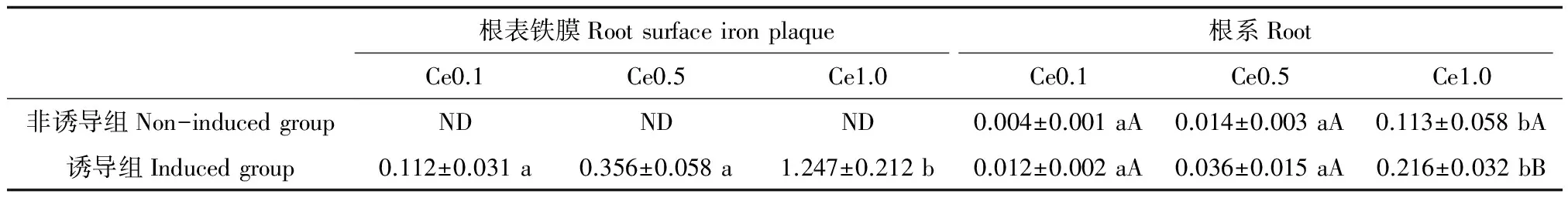
表3 Ce由水稻根表铁膜、根系向茎叶中的转运系数
注:Ce 0.1,Ce 0.5,Ce 1.0表示Ce处理浓度为0.1、0.5、1.0 mmol·L-1。不同小写字母表示不同Ce处理之间显著性差异,不同大写字母表示非诱导组和诱导组之间呈显著性差异(P<0.05),ND表示未检出。
Note: Ce 0.1, Ce 0.5, Ce 1 stand for that the treatment concentration of Ce is 0.1, 0.5, 1 mmol·L-1. Different small letters mean significant difference among different Ce treatment, different capital letters mean significant difference between induced and non-induced group (P< 0.05). ND indicates not detected.
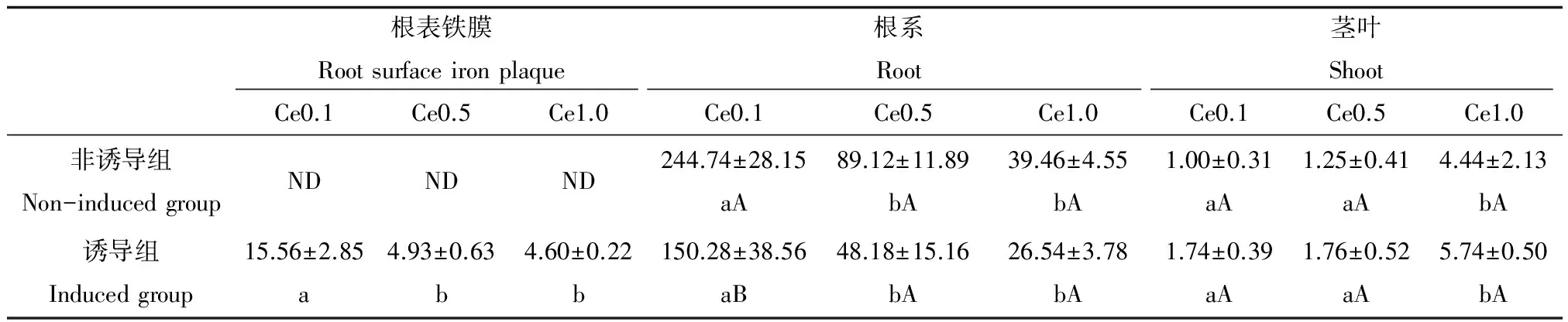
表4 Ce在水稻不同部位的富集系数
注:不同小写字母表示不同Ce处理之间显著性差异,不同大写字母表示诱导组与非诱导组之间呈显著性差异(P<0.05),ND表示未检出。
Note: Different small letters mean significant difference among different Ce treatment, different capital letters mean significant difference between induced and non-induced group (P<0.05). ND indicates not detected.
铁膜独特的物理、化学结构与性质影响元素在土壤中的化学行为和生物有效性,对植物吸收营养元素、重金属起着重要作用。本研究中,铁膜诱导组水稻根系吸收积累Ce比非诱导组显著降低,当溶液中Ce浓度为0.1~1.0 mmol·L-1时,诱导组水稻根系Ce含量分别比非诱导组水稻根系Ce含量降低32.75%~45.94%,说明根表铁膜形成对水稻根系吸收积累稀土元素Ce起着阻碍作用。国内外学者针对水稻、芦苇、香蒲等植物根表铁膜形成对营养元素和重金属的生态环境效应做了大量的研究,得出根表铁膜对土壤中重金属离子有富集作用,尤其对两价重金属阳离子Cd、Pb等有强烈的吸附作用[21-23],另外离子与氧化物的共沉淀作用,影响着重金属在介质中的移动性和生物有效性。铁膜还可以吸附介质中的阴离子,其吸附的阴离子与其他阳离子结合,进一步改变金属阳离子的有效性。有研究表明,吸附在铁膜外表的金属离子要经过解吸和跨越铁膜等复杂过程之后才能到达根表,根表铁膜是土壤中金属离子进入水稻体内的界面。由于铁膜对介质中的金属离子的吸附、氧化-还原、固定作用,使其成为这些离子进入根系组织的阻碍层,因此根表铁膜可以减少重金属向水稻植株体的迁移,使有铁膜水稻根系的重金属含量低于无铁膜水稻根系[24-25]。
我们的研究发现尽管铁膜诱导组水稻根系Ce含量比非诱导组显著降低,但是诱导组水稻茎叶Ce含量却比诱导组有所提高,这可能是因为水稻茎叶Ce含量积累除了与水稻根系铁膜形成有关外,还与水稻Ce的迁移和转运复杂机制相关。与我们的结果相类似,其他研究者也报道根表铁膜形成可促进植物对重金属元素的吸收积累[19]。由于湿地植物根表铁膜在近根区域能富集大量磷、锌、镁、锰等植物必须的营养元素,是营养元素的富集库[26-27]。铁膜富集的营养元素能够被植物活化吸收利用,从而提高根系的活力和转运重金属元素的能力。有研究表明,高浓度的Fe和P能促进冷水花植物对P的吸收,有铁膜沉积的芦竹和香蒲P元素利用的有效性比无铁膜的高[28]。Zhou等[29]对水稻根表铁膜吸附Se的研究也得出了相似的结论。铁膜一方面可缓解植物缺磷症状,另一方面可通过形成氧化物降低根际铁浓度,从而缓解二价铁的毒害[30]。Batty等[31]在芦苇的水培实验中发现铁膜并不会渗透到组织细胞内部,而是不均匀地沉积在细胞外,铁膜的这种分布特点可能不会阻碍重金属从植物根系向茎叶中迁移。由于水稻根表铁膜富集了大量的营养元素,减轻了二价铁毒害,提高了根系转运稀土元素Ce的能力,促进根系中Ce向茎叶迁移,使有铁膜的水稻茎叶Ce含量反而多于无铁膜的茎叶。当然,根表铁膜形成对植物吸收、积累和转运稀土元素的机制非常复杂,不同的植物种类、不同稀土元素种类、铁膜量以及不同环境条件等因素将影响这一吸收、积累和转运过程,导致植物不同部位稀土元素含量不一样。
综上可知:
1) Ce胁迫可抑制水稻根表铁膜的形成,而水稻根表铁膜可吸附溶液中的部分Ce,其吸附Ce量随着溶液中Ce浓度的增加而增加。
2) 根表铁膜形成显著地降低水稻根系对Ce的吸收积累,而提高水稻茎叶对Ce的吸收积累。当溶液中Ce浓度为0.1~1.0 mmol·L-1时,诱导组水稻根系Ce含量比非诱导组水稻根系Ce含量降低32.75%~45.94%。
[1] 张庆辉, 赵捷, 朱晋. 包头市南郊污灌区铈分布特征及其对生态环境的影响[J]. 湖北农业科学, 2012, 51(3): 478-481
Zhang Q H,Zhao J,Zhu J. Distribution and environmental impact of cerium in wastewater irrigation area of Baotou southern suburbs [J]. Hubei Agricultural Sciences, 2012, 51(3): 478-481 (in Chinese)
[2] 张庆辉, 王贵, 赵捷, 等. 包头市四道沙河流域污灌区稀土元素的分布特征[J]. 西北农林科技大学学报: 自然科学版, 2012, 40(5): 186-190
Zhang Q H, Wang G, Zhao J, et al. REE distribution characteristics of sewage irrigation in Sidaoshahe basin of Baotou City [J]. Journal of Northwest A & F University: Natural Science Edition, 2012, 40(5): 186-190 (in Chinese)
[3] 温小军, 张大超. 资源开发对稀土矿区耕作层土壤环境及有效态稀土的影响[J]. 中国矿业, 2012, 21(2): 44-47
Wen X J, Zhang D C.Effect of resource exploitation on soil environment and rare earth bioavailable fractions in plough layer of mining area [J]. China Mining Magazine, 2012, 21(2): 44-47 (in Chinese)
[4] Jiang D G, Yang J, Zhang S,et al. A survey of 16 rare earth elements in the major foods in China [J]. Biomedical and Environmental Sciences, 2012, 25(3): 267-271
[5] 黄淑峰, 李宗芸, 胡方方, 等. 稀土铈生物学效应的研究进展[J]. 农业环境科学学报, 2007, 26(s): 351- 356
Huang S F, Li Z Y, Hu F F, et al. Research progress on biological activity of rare earth element cerium [J]. Journal of Agro-Environment Science, 2007, 26(s): 351-356 (in Chinese)
[6] Lin Y S, Ding Z F, Li P, et al. Physiological and biochemical responses of rice root to La3+, Ce3+and Zn2+stress [J]. Agricultural Science & Technology, 2012, 13(1): 17-20, 107
[7] 徐淑霞, 唐艳红, 张世敏, 等. 镧和铈对杂色云芝生长及其漆酶活性的影响[J]. 河南农业大学学报, 2007, 41(5): 556-564
Xu S X, Tang Y H, Zhang S M, et al. Effects of La and Ce on the growth of Coriolus versicolor and its laccases activity [J]. Journal of Henan Agricultural University, 2007, 41(5): 556-564 (in Chinese)
[8] Wang X, Lin Y S, Liu D W, et al. Cerium toxicity, uptake and translocation in Arabidopsis thaliana seedlings [J]. Journal of the Chinese Rare Earth, 2012, 30(6): 579-785
[9] 黄儒珠, 洪丽亚, 魏瑜. Ce4+诱导的花生悬浮细胞程序性死亡[J]. 福建师范大学学报:自然科学学报, 2005, 21(2): 90-94
Huang R Z, Hong L Y, Wei Y. Programmed cell death induced by Ce4+in suspension culture of Arachis hypogaea [J]. Journal of Fujian Normal University: Natural Science Edition, 2005, 21(2): 90-94 (in Chinese)
[10] 陈祖义, 刘玉, 王元兴. 稀土元素铈(141Ce)在小鼠体内的分布与蓄积动态[J]. 南京农业大学学报, 2000, 23(3): 101-103
Chen Z Y, Liu Y, Wang Y X. Study on distributions and accumulations of rare earth element cerium (141Ce) in mice [J]. Journal of Nanjing Agricultural University, 2000, 23(3): 101-103 (in Chinese)
[11] 陈祖义. 稀土元素的脑部蓄积性、毒性及其对人群健康的潜在危害[J]. 农村生态环境, 2005, 21(4): 72-73, 80
Chen Z Y. Accumulation and toxicity of rare earth elements in brain and their potential effects on health [J]. Rural Eco-Environment, 2005, 21(4): 72-73, 80 (in Chinese)
[12] Zhao H, Cheng Z, Hu R, et al. Oxidative injury in the brain of mice caused by lanthanide [J]. Biological Trace Element Research, 2011, 142(2): 174-189
[13] 梁青青, 阴海静, 郝金奇, 等. 白云鄂博矿区小学生尿中稀土元素镧铈钕水平的调查[J]. 环境与健康杂志, 2014, 31(11): 1003-1004
Liang Q Q, Yin H J, Hao J Q, et al. Investigation of rare earth elements lanthanum, cerium and neodymium level in urine of pupils from Bayan Obo mining area [J]. Journal of Environmental Health, 2014, 31(11): 1003-1004 (in Chinese)
[14] 朱为方, 徐素琴, 邵萍萍, 等. 赣南稀土区生物效应研究—稀土日允许摄入量[J]. 中国环境科学, 1997, 17(1): 63-66
Zhu W F, Xu S Q, Shao P P, et al. Investigation on intake allowance of rare earth — A study on bio-effect of rare earth in South Jiangxi [J]. China Environmental Science, 1997, 17(1): 63-66 (in Chinese)
[15] 王立军, 胡霭堂, 周权锁, 等. 稀土元素在土壤-水稻体系中的迁移与吸收累积特征[J]. 中国稀土学报, 2006, 24(1): 91-97
Wang L J, Hu A T, Zhou Q S, et al. Accumulation and fractionation of rare earth elements in soil-rice system [J]. Journal of the Chinese Rare Earth society, 2006, 24(1): 91-97 (in Chinese)
[16] 胡莹, 黄益宗, 黄艳超, 等. 不同生育期水稻根表铁膜的形成及其对水稻吸收和转运Cd的影响[J]. 农业环境科学学报, 2013, 32(3): 432-437
Hu Y, Huang Y Z, Huang Y C, et al. Formation of iron plaque on root surface and its effect on Cd uptake and translocation by rice (Oryza sativa L.) at different growth stages [J]. Journal of Agro-Environment Science, 2013, 32(3): 432-437 (in Chinese)
[17] 胡莹, 黄益宗, 黄艳超, 等. 根表铁锰膜对不同生育期水稻吸收和转运As的影响[J]. 生态毒理学报, 2013, 8(2): 163-171
Hu Y, Huang Y Z, Huang Y C, et al. Influence of iron and manganese plaque on root surface on arsenic uptake and translocation by rice (Oryza sativa L.) at different growth stages [J]. Asian Journal of Ecotoxicology, 2013, 8(2): 163-171 (in Chinese)
[18] Povidisa K, Delefosse M, Holmer M. The formation of iron plaques on roots and rhizomes of the seagrass Cymodocea serrulata (R. Brown) Ascherson with implications for sulphide intrusion [J]. Aquatic Botany, 2009, 90(4): 303-308
[19] 刘春英, 陈春丽, 弓晓峰, 等. 湿地植物根表铁膜研究进展[J]. 生态学报, 2014, 34(10): 2470-2480
Liu C Y, Chen C L, Gong X F, et al. Progress in research of iron plaque on root surface of wetland plants [J]. Acta Ecologica Sinica, 2014, 34(10): 2470-2480 (in Chinese)
[20] 徐星凯, 王子健, 刘琰. 土壤-植物系统中稀土元素与氮磷养分的交互作用[J]. 应用生态学报, 2002, 13(6): 750-752
Xu X K, Wang Z J, Liu Y. Interaction between rare earths and nitrogen and phosphorus in soil-plant system [J]. Chinese Journal of Applied Ecology, 2002, 13(6): 750-752 (in Chinese)
[21] Ma X M, Liu J G, Wang M X. Differences between rice cultivars in iron plaque formation on roots and plant lead tolerance [J]. Advance Journal of Food Science and Technology, 2013, 5(2): 160-163
[22] Liu H J, Zhang J L, Christie P, et al. Influence of iron fertilization on cadmium uptake by rice seedlings irrigated with cadmium solution [J]. Communications in Soil Science and Plant Analysis, 2010, 41(5): 584-594
[23] Trivedt P, Axe L. Modeling Cd and Zn sorption to hydrous metal oxides [J]. Environmental Science & Technology, 2000, 34(11): 2215-2223
[24] Chen Z, Zhu Y G, Liu W J, et al. Direct evidence showing the effect of root surface iron plaque on arsenite and arsenate uptake into rice (Oryza sativa L.) roots [J]. New Phytologist, 2005, 165: 91-97
[25] Liu W J, Zhu Y G, Smith F A, et al. Do iron plaque and genotypes affect arsenate uptake and translocation by rice seedlings (Oryza sativa L.) grown in solution culture? [J]. Journal of Experimental Botany, 2004, 55: 1707-1713
[26] Liang Y, Zhu Y G, Xia Y, et al. Iron plaque enhances phosphorus uptake by rice (Oryza sativa) growing under varying phosphorus and iron concentrations [J]. Annals of Applied Biology, 2006, 149(3): 305-312
[27] Hossain M B, Jahiruddin M, Loeppert R H, et al. The effects of iron plaque and phosphorus on yield and arsenic accumulation in rice [J]. Plant and Soil, 2009, 317(1-2): 167-176
[28] 王振宇, 刘利华, 温胜芳, 等. 2种湿地植物根表铁氧化物胶膜的形成及其对磷素吸收的影响[J]. 环境科学, 2010, 31(3): 781-786
Wang Z Y, Liu L H, Wen S F, et al. Effect of iron plaque on root surfaces on phosphorus uptake of two wetland plants [J]. Environmental Science, 2010, 31(3): 781-786 (in Chinese)
[29] Zhou X B, Shi W M. Effect of root surface iron plaque on Se translocation and uptake by Fe-deficient rice [J]. Pedosphere, 2007, 17(5): 580-587
[30] 杨旭健, 傅友强, 沈宏, 等. 水稻根表铁膜及其形成的形态、生理及分子机理综述[J]. 生态学杂志, 2014, 33(8): 2235-2244
Yang X J,Fu Y Q, Sheng H, et al. A review on iron plaque on rice (Oryza sativa) root surface and the morphology, physiology and molecular biology of its formation mechanism [J]. Chinese Journal of Ecology, 2014, 33(8): 2235-2244 (in Chinese)
[31] Batty L C, Baker A J M, Wheeler B D. Aluminium and phosphate uptake by Phragmites australis: The role of Fe, Mn and Al root plaques [J]. Annals of Botany, 2002, 89(4): 443-449
Effect of Root Surface Iron Plaque on Uptake and Translocation of Cerium (Rare Earth Element) in Rice Seedlings
Pan Huahua1, Jin Shulan1, Huang Yizong2,*, Hu Ying3, Wang Fei3, Li Ji3, Xiang Meng3, Zhang Di sheng1
1. Shang Rao Normal University, Shangrao 334001, China 2. Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China 3. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
Effect of iron plaque formation of root surface on uptake, accumulation and translocation of Ce (rare earth element) by rice seedlings was evaluated by method of solution culture experiment. The result showed that Ce pollution stress could inhibit the formation of root surface iron plaque in rice seedlings, the amount of Ce which was uptaken by root surface iron plaque increased with the increase of Ce concentration in the solution. The iron plaque formation of root surface could decrease the uptake and accumulation of Ce by rice root system, but increase uptake and accumulation of Ce by rice stem and leaves. When Ce concentration in the solution is 0.1, 0.5 and 1.0 mmol·L-1, Ce content by rice roots with iron plaque induced group was decreased by 38.60%, 45.94% and 32.75% respectively when comparing with non-induced group, and Ce content by stem and leaves with iron plaque induced group was increased by 42.37%, 28.87% and 22.62% respectively when comparing with non-induced group. The formation of iron plaque on root surface could influence the accumulation and translocation of Ce in rice seedlings. The ability which rice roots accumulated Ce element was greater than that of the stem and leaves in non-induced group. The ability of accumulating Ce element was the strongest in rice roots in induced-group, followed by root surface iron plaque, and the last was the rice leaves and stem. The enrichment coefficient of rice roots in iron plaque induced group was significantly greater than that of rice roots in non-induced group, which meant iron plaque formation on root surface could increase Ce transfer from rice roots to stem and leaves. Thus, effect of root surface iron plaque on uptake and translocation of Ce element in rice seedlings was comparatively complicated.
cerium; rice; root surface iron plaque; translocation; enrichment coefficient
国家自然科学基金(41561096);江西省自然科学基金项目(20142BAB203026)
潘华华(1980-),女,讲师,研究方向为稀土元素环境效应,E-mail: jsl809@163.com
*通讯作者(Corresponding author), E-mail: hyz@rcees.ac.cn
10.7524/AJE.1673-5897.20160111004
2016-01-11 录用日期:2016-02-25
1673-5897(2016)4-130-08
X171.5
A
简介:黄益宗(1970—),男,博士,研究员,主要从事重金属在土壤-植物系统中的迁移、转化和积累研究,以及污染土壤修复技术、污染生态学等方面的研究,近年来在国内外核心刊物发表论文150多篇。
潘华华, 金姝兰, 黄益宗, 等. 根表铁膜对水稻吸收转运稀土元素Ce的影响[J]. 生态毒理学报,2016, 11(4): 130-137
Pan H H, Jin S L, Huang Y Z, et al. Effect of root surface iron plaque on uptake and translocation of cerium (rare earth element) in rice seedlings [J]. Asian Journal of Ecotoxicology, 2016, 11(4): 130-137 (in Chinese)

