多酚对猪肉肌原纤维蛋白氧化和凝胶特性的影响
张慧芸,吴静娟,郭新宇
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
多酚对猪肉肌原纤维蛋白氧化和凝胶特性的影响
张慧芸,吴静娟,郭新宇
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
采用羟自由基氧化体系研究添加不同质量分数多酚化合物——鞣酸(tannic acid,TA)、没食子酸(gallic acid,GA)对猪肉肌原纤维蛋白氧化和凝胶特性的影响。结果表明:与对照组相比,添加0.05% TA和0.25% GA可显著抑制肌原纤维蛋白中羰基和二聚酪氨酸含量的增加(P<0.05),提高肌原纤维蛋白的最大热变性温度和凝胶保水性(P<0.05)。扫描电子显微镜观察表明,不同酚类化合物对肌原纤维蛋白凝胶微观结构影响有显著差异,添加0.05%氧化TA后形成的肌原纤维蛋白凝胶结构更加致密。结论:多酚的添加抑制了肌原纤维蛋白氧化,改善了肌原纤维蛋白的热稳定性、凝胶保水性和凝胶强度。
多酚;肌原纤维蛋白;蛋白氧化;结构;凝胶性
猪肉是我国产量最大、消费最普遍的肉类。由于肉中富含较高浓度的不饱和脂肪酸、亚铁血红素、金属催化剂等其他促氧因子,使其在加工与贮藏过程中极易氧化变质[1]。肌原纤维蛋白作为蛋白质的主要成分对肉蛋白功能的凝胶性起着主要作用,这类蛋白在热诱导作用下能够形成三维网状结构,赋予肉制品较好的感官、质构、保水及保油性[2]。研究表明,肉制品中的蛋白氧化可能是其品质劣化的重要原因[3];蛋白氧化会降低肉的嫩度、风味、保水及保油性[4],使肉的质地变差,缩短产品的货架期[5]。因此,控制猪肉制品蛋白氧化,提高肉糜的凝胶强度是目前开发高品质猪肉所需解决的首要问题。
多酚既可抑制微生物生长,同时亦是一种天然抗氧化剂,主要存在于植物的硬组织中,如谷物颗粒的外壳、水果的细胞壁、咖啡豆、茶叶以及根茎类[6]。多酚虽然是植物组织中一种广泛分布的次要成分,但在提高蛋白质的交联方面有着很好的效果[7]。研究发现,多酚通过向活泼自由基提供氢,阻断其链式反应,进而延缓了油脂中不饱和脂肪酸的自动氧化[8]。Balange等[9]研究表明,向大眼鲷鱼糜中分别添加0.05%鞣酸、0.15%咖啡酸、0.2%月桂酸、0.05%儿茶酸可提高其凝胶特性。Murcia等[10]研究表明,植物酚类物质的抗氧化能力与其所含酚羟基数目成正比。Estévez等[11]研究发现植物酚类物质的抗氧化活性存在复杂的化学机制,一些植物酚类化合物随着体系中Fe3+和高铁肌红蛋白含量的变化,其活性由抗氧化转变为促氧化。Maqsood等[12]研究发现,经鞣酸处理并使用高氧气调包装可以保持肉的红色并减少脂肪氧化和微生物生长。然而有关蛋白质氧化的研究目前主要集中在临床医药方面,在肉品领域相对较少。虽然国外已将多酚化合物用来提高蛋白质的交联,但是关于多酚化合物对猪肉肌原纤维蛋白结构和凝胶特性影响的研究却鲜有报道。本研究采用羟自由基氧化体系,通过测定羰基和二聚酪氨酸含量、蛋白质热稳定性及凝胶保水性,观察凝胶微观结构变化,研究多酚对猪肉肌原纤维蛋白氧化与凝胶特性的影响,以期为多酚在肉类生产加工过程中的实际应用提供理论依据。
1 材料与方法
1.1 材料与试剂
冷鲜猪后腿肉 洛阳市丹尼斯超市;丁羟基茴香醚(butylated hydroxyanisole,BHA)、鞣酸、没食子酸 合肥博美生物有限公司;牛血清白蛋白(bovine serum albumin,BSA) 上海生工生物工程股份有限公司;乙二醇-双-(2-氨基乙醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)郑州久是生物技术有限责任公司;2,4-二硝基苯肼 河南普金生物技术有限公司;其他试剂均为分析纯,购于洛阳奥龙化玻有限公司。
1.2 仪器与设备
UV754N紫外-可见分光光度计、AL-104型精密电子天平 上海佑科仪器仪表有限公司;JSM-5610LV扫描电子显微镜 日本JEOL公司;PHS-3C pH计上海精密科学仪器有限公司;Cary Eclipse荧光分光光度计美国Aglient公司;XW-80A微型旋涡混合仪 上海泸西分析仪器厂有限公司;DHG-9140A型鼓风干燥箱 上海一恒科学仪器有限公司;H1850R高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;DZKW-S-4型电热恒温水浴锅 北京市永光明医疗仪器有限公司;差示扫描量热仪(differential scanning calorimetry,DSC) 瑞士Mettler-Toledo公司。
1.3 方法
1.3.1 猪肉肌原纤维蛋白的提取
肌原纤维蛋白提取参照Wu Mangang等[13]所述方法:取冷鲜猪后腿肉,去除脂肪和结缔组织,切成小块后,加入pH 7.0的4 倍提取缓冲液(10 mmol/L K2HPO4、0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EGTA)匀浆1 min后,用冷冻离心机8 000 r/min离心15 min,弃上清液取沉淀,重复以上步骤2 次;然后将粗提的肌原纤维蛋白沉淀加入4 倍体积的0.1 mol/L NaCl溶液,匀浆机匀浆1 min后,用冷冻离心机8 000 r/min离心15 min,此操作重复1 遍;将得到的沉淀加入8 倍体积的0.1 mol/L NaCl溶液,匀浆机匀浆1 min后,4 层纱布过滤,用0.1 mol/L HCl将滤液的 pH值调到6.0,滤液用冷冻离心机8 000 r/min离心15 min,所得蛋白膏为提纯的肌原纤维蛋白,将蛋白膏贮存在密闭的玻璃瓶中并保持在冰上,在48 h内使用。
蛋白质质量浓度采用双缩脲法测定,以BSA作为标准蛋白。
1.3.2 羟自由基氧化体系
实验采用的羟自由基氧化体系(hydroxyl radicalgenerating system,HRGS)主要由FeCl3、抗坏血酸和H2O2组成,该体系可以产生活性氧自由基(reactive oxygen species,ROS)。本实验主要采用固定体系:使H2O2的浓度为20 mmol/L,抗坏血酸为0.1 mmol/L;FeCl3为0.l mmol/L[3,5]。
1.3.3 多酚对肌原纤维蛋白氧化的影响
将不同的酚类化合物以不同质量分数分别加入到肌原纤维蛋白中混匀(多酚的添加量以蛋白质含量为基准),实验分为7组,第1组为空白对照(不加多酚),第2~6组中分别加入质量分数0.05%、0.10%、0.15%、0.20%、0.25%的多酚。第7组中加入质量分数0.02%的BHA作为阳性对照。将已加入多酚的肌原纤维蛋白溶解在50 mmol/L pH 6.0含有羟自由基氧化体系的磷酸盐缓冲液中,使得蛋白质的质量浓度为40 mg/mL。然后将所有样品在旋涡混合仪上振荡混匀1 min,4℃条件下放置1 h,使样品发生不同程度的氧化。加入1 mmol/L的BHATrolox-EDTA终止反应。氧化产物用冷冻离心机8 000 r/min离心处理10 min,得到的沉淀用于测定下列指标。
1.3.3.1 羰基含量的测定
参照Oliver等[14]所述的方法:将1 mL质量浓度为2 mg/mL的肌原纤维蛋白溶液与1 mL 10 mmol/L的2,4-二硝基苯肼溶液加入离心管中,室温下反应1 h,空白样品中不含2,4-二硝基苯肼。然后加入1 mL 20%的三氯乙酸,用冷冻离心机8 000 r/min离心10 min,将得到的蛋白沉淀用1 mL的乙酸乙酯-乙醇(1∶1,V/V)洗涤3次后,加入3 mL 6 mol/L的盐酸胍溶液,置于37 ℃条件下水浴保温30 min,再将所有样品用冷冻离心机8 000 r/min离心6 min除去不溶物质。以空白为对照,于370 nm波长处测定上清液吸光度。羰基含量(nmol/mg pro)使用摩尔吸光系数(22 000 L/(mol·cm))计算。
1.3.3.2 二聚酪氨酸含量的测定
参照Pacifici等[15]的方法略做修改。精确称取肌原纤维蛋白样品10 mg溶解于10 mL pH 6.0的20 mmol/L磷酸盐缓冲液中(含0.6 mol/L的KCl),过滤除去不溶性物质,采用双缩脲法测定蛋白质量浓度。利用荧光分光光度计测定二聚酪氨酸的含量,激发波长325 nm,发射波长420 nm,狭缝宽度10 nm。利用所测定的吸光度除以蛋白质量浓度得到最终的二聚酪氨酸含量,用相对荧光值表示,单位为AU。
1.3.3.3 蛋白热稳定性的测定
采用DSC分析蛋白质结构稳定性的变化。准确称取肌原纤维蛋白样品(12~15 mg)放入涂有聚合物的铝盘中,封好盖子,取一个空盘作对照,调整好DSC仪器后,将样品放入仪器的样品支持器上。对于热扫描的样品,实验采用的加热速率为10 ℃/min,测定温度范围为30~90 ℃。采用STARe软件进行数据处理和分析得到DSC曲线,焓值的变化可能与蛋白质的变性有关,通过曲线与基线之间的面积确定;峰值点温度为蛋白质的变性温度[16]。每个样品重复3 次,取平均值。
1.3.4 多酚对肌原纤维蛋白凝胶特性的影响
1.3.4.1 氧化酚溶液的制备
将鞣酸、没食子酸用蒸馏水溶解,参考Strauss等[17]的方法,用6 mol/L HCl或NaOH调节多酚溶液至pH 8.0。将制备好的多酚溶液放到40 ℃水浴锅中,通入氧气,持续起泡1 h,使多酚类化合物被氧化成醌,再将溶液的pH值用6 mol/L HCl调至7.0。
1.3.4.2 凝胶的制备
将质量浓度不同的氧化酚溶液分别加入到氧化后的肌原纤维蛋白中,使肌原纤维蛋白的最终质量浓度为30 mg/mL。搅拌均匀后取15 mL放入直径30 mm、高度50 mm的密闭玻璃瓶中,将所有的样品放在80 ℃水浴中加热30 min,形成凝胶后,立即取出,冰浴冷却30 min,将玻璃瓶中多余的水分用滤纸吸干后,盖上盖子,把制备好的凝胶于4 ℃的冰箱中过夜备用。
1.3.4.3 凝胶保水性的测定
参考Xia Xiufang等[18]的方法,精确称取5 g制备好的凝胶样品,置于50 mL离心管底部,用冷冻离心机4 ℃、6 000 r/min离心10 min后,将离心管中多余的水分用滤纸吸干,用电子天平称量离心前后凝胶的质量。每个样品重复3 次取平均值。公式如下:
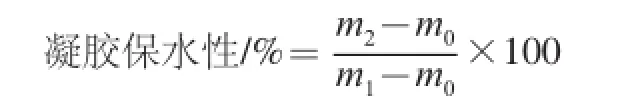
式中:m0是离心管质量/g;m1是离心前离心管和凝胶蛋白质量/g;m2是离心后离心管和凝胶蛋白质量/g。
1.3.4.4 凝胶微观结构的观察
参考P a l k a等[19]的方法,将凝胶样品切成约3 mm×3 mm×5 mm的小条,用体积分数2.5%的戊二醛固定,置于4 ℃冰箱中过夜,再用pH 6.8的0.1 mol/L磷酸缓冲液洗涤3 次,然后分别用体积分数为50%、70%、80%、90%、100%的乙醇梯度脱水;之后用氯仿脱脂1 h;再分别用乙醇-叔丁醇(1∶1,V/V)和叔丁醇各置换1 次;用液氮干燥后,粘样,镀膜后用于扫描电子显微镜微观结构观察。
1.4 数据分析
本实验除电子显微镜实验外,均为3 次独立的重复实验。数据分析使用DPS程序,使用绘图软件Origin 8.5进行处理。
2 结果与分析
2.1 多酚对肌原纤维蛋白中羰基含量的影响
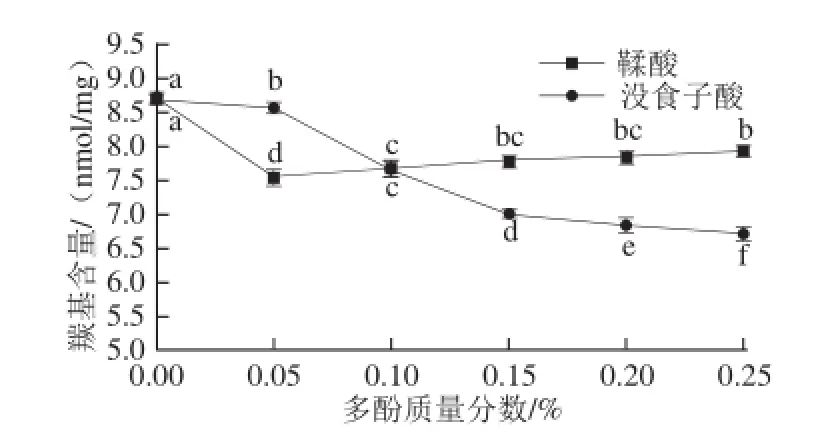
图1 多酚对肌原纤维蛋白羰基含量的影响Fig. 1 Effect of polyphenols at various concentrations on the carbonyl content of MP after oxidation
蛋白质发生羰基化可作为蛋白质氧化的一个重要指标,羰基主要由活性氧所致肽链的断裂及活性氧攻击氨基酸分子的氨基或亚氨基产生[20]。Dean等[21]研究表明,羰基含量越高蛋白质氧化损伤程度越高。由图1可知,与对照组相比,添加多酚降低了样品中的羰基含量(P<0.05)。对照组的羰基含量为8.68 nmol/mg。添加鞣酸质量分数为0.05%时,羰基含量最低为7.39 nmol/mg,与对照组相比差异显著(P<0.05),这是因为鞣酸中羟基含量较高,羟基可被转化为具有交联作用的醌[22]。随着鞣酸质量分数的增加,羰基含量反而逐渐升高,这可能与鞣酸的自我聚集有关,当积累到一定程度时,将破坏与蛋白质的交联能力,抵消鞣酸原有的抗氧化活性。Balange等[23]报道当鞣酸的质量分数为0.05%时,具有较高的蛋白交联能力(P<0.05)。与对照组相比,随着没食子酸质量分数的增加肌原纤维蛋白中羰基含量逐渐降低,当添加量为0.25%时肌原纤维蛋白中羰基含量最低(P<0.05),这是因为没食子酸中羟基含量较少、溶解度较低,与肌原纤维蛋白反应比较困难,但当浓度增加时,羟基含量也会增加,从而提高了与蛋白质相互反应的程度[24]。猪肉肌原纤维蛋白中添加0.02%的BHA(阳性对照)时羰基含量为7.29 nmol/mg,显著低于对照组(P<0.05)且与添加0.05%鞣酸的抗氧化效果相当,但低于添加0.25%没食子酸的抗氧化活性。
2.2 多酚对肌原纤维蛋白中二聚酪氨酸含量的影响

图2 多酚对肌原纤维蛋白二聚酪氨酸含量的影响Fig. 2 Effect of polyphenols at various concentrations on the bityrosine content of MP after oxidation
如图2所示,与对照相比,当鞣酸质量分数为0.05%时,二聚酪氨酸含量最低,随着质量分数的增加,二聚酪氨酸含量又逐渐升高;这可能与鞣酸的自我聚集有关,在油脂中使用时会因溶解性较差而影响其功能的发挥。随着没食子酸添加量的增加,二聚酪氨酸含量逐渐降低,当质量分数为0.25%时二聚酪氨酸含量最低(P<0.05)。对照组二聚酪氨酸含量较高,表明氧化蛋白质的聚集也与其他共价键或非共价键生成有关[25]。Kristensen等[26]研究发现,肌球蛋白氧化后二聚酪氨酸含量增加。Morzel等[27]也证实骨骼肌肌纤维蛋白氧化后二聚酪氨酸的含量增加。添加0.02% BHA(阳性对照组的肌原纤维蛋白二聚酪氨酸含量为61.33 AU,显著低于对照组(P<0.05),且与添加0.05%鞣酸、0.25%没食子酸差异不显著(P>0.05)。这说明猪肉肌原纤维蛋白中添加一定浓度的多酚化合物能抑制二聚酪氨酸含量的增加。
2.3 多酚对肌原纤维蛋白热稳定性的影响
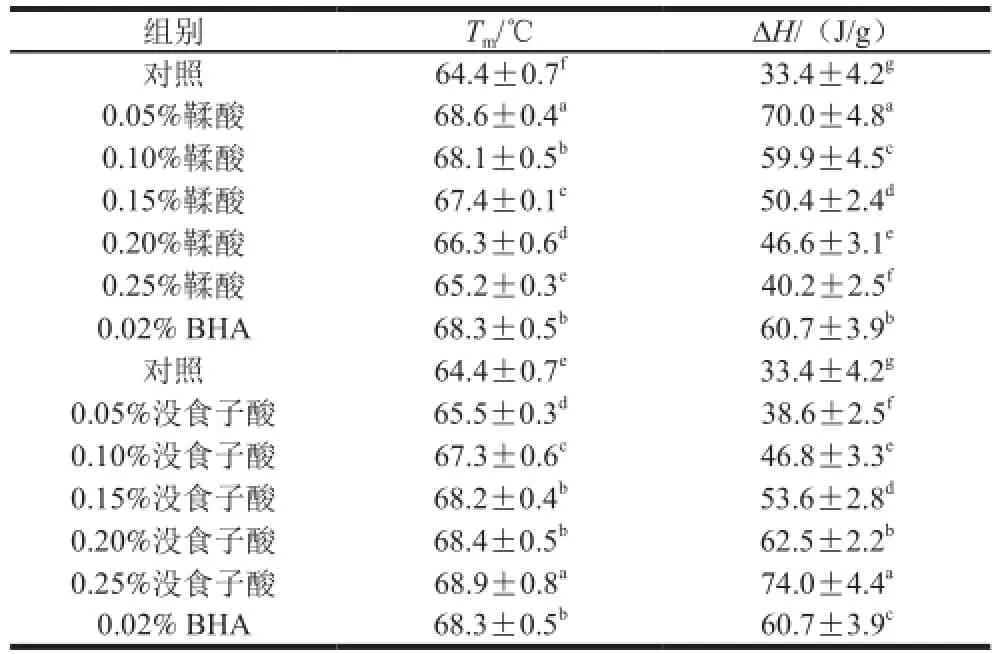
表1 不同多酚添加量对肌原纤维蛋白氧化后最大变性温度(Tm)和焓值(ΔH)的影响Table 1 Effect of polyphenols at various concentrations on the maximum transition temperature (Tm) and ehthalph (ΔH) of MP
如表1所示,添加多酚的处理组样品最大热变性温度和热焓值均高于对照组(P<0.05)。当鞣酸和没食子酸的质量分数为0.05%和0.25%时能最大程度改变蛋白质热变性温度和焓值。研究表明猪肉肌原纤维蛋白变性程度越大,热稳定性越差,焓值降低越多[28]。而添加一定量的多酚后猪肉肌原纤维蛋白变性温度和吸热量都发生了不同程度的提高,说明多酚化合物可与蛋白质以离子键或氢键的形式结合,从而起到抗氧化作用,在整体上提高了蛋白的热稳定性。李艳青等[16]报道向鱼糜肌原纤维蛋白中添加抗氧化剂可以提高蛋白质的热稳定性。
2.4 多酚对肌原纤维蛋白凝胶保水性的影响

图3 多酚对肌原纤维蛋白凝胶保水性的影响Fig. 3 Effect of polyphenols at various concentrations on the WHC of MP gel
如图3所示,与对照相比,随着没食子酸质量分数的增加,样品肌原纤维蛋白凝胶保水性逐渐升高,差异显著(P<0.05)。随着鞣酸质量分数的增加,样品肌原纤维蛋白凝胶保水性先升高后降低,鞣酸的质量分数为0.05%时,样品肌原纤维蛋白凝胶保水性最大,与对照相比差异显著(P<0.05)。这表明添加适量氧化酚类化合物能够增强蛋白质的交联能力,导致形成更强的网络具有更大的持水能力。这可能是由于多酚羟基与蛋白质二硫键、非二硫键之间产生相互作用,形成更稳定的结构[29]。添加0.02% BHA(阳性对照)的肌原纤维蛋白凝胶保水性为95.46%,与添加0.25%没食子酸的效果相当,但低于添加0.05%鞣酸的凝胶保水性(P>0.05)。Balange等[23]报道向鱼肌原纤维蛋白中添加0.05%鞣酸能显著提高鱼糜的凝胶保水性。
2.5 多酚对肌原纤维蛋白凝胶微观结构的影响
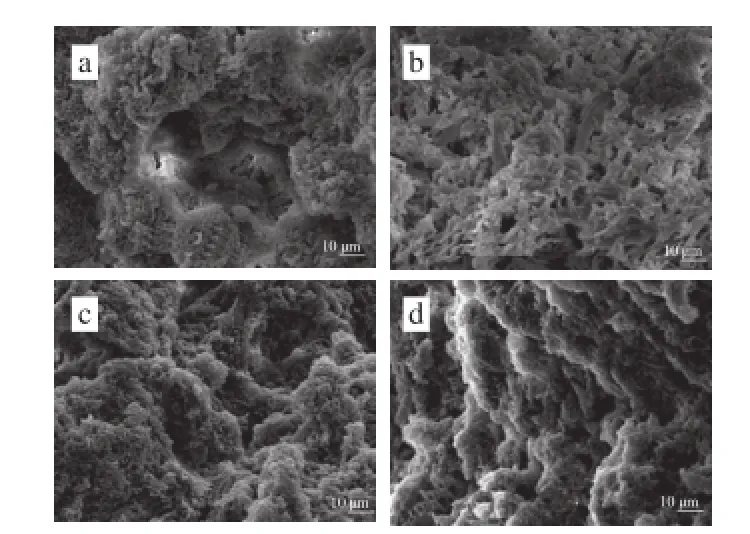
图4 多酚对肌原纤维蛋白凝胶微观结构的影响Fig. 4 Effect of polyphenols on the microstructure of MP gel
图4a中(没有添加氧化酚类化合物)形成的凝胶网状结构粗糙,质地疏松、不紧密,有一些不规则的空洞,还有蛋白质的聚集;而添加氧化酚类化合物和BHA组的肌原纤维蛋白形成的凝胶(图4b~d)结构致密、空隙较小、形状规则且分布均匀。这说明氧化酚类化合物对最终凝胶的微观结构有很大的影响,不同氧化酚类化合物对肌原纤维蛋白凝胶微观结构影响差异显著,其中添加0.05%鞣酸后(图4b)形成的凝胶网状结构更加致密、分布均匀,这可能是因为鞣酸有较多的结合位点与蛋白质发生交联,在基质中形成较大胶束,提高凝胶弹性[30]。三维网状结构的形成使得凝胶中能够容纳的水分更多,这与凝胶的保水性增强一致(图3)。与Balange等[9]向鱼糜中添加氧化酚类化合物使鱼糜凝胶特性增强所得的研究结果相似。
3 结 论
添加一定质量分数的多酚化合物可有效抑制猪肉肌原纤维蛋白氧化,对肌原纤维蛋白凝胶特性具有显著影响。与对照相比,添加0.05%鞣酸和0.25%没食子酸,可显著抑制肌原纤维蛋白羰基和二聚酪氨酸含量的增加;提高肌原纤维蛋白的热稳定性、凝胶保水性,效果与0.02% BHA相当。对肌原纤维蛋白凝胶微观结构研究表明,添加多酚可减少蛋白质聚合,使凝胶微观结构更加致密、光滑、分布均匀。可见,多酚对羟自由基引起的肌原纤维蛋白氧化起到了一定的抑制作用。因此,可通过向肉及肉制品中添加多酚化合物防止蛋白质氧化,同时提高蛋白质的功能特性。
[1] 黄莉, 孔保华, 李菁, 等. 氧化引起肉及肉制品品质劣变的机理及影响因素[J]. 食品科学, 2011, 32(9): 319-320.
[2] LIU G, XIONG Youling L., BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey-and soyprotein isolates[J]. Journal of Food Science, 2000, 65(5): 811-818. DOI:10.1111/j.1365-2621.2000.tb13592.x.
[3] PARK D, XIONG Youling L.. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J]. Food Chemistry, 2007, 103(2): 607-616. DOI:10.1016/ j.foodchem.2006.09.004.
[4] SRINIVASAN S, HULTIN H O. Chemical, physical, and functional properties of cod proteins modified by a nonenzymic free-radicalgenerating system[J]. Journal of Agricultural and Food Chemistry, 1997, 45(2): 310-320. DOI:10.1021/jf960367g.
[5] 李银, 李侠, 张春辉, 等. 羟自由基导致肉类肌原纤维蛋白氧化和凝胶性降低[J]. 农业工程学报, 2013, 29(12): 286-292. DOI:10.3969/ j.issn.1002-6819.2013.12.036.
[6] 王钰, 王锡昌, 刘源. 植物多酚在肉制品加工中的应用[J]. 肉类研究, 2013, 27(2): 37-40.
[7] RAWEL H M, ROHN S, KRUSE H P, et al. Structural changes induced in bovine serum albumin by covalent attachment of chlorogenic acid[J]. Food Chemistry, 2002, 78(4): 443-455. DOI:10.1016/S0308-8146(02)00155-3.
[8] 陈洪生, 孔保华, 刁静静, 等. 氧化引起的肌肉蛋白质功能性变化及其控制技术的研究进展[J]. 食品科学, 2015, 36(11): 215-219. DOI:10.7506/spkx1002-6630-201511041.
[9] BALANGE A K, BENJAKUL S. Effect of oxidised phenolic compounds on the gel property of mackerel (Rastrelliger kanagurta) surimi[J]. LWT-Food Science and Technology, 2009, 42(6): 1059-1064. DOI:10.1016/j.lwt.2009.01.013.
[10] MURCIA M A, MARTÍNEZ-TOMÉ M. Antioxidant activity of resveratrol compared with common food additives[J]. Journal of Food Protection, 2001, 64(3): 379-384.
[11] ESTÉVEZ M, HEINONEN M. Effect of phenolic compounds on the formation of α-aminoadipic and γ-glutamic semialdehydes from myofibrillar proteins oxidized by copper, iron, and myoglobin[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4448-4455. DOI:10.1021/jf903757h.
[12] MAQSOOD S, BENJAKUL S. Preventive effect of tannic acid in combination with modified atmospheric packaging on the quality losses of the refrigerated ground beef[J]. Food Control, 2010, 21(9): 1282-1290. DOI:10.1016/j.foodcont.2010.02.018.
[13] WU Mangang, XIONG Youling L., CHEN Jie. Rheology and microstructure of myofibrillar protein-plant lipid composite gels: effect of emulsion droplet size and membrane type[J]. Journal of Food Engineering, 2011, 106(4): 318-324. DOI:10.1016/ j.jfoodeng.2011.05.022.
[14] OLIVER C N, AHN B W, MOERMAN E J, et al. Age-related changes in oxidized proteins[J]. The Journal of Biological Chemistry, 1987, 262(12): 5488-5491.
[15] PACIFICI R E. Protein damage and degradation by oxygen radicals[D]. Los Angeles: University of Southern California, 1991: 9895-9901.
[16] 李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D]. 哈尔滨: 东北农业大学, 2013: 24. DOI:10.7666/d.Y2295487.
[17] STRAUSS G, GIBSON S M. Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J]. Food Hydrocolloids, 2004, 18(1): 81-89. DOI:10.1016/ S0268-005X(03)00045-6.
[18] XIA Xiufang, KONG Baohua, XIONG Youling L., et al. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science, 2010, 85(3): 481-486. DOI:10.1016/j.meatsci.2010.02.019.
[19] PALKA K, DAUN H. Changes in texture, cooking losses, and myofibrillar structure of boving M. semitendinosus during heating[J]. Meat Science, 1999, 51(3): 237-243. DOI:10.1016/S0309-1740(98)00119-3.
[20] STADTMAN E R. Protein oxidation and aging[J]. Science, 1992, 257: 1220-1224. DOI:10.1126/science.1355616.
[21] DEAN R T, FU S L, STOCKER R, et al. Biochemistry and pathology of radical-mediated protein oxidation[J]. Biochemical Journal, 1997, 324: 1-18. DOI:10.1042/bj3240001.
[22] ZHANG Xiaoqing, DO M D, CASEY P, et al. Chemical cross-linking gelatin with natural phenolic compounds as studied by high-resolution NMR spectroscopy[J]. Biomacromolecules, 2010, 11: 1125-1132. DOI:10.1021/bm1001284.
[23] BALANGE A, BENJAKUL S. Enhancement of gel strength of bigeye snapper (Priacanthus tayenus) surimi using oxidised phenolic compounds[J]. Food Chemistry, 2009, 113(1): 61-70. DOI:10.1016/ j.foodchem.2008.07.039.
[24] de FREITAS V, MATEUS N. Structural features of procyanidin interactions with salivary proteins[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 940-945. DOI:10.1021/jf000981z.
[25] SRINIVASAN S, XIONG Youling L., BLANCHARD S P. Effects of freezing and thawing methods and storage time on thermal properties of freshwater prawns (Macrobrachium rosenbergii)[J]. Journal of the Science of Food and Agriculture, 1997, 75: 37-44. DOI:10.1002/ (SICI)1097-0010(199709)75:1<37::AID-JSFA838>3.0.CO;2-L.
[26] KRISTENSEN L, MØLLER A J, ANDERSEN H J. Degradation myosin by cathepsin B. comparison of native and oxidatively modified protein[C]//Proceedings of 43rd International Congress of Meat Science and Technology, 1997: 412-413.
[27] MORZEL M, GATELLIER P, SAYD T, et a1. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar protein[J]. Meat Science, 2006, 73: 536-543. DOI:10.1016/ j.meatsci.2006.02.005.
[28] PARK D, XIONG Youling L., ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2006, 101: 1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
[29] RATTAYA S, BENJAKUL S, PRODPRAN T. Properties of fish skin gelatin film incorporated with seaweed extract[J]. Journal of Food Engineering, 2009, 95(1): 151-157. DOI:10.1016/ j.jfoodeng.2009.04.022.
[30] 吕宏宇, 许晓曦. 氧化酚类化合物对鲤鱼鱼糜凝胶特性影响的研究[J]. 食品工业科技, 2011, 32(5): 149-150. DOI:10.13386/ j.issn1002-0306.2011.05.107.
Effect of Polyphenols on the Oxidation and Gel Properties of Pork Myofibrillar Protein
ZHANG Huiyun, WU Jingjuan, GUO Xinyu
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China)
The objective of this study was to investigate the effects of different concentrations of polyphenol compounds including tannic acid (TA) and gallic acid (GA) on the oxidation and gel properties of pork myofibrillar protein (MP) in hydroxyl radical oxidation system. Results indicated that treatments with 0.05% TA and 0.25% GA could significantly inhibit the increase of carbonyl and bityrosine content (P < 0.05), increase the maximum transition temperature (Tm) and waterholding capacity (WHC) of MP, and their effect was equivalent to that of the 0.02% BHA treatment group. Scanning electron microscopy results revealed that different phenolic compounds had different influence on MP gel microstructure. MP gel structure became more compact after adding 0.05% TA. In conclusion, polyphenols can inhibit MP oxidation and improve thermal stability, WHC and gel strength of MP.
polyphenol; myofibrillar proteins; protein oxidation; structure; gelation
10.7506/spkx1002-6630-201621008
TS251.51
A
1002-6630(2016)21-0043-05
张慧芸, 吴静娟, 郭新宇. 多酚对猪肉肌原纤维蛋白氧化和凝胶特性的影响[J]. 食品科学, 2016, 37(21): 43-47.
DOI:10.7506/spkx1002-6630-201621008. http://www.spkx.net.cn
ZHANG Huiyun, WU Jingjuan, GUO Xinyu. Effect of polyphenols on the oxidation and gel properties of pork myofibrillar protein[J]. Food Science, 2016, 37(21): 43-47. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621008. http://www.spkx.net.cn
2016-01-03
国家自然科学基金-河南人才培养联合基金项目(C2003)
张慧芸(1977—),女,副教授,博士,主要从事天然产物活性研究。E-mail:zhanghuiyun21@163.com

