影响酪蛋白糖基化的因素分析
刘贵梅,夏秋琴,李 普,吕丽爽
(南京师范大学金陵女子学院,江苏 南京 210097)
影响酪蛋白糖基化的因素分析
刘贵梅,夏秋琴,李 普,吕丽爽*
(南京师范大学金陵女子学院,江苏 南京 210097)
目的:通过建立酪蛋白-乳糖、酪蛋白-丙酮醛、酪蛋白-乙二醛3 种模拟体系,考察影响该体系晚期糖基化终末产物(advanced glycation end products,AGEs)形成的因素。方法:荧光光谱法(λex/λem=370 nm/440 nm)检测还原糖种类、温度、pH值、金属离子、时间和染料木黄酮对AGEs形成的影响;并分析各个影响因素的作用效果。结果:还原糖为核糖、pH 7.4、加工温度121 ℃和贮藏温度37 ℃条件下荧光性AGEs的产生量最多,金属离子Fe2+和Ca2+、9 mmol/L抑制剂染料木黄酮对荧光性AGEs的形成有抑制作用。结论:还原糖种类、pH值、温度、金属离子和抑制剂染料木黄酮均对3 种模拟体系中荧光性AGEs的形成有影响,其中,还原糖是影响酪蛋白糖基化生成荧光性AGEs最重要的影响因素,其次为时间、温度。
酪蛋白;荧光光谱;荧光性晚期糖基化终末产物;染料木黄酮
非酶糖基化反应,也被称为非酶褐变和美拉德应,是发生于还原糖和蛋白质的氨基酸基团之间的一类复杂的反应,它对于食品中风味物质、色泽的形成具有重要作用[1]。还原糖和蛋白质发生的连续性非酶糖基化反应会产生中间产物——活性二羰基化合物,包括丙酮醛(methylglyoxal,MGO)和乙二醛(glyoxal,GO)等,它们是形成晚期糖基化终末产物(advanced glycation end products,AGEs)的前体物质,具有高反应活性,比葡萄糖的活性高200~50 000 倍[2]。蛋白质糖基化反应会形成分子内或者分子间交联,最终产生不同结构的AGEs[3]。
AGEs是一类复杂的化合物,有其独特的理化、生化特性,如部分AGEs呈棕色,部分AGEs具有荧光性等;且AGEs结构稳定,对酶稳定不易被降解。目前发现的AGEs的结构类型有:吡咯醛、苯妥西定、羧甲基丝氨酸、咪唑酮以及一些交联产物,包括褐色的荧光性交联成分(如戊糖素)、无荧光性的交联产物(如丙酮醛-赖氨酸二聚物、乙二醛-赖氨酸二聚物和无荧光性非交联产物(如羧甲基赖氨酸和吡咯素[4-5]。组织病理学研究表明,AGEs不仅在糖尿病及其并发症,如肾病、糖尿病视网膜病变、阿尔茨海默症、动脉粥样硬化等疾病发展过程中起着重要的作用,还会在一定程度上加快衰老的进程[6-8]。酪蛋白(casein,CN)作为牛乳中一种主要蛋白,占牛乳蛋白的80%左右;赖氨酸和精氨酸是CN中含量比较丰富的氨基酸,其总量分别占αS1-CN氨基酸总数的10.05%;占αS2-CN 13.53%;占β-CN 7.18%;占κ-CN 7.70%[9]。同时牛乳中主要的糖类为乳糖,大约占固体成分的37%[10]。CN和乳糖的存在和相互作用是牛乳制品发生糖基化现象的主要原因[11]。目前牛乳杀菌的处理手段主要有巴氏杀菌、超高温瞬时杀菌和“延长保存期奶”等。以上因素加快了牛乳发生糖基化反应的进程,从而使其成为潜在的危害人体健康的因素[12]。在热加工过程中,牛乳中的乳糖会与赖氨酸残基结合,从而导致赖氨酸利用率减少;而赖氨酸作为一种必需氨基酸,其利用率的减少必将导致食品品质的下降[13]。很多研究表明[14-16]乳制品中的蛋白糖基化反应导致的营养物质(如赖氨酸)的缺失归因于蛋白质分子中氨基酸的破坏和生物失活、蛋白质水解酶、糖酵解的抑制、以及与金属离子的交互作用等。其中,乳糖降解产生的半乳糖和葡萄糖也会与赖氨酸反应生成一系列AGEs产物;此外,牛乳中糖基化中间产物MGO和GO的产生大大加速了其糖基化反应的强度进而生成AGEs。有文献报道,酸奶中被检测出0.02~1.3 mg/kg的MGO和GO[17],奶酪中被检测出0~0.007 mg/mL的MGO和0.002~0.227 mg/mL的GO[18]。Fenaille等[19]研究了婴儿奶粉的产品加工过程,从中检测到MGO和GO以及交联蛋白二酪氨酸和赖丙氨酸。有文献分析德国41 种婴儿奶粉在相似的加工条件下,赖氨酸损失了约6 倍,乳果糖基赖氨酸含量增加了2~3 倍,而AGEs的含量也提高了3~5 倍[20]。Hull等[21]调查了247 种食品,发现牛乳中每1 000 g蛋白质中就含有6.04~16.00 mg AGEs。方便食品行业的高速发展、食品精加工程度的大大提高以及食品贮藏期的延长都在一定程度上导致了消费者对外源性AGEs摄入量的增加。因此,牛乳及其乳制品中的蛋白糖基化已成为食品安全中的隐患。
本研究以异黄酮染料木黄酮为抑制剂,分别建立了CN-乳糖、CN-MGO、CN-GO 3 个CN糖基化模型,运用荧光分光光度法考察还原糖种类、温度、pH值、金属离子、时间和染料木黄酮等对CN糖基化的影响。
1 材料与方法
1.1 材料与试剂
干酪素、葡萄糖、果糖、核糖、半乳糖、乳糖、磷酸二氢钠、磷酸氢二钠(分析纯) 上海国药集团化学试剂有限公司;二甲基亚砜 广东省化学试剂工程技术研究开发中心;染料木黄酮(98%,色谱级) 南京广润生物试剂有限公司。
1.2 仪器与设备
XW-80A微型漩涡混合仪 上海沪西分析仪器厂有限公司;HH-6数显恒温水浴锅、HH-S数显恒温油浴锅金坛市富华仪器有限公司;FA2104N电子分析天平上海精密科学仪器有限公司;PHS-3C数字式pH计 上海三信仪表厂;KQ-300B超声波清洗器 昆山市超声仪器有限公司;Infinite 200Pro TECAN多孔酶标仪 瑞士帝肯贸易有限公司。
1.3 方法
1.3.1 还原糖或二羰基化合物(MGO/GO)对CN糖基化产生荧光性AGEs的影响
依据文献[22]的测定方法加以改进。用浓度为0.2 mmol/L、pH 6.8的磷酸盐缓冲液分别溶解CN、还原糖、MGO和GO,配制一定质量浓度的储备液。在10 mL样品管中加入CN溶液2 mL,分别加入葡萄糖、果糖、核糖、乳糖、半乳糖、MGO、GO溶液各2 mL,再加入磷酸盐缓冲液至6 mL,使CN、还原糖、MGO和GO的最终质量浓度分别为1.000、3.000、0.108 mg/mL和0.087 mg/mL,其中CN溶液为空白组。将反应物于100 ℃水浴加热,在0、5、15、25、40、60、90 min分别取样800 μL于2 mL样品管,-80 ℃冷冻保存。解冻后以14 000 r/min的转速离心10 min,取0.3 mL上清液测λex/λem=370 nm/440 nm波长处荧光值(AGEs荧光值的大小在一定程度上可以反映糖基化产物AGEs含量的多少)。所有实验均做3 组平行,结果取平均值。
1.3.2 pH值对CN糖基化产生荧光性AGEs的影响
依据文献[22]的测定方法加以改进。用浓度为0.2 mmol/L、pH 6.0 (或pH 6.8、7.0、7.4)的磷酸盐缓冲液分别溶解CN、乳糖、MGO和GO,配制一定质量浓度的储备液。在10 mL样品管中加入CN 2 mL,分别加入乳糖、MGO和GO溶液各2 mL,再加入磷酸盐缓冲液至6 mL,使CN、乳糖、MGO和GO的最终质量浓度分别为1.000、3.000、0.108 mg/mL和0.087mg/mL。将反应物于100 ℃水浴加热,在0、5、15、25、40、60、90 min分别取样800 μL于2 mL样品管,-80 ℃冷冻保存。其他实验步骤同1.3.1节。
1.3.3 温度对CN糖基化产生荧光性AGEs的影响
1.3.3.1 加工温度对CN糖基化产生荧光性AGEs的影响
依据文献[22]的测定方法加以改进。用浓度为0.2 mmol/L、pH 6.8的磷酸盐缓冲液分别溶解CN、乳糖、MGO和GO,配制一定质量浓度的储备液。在10 mL样品管中加入CN 2 mL,分别加入乳糖、MGO和GO溶液各2 mL,再加入磷酸盐缓冲液至6 mL,使CN、乳糖、MGO和GO的最终质量浓度分别为1.000、3.000、0.108 mg/mL和0.087 mg/mL。将反应物于65、75、85、95、100、121 ℃分别加热,在0、5、15、25、40、60、90 min分别取样800 μL于2 mL样品管,-80 ℃冷冻保存。其他实验步骤同1.3.1节。
1.3.3.2 贮藏温度对CN糖基化产生荧光性AGEs的影响
依据文献[22]的测定方法加以改进。用浓度为0.2 mmol/L、pH 6.8的磷酸盐缓冲液分别溶解CN、乳糖、MGO和GO,配制一定质量浓度的储备液。在20 mL样品管中加入CN 4 mL,分别加入乳糖、MGO和GO溶液各4 mL,再加入磷酸盐缓冲液至12 mL,使CN、乳糖、MGO和GO的最终质量浓度分别为1.000、3.000、0.108 mg/mL和0.087 mg/mL。将反应物于37 ℃或25 ℃培养箱反应,在0、1、2、4、8、12、24、48、72、120、168、336、504、720 h(30 d)分别取样800 μL于2 mL样品管,-80 ℃冷冻保存。其他实验步骤同1.3.1节。
1.3.4 不同金属离子对CN糖基化产生荧光性AGEs的影响
依据文献[22]的测定方法加以改进。用浓度为0.05 mmol/L、pH 6.8的磷酸盐缓冲液分别溶解金属氯化物FeCl2、MgCl2、ZnCl2和CaCl2,使其最终浓度为0.2 mmol/L,并以此溶解CN、乳糖、MGO和GO,配制一定质量浓度的储备液。在10 mL样品管中加入CN 2 mL,分别加入乳糖、MGO和GO溶液各2 mL,再加入磷酸盐缓冲液至6 mL,使CN、乳糖、MGO和GO的最终质量浓度分别为1.000、3.000、0.108 mg/mL和0.087 mg/mL。将反应物于100 ℃加热90 min分别取样800 μL于2 mL样品管,-80 ℃冷冻保存。其他实验步骤同1.3.1节。
1.3.5 高温加工条件下染料木黄酮抑制CN糖基化产生荧光性AGEs的作用
依据文献[22]的测定方法加以改进。用浓度为0.2 mmol/L、pH 6.8的磷酸盐缓冲液溶解CN、乳糖、MGO和GO。在10 mL样品管中加入最终质量浓度为1 mg/mL的CN溶液2 mL,最终质量浓度分别为3 mg/mL的乳糖、0.108 mg/mL的MGO和0.087 mg/mL的GO溶液各2 mL,再加入用DMSO溶解的染料木黄酮2 mL,使染料木黄酮的最终浓度分别为1.5、3.0、6.0、9.0 mmol/L。100 ℃水浴加热,在0、5、15、25、40、60、90 min分别取样800 μL于2 mL样品管,-80 ℃冷冻保存。其他实验步骤同1.3.1节。
1.3.6 低温贮藏条件下染料木黄酮抑制CN糖基化产生荧光性AGEs的作用
依据文献[22]的测定方法。用浓度为0.2 mmol/L, pH 6.8的磷酸盐缓冲液溶解CN、乳糖、MGO和GO。在20 mL样品管中加入最终质量浓度为1 mg/mL的CN溶液4 mL,分别加入最终质量浓度为3 mg/mL的乳糖、0.108 mg/mL的MGO和0.087 mg/mL的GO溶液各4 mL,再加入用DMSO溶解的染料木黄酮4 mL,使其浓度分别为1.5、3.0、6.0、9.0 mmol/L。25 ℃或37 ℃培养箱加热,在0、1、2、4、8、12、24、48、72、120、168、336、504、720 h(30 d)分别取样800 μL 于2 mL样品管,-80 ℃冷冻保存。其他实验步骤与同1.3.1节。荧光性AGEs抑制率按下式进行计算。
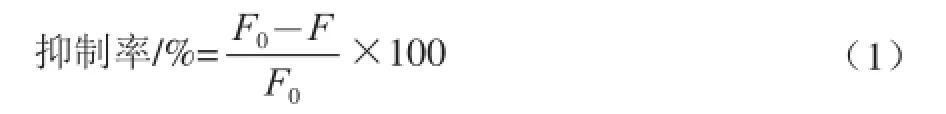
式中:F0为初始荧光值;F为实验荧光值。
1.4 数据统计分析
Excel 2013软件用于分析实验所测得的荧光性AGEs;采用Minitab16软件分析可得在各个条件下影响CN糖基化的因素(还原糖、时间、金属离子、温度、染料木黄酮、pH值)所占比例,其中每组实验数据均做3 组平行,测定结果以表示。采用Duncan’s多重比较法进行显著性检验。
2 结果与分析
2.1 还原糖或二羰基化合物(MGO和GO)对CN糖基化的影响

图1 还原糖或MGO/GO对CN糖基化的影响Fig. 1 Effect of different reducing sugars and MGO/GO on casein glycation
由图1可知,不同的底物对CN糖基化的影响结果差距非常大(P<0.05)。空白组产生的荧光性AGEs最低,MGO与CN反应产生的荧光性AGEs远远高出其他反应底物,反应最为强烈;其次为GO,与核糖接近。其他还原糖的反应活性依次为乳糖、果糖、半乳糖、葡萄糖。有文献报道,核糖与CN的反应速率大于其他葡萄糖和果糖,即五碳糖比六碳糖更能引起CN的糖基化[23],这与本实验结果一致。其中乳糖为二糖,其活性高于单糖,其作用机理有待进一步探讨。
2.2 pH值对CN糖基化的影响
pH 7.4为生理条件的pH值,产生荧光性AGEs量较高;pH 6.0为酸奶的pH值,产生的荧光性AGEs量较低。pH 6.8为一般牛乳的pH值,产生荧光性AGEs的pH值介于6.0~7.4之间。文献报道在偏酸性环境中,N-葡萄糖胺容易被水解,因此不利于反应的进行;而碱性条件pH 9.2的荧光性AGEs则随着时间的延长不断增强[24]。由图2可知,比较3 个反应体系CN-乳糖、CN-MGO和CN-GO,CN-乳糖和CN-GO模型的反应活性接近;乳糖诱导CN产生荧光性AGEs随时间变化较为缓慢;而GO则快速诱导CN产生荧光性AGEs,而后稳定在一定的值;MGO反应活性最高,更为强烈迅速地诱导CN反应,由此产生的荧光性AGEs量几乎为前两者的3 倍。
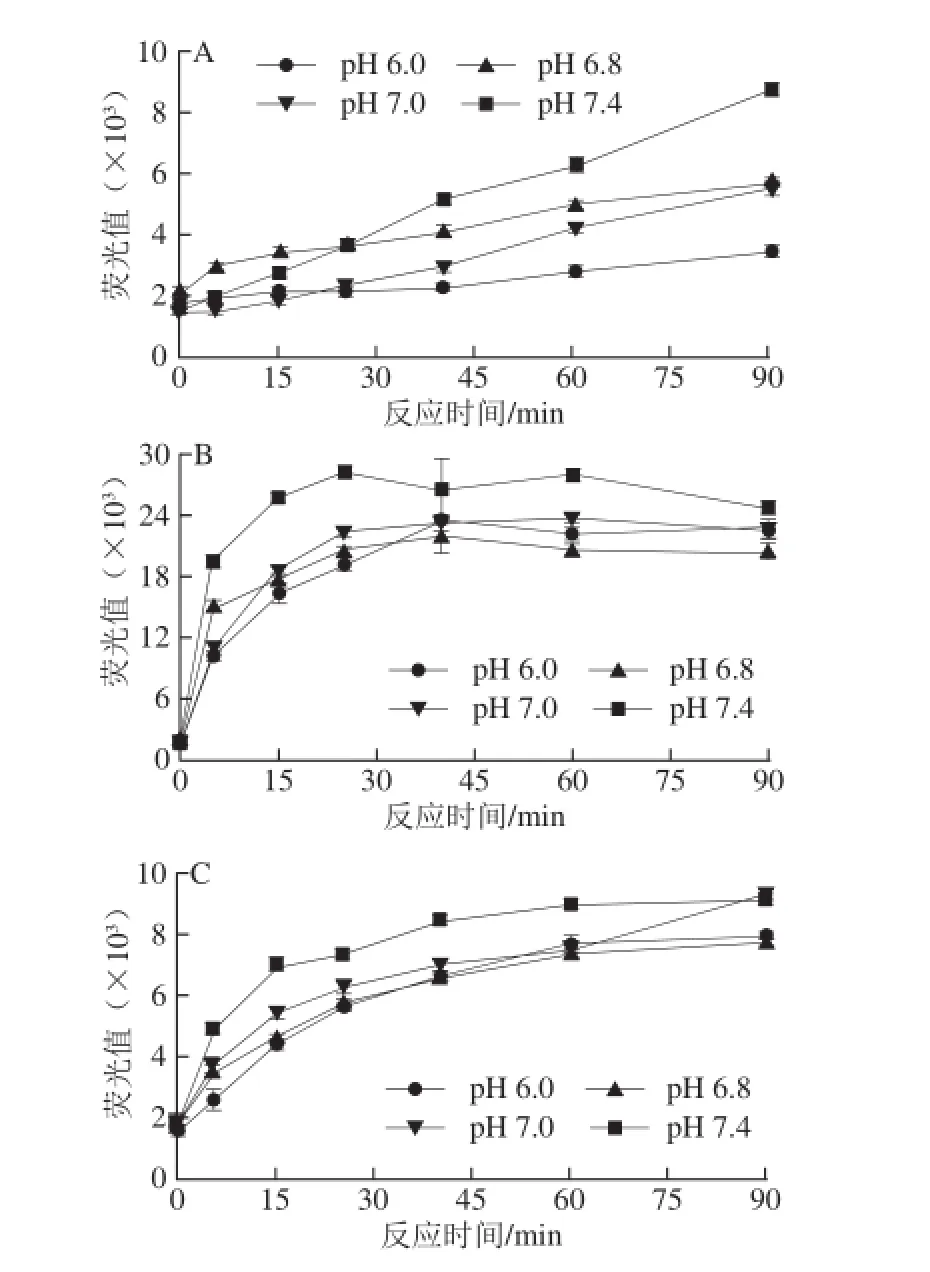
图2 pH值对CN糖基化的影响Fig. 2 Effect of pH on casein glycation
2.3 温度对CN糖基化的影响结果
2.3.1 加工温度对CN糖基化的影响
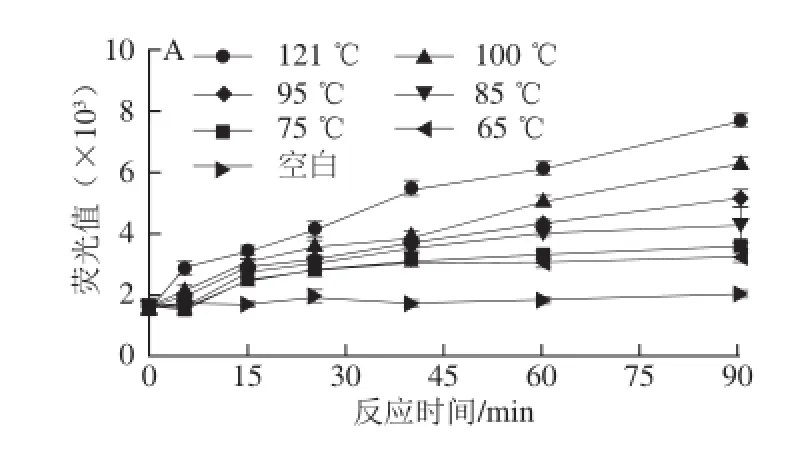
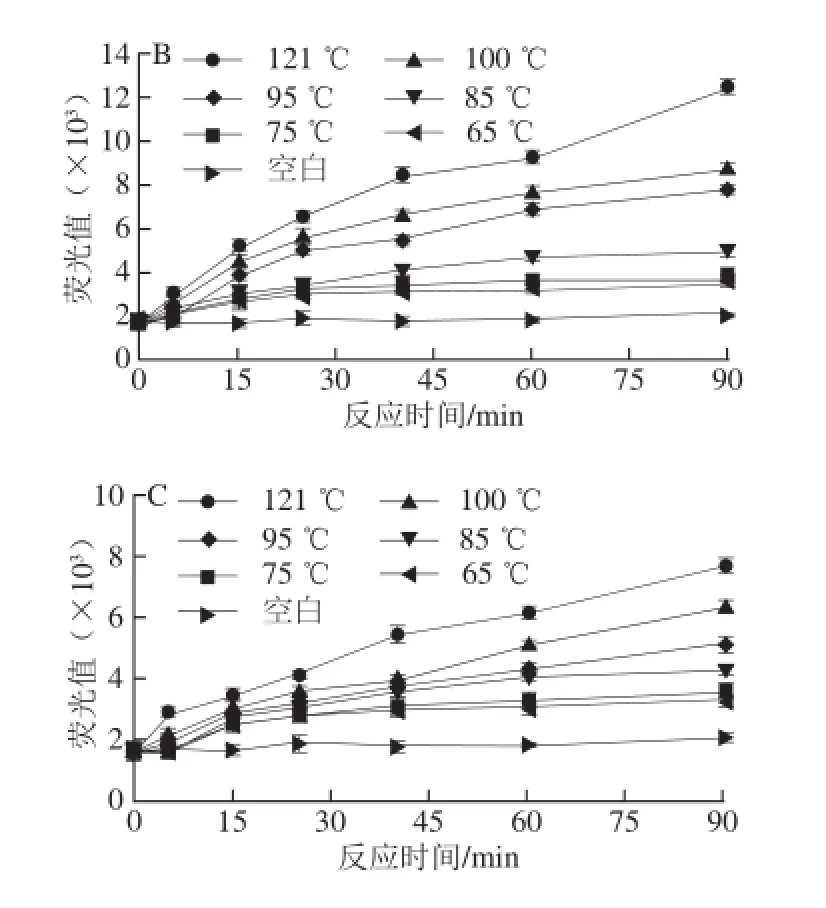
图3 加工温度对CN糖基化的影响Fig. 3 Effect of processing temperature on casein glycation
如图3所示,3 个模型中,空白组的荧光性AGEs随着时间的延长没有明显的变化,而随着温度(65~121 ℃)的升高,体系中产生的荧光性AGEs均逐步提高。其中温度对MGO引发的CN糖基化的影响最大,产生的荧光性AGEs最多,约为其他2 个模型产生最高量的3 倍;其次为CN-GO模型;3 个模型中,CN-乳糖模型产生的荧光性AGEs的含量相对较低。其中乳糖糖基化体系温度对AGEs产生量的影响可以分割为3 个区,65~75、85~100、121 ℃。
2.3.2 贮藏温度对CN糖基化的影响
低温贮藏(25、37 ℃)30 d对CN糖基化的影响结果如图4所示,在贮藏温度范围内,空白组的AGEs含量随着时间的延长呈现逐渐上升的趋势,但是增加的趋势不明显;随着温度的升高,CN糖基化趋势依次加强。而在3 个CN模型中,尽管MGO/GO的作用强度显著高于乳糖模型,但低温范围内MGO和GO引发CN低温糖基化的活性较高温条件下大幅减弱。这与Bosch等[25]分析了牛乳-谷物中婴儿食品,在贮藏温度分别为25、37 ℃条件下贮藏9 个月,发现AGEs的含量随着温度的升高而上升的结果一致。
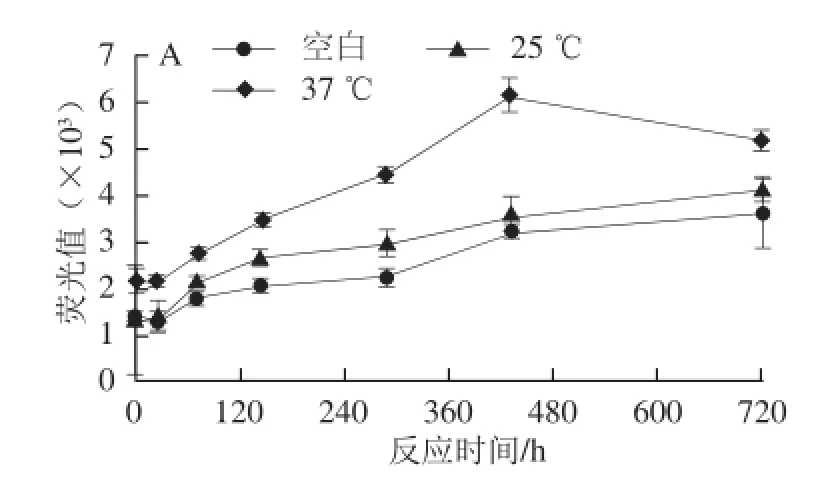
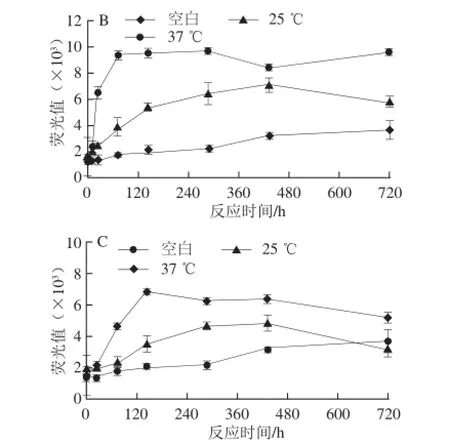
图4 贮藏温度对CN糖基化的影响Fig. 4 Effect of storage temperature on casein glycation
2.4 金属离子对CN糖基化的影响
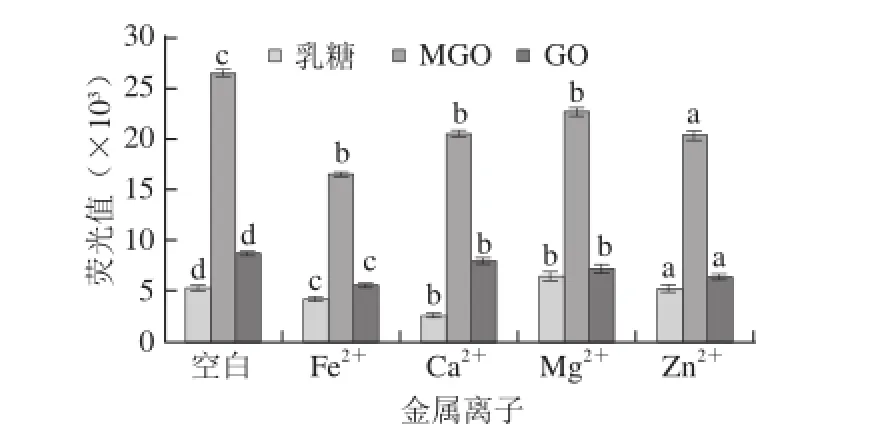
图5 金属离子对CN糖基化的影响Fig. 5 Effect of metal ions on casein glycation
如图5所示,不同金属离子对CN糖基化影响有显著差异(P<0.05),但金属离子对3 个CN糖基化模型均显示抑制性作用,这与氨基酸模型存在差异。在空白对照组中,CN-MGO组产生的荧光性AGEs的含量最高,其次是CN-GO组,产生最少的是CN-乳糖;在CN-MGO模型,特别是Fe2+,抑制效果最为明显;在CN-乳糖模型中,Ca2+抑制作用最强;在CN-GO模型中,也是Fe2+的抑制作用最明显。Ramonaitytė等[26]研究Maillard反应中Cu2+、Zn2+和Fe2+对乳糖-甘氨酸模拟的影响,发现Fe2+(20~100 mg/L)可以促进Maillard反应中颜色物质的生成,而Cu2+(1 mg/L)和Zn2+(5 mg/L)只有在质量浓度较低的情况下有作用,在较高质量浓度下则会抑制颜色物质的生成。
2.5 高温加工条件下染料木黄酮对产生荧光性AGEs的影响
由图6可知,在3 个CN模拟体系中,在100 ℃,染料木黄酮浓度与其抑制效果呈现量效关系。3 个模型中的空白组荧光性AGEs含量随着时间的延长呈现逐渐增长的趋势,在90 min达到最大值。随着染料木黄酮添浓度的增加,对荧光性AGEs产生的抑制作用也随之增强。以反应最强烈的CN-MGO体系为例,在反应达到90 min时,染料木黄酮浓度为1.5、3.0、6.0、9.0 mmol/L时,荧光性AGEs抑制率分别为64.5%、72.6%、81.6%和89.4%。由此可见,染料木黄酮可以有效抑制CN糖基化。Jung等[27]通过荧光检测的方法寻找AGEs受体的阻断剂,在检测了50 个样品之后,发现染料木黄酮可以阻止晚期糖基化终产物-晚期糖基化终产物受体的交联,并且随着染料木黄酮剂量的增加,其阻断程度也呈线性增加。

图6 高温加工条件下染料木黄酮对CN糖基化的抑制作用Fig. 6 Inhibitory effect of genistein on the production of fluorescent AGEs from casein glycation
2.6 低温贮藏条件下,染料木黄酮抑制CN糖基化产生荧光性AGEs的结果
染料木黄酮抑制CN在贮藏温度25 ℃条件下出现的糖基化的结果如图7所示,图中发现3个模型中的空白组在贮藏过程中荧光性AGEs的含量随着贮藏时间的延长呈现逐渐增长的趋势,其中CN-MGO和CN-GO模型中,荧光性AGEs的含量在贮藏时间为432 h时达到最大值,在432~720 h时间内略有轻微下降的趋势,染料木黄酮在贮藏条件下亦能有效抑制CN糖基化。以CN-乳糖体系为例,在反应时长为720 h时,染料木黄酮的浓度分别为1.5、3.0、6.0、9.0 mmol/L时,木黄酮抑制CN-乳糖模型体系产生荧光性AGEs的抑制率分别为(36.8±0.23)%、(42.6±0.45)%、(54.5±0.15)%和(63.8±0.2)%。由此可见,染料木黄酮可以在食品贮藏过程中有效抑制CN糖基化。
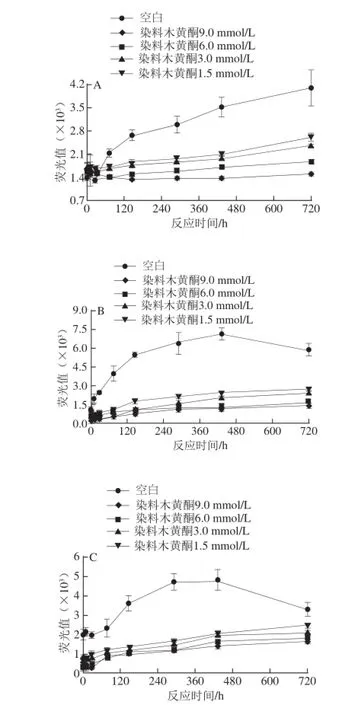
图7 低温贮藏条件下染料木黄酮抑制CN糖基化的结果Fig. 7 Inhibitory effect of genistein on the production of fluorescent AGEs from casein glycation
2.7 影响CN糖基化产生荧光性AGEs的因素及其交互作用分析
如表1所示,还原糖种类(包括MGO和GO)是影响CN糖基化生成荧光性AGEs最重要的影响因素,其次为时间、温度等,此外交互作用中葡萄糖×时间和温度×时间、温度、pH值、抑制剂染料木黄酮和金属离子对CN体系糖基化的作用不显著。
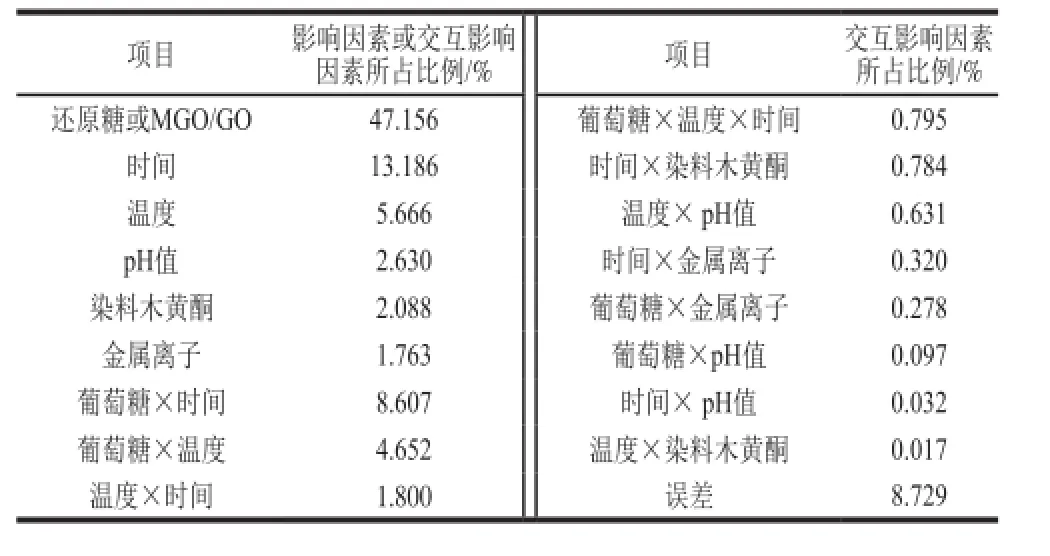
表1 影响CN糖基化产生荧光性AGEs的因素及其交互作用分析Table 1 Contributions of individual factors and interactions on the production of AGEs
还原糖种类对CN糖基化的作用效果最明显,原因是不同的还原糖对CN糖基化产生荧光性AGEs的效果不尽相同,特别是活性二羰基化合物MGO和GO,它们诱导CN糖基化的作用效果很强。反应时间是影响CN糖基化产生荧光性AGEs的第二主要因素,糖基化反应尤其是CN-乳糖模型体系,随着反应时间的延长而呈持续增强的效应。其次,温度对CN的糖基化作用效果亦不可忽视,温度越高,产生的荧光性AGEs也越多。此外,抑制剂染料木黄酮对CN糖基化具有显著的抑制功效,尽管在整个糖基化反应过程中,它并不是决定性因素,但依旧可以通过调整加工条件、外加抑制剂共同降低AGEs的含量。
3 结 论
在CN-乳糖、CN-MGO和CN-GO 3个模拟体系中,还原糖种类、温度、pH值、金属离子对荧光性AGEs的产生有重要的作用,其中,当反应温度(121 ℃)一定时,反应时间(0、15、30、45、60、75、90 min)越长,产生的荧光性AGEs的强度就越高,pH值接近7.4时产生的荧光性AGEs较多;在3 种不同的体系条件下,荧光性AGEs的产量不同。在加工和贮藏两种不同的条件下,3 种体系中产生的荧光性AGEs的量也不尽相同,此外,抑制剂染料木黄酮对荧光性AGEs的形成有抑制作用。
在还原糖种类、温度、pH值、金属离子以及抑制剂染料木黄酮等影响因素和交互作用中,还原糖是影响CN糖基化生成荧光性AGEs最重要的影响因素,其次为反应时间、温度等。其他作用因素,如还原糖×时间、温度×时间、温度、pH值、抑制剂染料木黄酮和金属离子对CN体系糖基化的作用不显著。
本课题以CN糖基化为导向为食品工业加工过程中染料木黄酮抑制CN糖基化提供一定的理论依据,并为改善食品安全降低食品中AGEs的产生提供新的思路。但是对CN糖基化过程中MGO、GO生成动力学以及染料木黄酮介入后的动力学变化过程需要进行更加深入研究。因此,在食品的加工、贮藏和运输等过程中可通过选择性缩短加工食品的时间、降低加工温度、降低食品pH值,适当调控还原糖的浓度和添加天然黄酮类化合物来控制糖基化过程中有害中间产物MGO/GO和终末产物荧光性AGEs的产生。
[1] HENLE T. Protein-bound advanced glycation endproducts (AGEs) as bioactive amino acid derivatives in foods[J]. Amino Acids, 2005, 29(4): 313-322. DOI:10.1007/s00726-005-0200-2.
[2] RABBANIN, THORNALLEYP J. Dicarbonyls linked to damage in the powerhouse: glycation of mitochondrial proteins and oxidative stress[J]. Biochemical Society Transactions, 2008, 36(Pt 5): 1045. DOI:10.1042/BST0361045.
[3] 杨秀颖, 杜冠华. 糖基化终末产物及相关药物研究进展[J].中国药理学通报, 2011, 27(9): 1185-1188. DOI:103969/ jissn1001-1978201109001.
[4] PENG X, MA J, CHEN F, et al. Naturally occurring inhibitors against the formation of advanced glycation end-products[J]. Food & Function, 2011, 2(6): 289-301. DOI:10.1039/C1FO10034C.
[5] AL-ABED Y, MITSUHASHI T, LI H, et al. Inhibition of advanced glycation end product formation by acetaldehyde: role in the cardioprotective effect of ethanol[J]. Proceedings of the National Academy of Sciences, 1999, 96(5): 2385-2390. DOI:10.1073/ pnas.96.5.2385.
[6] GOLDIN A, BECKMAN J A, SCHMIDT A M, et al. Advanced glycation end products sparking the development of diabetic vascular injury[J]. Circulation, 2006, 114(6): 597-605. DOI:10.1161/ CIRCULATIONAHA.106.621854.
[7] BAYNES J W. The role of AGEs in aging causation or correlation[J]. Experimental Gerontology, 2001, 36(9): 1527-1537. DOI:10.1016/ S0531-5565(01)00138-3.
[8] CHAO P, HSU C, YIN M. Analysis of glycative products in sauces and sauce-treated foods[J]. Food Chemistry, 2009, 113(7): 262-266. DOI:10.1016/j.foodchem.2008.06.076.
[9] 刘纳. 酪蛋白组分分离, 纯化研究[D]. 成都: 西华大学, 2010: 1-2.
[10] 兰欣怡, 王加启, 卜登攀, 等. 牛奶β-乳球蛋白研究进展[J]. 中国畜牧兽医, 2009(6): 109-112.
[11] SCALONI A, PERILLO V, FRANCO P, et al. Characterization of heat-induced lactosylation products in caseins by immunoenzymatic and mass spectrometric methodologies[J]. Biochimica et Biophysica Acta, 2002, 1598(1/2): 30-39. DOI:10.1016/S0167-4838(02)00290-X.
[12] JING H, KITTS D D. Chemical characterization of different sugarcasein Maillard reaction products and protective effects on chemicalinduced cytotoxicity of Caco-2 cells[J]. Food and Chemical Toxicology, 2004, 42(11): 1833-1844. DOI:10.1016/j.fct.2004.06.019.
[13] ERBERSDOBLER H F, SOMOZA V. Forty years of furosineforty years of using Maillard reaction products as indicators of the nutritional quality of foods[J]. Molecular Nutrition & Food Research, 2007, 51(4): 423-430. DOI:10.1002/mnfr.200600154.
[14] FRIEDMAN M. Food browning and its prevention: an overview[J]. Journal of Agriculture and Food Chemistry, 1996, 44(3): 631-653. DOI:10.1021/jf950394r.
[15] MARTINS S I F S, JONGEN W M F, van BOEKEL M A J S. A review of Maillard reaction in food and implications to kinetic modelling[J]. Trends in Food Science & Technology, 2001, 11(9/10): 364-373. DOI:10.1016/S0924-2244(01)00022-X.
[16] NAMIKI M. Chemistry of Maillard reactions: recent studies on the browning reaction mechanism and the developments of antioxidants and mutagens[J]. Advances in Food and Nutrition Research, 1988, 32: 115-184. DOI:10.1016/S0065-2628(08)60287-6.
[17] BARROS A, RODRIGUES J A, ALMEIDA P J, et al. Determination of glyoxal, methylglyoxal, and diacetyl in selected beer and wine, by HPLC with UV spectrophotometric detection, after derivatization with O-phenylenediamine[J]. Journal of Liquid Chromatography & Related Technologies, 1999, 22(13): 2061-2069. DOI:10.1081/JLC-100101786.
[18] BEDNARSKI W, JEDRYCHOWSKI L, HAMMOND E G, et al. A method for the determination of α-dicarbonyl compounds[J]. Journal of Dairy Science, 1989, 72(10): 2474-2477. DOI:10.3168/jds.S0022-0302(89)79387-5.
[19] FENAILLE F, PARISOD V, VISANI P, et al. Modifications of milk constituents during processing: a preliminary benchmarking study[J]. International Dairy Journal, 2006, 16(7): 728-739. DOI:10.1016/ j.idairyj.2005.08.003.
[20] BIRLOUEZ A I, PISCHETSRIEDERB M, LECLÈREA J, et al. Assessment of protein glycation markers in infant formulas[J]. Food Chemistry, 2004, 87(2): 253-259. DOI:10.1016/ j.foodchem.2003.11.019.
[21] HULL G L J, WOODSIDE J V, AMES J M, et al. Nε-(carboxymethyl)-lysine content of foods commonly consumed in a Western style diet[J]. Food Chemistry, 2012, 131(1): 170-174. DOI:10.1016/ j.foodchem.2011.08.055.
[22] CHEN X M, KITTS D D. Identification and quantification of α-dicarbonyl compounds produced in different sugar-amino acid Maillard reaction model systems[J]. Food Research International, 2011, 44(9): 2775-2782. DOI:10.1016/j.foodres.2011.06.002.
[23] BUNN H F, HIGGINS P J. Reaction of monosaccharides with proteins: possible evolutionary significance[J]. Science, 1981, 213: 222-224. DOI:10.1126/science.12192669.
[24] 肖怀秋, 李玉珍, 林亲录. 美拉德反应及其在食品风味中的应用研究[J]. 中国食品添加剂, 2005(2): 27-30.
[25] BOSCH L, ALEGRÍA A, FARRÉ R, et al. Fluorescence and color as markers for the Maillard reaction in milk-cereal based infant foods during storage[J]. Food Chemistry, 2007, 105(3): 1135-1143. DOI:10.1016/j.foodchem.2007.02.016.
[26] RAMONAITYTĖ D T, KERŠIENĖ M, ADAMS A, et al. The interaction of metal ions with Maillard reaction products in a lactoseglycine model system[J]. Food Research International, 2009, 42(3): 331-336. DOI:10.1016/j.foodres.2008.12.008.
[27] JUNG D H, KIM Y S, KIM J S. Screening system of blocking agents of the receptor for advanced glycation end products in cells using fluorescence[J]. Biological & Pharmaceutical Bulletin, 2012, 35(10): 1826-1830. DOI:10.1248/bpb.b12-00361.
Analysis of the Factors Affecting Casein Glycosylation
LIU Guimei, XIA Qiuqin, LI Pu, LÜ Lishuang*
(Ginling College, Nanjing Normal University, Nanjing 210097, China)
Objective: To investigate the factors influencing the formation of fluorescent advanced glycation end products (AGEs) in casein-lactose, casein-MGO and casein-GO model systems. Methods: The influencing factors including reducing sugar type, temperature, pH, metal ion, time and genistein concentration were detected by fluorescence spectrometry, (λex/λem= 370 nm/440 nm). Results: The strongest fluorescent intensity of AGEs was obtained under the conditions: ribose as reducing sugar, pH 7.4, storage temperature of 121 ℃ and processing temperature of 37 ℃, whereas the presence of Fe2+and Ca2+and 9 mmol/L genistein could effectively inhibit the formation of fluorescent AGEs. Conclusion: Reducing sugar type, pH, and temperature have a significant effect on the formation of fluorescent AGEs, and metal ion and genistein could inhibit the fluorescent AGEs. Among these, reducing sugar has the greatest influence on the formation of fluorescent AGEs, followed by time and temperature.
casein; fluorescence spectrometry; advanced glycation end products (AGEs); genistein
10.7506/spkx1002-6630-201621003
TS201.2
A
1002-6630(2016)21-0014-07
刘贵梅, 夏秋琴, 李普, 等. 影响酪蛋白糖基化的因素分析[J]. 食品科学, 2016, 37(21): 14-20. DOI:10.7506/spkx1002-6630-201621003. http://www.spkx.net.cn
LIU Guimei, XIA Qiuqin, LI Pu, et al. Analysis of the factors affecting casein glycosylation[J]. Food Science, 2016, 37(21): 14-20. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621003. http://www.spkx.net.cn
2015-10-25
国家自然科学基金面上项目(31571783);江苏省2015年度普通高校研究生科研创新计划项目(KYLX15_0761)
刘贵梅(1989—),女,硕士研究生,研究方向为食品化学。E-mail:sunshine6324@126.com
*通信作者:吕丽爽(1969—),女,教授,博士,研究方向为食品化学、功能性食品的分离及活性。E-mail:lishuanglv@126.com

