大豆分离蛋白联合海藻酸钠制备番茄红素胶束
赵 磊,张晓蕾,胡济美,赵 磊,王成涛,
(1.北京工商大学食品学院,食品营养与人类健康北京高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048;2.中国国际工程咨询公司,北京 100048)
大豆分离蛋白联合海藻酸钠制备番茄红素胶束
赵 磊1,张晓蕾1,胡济美2,赵 磊1,王成涛1,*
(1.北京工商大学食品学院,食品营养与人类健康北京高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048;2.中国国际工程咨询公司,北京 100048)
采用大豆分离蛋白-海藻酸钠共聚物(soy protein isolate-sodium alginate,SPI-SA)和大豆分离蛋白+海藻酸钠混合物(SPI+SA)分别制备番茄红素胶束,并考察了番茄红素胶束的稳定性和消化释放特性。结果表明:SPI-SA与SPI+SA对番茄红素的包封效果相当;而SPI-SA胶束的抗氧化能力及稳定性均优于SPI+SA胶束;经模拟胃肠消化SPI-SA和SPI+SA制备的番茄红素胶束均具有较好的缓释效果。故SPI-SA可作为新型壁材对番茄红素进行包埋,生产新型保健品。
番茄红素;大豆分离蛋白;海藻酸钠;胶束;稳定性;消化特性
番茄红素具有抗氧化、防癌抗癌、降低胆固醇等重要生理功能[1],是目前生物、医药和食品领域的研究热点。然而,番茄红素作为一种脂溶性色素,对光、热、pH值、氧等不良条件十分敏感[2],这就限制了它的使用。所以一般在应用过程中会将番茄红素做成胶束、乳状液、胶囊或油剂以保持番茄红素的稳定性。赵广华等[3]将番茄红素溶解于食用油中,将乳化剂加入到油中,同时乙醇与水混合,经均质乳化处理制备水分散型番茄红素微乳。曹雯丽[4]研究了番茄红素纳米脂质体的制备,采用熔融-乳化-高压均质工艺,选用Tween 20和Span 20复配作为乳化剂,制成粒径为125.9 nm的番茄红素纳米分散溶液。总结上述研究发现,简单乳化工艺最大的缺点就是分散度较低、稳定性较差。针对此本研究用蛋白和多糖联合的新型壁材制备番茄红素胶束,可以提高其水溶性和生物利用率[5],且致密紧凑、稳定性好、省时省力。
蛋白质、胶类是制备胶束较为常用的乳化剂[6]。蛋白质在成膜性、水化性、营养性等诸多方面有许多优点,但由于结构特殊,对光照、温度、pH值等外界刺激较为敏感,单一使用有较多限制[7]。而胶类如阿拉伯胶对pH值不敏感,能在较宽pH值范围内形成稳定的胶束体系,但因其价格高、供应不稳定且纯度有限限制了其应用[8]。随着蛋白质-多糖共聚反应研究的深入,越来越多的研究发现其兼具有蛋白质和多糖的多种优良性状[9],作为胶囊壁材或胶束乳化剂显示了其优越的性能。然而,对于复配型乳化剂及新型乳化剂而言,其对番茄红素胶束的影响仍缺乏深入研究。因此,本研究主要使用大豆分离蛋白+海藻酸钠混合物(soy protein isolate+sodium alginate,SPI+SA)、大豆分离蛋白-海藻酸钠共聚物(SPI-SA)制备番茄红素胶束,对其性能如包封率、抗氧化性等进行了研究,并考察了不同处理条件对番茄红素胶束稳定性的影响及其胃肠消化释放特性,对解决实际生产中遇到的不稳定、难溶等问题做了较好的理论铺垫。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(蛋白质含量≥90%) 河南亿达化工产品有限公司;海藻酸钠 西陇化工股份有限公司;荧光素钠 北京博奥拓科技有限公司;奎诺二甲基丙烯酸酯(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、α-淀粉酶、胃蛋白酶、胰蛋白酶、2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis-2-methylpropanimidamide,AAPH) 美国Sigma公司;番茄红素(色谱纯,≥95%) 成都瑞芬思生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
全波长酶标仪 美国伯腾公司;UV-2450紫外-可见分光光度计 日本岛津公司;THZ-D台式恒温振荡器、水浴恒温振荡器 天津市欧诺仪器仪表有限公司;PHS-3D型pH计 上海三信仪表厂;Nano-ZS90激光粒度仪英国马尔文仪器有限公司;HJ-1型磁力加热搅拌器 国华仪器厂;超声波发生器 济宁金百特电子有限责任公司。
1.3 方法
1.3.1 干热法制备SPI-SA
称取一定质量的SPI溶解于蒸馏水中,按10∶9(m/m,下同)的比例加入SA,将混合物放置在磁力搅拌器上搅拌30 min,分装,冷冻干燥备用[10]。将干燥后的SPI和SA混合物冻干后的样品磨成粉末,然后平铺于培养皿中置于干燥器中,干燥器底部盛有一定量饱和KBr溶液控制相对湿度为79%,于68 ℃反应时间24 h,得到SPI-SA[11-12]。
1.3.2 番茄红素胶束的制备
采用乳化-溶剂挥发法制备番茄红素胶束[13-14]。将0.2 g SPI-SA或SPI+SA(SPI和SA按10∶9比例混合)分别溶于15 mL水中,搅拌至充分溶解。将1 mL番茄红素乙酸乙酯溶液(15 mg/mL)快速注入上述溶液中,超声充分搅拌,挥发除去乙酸乙酯,随后8 000 r/min高速搅拌3 min得到番茄红素胶束样品。
1.3.3 番茄红素胶束的粒径测定
分别配制质量浓度为10 mg/mL的番茄红素胶束,用50 mmol/L、pH 7的磷酸盐缓冲液稀释100 倍,采用激光粒度仪于室温条件下分析胶束粒径大小,以平均粒径(nm)表示。
1.3.4 番茄红素胶束中番茄红素含量及包封率的测定
配制质量浓度为0.4、0.8、1.2、1.6、3.2 μg/mL的番茄红素-丙酮溶液,分别测定各溶液在472 nm波长处的吸光度,以番茄红素质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到标准曲线方程为:y=0.237 6x+ 0.019(r2=0.995)。吸取100 μL番茄红素胶束于2 mL水中,加入石油醚-丙酮混合液(1∶1,V/V)反复萃取,直至水相变为无色,将有机相合并,丙酮定容至100 mL,在472 nm波长处测吸光度A0,代入标准曲线,计算胶束中番茄红素总含量(C0,g/L);另取100 μL番茄红素胶束,加入石油醚振荡充分混匀,离心收集上层有机相,重复2 次,合并有机相用丙酮定容至100 mL,在472 nm波长处测吸光度A1,代入标准曲线,计算胶束中游离番茄红素含量(C1,g/L)。经式(1)计算可得包封率。

1.3.5 番茄红素胶束抗氧化能力测定
通过测定氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)来测定样品的抗氧化能力[15]。采用黑色96 孔酶标板测量,先分别将两种20 μL番茄红素胶束(14.3 mg/mL,体积分数0.2%二甲基亚砜(dimethyl sulphoxide,DMSO))和番茄红素的溶液(1 mg/mL,体积分数0.2% DMSO)加入到小孔内。随后加入120 μL 35.1 nmol/L荧光素钠溶液,混匀后于37 ℃条件下孵育12 min。之后添加0.032 5 g/mL AAPH溶液60 μL,立即将酶标板放入多功能酶标仪内测定,激发光485 nm,发射光520 nm,温度37 ℃,检测时间2 h,每2 min测定一次荧光值。将荧光值与对应时间绘制曲线,采用磷酸盐缓冲盐溶液代替样品作为空白对照,并按式(2)、(3)计算净曲线下面积(NetAUC)。用25~500 μmol/L的Trolox溶液绘制标准曲线,横坐标为Trolox溶液的浓度(μmol/L),纵坐标为NetAUC,得到标准曲线方程为y=0.062x(r2=0.996)将所得的面积值代入标准曲线中,番茄红素胶束的抗氧化能力用待测物质Trolox当量(mmol Trolox/g)值来表示。


式中:f0为0 min的初始荧光值;fi为第i分钟的荧光值。
1.3.6 番茄红素胶束稳定性的研究
1.3.6.1 常温光照处理对番茄红素胶束稳定性的影响
将样品放置在自然条件下(敞口放置,温度25 ℃,自然光照8 h/d),每隔一定时间测定胶束中番茄红素的含量,按式(4)计算胶束中番茄红素的保留率。

式中:C1为处理后胶束中番茄红素含量/(g/L);C0为处理前胶束中番茄红素含量/(g/L)。
1.3.6.2 温度对番茄红素胶束粒径和稳定性的影响
制备7.5%番茄红素的SPI-SA和SPI+SA番茄红素胶束,分别放置在30、40、50、60、70 ℃的恒温装置中24 h后,比较放置前后胶束粒径的变化,同时测定番茄红素的剩余含量并计算番茄红素保留率。
1.3.6.3 pH值对番茄红素胶束粒径和稳定性的影响
制备7.5%番茄红素的SPI-SA和SPI+SA番茄红素胶束,分别调节pH值为2、3、4、5、6、7、8、9,比较不同pH值条件下各胶束的粒径,方法同上。然后将各胶束避光放置24 h后测定胶束中番茄红素含量,按式(4)计算番茄红素的保留率。
1.3.6.4 模拟体液消化对胶束中番茄红素释放率的影响
称取1 g样品,加入到37 ℃预温的200 mL模拟胃液[16](0.2 g/100 mL NaCl、0.32 g/100 mL胃蛋白酶、HCl调节pH值至1.5)中,置于37 ℃水浴摇床(100 r/min)消化2 h,期间每30 min调一次pH值使其稳定于1.5,分别于5、10、20、30、60、120 min取样品测定番茄红素的释放率。胃消化阶段结束后,用1 mol/L NaOH调pH值至7.5,转移至模拟肠液[17](0.68 g/100 mL KH2PO4、5 mmol/L CaCl2、1 g/100 mL胰蛋白酶,NaOH调节pH值至7.5)的环境中,继续置于水浴摇床(37 ℃,100 r/min)消化5 h,期间每30 min调一次pH值使其稳定于7.5,分别于5、10、20、30、60、120、180、240、300 min取样品测定番茄红素的释放率。
取模拟胃肠消化处理后的番茄红素胶束离心分离(8 000 r/min,20 min),取中间胶束相按1.3.4节测定游离番茄红素质量浓度(C2,g/L),同时测定模拟胃肠消化处理前胶束中游离番茄红素质量浓度(C1,g/L)和番茄红素总质量浓度(C0,g/L),并按式(5)计算释放率。

2 结果与分析
2.1 不同番茄红素胶束的抗氧化性

图1 番茄红素溶液及SPI+SA、SPI-SA番茄红素胶束的抗氧化能力Fig. 1 Antioxidant capacity of lycopene and lycopene micelles prepared with SPI + SA and SPI–SA
SPI-SA和SPI+SA番茄红素胶束对番茄红素的包封率分别可达到90.1%和90.3%,故两种番茄红素胶束所含番茄红素含量无显著性差异。各番茄红素胶束样品的抗氧化性结果如图1所示。含相同质量浓度番茄红素的不同样品抗氧化能力依次为:SPI-SA番茄红素胶束>SPI+ SA番茄红素胶束>番茄红素溶液。这表明,制备成番茄红素胶束后抗氧化能力有一定提高,SPI+SA番茄红素胶束的抗氧化性提高了16.0%,SPI-SA番茄红素胶束的抗氧化性提高了53.0%,这是由于经干热美拉德反应生成的SPI-SA具有较强的抗氧化能力,从而使得SPI-SA番茄红素胶束的抗氧化活性得到明显提高。这与文献报道的蛋白质经美拉德反应改性后,可使蛋白质的抗氧化性显著提高的结果[18-19]相一致。
2.2 常温光照处理对番茄红素胶束稳定性的影响

图2 常温光照处理下番茄红素溶液(a)及SPI +SA、SPI-SA番茄红素胶束中番茄红素(b)保留率Fig. 2 Stability of lycopene and lycopene micelles prepared with SPI + SA and SPI–SA stored at room temperature in daylight
番茄红素溶液及各番茄红素胶束在自然条件下放置不同时间后番茄红素的保留率如图2所示。番茄红素溶液在自然状态下放置1 d以后,番茄红素保留率就会下降到52.8%以下,4 d左右基本消耗殆尽。而胶束中的番茄红素经过1 个月后,依然能保留43.2%以上,说明该方法对保护番茄红素能够起到良好的效果。对比不同胶束番茄红素的保留率可知,SPI-SA胶束优于SPI+SA胶束。其原因是SPI-SA具有很强的抗氧化和抗菌能力,能对番茄红素起到很好的保护作用。
2.3 放置温度对番茄红素胶束粒径及稳定性的影响
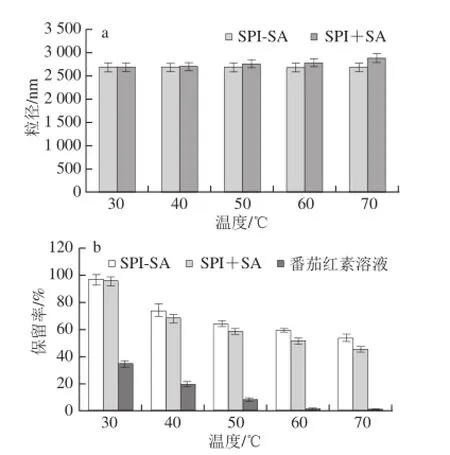
图3 不同温度条件下SPI +SA、SPI-SA番茄红素胶束粒径(a)及其中番茄红素的保留率(b)Fig. 3 Effect of temperature on the stability of lycopene micelles prepared with SPI + SA and SPI-SA
由图3a可知,不同温度条件下放置24 h后,SPI-SA番茄红素胶束的粒径均无明显变化(P>0.05);对于SPI+SA胶束,当放置温度≤50 ℃时,胶束粒径也无明显变化,当放置温度>50 ℃时,24 h后SPI+SA胶束的粒径出现明显增大(P<0.05),60 ℃和70 ℃条件下SPI+SA胶束的粒径分别增加了3.7%和7.4%,这可能是因为SPI+SA胶束在较高的温度时SPI和SA之间的静电引力有一定减弱,与番茄红素吸附的紧密程度减弱,导致胶束粒径的增大,该推测还有待进一步证实。
不同放置温度对胶束和番茄红素溶液保留率的影响如图3b所示,番茄红素对温度非常敏感,当温度为30 ℃时,放置24 h后番茄红素保留率为33.9%,当温度为50℃时,番茄红素保留率为7.9%,继续升高温度,番茄红素基本完全被消耗。然而,温度对SPI-SA和SPI+SA胶束中番茄红素影响明显低于对番茄红素的影响。当温度为30 ℃时,24 h后两种胶束中番茄红素的保留率依然可以高达96.4%和95.4%;即使温度上升到70 ℃,番茄红素的保留率依然能达到50%左右,说明两种胶束对番茄红素可以起到良好的保护效果。
对比温度对SPI-SA和SPI+SA胶束中番茄红素影响可知,当放置温度为30 ℃时,两种胶束对番茄红素的保护效果无明显差异,这是因为温度较低,对番茄红素影响较小;当温度>30 ℃时,SPI-SA胶束对番茄红素的保护效果明显优于SPI+SA胶束(P<0.05)。这可能是因为SPI-SA比SPI+SA具有更好的抗氧化能力,所以能够更好地保护番茄红素。
2.4 pH值对番茄红素胶束粒径及稳定性的影响
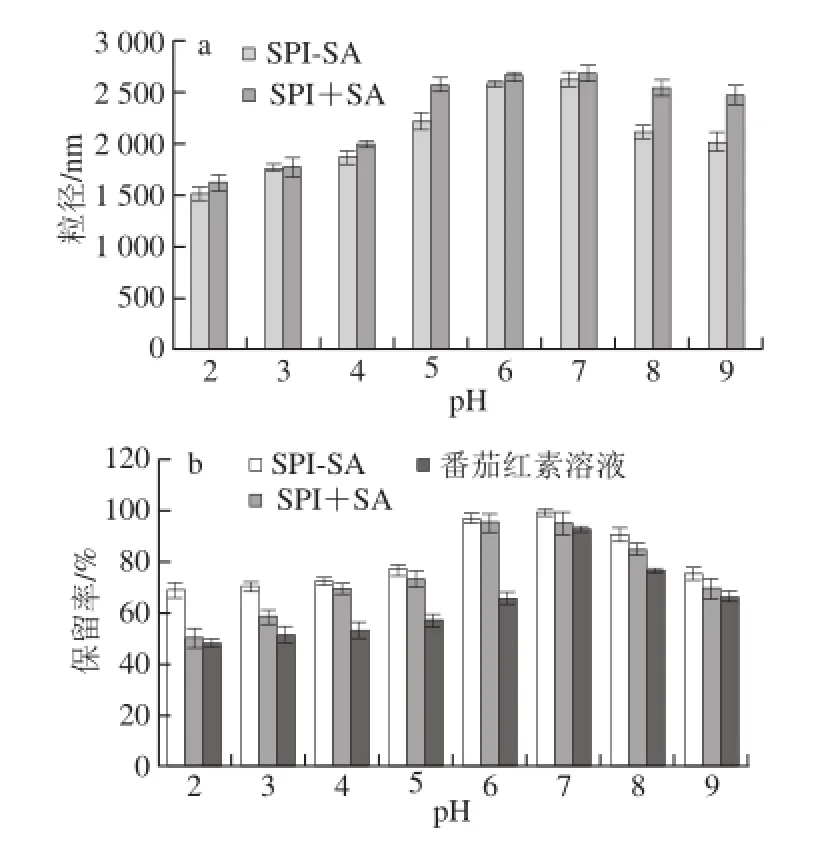
图4 不同pH值条件下SPI +SA、SPI-SA番茄红素胶束的粒径(a)及其中番茄红素的保留率(b)Fig. 4 Effect of pH on the stability of lycopene micelles prepared with SPI + SA and SPI-SA
由4a可知,pH值不同,番茄红素胶束的粒径也不相同,pH值越接近中性,胶束的平均粒径也越大。当pH值降至2.0时,SPI-SA和SPI+SA胶束的平均粒径反而减小,可能是SA处于酸性条件时,糖链不可溶,糖链收缩从而形成较致密的胶束颗粒,使粒径变小。而SA处于偏碱性条件时,糖链溶于周围的水溶液,糖链疏松从而形成了粒径较大的空间结构。这表明SPI混合SA以及两者以共价键结合后均能改善胶束体系的酸碱稳定性[20]。不同pH值条件下SPI-SA番茄红素胶束的平均粒径明显小于SPI+SA番茄红素胶束(P<0.01),说明SPI-SA番茄红素胶束结构更为致密,其稳定性优于SPI+SA番茄红素胶束,得到了进一步改善。
不同pH值下SPI-SA和SPI+SA胶束放置24 h后番茄红素的保留率见图4b,番茄红素对酸碱变化非常敏感,在不同的pH值环境下,其溶液的颜色不同,越接近中性颜色越深[21]。当在中性环境下时,其在472 nm波长处的吸光度最大,且稳定性较好。pH值越偏离中性,其在472 nm波长处的吸光度越低,酸性条件下稳定性相对较差。
与单一的番茄红素溶液相比,SPI-SA和SPI+SA胶束在不同的pH值条件下对番茄红素的保存效果均明显提高;比较SPI-SA和SPI+SA胶束在不同pH值条件下(尤其是在酸性条件下)番茄红素的保留率可知,SPI-SA胶束中番茄红素稳定性要高于SPI+SA胶束。这说明将番茄红素胶束化能够提高其在偏酸或偏碱环境下的保留率,而SPI-SA在这方面表现的效果更好。
2.5 模拟胃肠消化对胶束中番茄红素释放率的影响

图5 模拟胃液处理后SPI+SA和SPI-SA胶束番茄红素的释放率Fig. 5 Release rate of lycopene from micelles prepared with SPI + SA and SPI-SA when treated with simulated gastric fluid
模拟胃液中SPI-SA及SPI+SA胶束中番茄红素释放率如图5所示。在前30 min内,番茄红素释放较快。原因可能是有一部分番茄红素吸附在胶束颗粒的表面,在模拟胃液的极性环境中,与介质发生强相互作用,导致番茄红素脱离胶束颗粒表面,同时也在胶束表面形成微孔道,利于其进一步释放。在30~120 min番茄红素释放较慢。原因可能是由于胶束表面存在微孔道,导致番茄红素从孔道中以扩散的方式释放出来[22]。
经过模拟胃液处理2 h后,SPI+SA胶束中番茄红素释放率为52.5%,而SPI-SA胶束中番茄红素释放率能达到39.7%,这说明采用SPI-SA制备番茄红素胶束,可使更多的番茄红素留在胶束内部,从而可提高番茄红素在酸性条件下的稳定性,将更多的番茄红素运送到肠道,有利于后续的吸收过程。与本研究结果相似,有研究报道称糖基化会降低蛋白对胃蛋白酶的敏感性[23]。分析原因可能是SPI-SA共聚物胶束由于SA在SPI表面形成了具有保护作用的界面层,将疏水氨基酸保护在内核区域,在胃蛋白酶和低pH值作用下,结构相对稳定[13],这也与低pH值条件下SPI-SA胶束的粒径较小,稳定性较强相一致。

图6 模拟肠液处理后SPI+SA和SPI-SA胶束番茄红素的释放率Fig. 6 Release rate of lycopene from micelles prepared with SPI + SA and SPI-SA when treated with simulated intestinal fluid
由图6可知,番茄红素胶束在模拟肠液中的释放也分为突释和缓释两个阶段[24]。在前30 min,番茄红素突释了近20%,其原因可能是SA处于偏碱性的模拟肠液时,糖链溶于周围的水溶液,胶束突然溶胀并形成了结构疏松的空间结构,使胶束表面的和靠近表面的番茄红素突然释放出来。后续的释放曲线相对比较平缓,具有缓释效应[25]。经过5 h模拟肠液处理,SPI+SA胶束和SPI-SA胶束中番茄红素释放率分别达到了32.5%和32.1%。这说明采用SPI+SA和SPI-SA制备的番茄红素胶束均能有效释放出番茄红素,并具有一定的缓释作用,且两者之间无显著性差异。
3 结 论
采用SPI+SA混合物和SPI-SA共聚物制备番茄红素胶束,均能有效提高番茄红素的抗氧化性和稳定性,并具有较好的释放效果和缓释能力,有助于使更多的番茄红素在小肠内吸收。而用SPI-SA制备的番茄红素胶束在稳定性和抗氧化性上明显优于SPI+SA,因此,采用SPI-SA制备番茄红素胶束更有优势。番茄红素制备成胶束后可以通过喷雾干燥制成微胶囊产品,方便贮存、运输和食用。由于该胶束解决了番茄红素在水中不能溶解及稳定性差等问题,还可以添加到饮料产品中,作为饮料中的着色剂和营养物质。
[1] 孙庆杰, 丁霄霖. 番茄红素的研究进展[J]. 中国食品添加剂, 1998(1): 1-6.
[2] 赵娟娟. 番茄红素的抗氧化活性研究[J]. 食品科技, 2010, 35(7): 62-65.
[3] 赵广华, 戴玉子, 陈芳, 等. 一种透明水分散型番茄红素浓缩液的制备方法: CN200710119790.5[P]. 2009-07-08[2015-11-10]. http://www. pss-system.gov.cn/sipopublicsearch/patentsearch/showSearchResultdrillSearchByViewSetting.shtml.
[4] 曹雯丽. 番茄红素纳米分散体的制备及稳定性研究[D]. 无锡: 江南大学, 2009: 15-26.
[5] SHI J, MAGUER M L. Lycopene in tomatoes: chemical and physical properties affected by food processing[J]. Critical Reviews in Biotechnology, 2000, 20(4): 293-334. DOI:10.1080/07388550091144212.
[6] BOOBALAN G, IMRAN P K M, NAGARAJAN S. Luminescent onedimensional nanostructures of perylene bisimides[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 113: 340-345. DOI:10.1016/j.saa.2013.05.010.
[7] KATO A, SHIMOKAWA K, KOBAYASHI K. Improvement of the functional properties of insoluble gluten by pronase digestion followed by dextran conjugation[J]. Journal of Agricultural and Food Chemistry, 1991, 39(6): 1053-1056. DOI:10.1021/jf00006a010.
[8] 项惠丹, 许时婴, 王璋. 蛋白质与还原糖美拉德反应产物的抗氧化活性[J]. 食品科学, 2008, 29(7): 52-57. DOI:10.3321/ j.issn:1002-6630.2008.07.005.
[9] MCCLEMENTS D J. Edible nanoemulsions: fabrication, properties, and functional performance[J]. Soft Matter, 2011, 7(6): 2297-2316. DOI:10.1039/C0SM00549E.
[10] 王晓文, 张华伟, 闫圣坤, 等. 番茄红素在微乳液制备和贮藏过程中构型转化及稳定性研究[J]. 食品与生物技术学报, 2013, 32(1): 22-29. DOI:10.3969/j.issn.1673-1689.2013.01.004.
[11] 赵磊, 赵磊, 王旋, 等. 大豆分离蛋白-多糖美拉德反应共聚物的制备及性能研究[J]. 食品科技, 2015, 40(8): 256-261.
[12] LILLARD S J. Expanding the utility of a modified whey protein ingredient via carbohydrate conjugation[D]. Raleigh: North Carolina State University, 2007: 34-36.
[13] 张雅婷. 酪蛋白美拉德反应产物理化性质与包埋释放性能研究[D].无锡: 江南大学, 2013: 12.
[14] 李敏. 番茄红素微胶囊化及其性质研究[D]. 南京: 南京财经大学, 2012: 11.
[15] ZHANG L, LI J, ZHOU K. Chelating and radical scavenging activities of soy protein hydrolysates prepared from microbial proteases and their effect on meat lipid peroxidation[J]. Bioresource Technology, 2010, 101(7): 2084-2089. DOI:10.1016/j.biortech.2009.11.078.
[16] 许朵霞. 乳清分离蛋白-甜菜果胶不同相互作用对β-胡萝卜素乳状液稳定机理及体外释放特性的研究[D]. 北京: 中国农业大学, 2012: 82-83.
[17] UNTERSMAYR E, POULSEN L K, PLATZER M H, et al. The effects of gastric digestion on coldfish allergenicity[J]. Journal of Allergy and Clinical Immunology, 2005, 115(2): 377-382. DOI:10.1016/j.jaci.2004.10.029.
[18] KATO A. Maillard-type protein-polysaccharide conjugates[J]. Developments in Food Science, 2000, 41: 385-395. DOI:10.1016/ S0167-4501(00)80017-5.
[19] 孙常雁. 乳清蛋白肽美拉德反应产物的制备及其抗氧化作用机理研究[D]. 哈尔滨: 东北农业大学, 2014: 37-41.
[20] DLUSKA E, MARKOWSKA A, LUSKA E, et al. One-step preparation method of multiple emulsions entrapping reactive agent in the liquidliquid Couette-Taylor flow[J]. Chemical Engineering & Processing Process Intensification, 2009, 48(1): 438-445. DOI:10.1016/ j.cep.2008.06.005.
[21] SHI J, LE MAGUER M L. Lycopene in tomatoes: chemical and physical properties affected by food processing[J]. Critical Reviews in Biotechnology, 2010, 20(4): 293-334. DOI:10.1080/10408690091189275.
[22] 李振声, 邓玲, 杨晓占. 溶液的酸碱性对番茄红素荧光光谱的影响[J].光散射学报, 2010, 22(1): 77-80.
[23] CORZO-MARTINEZ M, SORIA A C, BELLOQUE J, et al. Effect of glycation on the gastrointestinal digestibility and immunoreactivity of bovine β-lactoglobulin[J]. International Dairy Journal, 2010, 20(11): 742-752. DOI:10.1016/j.idairyj.2010.04.002.
[24] POOJARY M M, PASSAMONTI P. Extration of lycopene from tomato processing waste: kinetics and modeling[J]. Food Chemistry, 2015, 173: 943-950. DOI:10.1016/j.foodchem.2014.10.127.
[25] DEHGHAN-SHOAR Z, HARDACRE A K, MEERDINK G, et al. Lycopene extraction from extrude products containing tomato skin[J]. International Journal of Food Science and Technology, 2011, 46(2): 365-371. DOI:10.1111/j.1365-2621.2010.02491.x.
Preparation of Lycopene Micelle by Combination of Soy Protein Isolate and Sodium Alginate
ZHAO Lei1, ZHANG Xiaolei1, HU Jimei2, ZHAO Lei1, WANG Chengtao1,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Engineering and Technology Research Center of Food Additives, School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China; 2. China International Engineering Consulting Corporation, Beijing 100048, China)
In this experiment, soy protein isolate-sodium alginate conjugate (SPI-SA) and their physical mixture (SPI+SA) were used to prepare lycopene micelles, respectively. The stability and release rate under simulated digestion conditions of lycopene micelles were studied. The results showed that the effects of SPI-SA and SPI+SA on the encapsulation efficiency of lycopene were comparable. The antioxidant capacity and stability of SPI-SA micelle were better than those of SPI+SA micelle. Both micelles prepared with SPI-SA and SPI+SA showed good sustained release effect during simulated gastrointestinal digestion. Therefore, SPI-SA can be used as a new type of wall material for embedding lycopene in the production of new health products.
lycopene; soy protein isolate; sodium alginate; micelles; stability; digestion conditions
10.7506/spkx1002-6630-201621001
TS264.4;TS202.3
A
1002-6630(2016)21-0001-06
赵磊, 张晓蕾, 胡济美, 等. 大豆分离蛋白联合海藻酸钠制备番茄红素胶束[J]. 食品科学, 2016, 37(21): 1-6.
DOI:10.7506/spkx1002-6630-201621001. http://www.spkx.net.cn
ZHAO Lei, ZHANG Xiaolei, HU Jimei, et al. Preparation of lycopene micelle by combination of soy protein isolate and sodium alginate[J]. Food Science, 2016, 37(21): 1-6. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621001. http://www.spkx.net.cn
2015-11-10
国家自然科学基金青年科学基金项目(31201324);北京市科技计划项目(Z151100001215008)
赵磊(1982—),女,副教授,博士,研究方向为功能性食品。E-mail:zhaolei@th.btbu.edu.cn
*通信作者:王成涛(1969—),男,教授,博士,研究方向为功能性食品和食品生物技术。E-mail:wct5566@163.com

