螃蟹脚全粉的急性毒性和遗传毒性
郝彬秀,应 剑,孟庆佳,王黎明,刘 婷,李 颂,王春玲
(中粮营养健康研究院,北京 102209)
螃蟹脚全粉的急性毒性和遗传毒性
郝彬秀,应 剑,孟庆佳,王黎明,刘 婷,李 颂,王春玲*
(中粮营养健康研究院,北京 102209)
参考2015年实施的GB 15193.1—2014《食品安全性毒理学评价程序》的实验方法,采用急性毒性实验、骨髓嗜多染红细胞微核实验、精原细胞染色体畸变实验和Ames实验,观察螃蟹脚全粉的急性毒性和遗传毒性作用。结果:螃蟹脚全粉对雌、雄性大鼠经口半数致死量(medium lethal dose,LD50)均为10.25 g/kg,属实际无毒级;骨髓嗜多染红细胞微核实验和Ames实验结果均为阴性;精原细胞染色体畸变实验表明,10.25 g/kg和5.12 g/kg的螃蟹脚全粉可能引起染色体一过性的畸变率升高,2.57 g/kg未观察到该现象。结论:螃蟹脚全粉未显示存在急性毒性,未观察到明确的遗传毒性。
螃蟹脚;急性毒性;骨髓嗜多染红细胞微核实验;精原细胞染色体畸变实验;Ames实验;全粉
螃蟹脚系桑寄生科槲寄生属植物,是一种寄生在树龄较高的古乔木茶树上的寄生物,形状像小珊瑚,寄生枝杆节状,形如蟹肢而得名[1]。螃蟹脚学名枫香槲寄生(Viscum liquidambaricolum Hayata),也有人称其为扁枝槲寄生。因寄生于茶树,又被称为“茶茸”[2]。
螃蟹脚从清朝起即是云南景迈地区普洱茶出口外销和进贡的特殊标记[3-5]。如今,螃蟹脚在云南的少数民族地区被认为是珍贵的食用植物,每次食用量为1~2 g,可以单独饮用或者与普洱茶共饮,也用作炖滋补鸡汤的食材[6]。《云南茶典》认为螃蟹脚具有清热解毒、健胃消食、清胆利尿、降低血压等功效[2,7]。现代科学研究发现,螃蟹脚主要有效成分为多糖、黄酮、蛋白质、三萜、生物碱等化合物,其提取物具有抗菌、抗肿瘤等药理活性,民间用其治疗风湿性关节疼痛、腰肌劳损[6,8-12]。然而,目前的研究仅限于对螃蟹脚的成分分析上,对于其食用的安全性情况鲜见文献和研究成果,只在民间流传有“性凉,不可多喝”的说法[3-5]。
为了确认螃蟹脚是否可以作为食品进行开发,本实验对螃蟹脚全粉的急性毒性和遗传毒性进行研究,为对其安全性研究提供初步依据,并为其合理开发和进一步利用提供可靠的理论依据。
1 材料与方法
1.1 材料与试剂
螃蟹脚全粉由中国土产畜产进出口总公司提供,目数为180 目,黄褐色粉末,具有甘甜香气,味甘。
清洁级SD(Sprague Dawley)大鼠和ICR(Institute of Cancer Research)小鼠,购买自北京维通利华实验动物技术有限公司,动物实验生产许可证编号:SCXK(京)2012-0001;实验动物质量合格证编号分别为SD大鼠(急性毒性实验):No.11400700100902;ICR小鼠(骨髓嗜多染红细胞微核实验):No.11400700108380;ICR小鼠(精原细胞染色体畸变实验):No. 11400700109805。所有动物实验前在环境中适应3 d,并进行检疫观察。动物实验经中国疾控预防中心职业卫生与中毒控制所实验动物管理与福利伦理审查委员会审查决议通过,伦理审查批准号:EAWE-2015-006。实验动物使用许可证编号:SYXK(京)2014-0043。
鼠伤寒沙门氏菌组氨酸缺陷型菌株TA97a、TA98、TA100、TA102和TA1535,由上海君科生物科技有限公司代理购自美国Moltox公司。对其基因型、自发回复突变数和对阳性致突变物敏感性进行鉴定,5 株菌株特性经鉴定达到实验要求。
牛肉膏、胰蛋白胨、琼脂粉 北京奥博星生物技术有限公司;磷酸氢钠铵、柠檬酸、硫酸镁、葡萄糖、敌克松 国药集团化学试剂有限公司;2-氨基芴、1,8-二羟蒽醌、L-组氨酸、D-生物素、氧化型辅酶Ⅱ、葡萄糖-6-磷酸钠盐、叠氮钠 美国Sigma-Aldrich公司;氯化镁、氯化钾 西陇化工有限公司;SD大鼠肝S9 美国Moltox公司;所有溶剂均为分析纯。
1.2 仪器与设备
Axio Lab.A1显微镜 德国卡尔蔡司公司;Galaxy 230菌落计数器 德国Wiggens公司。
1.3 方法
1.3.1 急性毒性实验
取SD大鼠20 只,雌雄各半,体质量190~220 g,采用限量法进行实验。用0.5%羧甲基纤维素钠配制全粉悬液,最大灌胃剂量为10.25 g/kg。灌胃后对动物进行临床观察及体质量检测,记录不良反应、死亡情况。如有死亡,进行解剖并进行肉眼病理观察。连续观察2 周,第15天处死所有动物,解剖并进行肉眼病理观察[13-16]。
1.3.2 骨髓嗜多染红细胞微核实验
取ICR小鼠50 只,雌雄各半,体质量25~35 g,随机分为5 组,设阴性对照组、阳性对照组和3 个不同剂量实验组。以急性毒性实验中螃蟹脚全粉的最大剂量10.25 g/kg为最高剂量,下设1/2(即5.12 g/kg)和1/4(即2.57 g/kg)剂量组,分别在0 h和24 h经口灌胃给予受试物。阴性对照组经口灌服0.5%羧甲基纤维素钠,阳性对照组于0 h腹腔注射40 mg/kg环磷酰胺。30 h将小鼠脱颈处死,采集股骨骨髓,制备细胞涂片,Gimesa染色后镜检。嗜多染红细胞呈灰蓝色,成熟正染红细胞呈红色,每只小鼠观察2 000 个嗜多染红细胞,记录含微核的嗜多染红细胞数,计算微核率(micronucleus frequency,MNF)[17-18]。
1.3.3 精原细胞染色体畸变实验
取雄性ICR小鼠35 只,体质量25~35 g,随机分为7 组,设阴性对照组(2 组)、阳性对照组(1 组)和不同剂量实验组(其中高剂量组为2 组,中剂量和低剂量组各1 组)。以急性毒性实验中螃蟹脚全粉的最大剂量10.25 g/kg为最高剂量,下设1/2(即5.12 g/kg)和1/4(即2.57 g/kg)剂量组。阴性对照组经口灌服0.5%羧甲基纤维素钠,阳性对照组一次性腹腔注射40 mg/kg环磷酰胺。其中1 组阴性对照组和高剂量组,以及阳性对照组、中剂量组和低剂量组的动物于24 h脱颈处死采样,剩余的1 组阴性对照组和高剂量组的动物在观察48 h后脱颈处死采样。动物处死前3~5 h腹腔注射秋水仙素6 mg/kg。取小鼠双侧睾丸,分离睾丸曲细精管,用1%柠檬酸三钠溶液处理后进行固定、软化、离心,制备细胞悬液滴片,Giema染色后镜检。每只小鼠观察100~200 个中期分裂相精原细胞,记录染色体结构畸变的细胞数和染色体畸变类型,计算染色体畸变频率,并与溶媒组进行统计学分析比较[19-20]。
1.3.4 Ames实验
实验采用平板掺入法。预实验显示螃蟹脚全粉添加量为5 000 µg/皿时,有较明显的抑菌现象,故实验以3 000 µg/皿为最大剂量,采用等比组距,以倍为组距,下设950、300、95、30 µg/皿剂量组。同时设立溶剂对照组、阴性对照组和阳性对照组,以二甲基亚砜为溶剂对照组,以自发回复突变数为阴性对照,以叠氮钠(1.5 µg/皿,不加S9的TA100和TA1535)、敌克松(50 µg/皿,不加S9的TA97、TA98、TA102)、2-氨基芴(10 µg/皿,加S9的TA97、TA98、TA100)、1,8-二氢蒽醌(50 µg/皿,加S9的TA102)、环磷酰胺(200 µg/皿,加S9的TA1535)为阳性对照。在加入S9和不加入S9条件下进行实验。每个菌株每个剂量设3 个平板。计数回复突变菌落数,并进行统计学分析。菌株TA98和TA1535的回复突变菌落数等于或大于阴性对照组回复突变菌落数的2 倍可判定为阳性结果;菌株TA97a、TA100和TA102的回复突变菌落数等于或大于阴性对照组回复突变菌落数的2 倍,且有剂量反应或某一测试点有可重复阳性结果,可判定为阳性结果[21-24]。
1.4 数据统计分析
2 结果与分析
2.1 急性毒性实验结果
实验期间未见大鼠出现中毒症状,无动物死亡,各组大鼠外观特征基本正常。雄性组大鼠在给予螃蟹脚全粉后出现极显著的一过性体质量下降,但在48 h后即恢复正常的体质量增长,推测为大量给予食物导致暂时的胃肠道不适。于第15天处死动物,进行病理解剖,均未观察到异常。实验结果显示大鼠急性毒性实验LD50大于10.25 g/kg。据此判断螃蟹脚全粉的急性毒性属于实际无毒。实验期间SD大鼠体质量变化如表1所示。

表1 大鼠急性毒性实验结果Table 1 Results of acute toxicity in SD rats
2.2 骨髓嗜多染红细胞微核实验结果
螃蟹脚全粉在2.57、5.12、10.25 g/kg剂量下,雄性小鼠和雌性小鼠的嗜多染红细胞微核率与阴性对照组均无显著差异(P>0.05),且无剂量-反应关系;阳性对照组与阴性对照组相比差异极显著(P<0.01),见表2、图1。表明在本实验条件下,螃蟹脚全粉无致小鼠骨髓嗜多染红细胞微核形成的作用。

表2 小鼠骨髓嗜多染红细胞微核实验结果Table 2 Results of micronucleus test of bone marrow PCE cells in mice
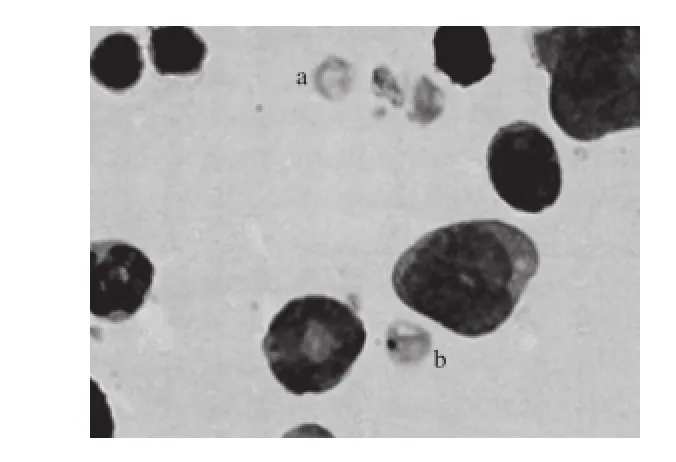
图1 嗜多染红细胞微核实验结果(×1 000)Fig. 1 Polychromatic erythrocytes (×1 000)
2.3 精原细胞染色体畸变实验结果
螃蟹脚全粉在2.57、5.12、10.25 g/kg剂量下,阳性对照组与24 h和48 h的阴性对照组相比差异显著(P<0.05)。24 h的低剂量组与阴性对照组相比无显著性差异,高、中剂量组与阴性对照组相比有显著性差异(P<0.05);48 h的高剂量组与阴性对照组相比,无显著性差异(P>0.05),见表3、图2。表明在本实验条件下,灌胃给予较高剂量的螃蟹脚全粉,可能一过性地促进小鼠精原细胞染色体畸变。
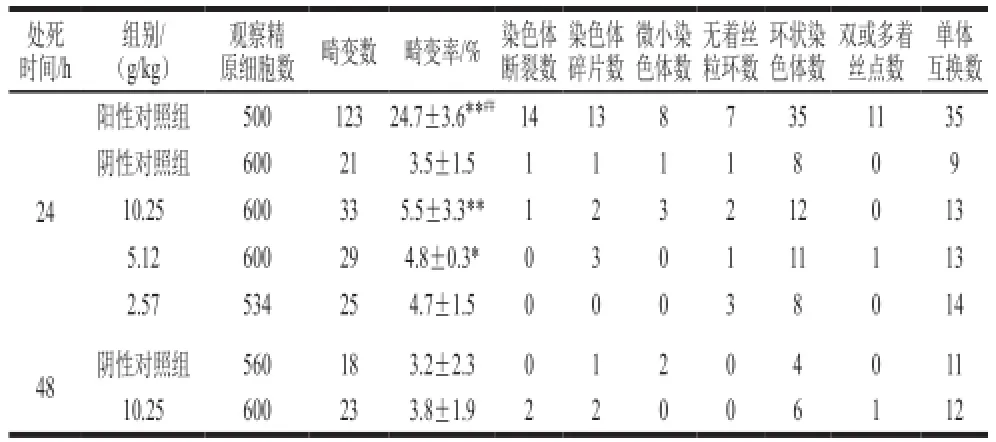
表3 小鼠精原细胞染色体畸变实验结果Table 3 Results of spermatogonium chromosome aberration in mice
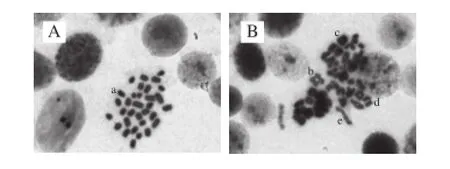
图2 精原细胞染色体畸变情况(×1 000)Fig. 2 Sperm cell chromosome aberration (×1 000)
2.4 Ames实验结果
实验各剂量组的回复突变菌落数,不论是否加入S9,均未超过相应阴性对照组的2 倍,且无剂量-反应关系;阳性对照组超过阴性对照组2 倍以上,显示出明显的诱变性,结果见表4。表明在实验剂量范围内,加或不加S9条件下,螃蟹脚全粉对鼠伤寒沙门氏菌组氨酸缺陷型的5 株菌株均无致突变作用。
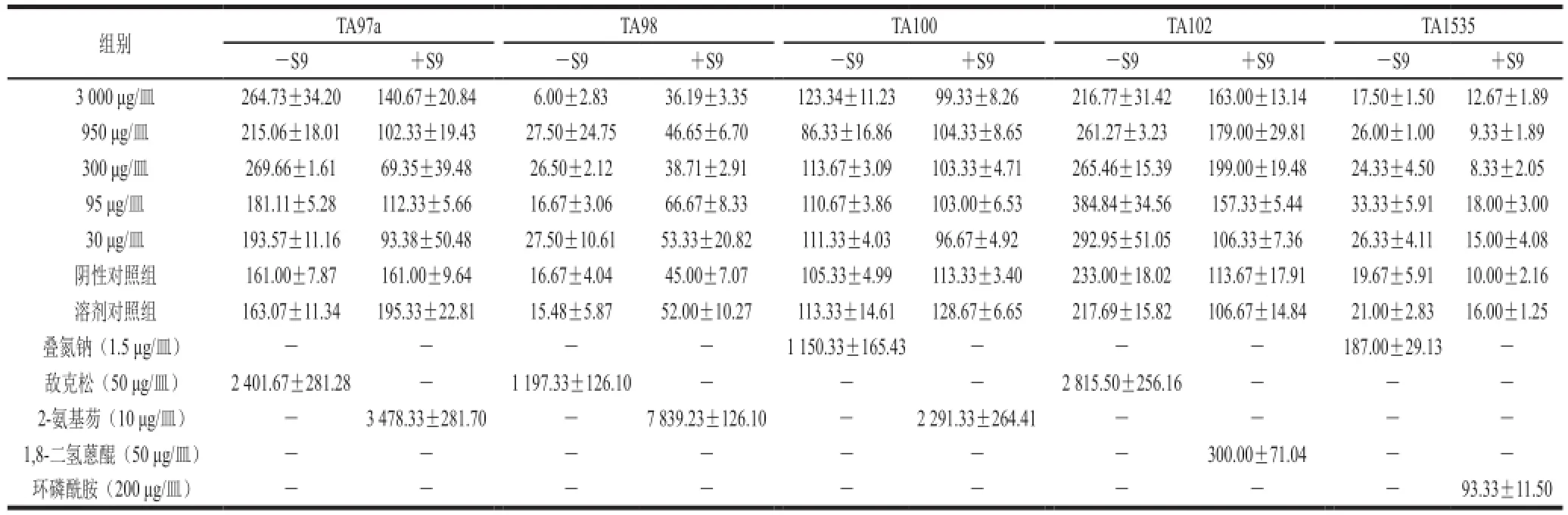
表4 Ames实验结果Table 4 Results of Ames tests
3 讨论
本实验以2015年5月1日开始实施的GB 15193.1—2014《食品安全性毒理学评价程序》[25]为标准,对螃蟹脚全粉开展了急性毒性和遗传毒性实验。在急性毒性实验中,实验结果显示螃蟹脚全粉的LD50大于最大耐受剂量10.25 g/kg,属于实际无毒(LD50>5 g/kg),符合食品安全的要求。在遗传毒性实验中,Ames实验、小鼠骨髓嗜多染红细胞微核实验均为阴性,表明在实验剂量下,未观察到螃蟹脚全粉有遗传毒性作用。在精原细胞染色体畸变实验中,24 h观察到高中剂量组染色体畸变率升高,但该现象是一过性的,在48 h高剂量组未观察到。与Ames实验、小鼠骨髓嗜多染红细胞微核实验相比,精原细胞染色体畸变实验存在一定随机误差,因此下一步将通过其他实验确认是否存在遗传毒性。
综上,螃蟹脚全粉无急性毒性;未观察到明确的遗传毒性,可以通过其他毒理实验方法进行论证。
[1] 倪婷婷, 李璐, 赵明, 等. 茶槲寄生“螃蟹脚”中黄酮醇及黄烷醇类化合物的分析[J]. 天然产物研究与开发, 2013, 25(4): 484-488. DOI:10.3969/j.issn.1001-6880.2013.04.012.
[2] 陈安发. 古茶树上的普洱伴侣-螃蟹脚[J]. 营养课堂, 2014(9): 17.
[3] 傅小冰. 生机盎然的澜沧古茶园[N]. 中国质量报, 2006-07-21.
[4] 陈红伟, 张俊, 王平盛, 等. 澜沧景迈古茶山考察与研究[J]. 茶业通报, 2003, 25(3): 105-106.
[5] 浩仁. 螃蟹脚: 百年古茶树上的传奇[J]. 茶健康天地, 2009(1): 40-43.
[6] 苏驰, 薛桥丽, 胡永金, 等. 云南古树茶上寄生的“螃蟹脚”提取物的体外抑菌效应研究[J]. 安徽农业科学, 2012, 40(13): 7919-7920. DOI:10.3969/j.issn.0517-6611.2012.13.111.
[7] YANG Yanjun, LIN Jiehong, XU Xiongwei. Isolation and structure identification of chemical constituents from Viscum liquidambaricolum[J]. Acta Pharmaceutica Sinica, 2005, 40(40): 351-354.
[8] 孙艳琳, 司民真, 刘仁明, 等. “螃蟹脚”的红外光谱分析[J]. 光谱实验室, 2012, 29(5): 2639-2642. DOI:10.3969/j.issn.1004-8138.2012.05.007.
[9] 杨燕军, 林洁红, 许雄伟. 枫香槲寄生化学成分的分离与结构鉴定[J].药学学报, 2005, 40(4): 351-354. DOI:10.3321/j.issn:0513-4870.2005.04.013.
[10] 杨燕军, 沙聪威, 安洁, 等. 枫香槲寄生抗肿瘤有效部位总皂苷的提取及含量测定研究[J]. 时珍国医国药, 2007, 18(12): 2970-2972. DOI:10.3969/j.issn.1008-0805.2007.12.049.
[11] 李超. 槲寄生和扁枝槲寄生化学成分与生物活性研究[D]. 济南: 山东大学, 2014: 1-85.
[12] 徐明远, 刘鑫, 林博涛. 槲寄生化学成分及药理作用的研究[J]. 黑龙江中医药, 2010(5): 51.
[13] 国家卫生和计划生育委员会. 食品安全国家标准 急性经口毒性试验: GB 15193.3—2014[S]. 北京: 中国标准出版社, 2014: 1-21.
[14] 高丽芳, 曹丽歌, 田蜜, 等. 元宝枫叶提取物的安全性毒理学研究[J]. 首都医科大学学报, 2014, 35(5): 644-652. DOI:10.3969/ j.issn.1006-7795.2014.05.025.
[15] 李建科. 食品毒理学[M]. 北京: 中国计量出版社, 2011: 133.
[16] 卢静, 关爽, 刘静波. 杜香熊果酸提取物的急性毒性和遗传毒性研究[J]. 食品科学, 2009, 30(13): 250-252. DOI:10.3321/ j.issn:1002-6630.2009.13.057.
[17] 国家卫生和计划生育委员会. 食品安全国家标准 哺乳动物红细胞微核试验: GB 15193.5—2014[S]. 北京: 中国标准出版社, 2014: 1-4.
[18] 吴雨龙, 华春, 扶庆权, 等. 芦蒿总黄酮提取物的急性毒性及遗传毒性[J]. 食品科学, 2014, 35(7): 206-210. DOI:10.7506/spkx1002-6630-201407041.
[19] 国家卫生和计划生育委员会. 食品安全国家标准 小鼠精原细胞或精母细胞染色体畸变试验: GB 15193.6—2014[S]. 北京: 中国标准出版社, 2014: 1-6.
[20] 王心如. 毒理学实验方法与技术[M]. 北京: 人民卫生出版社, 2006: 62.
[21] 国家卫生和计划生育委员会. 食品安全国家标准 细菌回复突变试验: GB 15193.4—2014[S]. 北京: 中国标准出版社, 2014: 1-15.
[22] 陈乃富, 谷仿丽, 陈乃东, 等. 蕨菜乙醇提取物的Ames试验研究[J]. 中国野生植物资源, 2013, 32(6): 7-9. DOI:10.3969/ j.issn.1006-9690.2013.06.003.
[23] 韩丽, 胡海, 刘平, 等. 艾烟中可吸入颗粒物致鼠伤寒沙门氏菌回复突变试验[J]. 中华中医药杂志, 2013, 28(6): 1860-1863.
[24] 李奇慧, 朱明学, 张黎明. 硫芥诱导小鼠染色体畸变和微核形成作用研究[J]. 第三军医大学学报, 2004, 26(19): 1701-1702. DOI:10.3321/j.issn:1000-5404.2004.19.001.
[25] 国家卫生和计划生育委员会. 食品安全国家标准 食品安全性毒理学评价程序: GB 15193.1—2014[S]. 北京: 中国标准出版社, 2014: 1-6.
Acute and Genetic Toxicity of Whole Powder of Viscum liquidambaricolum Hayata
HAO Binxiu, YING Jian, MENG Qingjia, WANG Liming, LIU Ting, LI Song, WANG Chunling*
(COFCO Nutrition and Health Research Institute, Beijing 102209, China)
The acute and genetic toxicity of whole powder of Viscum liquidambaricolum Hayata were evaluated using acute toxicity, bone marrow polychromatic erythrocyte micronucleus, mouse spermatogonium chromosome aberration and Ames tests as described in the Chinese national standard Toxicological Evaluation Procedure for Food Safety (GB 15193.1-2014). The oral acute toxicity test revealed that the medium lethal dose (LD50) of the powder was 10.25 g/kg for both male and female rats, which suggested that it was actually non-toxic. Both bone marrow polychromatic erythrocyte micronucleus and Ames tests gave negative results. Spermatogonium chromosome aberration tests at 10.25 and 5.12 g/kg doses revealed temporarily high aberration rate, which was not observed in the 2.57 g/kg group. Therefore, whole powder of Viscum liquidambaricolum Hayata showed neither acute nor genetic toxicity.
Viscum liquidambaricolum Hayata; acute toxicity; bone marrow polychromatic erythrocyte micronucleus test; spermatogonium chromosome aberration test; Ames test; whole powder
10.7506/spkx1002-6630-201621042
R114
A
1002-6630(2016)21-0248-04
郝彬秀, 应剑, 孟庆佳, 等. 螃蟹脚全粉的急性毒性和遗传毒性[J]. 食品科学, 2016, 37(21): 248-251. DOI:10.7506/ spkx1002-6630-201621042. http://www.spkx.net.cn
HAO Binxiu, YING Jian, MENG Qingjia, et al. Acute and genetic toxicity of whole powder of Viscum liquidambaricolum Hayata[J]. Food Science, 2016, 37(21): 248-251. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621042. http://www.spkx.net.cn
2015-12-23
北京市科技计划项目(161100000616012)
郝彬秀(1987—),女,工程师,硕士,研究方向为食品安全与功效。E-mail:haobx@cofco.com
*通信作者:王春玲(1972—),女,高级工程师,博士,研究方向为营养学。E-mail:wangchunling@cofco.com

