对称偶氮苯的合成及性质
严 超, 肖玉龙, 戴衡, 程晓红
(教育部自然资源药物化学重点实验室, 云南大学化学科学与工程学院, 昆明 650091)
对称偶氮苯的合成及性质
严 超, 肖玉龙, 戴衡, 程晓红
(教育部自然资源药物化学重点实验室, 云南大学化学科学与工程学院, 昆明 650091)
以Cu(Ⅰ)催化的氨基偶联反应为关键步骤, 合成了末端各带3条柔性烷基链的最简单小分子偶氮凝胶剂----对称偶氮苯化合物A; 通过1H NMR,13C NMR和元素分析鉴定了其结构; 采用紫外光谱和SEM等手段对其性质进行了表征. 凝胶实验结果表明, 该化合物能在极性、 非极性有机溶剂中形成凝胶, 且该凝胶在紫外光和可见光照射下能够发生凝胶-溶液的可逆转化. SEM表征结果表明, 该凝胶具有由纤维束聚集成的三维网状结构, 此外还具有热响应性和机械响应性. 紫外光谱测试结果表明, 该化合物具有光响应性.
偶氮苯; 光响应; 凝胶
偶氮苯及其衍生物是一类典型的光致异构化和光致变色分子, 其光学性能优良、 热稳定性好且制备方法简单[1], 已被广泛用于非线性光电材料[2]、 光学存储介质[3]、 化学传感器[4]、 液晶材料[5~7]、 光化学开关[8~12]、 生物荧光显影成像剂[13]、 分子机器[14]和纳米管[15,16]等领域. 作为一类新型的功能材料, 偶氮苯及其衍生物近年来已引起广泛关注[17]. 超分子凝胶是有机小分子凝胶剂(LMOGs)在氢键、 π-π堆积和范德华力等非共价键作用下, 在溶剂中自组装成为网络状结构的一类智能材料[18~23]. 迄今发现的LMOGs多为含酰胺基、 羟基等能形成氢键官能团的脲衍生物、 氨基酸衍生物和多糖衍生物, 含胆固醇基团的非氢键衍生物以及具有复合结构的有机化合物和多组分复合有机胶凝剂等[24]. 在凝胶剂中引入光活性基团如偶氮苯, 可通过光照改变偶氮苯的构型, 进而改变超分子的网络结构, 实现光控的凝胶-溶液的转变, 从而获得因环境变化(如温度、 pH、 光、 电场、 磁场和压力等)而产生响应性的智能型分子材料[25,26]. 但目前仅有少部分含偶氮的凝胶因子可通过光照的改变来实现凝胶-溶胶的转变[27~30], 凝胶-溶液的光响应时间从几分钟到几小时不等[31,32]; 偶氮衍生物在有机溶剂中最快的光响应时间有几秒[33,34], 几十秒[35~37], 最慢的响应时间长达几个小时[38~40]. 最值得注意的是, 偶氮基团总是被引入到其它凝胶剂结构中合成偶氮苯修饰的凝胶剂, 目前尚未见关于仅含偶氮苯基团的小分子作为凝胶剂的报道. 基于偶氮苯及偶氮苯凝胶因子的研究具有重大意义[41], 本文设计合成了末端各带3条柔性烷基链的对称偶氮苯小分子1,2-双[3,4,5-三(十二烷氧基)苯基]偶氮(A). 紫外光谱测试表明, 化合物A具有光响应特性, 而且能在多种有机溶剂中形成凝胶; SEM照片表明, 该凝胶具有三维超分子网络状纤维有序结构; 该凝胶还具有热、 光及机械响应性.
1 实验部分
1.1 试剂与仪器
所用试剂均为市售分析纯; 溶剂均以标准方法干燥并蒸馏后使用. Bruker 400型核磁共振波谱仪(瑞士Bruker公司); Vario EL Ⅲ型元素分析仪(德国Elementar公司); UV2401PC型紫外-可见分光光度计(日本岛津公司); JSM-6510A型扫描电子显微镜(日本电子公司); XRC-1型显微熔点测定仪(四川大学科学仪器厂).
1.2 实验过程
1.2.1 1,2,3-三-十二烷氧基苯(2)的合成及表征 在100 mL圆底烧瓶中加入1,2,3-苯三醇(600 mg, 4.76 mmol)、 溴代十二烷(4.0 g, 16.10 mmol)、 K2CO3(1.2 g, 8.69 mmol)及20 mL N,N-二甲基甲酰胺(DMF), 于83 ℃回流24 h. 冷却后, 用乙酸乙酯萃取(20 mL×3), 真空蒸除溶剂后, 残余物经柱层析[V(石油醚)∶V(乙酸乙酯)=40∶1]分离提纯, 得到2.76 g浅黄色固体中间体2, 产率92.0%.1H NMR(CDCl3, 400 MHz), δ: 7.38(t, 1H, J=8.8 Hz, ArH), 7.21(d, 2H, J=8.6 Hz, ArH), 4.06(t, 6H, J=6.5 Hz, OCH2), 1.78~1.31(m, 60H, CH2), 0.88(t, 9H, J=6.3 Hz, CH3).
1.2.2 1,2,3-三-十二烷氧基-5-硝基苯(3)的合成及表征 在100 mL圆底烧瓶中, 将中间体2(700 mg, 1.11 mmol)和NaNO2(75 mg, 1.09 mmol)溶于10 mL二氯甲烷中, 逐滴加入5 mL浓HNO3, 溶液逐渐由浅黄色变成棕色, 室温下反应5 h后, 加入50 mL水终止反应. 用二氯甲烷萃取(20 mL×3), 真空蒸除溶剂后, 得棕色胶状液体残余物, 用无水甲醇重结晶, 过滤, 得到600 mg化合物3, 产率80.1%, 淡黄色固体, m. p. 48~50 ℃;1H NMR(CDCl3, 400 MHz), δ: 7.39(s, 2H, ArH), 4.06(t, 6H, J=6.5 Hz, OCH2), 1.8~1.28(m, 60H, CH2), 0.88(t, 9H, J=6.3 Hz, CH3);13C NMR(CDCl3, 75 MHz), δ: 152.8(2C), 143.9(1C), 143.2(1C), 102.2(2C), 73.9(1C), 69.5(2C), 32.0(3C), 30.5(1C), 29.5(19C), 26.1(4C), 22.8(3C), 14.3(3C); 元素分析(%, C42H77NO5理论值): C 74.66(74.62), H 11.41(11.48), N 2.07(2.07).
1.2.3 3,4,5-三-十二烷氧基苯胺(4)的合成及表征 在100 mL圆底烧瓶中加入中间体3(600 mg, 0.96 mmol), 用10 mL四氢呋喃(THF)溶解, 加入催化量的Pd/C, 通氢气, 搅拌12 h. 用二氯甲烷萃取(20 mL×3), 真空蒸除溶剂后, 残余物经柱层析[V(石油醚)∶V(乙酸乙酯)=40∶1]分离, 得到450 mg化合物4, 产率78.5%, 淡黄色固体, m. p. 71~72 ℃;1H NMR(CDCl3, 400 MHz), δ: 7.25(s, 2H, NH2), 5.90(s, 2H, ArH), 4.06(t, 6H, J=6.5 Hz, OCH2), 1.78~1.26(m, 60H, CH2), 0.88(t, 9H, J=6.3 Hz, CH3);13C NMR(CDCl3, 75 MHz), δ: 154.8(1C), 144.5(2C), 131.2(1C), 94.1(2C), 60.9(1C), 56.5(2C), 31.9(3C), 30.2(1C), 29.2(19C), 25.9(4C), 22.5(3C), 14.1(3C); 元素分析(%, C42H79NO3理论值): C 78.01(78.08), H 12.35(12.32), N 2.19(2.17).
1.2.4 1,2-双[3,4,5-(三-十二烷氧基)苯基]偶氮(A)的合成及表征 在100 mL圆底烧瓶中加入中间体4(200 mg, 0.32 mmol)、 2 mL吡啶、 8 mL甲苯和催化量的CuBr, 于60 ℃回流12 h. 冷却后, 用二氯甲烷萃取(20 mL×3), 真空蒸除溶剂后, 残余物经柱层析[V(石油醚)∶V(乙酸乙酯)=40∶1]分离, 得到170 mg化合物A, 产率85.3%, 黄色固体, m. p. 63~64 ℃;1H NMR(CDCl3, 400 MHz), δ: 7.16(s, 4H, ArH), 4.06(t, 12H, J=6.5 Hz, OCH2), 1.88~1.47(m, 120H, CH2), 0.88(t, 18H, J=6.3 Hz, CH3);13C NMR(CDCl3, 75 MHz), δ: 153.5(4C), 148.3(2C), 140.6(2C), 101.4(4C), 73.7(2C), 69.2(4C), 32.1(6C), 30.5(2C), 29.6(42C), 26.3(8C), 22.8(6C), 14.1(6C); 元素分析(%, C84H154N2O6理论值): C 78.38(78.32), H 11.98(12.05), N 2.17(2.17).
2 结果与讨论
2.1 化合物A的合成
目标化合物A的合成路线如 Scheme 1所示; 其结构经1H NMR,13C NMR及元素分析确证.
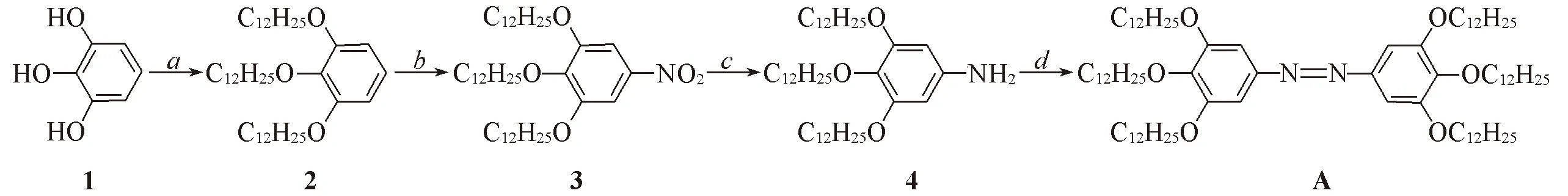
Scheme 1 Synthetic route of compound Aa. n-C12H25Br, K2CO3, DMF, reflux 24 h, 83 ℃(yield 92%); b. NaNO2, H2NO3, THF, H2O, 20 ℃, 5 h, (yield 80%); c. H2, Pd/C, THF, 20 ℃, 12h(yield 78%); d. CuBr, pyridine, toluene, 60 ℃, 12 h(yield 86%).
2.2 化合物A的凝胶性质
如表1所示, 对称偶氮苯化合物A能够在1,4-二氧六环、 正丁醇、 丙酮、 吡啶及体积比为1∶1的甲醇/二氯甲烷混合溶液中形成凝胶(溶液浓度为4.8 mg/mL); 在甲苯和环己酮中具有良好的溶解性; 在乙酸乙酯、 正己烷、 环己烷等有机溶剂中, 化合物A加热均能溶解, 冷却后有大量沉淀析出; 而在DMF和二甲基亚砜(DMSO)中几乎不溶解.
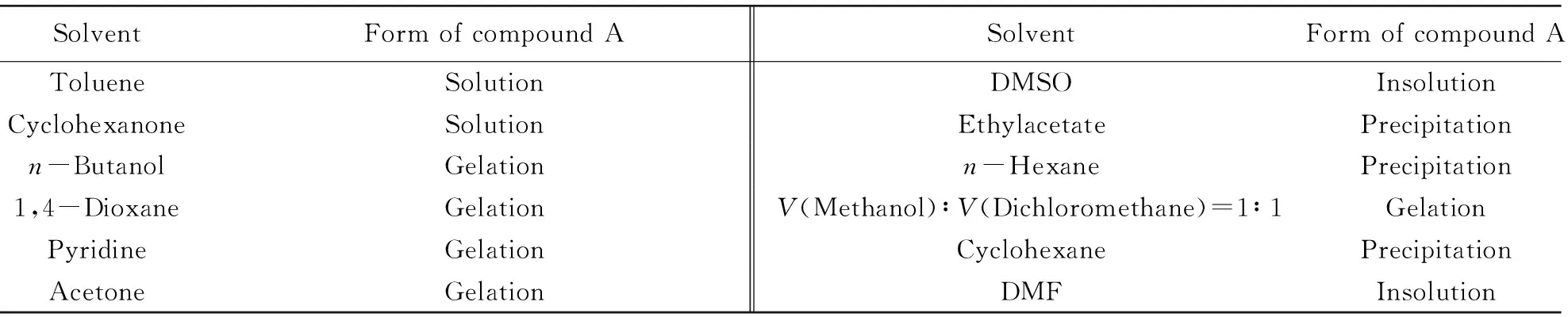
Table 1 Gels prepared with compound A in different solvents*
* c(Gelator)=4.8 mg/mL.

Fig.1 Photographs of gels prepared with compound A in n-butanol
由图1可见, 化合物A形成的凝胶具有较好的热、 光及机械多重响应性. 将化合物A溶于正丁醇中, 加热到45 ℃形成热的溶液后, 迅速冷却至室温, 可得到黄色凝胶; 将形成的凝胶加热到40 ℃, 或通过振荡可使凝胶转变为溶液; 使用强度为10 mW/cm2的紫外灯对凝胶进行100 s照射后, 可观察到凝胶到溶液的转变. 冷却、 静止或移除紫外灯可恢复凝胶态.
由SEM照片(图2)可见, 化合物A分子聚集形成的凝胶具有由相互缠绕的纤维束聚集而成的三维网状结构, 在正丁醇中形成的凝胶纤维的直径为210~807 nm, 长度>16 μm; 在1,4-二氧六环中形成的凝胶纤维的直径为178~758 nm, 长度>20 μm. 可确认化合物A在有机溶剂中形成的凝胶为有序三维网络结构.

Fig.2 SEM images of xerogel formed by compound A in n-butanol(A) and in 1,4-dioxane(B)
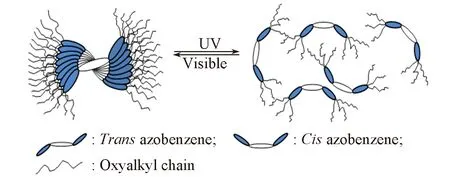
Fig.3 Photoinduced reversible gel-sol transitions in n-butanol gel of compound A
2.3 化合物A的光响应性能
光响应凝胶的最大特点是响应过程具有可逆性. 偶氮苯及其衍生物是一类典型的光致异构分子, 偶氮苯可在光照下发生可逆的顺-反异构, 进而引起分子极性的改变, 改变分子间的范德华力, 从而使凝胶表现出溶胀-收缩, 导致凝胶网络的塌陷、 重组以及凝胶-溶液的可逆转变. 如图3所示, 反式偶氮苯在吸收紫外光后变成顺式偶氮苯, 顺式偶氮苯在可见光的照射下又回到反式结构. 凝胶实验结果表明, 化合物A具有较好的光响应性(图1), 这种光响应性与分子结构中偶氮苯基团发生顺-反异构密切相关[42].
为了进一步研究该化合物的光响应, 测试了其在溶液中的紫外光谱(图4). 将化合物A溶于二氯甲烷中, 先后以365 nm紫外灯和可见光照射, 测定不同时间的吸收光谱. 结果表明, 随着紫外光的照射, 376 nm附近的π-π*吸收减弱, 而450 nm附近的n-π*吸收增强, 这是因为随着紫外光的照射, 分子从反式向顺式异构化, 顺式异构体的π-π*跃迁减弱, 而n-π*跃迁增强. 将化合物A从紫外光下移至可见光下照射时, 371 nm附近的吸收增强, 而450 nm附近的吸收减弱, 这是因为随着可见光的照射, 分子从顺式向反式异构化, 顺式异构体的π-π*跃迁增强, 而n-π*跃迁减弱, 表明该偶氮化合物具有明显的光敏特性和光致异构特性. 化合物A完成顺-反转变的时间约为10 min.
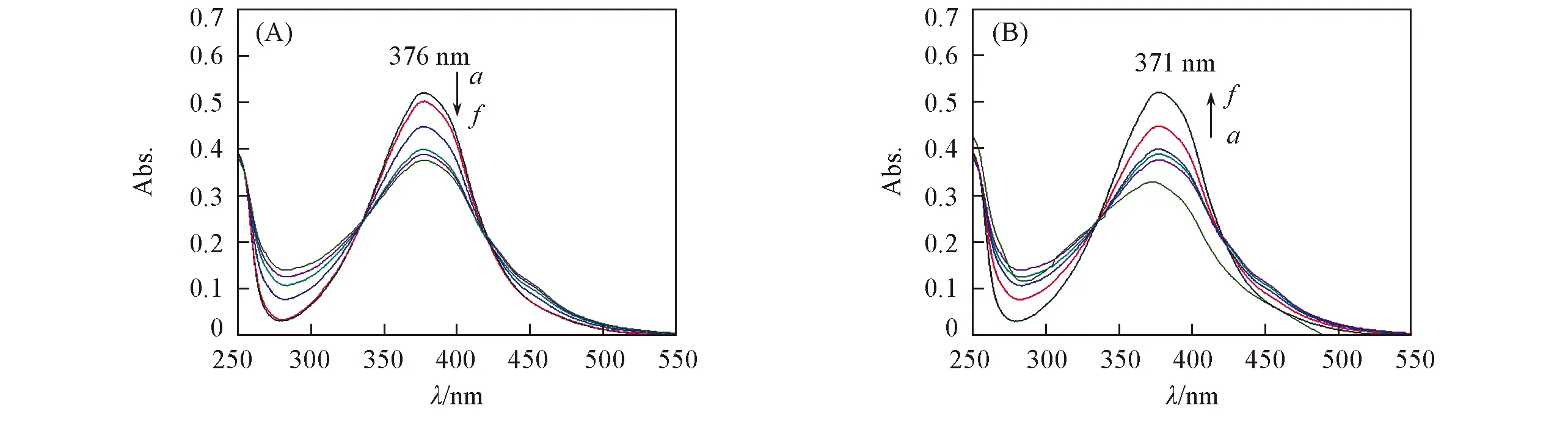
Fig.4 UV-Vis spectra of compound A in CH2Cl2 under irradiation of UV-light(A) and visible light(B)Time/s: a—f. 5, 15, 60, 120, 300, 600.
综上所述, 本文报道了对称偶氮苯衍生物A的合成、 凝胶性能及光学响应性能. 化合物A能在多种溶剂中形成凝胶, 该凝胶具有三维网络结构, 并对光、 热及机械力具有凝胶-溶液的可逆响应性, 紫外光谱结果也表明化合物A具有顺-反可逆光响应特性. 化合物A在溶液中的光响应时间为10 min, 化合物A凝胶的凝胶-溶液的光响应时间为2~3 min. 与报道的偶氮苯凝胶剂相比, 化合物A结构中不含酰胺基、 羟基、 胆甾基团和离子盐等凝胶剂基团, 但其仍然能在有机溶剂中形成凝胶, 与常规凝胶剂的结构特点显著不同. 化合物A为目前报道的结构最简单的偶氮苯凝胶剂, 且制备方便, 为偶氮凝胶剂的制备开辟了更广阔的途径和方法.
[1] Wang G. B., Hou L. S., Gan F. X., Chin. J. Lasers, 2000, 9(27), 12—15(王光斌, 侯立松, 干福熹. 中国激光, 2000, 9(27), 12—15)
[2] Natansohn A., Rochon P., Chem. Rev., 2002, 102(35), 4139—4145
[3] Lee K. M., Wang H. D., Koerner H., Vaia A. R., Tan L.S., White J. T., Angew. Chem. Int. Ed., 2012, 51(17), 4117—4121
[4] Deloncle R., Caminade A. M., J. Photochem Photobiol C: Photochem Rev., 2010, 11(1), 25—45
[5] Bandara H., Burdette C. S., Chem. Soc. Rev., 2012, 41(5), 1809—1825
[6] Ikeda T., Tsutsumi O., Science, 1995, 268(35), 1873—1880
[7] Tamaoki N., Adv. Mater., 2001, 13(15), 1135—1143
[8] Feringa B. L., Dra V., Koumura N., Geertsema E. M., Chem. Rev., 2000, 100(5), 1789—1816
[9] Wegner A. H., Angew. Chem. Int. Ed., 2012, 51(20), 4787—4788
[10] Beharry A. A., Woolley G. A., Chem. Soc. Rev., 2011, 40(8), 4422—4430
[11] Hoppmann C., Seedorff S., Richter A., Fabian H., Schmieder P., Angew. Chem. Int. Ed., 2009, 48(36), 6636—6645
[12] Gorostizal P., Isacoff E. Y., Science, 2008, 322(5900), 395—399
[13] Beharry A. A., Wong L., Tropepe V., Woolley G. A., Angew. Chem. Int. Ed., 2011, 50(6), 1325—1332
[14] Murakami H., Kawabuchi A., Kotoo K., Kutinake M., Naka-shima N., J. Am. Chem. Soc., 1997, 119(32), 7605—7613
[15] Banerjee I. A., Yu L., Matsui H., J. Am. Chem. Soc., 2003, 125(21), 6532—6546
[16] Yi Z. S., Jiann T. L., Yu T. T., Chung W. K., Su C. L., Shi S. S., Chem. Mater., 2002, 14(4), 357—361
[17] Cheng N., Chin. J. Lasers, 1996, 23(5), 398—402(程宁. 中国激光, 1996, 23(5), 398—402)
[18] Xu F. M., Wang H. B., Zhao J., Liu X. S., Li D. D., Chen J. C., Ji J., Macromolecules, 2013, 46(11), 4235—4246
[19] Dobashi T., Nobe M., Yosihara H., Langmuir, 2004, 20(16), 6530—6534
[20] Sangeethe N. M., Maitra U., Chem. Soc. Rev., 2005, 34(10), 821—836
[21] Lee K. Y., Mooney D. J., Chem. Rev., 2001, 101(7), 1869—1879
[22] Miyataa T., Uragamia T., Nakamaeb K., Advanced Drug Delivery Reviews, 2002, 54(1), 79—98
[23] Eva B., Bernhard V. K. J. S., Christopher B. K., Milagros P., Luis O., Macromolecules, 2014, 47(11), 3693—3700
[24] Terech P., Weiss R. G., Chem. Rev., 1997, 97(8), 3133—3160
[25] Blair H. S., Mcardle C. B., Polymer, 1984, 25(9), 1347—1352
[26] Ji B., Ma Y. Z., Feng X. Z., Chinese Journal of Liquid Crystals and Displays, 2008, 23(6), 699—706(冀彬, 马永正, 冯喜增. 液晶与显示, 2008, 23(6), 699—706)
[27] Murata K., Aoki M., Suzuki T., Harada T., Kawabata H., Komori T., Ohseto F., Ueda K., Shinkai S., J. Am. Chem. Soc., 1994, 116(15), 6664—6676
[28] Ono Y., Nakashima K., Sano M., Hojo J., Shinkai S., J. Mater. Chem., 2001, 11(13), 2412—2419
[29] Ono Y., Nakashima K., Sano M., Kanekiyo Y., Inoue K., Hojo J., Shinkai S., Chem. Commun., 1998, (14), 1477—1478
[30] Kawabata H., Murata K., Harada T., Shinkai S., Langmuir, 1995, 11(2), 623—626
[31] Wu Y. P., Wu S., Tian X. J., Wang X., Wu W. X., Zou G., Zhang Q. J., Soft Matter, 2011, 7(2), 716—721
[32] Fan D. L., Zhai Y., Huang Y. D., Chem. J. Chinese Universities, 2014, 35(11), 2447—2454(樊冬丽, 翟岩, 黄耀东. 高等学校化学学报, 2014, 35(11), 2447—2454)
[33] Rahman M. L., Yuso M. M., Kumar S., RSC Adv., 2014, 4(66), 35089—35098
[34] Adrianne M., Kelly M., Eric M.N., Biomacromolecules, 2015, 16(9), 798—806
[35] Xu L., Zhang W. Y., Cai H. B., Liu F., Wang Y., Gao Y., Zhang W. A., J. Mater. Chem. B, 2015, 3(37), 7417—7426
[36] Xie Z., He H. F., Deng Y. H., Wang X. G., Liu C.Y., J. Mater. Chem. C, 2013, 1(9), 1791—1797
[37] Green L., Li Y. N., White T.,Augustine U., Timothy B., Li Q., Org. Biomol. Chem., 2009, 7(19), 3930—3933
[38] Shrivastava S., Matsuoka H., Langmuir, 2014, 30(14), 3957—3966
[39] Chen D., Liu H., Kobayashi T., Hai F. Y., J. Mater. Chem., 2010, 20(18), 3610—3614
[40] Wang X. T., Li Z. H., Yang Y. K., Gong X. H., Liao Y. G., Xie X. L., Langmuir, 2015, 31(19), 5456—5463
[41] Yagai S., Karatsu T., Kitamura A., Chem. Eur. J., 2005, 11(14), 4054—4063
[42] Chen L., Li S.G., Zhao Y. P., J. Appl. Polym. Sci., 2005, 96(6), 2163—2167(陈莉, 李世庚, 赵轶平. 通信和信息技术, 2005, 96(6), 2163—2167)
(Ed.: P, H, F, K)
Synthesis and Properties of Symmetric Azobenzene Derivative†
YAN Chao, XIAO Yulong, DAI Heng, CHENG Xiaohong*
(Key Laboratory of Medicinal Chemistry for Natural Resource, Ministry of Education, School of Chemical Science and Technology, Yunnan University, Kunming 650091, China)
A new symmetric azobenzene compound(A) with triple alkoxy chain in each terminal was synthesized via Cu(Ⅰ)-catalyzed amino coupling reaction as the key step. The structure of this compound was identified with1H NMR,13C NMR and elemental analysis. The property of compound A was investigated by UV-Vis spectroscopy and scanning electron microscopy(SEM). The results showed that compound A can form organolgels with different organic solvents, and the sol-gel transition could be observed under UV and visible light irradiation. The SEM images of xerogels of compound A showed the formation of three-dimensional networks composed of entangled fibrous aggregates. The gels were heating-, light- and mechan- responsive. The UV-Vis spectroscopy confirmed the photoresponsible behavior of compound A.
Azobenzene; Photoresponsible behavior; Gel
10.7503/cjcu20150839
2015-11-02.
日期: 2016-02-03.
国家自然科学基金(批准号: 21274119, 21364017)、 云南省应用基础研究计划重点项目(批准号: 2013FA007)和云南省教育厅科学研究基金重大专项项目(批准号: ZD2015001)资助.
O625.65
A
联系人简介: 程晓红, 女, 博士, 教授, 博士生导师, 主要从事超分子化学研究. E-mail: xhcheng@ynu.edu.cn
† Supported by the National Natural Science Foundation of China(Nos. 21274119, 21364017), the Yunnan Natural Science Foundation Key Project, China(No.2013FA007) and the Yunnan Education Department Foundation Key Project, China(No.ZD2015001).

