CDK14对人食管癌细胞增殖的影响及其可能机制研究
钱 佶 王燏婵 张学俭
江苏大学附属宜兴医院消化内科1(214200) 南通大学免疫学与微生物学教研室2
·论 著·
CDK14对人食管癌细胞增殖的影响及其可能机制研究
钱 佶1*王燏婵2张学俭1#
江苏大学附属宜兴医院消化内科1(214200) 南通大学免疫学与微生物学教研室2
背景:CDK14是一种新发现的细胞周期蛋白依赖性激酶,在多种恶性肿瘤中表达增高,并与肿瘤恶性行为相关。目的:探讨CDK14对人食管癌细胞增殖的影响及其可能机制。方法:采用蛋白质印迹法和免疫组化法检测8例新鲜食管鳞癌组织、96例食管鳞癌石蜡包埋组织和人食管癌细胞株Eca-109中的CDK14和细胞增殖标记物PCNA、Ki-67表达,分析CDK14表达与食管癌临床病理特征和患者预后的关系。以血清饥饿释放试验分析CDK14表达与Eca-109细胞细胞周期的关系。以shRNA干扰Eca-109细胞中的CDK14表达,观察抑癌蛋白Rb磷酸化水平、细胞周期进程和细胞增殖能力的变化。结果:CDK14在食管癌组织和细胞中呈高表达,与PCNA、Ki-67的表达趋势相一致,其表达与食管癌的大小、组织学分级、浸润和转移显著相关(P<0.05),高表达者总体生存率显著低于低表达者(P<0.05)。血清饥饿释放试验显示CDK14的表达具有细胞周期依赖性。干扰CDK14可抑制Eca-109细胞Rb蛋白磷酸化,细胞发生G1期阻滞,克隆形成数显著减少(P均<0.05)。结论:CDK14在食管癌中呈高表达,其可能通过促进下游Rb蛋白磷酸化推动细胞周期进程,从而促进肿瘤细胞增殖,参与食管癌的发生、发展。
细胞周期蛋白依赖性激酶14; 食管肿瘤; 成视网膜细胞瘤蛋白; 细胞周期; 细胞增殖
Cell Proliferation
食管癌是全球范围内最常见的八大恶性肿瘤之一,我国为食管癌高发国,也是该病死亡率最高的国家[1-2]。食管癌恶性程度高,病程进展迅速,易复发和转移,患者预后较差。因此,开发和寻找新的治疗食管癌的方法和分子靶点成为当前重要课题。细胞周期蛋白依赖性激酶14(cyclin-dependent kinase 14, CDK14)又名PFTK1(PFTAIRE protein kinase 1),研究发现其在肝细胞癌、乳腺癌、食管癌、胃癌等多种恶性肿瘤中表达增高,并与肿瘤恶性行为相关[3-4]。对食管鳞癌患者的研究[5]显示,癌组织中CDK14高表达与化疗耐药和预后不良有密切联系。本研究在此基础上探讨CDK14对人食管癌细胞增殖的影响及其可能机制,以期进一步阐明CDK14在食管癌发生、发展中的意义。
材料与方法
一、标本来源
用于免疫组化染色的96例食管鳞癌石蜡包埋组织及其配对癌旁组织切片源自江苏大学附属宜兴医院2004—2008年病理诊断明确的手术切除食管鳞癌标本。来源病例男性27例,女性69例,年龄39~78岁,平均62岁,术前均未接受放化疗或其他抗肿瘤治疗,临床和病理资料完整,通过电话随访获取患者预后信息。
另收集8例术前未接受放化疗或其他抗肿瘤治疗的食管鳞癌患者的新鲜手术切除标本,取癌组织及其配对癌旁组织(距癌组织边缘2 cm),迅速液氮保存,用于蛋白质印迹法检测。
二、细胞株和主要试剂
人食管癌细胞株Eca-109、TE-1购自中国科学院细胞库上海保藏中心。鼠抗人CDK14单克隆抗体(PFTAIRE-1抗体C-3)、兔抗人cyclin E多克隆抗体(M-20)(Santa Cruz Biotechnology),鼠抗人增殖细胞核抗原(PCNA)单克隆抗体(Abcam plc.),鼠抗人Ki-67单克隆抗体(BD Biosciences),Rb相关抗体试剂盒(Cell Signaling Technology, Inc.),PI(江苏晶美生物科技有限公司)。靶向干扰CDK14的shRNA(sh-CDK14)由上海吉凯基因化学技术有限公司设计、合成,sh-CDK14#1序列:5’-GTT CAT TCT TTA CCA CAT T-3’,sh-CDK14#2序列:5’-AGG TTG CAT CTT TGT TGA A-3’,sh-CDK14#3序列:5’-AAA GAG TCA CCT AAA GTT A-3’,sh-CDK14#4序列:5’-ACC CAT ACA GGA AAT CCA A-3’;Super-Fect转染试剂(QIAGEN)。
三、方法
1.细胞培养:Eca-109细胞培养使用含10% FBS(56 ℃水浴30 min灭活补体)、2 mmol/L L-谷氨酰胺、100 U/mL青霉素、100 μg/mL链霉素的RPMI1640培养基,于37 ℃、5%CO2、饱和湿度培养箱内常规培养传代,收集对数生长期细胞进行实验。
2. 蛋白质印迹法:取食管癌组织及其配对癌旁组织各100 mg,加入1 mL RIPA裂解液,匀浆后离心15 min,取上清,BCA法测定蛋白浓度。取等量蛋白进行SDS-PAGE电泳,电湿转法将凝胶上的蛋白转移至PVDF膜,含5%脱脂奶粉的TBST室温封闭2 h,加入一抗(CDK14 1∶500, PCNA 1∶1 000,GAPDH 1∶3 000),室温孵育6~8 h或4 ℃过夜,加入HRP偶联的二抗(1∶1 000),室温孵育2 h,ECL显影。目的蛋白相对表达量以该蛋白条带灰度值与内参条带灰度值的比值表示。
收集经前期处理的不同人食管癌细胞株,加入适量细胞裂解液提取总蛋白,其余操作步骤与上述相同,一抗工作浓度分别为:CDK14 1∶500,β-actin 1∶1 000,GAPDH 1∶3 000, cyclin E 1∶500,Rb 1∶2 000,磷酸化Rb(p-Rb) 1∶1 000。
3.免疫组化染色:食管癌组织及其配对癌旁组织切片脱蜡、水化,0.01 mol/L柠檬酸盐缓冲液(pH 6.0)高温高压抗原修复,3%H2O2孵育10 min去除内源性过氧化物酶,加入CDK14抗体或Ki-67抗体,室温孵育1~3 h或4 ℃过夜,加入二抗试剂A 37 ℃孵育20 min、二抗试剂B 37 ℃孵育30 min,DAB显色,苏木精复染,脱水、透明,封片。
结果判断:根据染色强度和阳性细胞百分率综合判断免疫组化评分。染色强度:0分,无染色;1分,浅棕色;2分,棕色;3分,深棕色。阳性细胞百分率:0分,<25%;1分,25%~50%;2分,50%~75%;3分,≥75%。总分为两项评分的乘积(0~9分):<5分为低表达,≥5分为高表达。
4. 血清饥饿释放试验:对数生长期Eca-109细胞以完全培养基配制成5×104/mL,接种于培养瓶,培养24 h后,以无血清培养基饥饿细胞72 h使细胞周期同步化,更换新鲜完全培养基,分别继续培养0、3、6、9、12、24 h,收集细胞进行检测。
5. 流式细胞分析:收集经前期处理的Eca-109细胞,将单细胞悬液加入2 mL圆底离心管中,离心洗涤3次,加入2 mL预冷70%乙醇,4 ℃固定30 min,离心,PBS洗涤1次,加入RNA酶A,37 ℃孵育30 min,加入PI,室温避光孵育30 min,过300目筛网,上流式细胞仪分析细胞周期。
6. 细胞转染:对数生长期Eca-109细胞以不含青-链霉素的完全培养基配制成1×106/mL,在6 cm培养皿内以4 mL培养基铺板。24 h后以500 mL无血清培养基稀释分别携带sh-CDK14#1、#2、#3、#4的质 粒和携带非特异性序列的对照质粒各2 g;以500 mL 无血清培养基稀释4 mL SuperFect转染试剂,室温保温5 min;将稀释的质粒与稀释的转染试剂混合,轻混匀,室温孵育15 min以形成RNA-脂质体复合物,将复合物加入细胞中,6 h后换液,36~48 h后收集细胞进行检测。
7. 克隆形成实验:收集各组对数生长期Eca-109细胞,0.25%胰蛋白酶消化、吹打成单个细胞,悬浮于含10% FBS的培养基中备用。细胞悬液作梯度倍数稀释,分别以50、100、200个/皿的梯度密度接种于含10 mL 37 ℃预温培养基的培养皿中,轻轻转动使细胞分散均匀,37 ℃、5% CO2、饱和湿度培养箱内培养2~3周,定期观察,培养皿中出现肉眼可见克隆时终止培养,弃上清,PBS小心浸洗2次,4%多聚甲醛固定细胞15 min,去固定液,加入适量Gimsa染液染色10~30 min,流水缓慢洗去染色液,空气中干燥。将平皿倒置并叠加一张带网格的透明胶片,肉眼直接计数克隆数。
四、统计学分析
结 果
一、CDK14在食管癌组织和细胞中呈高表达
蛋白质印迹法检测显示,CDK14在食管癌组织中的表达显著高于配对癌旁组织(P<0.05),与细胞增殖标记物PCNA表达趋势相一致(图1A、1B);CDK14在人食管癌细胞株Eca-109和TE-1中亦呈阳性表达(图1C、1D)。上述结果表明CDK14可能通过促进肿瘤细胞增殖参与食管癌的发生、发展。
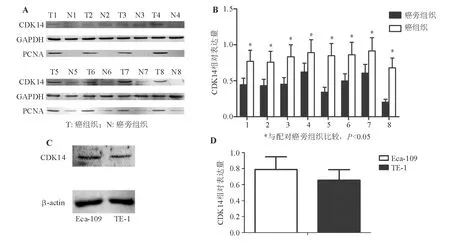
图1 CDK14在食管癌组织和细胞中呈高表达
二、食管癌组织中CDK14表达与肿瘤临床病理特征和患者预后的关系
免疫组化染色显示,CDK14在食管癌组织中的表达定位于细胞质和细胞核(图2)。统计学分析显示其表达与细胞增殖标记物Ki-67表达呈正相关,并与肿瘤大小、组织学分级、肿瘤浸润和转移(包括淋巴结转移和远处转移)以及患者预后显著相关(P<0.05),与患者性别、年龄无明显相关性(P>0.05)(表1)。生存分析显示,CDK14高表达者总体生存率显著低于低表达者(P<0.05)(图3)。上述结果表明CDK14高表达可能与食管癌恶性程度高和预后不良有关。
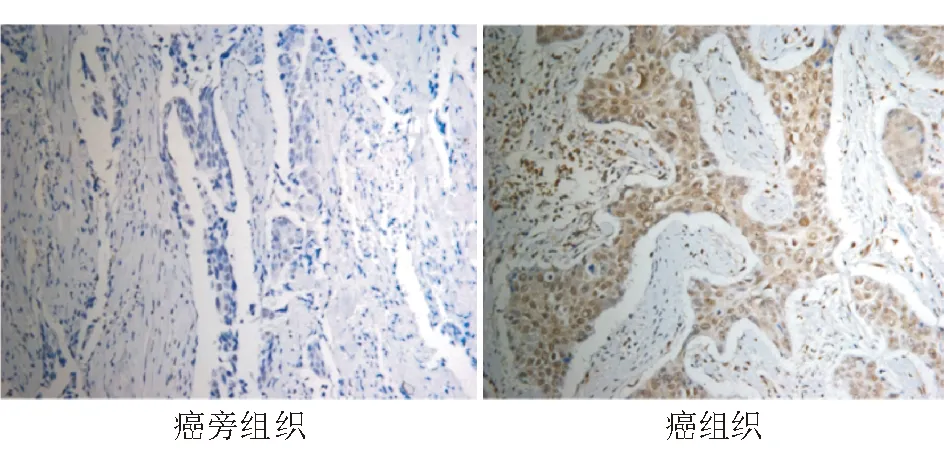
图2 CDK14在食管癌组织及其配对癌旁组织中的表达(免疫组化染色,×20)
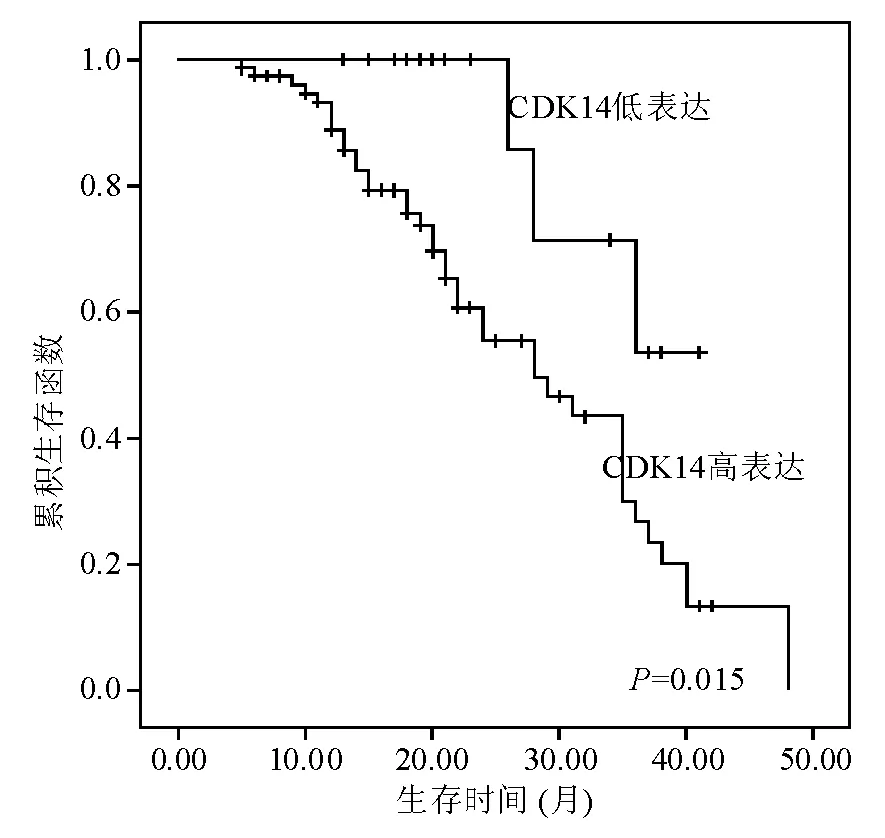
图3 CDK14表达与食管癌患者预后的关系(Kaplan-Meier生存曲线)
三、血清饥饿释放试验中Eca-109细胞CDK14表达情况
流式细胞分析显示,Eca-109细胞经无血清培养基饥饿72 h使细胞周期同步化后,73.98%的细胞停滞于G1期(0 h),而血清释放(即更换新鲜完全培养基继续培养)可推进细胞周期进程,随着时间的推移,细胞逐渐由G1期向S期(6~9 h)、G2期(12 h)转换,提示细胞处于增殖状态(图4A)。蛋白质印迹法检测显示,经血清饥饿72 h的Eca-109细胞CDK14表达水平较低,血清释放后其表达逐渐升高,于9 h时(G1/S期)达峰值,而后逐渐下降,与cyclin E的表达趋势相一致(图4B、4C)。上述发现表明,CDK14主要表达于G1/S期,其表达具有细胞周期依赖性,食管癌中CDK14高表达可能通过影响肿瘤细胞周期进程发挥作用。
表1 96例食管癌组织中CDK14表达与肿瘤临床病理特征 的关系n(%)
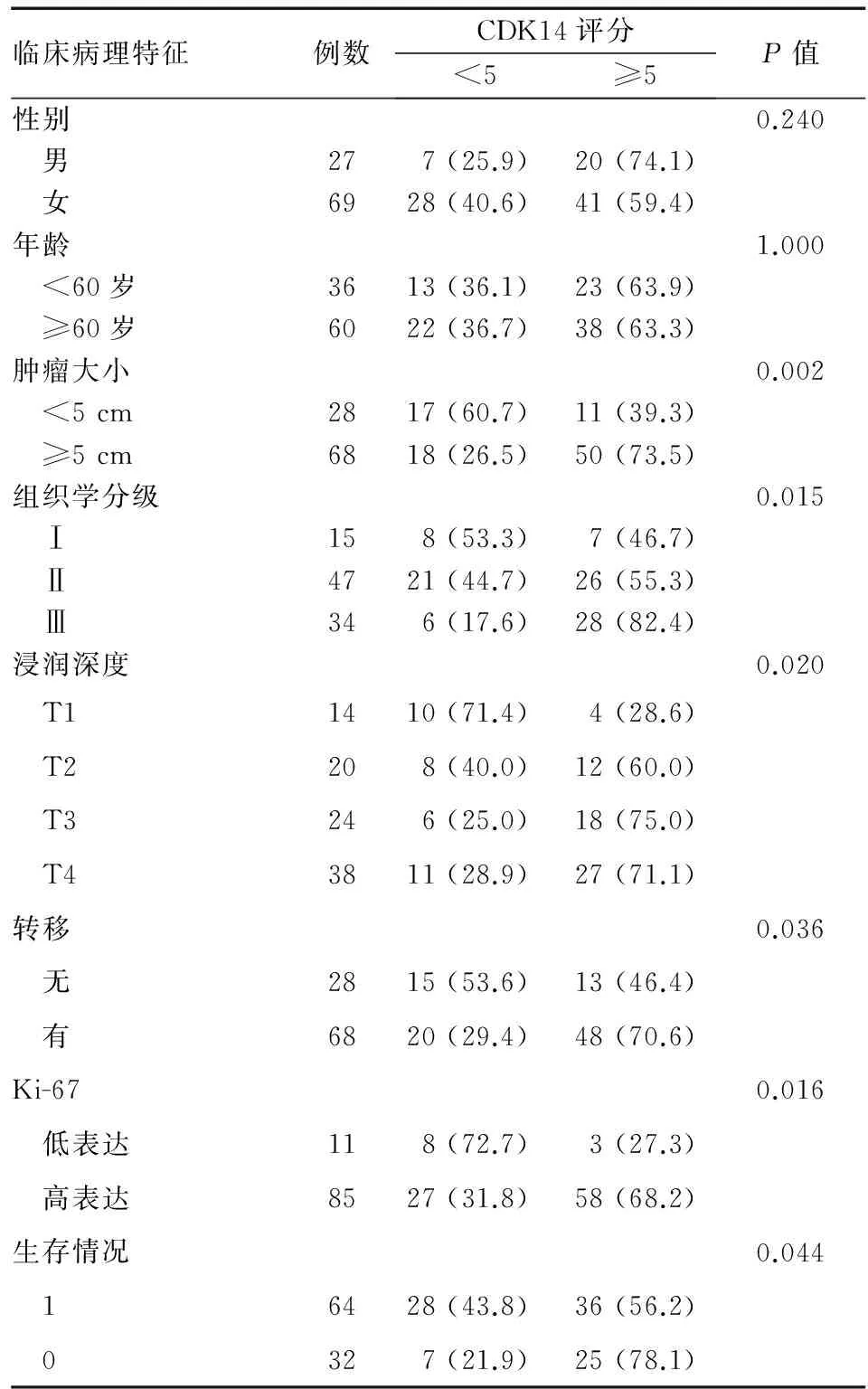
临床病理特征例数CDK14评分<5≥5P值性别0.240 男277(25.9)20(74.1) 女6928(40.6)41(59.4)年龄1.000 <60岁3613(36.1)23(63.9) ≥60岁6022(36.7)38(63.3)肿瘤大小0.002 <5cm2817(60.7)11(39.3) ≥5cm6818(26.5)50(73.5)组织学分级0.015 Ⅰ158(53.3)7(46.7) Ⅱ4721(44.7)26(55.3) Ⅲ346(17.6)28(82.4)浸润深度0.020 T11410(71.4)4(28.6) T2208(40.0)12(60.0) T3246(25.0)18(75.0) T43811(28.9)27(71.1)转移0.036 无2815(53.6)13(46.4) 有6820(29.4)48(70.6)Ki-670.016 低表达118(72.7)3(27.3) 高表达8527(31.8)58(68.2)生存情况0.044 16428(43.8)36(56.2) 0327(21.9)25(78.1)
四、干扰CDK14可抑制Eca-109细胞Rb蛋白磷酸化
蛋白质印迹法检测显示,4个靶向干扰CDK14的shRNA中,shCDK14#3转染后对Eca-109细胞CDK14表达的抑制作用最强(P<0.05)(图5A、5B),故后续实验均使用shCDK14#3转染。干扰CDK14表达后,抑癌基因Rb蛋白表达虽无明显改变,但其磷酸化水平较对照组显著降低(P<0.05)(图5C、5D),表明食管癌中CDK14高表达可能通过磷酸化下游分子Rb发挥作用。

图4 CDK14在Eca-109细胞细胞周期进程中的表达情况
五、干扰CDK14可使Eca-109细胞发生细胞周期G1期阻滞
流式细胞分析显示,在Eca-109细胞中干扰CDK14表达后,细胞发生G1期阻滞,细胞周期分布与对照组相比差异有统计学意义(P<0.05)(图5E),表明食管癌中CDK14高表达可能推动细胞周期进程。
六、干扰CDK14可促进Eca-109细胞增殖
克隆形成实验显示,在Eca-109细胞中干扰CDK14表达后,形成的克隆数较对照组显著减少(P<0.05)(图5F),表明食管癌中CDK14高表达可能增强肿瘤细胞的增殖能力。
讨 论
目前研究发现,细胞周期调节紊乱在各种因素引起的食管鳞癌发生、发展中发挥重要作用[6-7]。精确而严格的细胞周期调控取决于以下因素:cyclins、CDKs和CDK抑制因子(CKI),其中CDK为核心调控成分,其调控异常与肿瘤发生过程中的非程序性增殖、基因组不稳定性和染色体不稳定性密切相关[8]。多种CDKs失调参与了食管癌的发生、发展和化疗耐药过程,如CDK2在食管癌组织中高表达,并与肿瘤进展相关[9],而CDK4/6可作为食管癌治疗的靶点[10]。因此,研究食管癌中CDKs的调节机制及其与细胞周期的相关性对于明确食管癌发生、发展和化疗耐药的分子机制以及探索干预食管癌进程的分子靶点具有重要意义。
CDKs家族以具有相同催化活性的蛋白序列为特点,目前已重新命名为CDK1至CDK20[11]。其中CDK14又名PFTK1,是一种新发现的CDK,为Cdc2(cell division cycle 2)相关蛋白激酶家族成员之一,已知该家族成员可参与调控细胞周期G1/S、G2/M期转化[12]。既往研究发现CDK14在多种恶性肿瘤中表达增高,本研究对食管癌组织和细胞的检测亦显示CDK14呈高表达,与细胞增殖标记物PCNA、Ki-67的表达趋势相一致,且其高表达与食管癌的大小、组织学分级和浸润、转移呈正相关,并预示预后不良。上述发现提示CDK14在食管癌中可能起癌基因作用,因此有必要深入研究CDK14在食管癌中的临床意义。
本研究血清饥饿释放试验结果提示CDK14在人食管癌细胞株Eca-109中的表达具有细胞周期依赖性,其主要在G1/S期高表达,而后逐渐下降, 与

图5 干扰CDK14对Eca-109细胞Rb蛋白磷酸化、细胞周期进程和细胞增殖能力的影响
cyclin E的表达趋势相一致。既往研究发现cyclin E/CDK2在G1期和G1/S期转化过程中发挥重要作用,能通过磷酸化抑癌蛋白Rb促进细胞由G1期向S期转化[7,13]。为进一步了解CDK14在食管癌细胞中的功能及其作用机制,本研究以RNA干扰技术靶向抑制Eca-109细胞中的CDK14表达(实验组),并以转染非特异性序列的Eca-109细胞作为对照组,结果显示实验组Rb蛋白磷酸化水平较对照组显著降低。Rb蛋白是一个经典的抑癌蛋白,在细胞周期进程中可与转录因子E2F结合而抑制其活性,通过减少癌基因转录、表达而发挥抑癌作用。诸多细胞周期相关分子可磷酸化Rb蛋白而使之失活,从而使游离的E2F进入细胞核,与下游基因启动子区序列结合而促进其转录、表达,推动细胞周期由G1期进入S期,增强细胞增殖能力[14]。由此推测在食管癌细胞中,CDK14可能是通过磷酸化Rb蛋白,进而影响细胞周期而发挥促增殖作用。有研究[15]报道,在人神经母细胞瘤细胞株SH-SY5Y中干扰CDK14表达后,细胞发生G1期阻滞,同时Rb蛋白磷酸化水平降低,佐证了本实验结果。本研究在食管癌细胞中干扰CDK14表达,同样发现细胞发生G1期阻滞,细胞克隆形成数显著减少。除通过磷酸化Rb蛋白外,CDK14还可通过磷酸化激活钙调结合蛋白(caldesmon)、影响细胞骨架而促进肿瘤细胞转移[16]。
综上所述,本研究发现CDK14在食管癌中呈高表达,其可能通过促进下游Rb蛋白磷酸化导致转录因子E2F释放及其下游靶基因转录、表达,从而推动细胞周期进程,促进肿瘤细胞增殖,参与食管癌的发生、发展。本研究结果有助于理解CDK14在食管癌发生、发展和预后中的作用,并为抗癌药物的设计提供了新的作用靶点。
1 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2): 69-90.
2 Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127 (12): 2893-2917.
3 Sun T, Co NN, Wong N. PFTK1 interacts with cyclin Y to activate non-canonical Wnt signaling in hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2014, 449 (1): 163-168.
4 Yang L, Zhu J, Huang H, et al. PFTK1 Promotes Gastric Cancer Progression by Regulating Proliferation, Migration and Invasion[J]. PLoS One, 2015, 10 (10): e0140451.
5 Miyagaki H, Yamasaki M, Miyata H, et al. Overexpression of PFTK1 predicts resistance to chemotherapy in patients with oesophageal squamous cell carcinoma[J]. Br J Cancer, 2012, 106 (5): 947-954.
6 Zhang K, Dai L, Zhang B, et al. miR-203 is a direct transcriptional target of E2F1 and causes G1 arrest in esophageal cancer cells[J]. J Cell Physiol, 2015, 230 (4): 903-910.
7 Jiang XR, Yu XY, Fan JH, et al. RFT2 is overexpressed in esophageal squamous cell carcinoma and promotes tumorigenesis by sustaining cell proliferation and protecting against cell death[J]. Cancer Lett, 2014, 353 (1): 78-86.
8 Malumbres M, Barbacid M.Cell cycle, CDKs and cancer: a changing paradigm[J].Nat Rev Cancer, 2009, 9 (3):153-166.
9 Matsumoto M, Furihata M, Ishikawa T, et al. Comparison of deregulated expression of cyclin D1 and cyclin E with that of cyclin-dependent kinase 4 (CDK4) and CDK2 in human oesophageal squamous cell carcinoma[J]. Br J Cancer, 1999, 80 (1-2): 256-261.
10 Roberts PJ, Bisi JE, Strum JC, et al. Multiple roles of cyclin-dependent kinase 4/6 inhibitors in cancer therapy[J]. J Natl Cancer Inst, 2012, 104 (6): 476-487.
11 Malumbres M. Cyclin-dependent kinases[J]. Genome Biol, 2014, 15 (6): 122.
12 Suryadinata R, Sadowski M, Sarcevic B. Control of cell cycle progression by phosphorylation of cyclin-dependent kinase (CDK) substrates[J]. Biosci Rep, 2010, 30 (4): 243-255.
13 Hinds PW, Mittnacht S, Dulic V, et al. Regulation of retinoblastoma protein functions by ectopic expression of human cyclins[J]. Cell, 1992, 70 (6): 993-1006.
14 Barnoud T, Donninger H, Clark GJ. Ras Regulates Rb via NORE1A[J]. J Biol Chem, 2016, 291 (6): 3114-3123.
15 Shu F, Lv S, Qin Y, et al. Functional characterization of human PFTK1 as a cyclin-dependent kinase[J]. Proc Natl Acad Sci U S A, 2007, 104 (22): 9248-9253.
16 Leung WK, Ching AK, Wong N. Phosphorylation of Caldesmon by PFTAIRE1 kinase promotes actin binding and formation of stress fibers[J]. Mol Cell Biochem, 2011, 350 (1-2): 201-206.
(2016-02-24收稿;2016-05-06修回)
Effect of CDK14 on Proliferation of Human Esophageal Carcinoma Cells and its Possible Mechanism
QIANJi1,WANGYuchan2,ZHANGXuejian1.
1DepartmentofGastroenterology,AffiliatedYixingHospitalofJiangsuUniversity,Yixing,JiangsuProvince(214200);2DepartmentofImmunologyandMicrobiology,NantongUniversity,Nantong,JiangsuProvince
ZHANG Xuejian, Email: staff1232@yxph.com
Cyclin-Dependent Kinase 14; Esophageal Neoplasms; Retinoblastoma Protein; Cell Cycle;
10.3969/j.issn.1008-7125.2016.10.002
*Email: jill_qj@163.com
#本文通信作者,Email: staff1232@yxph.com
Background: CDK14 is a novel cyclin-dependent kinase, which is overexpressed in a variety of cancer and related to their malignant behavior. Aims: To investigate the effect of CDK14 on proliferation of human esophageal carcinoma cells and its possible mechanism. Methods: Expressions of CDK14 and two cell proliferation markers, PCNA and Ki-67 were estimated in 8 fresh-frozen specimens of esophageal squamous cell carcinoma (ESCC), 96 paraffin-embedded specimens of ESCC, and human ESCC cell line Eca-109 by Western blotting and immunohistochemistry. Correlations of CDK14 expression with the clinicopathological characteristics and prognosis of ESCC were analyzed. Serum starvation and release assay was performed to evaluate the relationship between CDK14 expression and cell cycle progression in Eca-109 cells. Furthermore, Eca-109 cells were transiently transfected with shRNA-CDK14 to reduce CDK14 protein level, and then the phosphorylation of tumor suppressor protein Rb, cell cycle progression and proliferation capability of Eca-109 cells were determined. Results: CDK14 was highly expressed in both ESCC tissue and cell line, which was paralleled with the expressions of PCNA and Ki-67 and correlated significantly with the tumor size, histological grade, invasiveness and metastasis of ESCC (P<0.05). The overall survival was poor in patients with high CDK14 expression than those with low CDK14 expression (P<0.05). Serum starvation and release assay showed that the expression of CDK14 was cell cycle-dependent. Knockdown of CDK14 reduced the expression level of phosphorylated Rb, induced significant G1 phase arrest and resulted in less colony formation in Eca-109 cells (Pall <0.05). Conclusions: CDK14 is highly expressed in ESCC. It may promote cell cycle progression by phosphorylating downstream Rb protein, thus enhancing the proliferation of tumor cells, and ultimately participating in the occurrence and development of ESCC.

