高脂饮食诱导高胆汁酸通过下调干细胞功能损伤肠黏膜
周 慧 罗声政 钱月琴 陆伦根
上海交通大学附属第一人民医院消化科(201620)
高脂饮食诱导高胆汁酸通过下调干细胞功能损伤肠黏膜
周 慧*罗声政 钱月琴 陆伦根#
上海交通大学附属第一人民医院消化科(201620)
背景:高脂饮食可破坏肠道黏膜屏障功能,但机制未明。高脂饮食可诱导胆汁酸产生增加。目的:探讨高脂饮食诱导的高胆汁酸通过下调小肠干细胞功能损伤肠黏膜。方法:将24只大鼠分为3组,分别给予常规饮食、高脂饮食、高脂饮食+考来烯胺,连续2周。采用ELISA法测定血清胆汁酸浓度,测量小肠直径,行HE染色观察小肠黏膜组织学表现,以RT-qPCR检测Lgr5基因表达。体外研究将常规饮食大鼠的回肠组织与脱氧胆酸(DCA)或DCA+考来烯胺共培养24 h,以RT-qPCR检测Lgr5基因表达。结果:与对照组相比,高脂饮食组血清胆汁酸浓度明显升高(P<0.05),肠管直径明显降低(P<0.05),肠道绒毛+隐窝长度明显降低(P<0.05),Lgr5基因表达明显降低(P<0.01);给予考来烯胺后,上述指标均明显改善(P<0.05)。DCA组Lgr5基因表达显著降低(P<0.01),而考来烯胺可明显上调Lgr5表达(P<0.05)。结论:高脂饮食引起的循环高胆汁酸通过下调小肠干细胞功能破坏肠道黏膜,而考来烯胺可改善此病理过程。
膳食,高脂; 胆汁酸; 脱氧胆酸; 干细胞; 考来烯胺
近数十年来随着我国人民饮食结构的西方化,高脂饮食与炎症性肠病等疾病的关系受到越来越多的关注。实验、临床和流行病学数据表明高脂饮食可损伤肠道黏膜的屏障功能[1-3],但具体作用机制目前尚未完全阐明。高脂饮食可导致胆汁酸产生增加,尤其是脱氧胆酸(deoxycholic acid, DCA)的增加[4]。胆汁酸具有促进脂类和脂溶性维生素消化吸收、调节胆固醇代谢的作用[5]。但高浓度胆汁酸尤其是疏水的次级胆汁酸如DCA具有细胞毒性。在胆汁酸肠肝循环[5]中,末段回肠上皮细胞暴露于强疏水性的次级胆汁酸和非结合胆汁酸中,大大增加了其遭受胆汁酸攻击的危险。肠道是能快速增殖再生的器官。肠上皮层隐窝底部储存着一些可分化为更成熟、特有的肠道细胞的成体干细胞,可不断地补充肠黏膜上皮细胞。Barker等[6]于2007年发现了肠上皮干细胞的特异性标记物Lgr5蛋白,其表达提示干细胞快速分化以及再生为完整绒毛的功能。Luu[7]的研究发现高脂饮食动物模型中间充质干细胞显著减少。由此推测饮食因素可调节肠道干细胞功能。而相关研究多仅限于高脂饮食本身因素对肠道干细胞的影响,目前尚无胆汁酸因素对肠道干细胞影响的报道。本研究通过给予大鼠高脂饮食导致末段回肠暴露于高浓度DCA,旨在探讨其对肠道干细胞功能的影响。
材料与方法
一、实验动物
成年雄性Sprague-Dawley大鼠24只购自上海市第一人民医院实验动物中心,体质量200~220 g。实验前适应性饲养1周,自然光照,室温(22±2) ℃,自由摄取食物和水,每日定时更换饲料,通风良好,排除其他应激因素干扰。
二、研究方法
1. 模型制备和动物分组:大鼠随机分为3组,每组8只。对照组给予常规饮食(11.3% kcal/g脂肪),高脂饮食组给予高脂饮食(53% kcal/g脂肪),考来烯胺组给予高脂饮食(53% kcal/g脂肪)+考来烯胺(6%)(Sigma-Aldrich公司)。2周后,大鼠禁食6 h,麻醉,心脏取血,留取末段回肠组织用于形态学和基因检测。
2. 血清胆汁酸浓度测定:留取3组大鼠血清0.2 mL,采用大鼠胆汁酸测定试剂盒(Crystal Chem Inc.),以ELISA法测定胆汁酸浓度。
3. 大体形态观察:取各组大鼠回肠组织,观察肠管直径和肠壁形态。
4. HE染色:取各组大鼠末段回肠组织,固定、脱水透明、包埋,行HE染色,观察回肠组织形态结构,通过自动成像系统采图拍照。
5. 在体Lgr5基因表达的检测:收集各组大鼠组织,采用Direct-zol抽提总RNA,逆转录合成cDNA,行qPCR。以GAPDH作为内参,使用iQ SYBR Green Supermix仪器检测Lgr5基因表达,Lgr5和GAPDH引物均购自Qiagen公司。
6. 离体Lgr5基因表达的检测:留取对照组大鼠末段回肠,剪成每段0.5 cm,PBS冲洗,置于含有10 mL DMEM(内含100 U/mL青链霉素双抗溶液)的6孔板培养基中,然后分为对照组(无水乙醇)、DCA组(10-4mol/L DCA,购自Sigma-Aldrich公司)和DCA+考来烯胺组(10-4mol/L DCA+10-4mol/L考来烯胺),置于37 ℃、5% CO2培养箱中培养24 h。采用RT-qPCR法检测Lgr5基因表达。
三、统计学分析
结 果
一、血清胆汁酸浓度
高脂饮食组血清胆汁酸浓度显著高于对照组(P<0.05);给予考来烯胺后,血清胆汁酸浓度显著降低(P<0.05)(图1)。
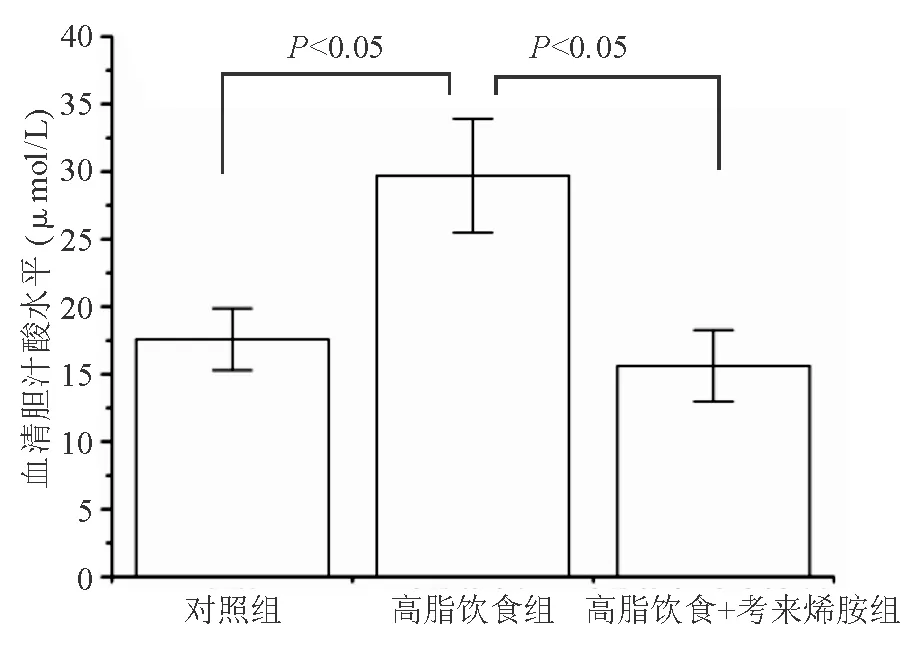
图1 各组大鼠血清胆汁酸浓度
二、回肠大体形态
高脂饮食组大鼠回肠肠管直径显著低于对照组[(3.26±0.17)×10-3m对(4.08±0.14)×10-3m,P<0.05],肠壁菲薄可透光;给予考来烯胺后,肠管直径明显增加[(4.20±0.17)×10-3m对(3.26±0.17)×10-3m,P<0.05](图2)。
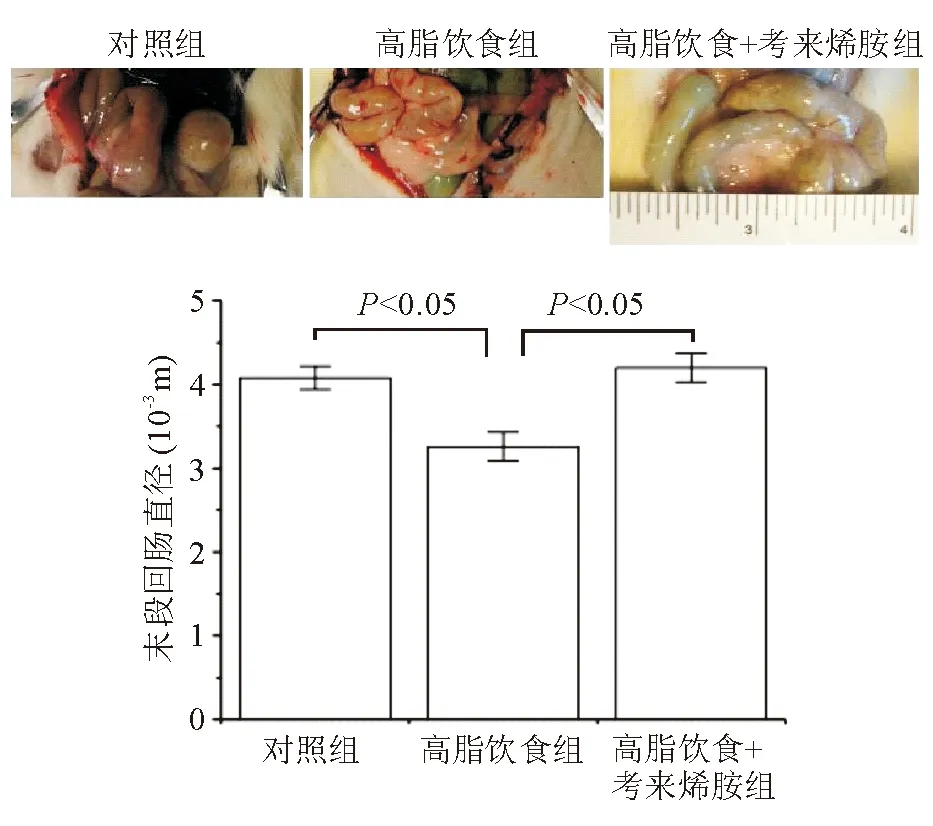
图2 各组大鼠回肠大体形态
三、回肠组织学表现
对照组小肠黏膜结构完整,绒毛排列整齐,黏膜无水肿、溃疡、剥脱,未见黏膜上皮细胞损伤。高脂饮食组肠黏膜结构完整,绒毛排列尚整齐,但绒毛+隐窝长度均较对照组明显降低[(3.87±0.21)×10-4m对(4.68±0.26)×10-4m,P<0.05]。给予考来烯胺后,大鼠肠黏膜结构完整,绒毛排列整齐,
绒毛+隐窝长度显著增加[(4.59±0.22)×10-4m对(3.87±0.21)×10-4m,P<0.05],且与对照组无明显差异(P>0.05)(图3、图4)。
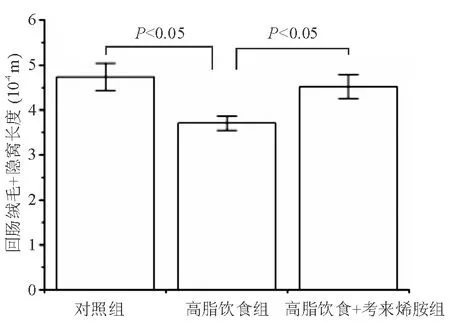
图4 各组大鼠绒毛+隐窝长度比较情况
四、Lgr5基因表达
1. 在体研究:高脂饮食组回肠组织中干细胞Lgr5基因表达较对照组显著降低(P<0.01),给予考来烯胺后,Lgr5基因表达显著升高(P<0.05)(图5A)。
2. 离体研究:与对照组相比,DCA组干细胞Lgr5基因表达显著下降(P<0.01)。给予考来烯胺后,回肠组织Lgr5基因表达明显升高(P<0.05)(图5B)。
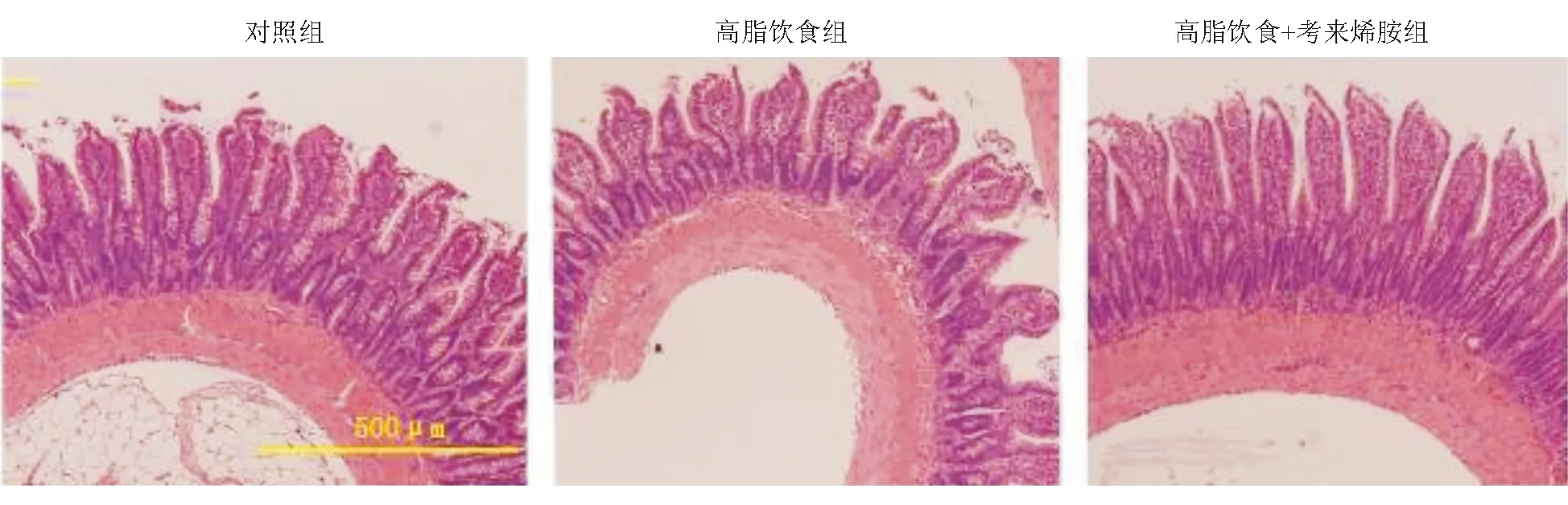
图3 各组大鼠回肠组织学结果(HE染色,×200)

A:在体研究;B:离体研究
讨 论
肠道上皮屏障功能在维持肠道稳态、阻止肠腔内细菌、病毒和饮食抗原等有害物质入侵中发挥重要作用[8-9]。既往研究提示高脂饮食可导致肠道通透性增加,与肠道低度慢性炎症以及内毒素血症相关[3]。对此发病机制的研究多关注高脂饮食因素对肠道黏膜的损害,如破坏紧密连接蛋白、减少杯状细胞数目从而降低黏液层厚度等[1]。有研究报道短期高脂饮食(2~3周)即可导致小肠增生不良,绒毛长度或黏膜表面积的减低[2]。本研究发现高脂饮食可使大鼠小肠管腔直径变细,肠壁变薄,绒毛和隐窝长度减低。
目前已知高脂饮食可促进胆汁酸分泌异常增高,本研究亦发现高脂饮食组血清胆汁酸浓度明显升高。胆汁酸是双亲媒性分子,由肝细胞中的胆固醇合成。初级胆汁酸分别与牛磺酸和甘氨酸结合,分泌至肠腔,介导饮食脂肪和脂溶性维生素的吸收。结合胆汁酸因具有高度亲水性很少被近段小肠重吸收。当传输至末段回肠和结肠,小部分结合胆汁酸在肠腔内定植细菌作用下,经过解偶联成为非结合胆汁酸,再进一步脱氢转变为强疏水性的次级胆汁酸[10],如DCA和石胆酸。大多数结合胆汁酸可由回肠末段黏膜上皮胆汁酸转运蛋白主动摄取重吸收,经循环至门静脉系统回流入肝脏,该过程称为胆汁酸的肠肝循环[5]。
具有强疏水性的次级胆汁酸和非结合胆汁酸可攻击肠黏膜细胞,因而具有细胞毒性。Low-Beer等[11]的研究发现豚鼠体内和体外灌注非结合胆汁酸后小肠黏膜形态受损。口服次级胆汁酸亦可破坏上皮紧密连接结构,增加肠道通透性[12],具体机制可能是通过刺激线粒体生成氧自由基造成细胞DNA损伤而诱导细胞凋亡[13]。大鼠的21种循环胆汁酸组成成分中,DCA是主要的、也是影响末段回肠最重要的胆汁酸之一[14]。多项研究[4,13,15]表明DCA对细胞的损害可能与肝癌、结肠癌、Barrett食管相关。高脂饮食可导致具有细胞毒性的血清DCA浓度显著升高[4,14]。Yoshimoto等[4]的研究发现高脂饮食小鼠DCA浓度较对照组小鼠高2倍。Suzuki等[14]的研究亦证实,2周高脂饮食大鼠血清DCA浓度较对照组大鼠高4倍。因此高脂饮食不仅是导致末段回肠肠腔暴露于高浓度DCA的有害因素,还可使肠黏膜组织面临高DCA血症的危险。
考来烯胺是胆汁酸的结合剂,可阻断末段回肠重吸收胆汁酸,促进胆汁酸从肠道排出,临床用于治疗血脂异常和皮肤瘙痒。组织学研究发现给予大鼠考来烯胺可显著增加小肠黏膜厚度,并有保护胃黏膜的作用[16]。考来烯胺还可缓解炎症导致的肠细胞和杯状细胞的破坏,降低结肠细胞凋亡[17]。本研究证实考来烯胺可明显降低2周高脂饮食引起的血清胆汁酸浓度升高,并改善高脂饮食模型大鼠小肠肠管变细和肠道隐窝+绒毛长度的减低。
肠道上皮每3~5 d更新一次,肠道干细胞增生分化可变成所有的肠上皮细胞类型,逐步向绒毛顶端迁移[18]。Lgr5蛋白作为肠上皮干细胞的一种特异性标记物,其表达提示干细胞快速分化以及增殖为完整黏膜上皮的功能[6]。Luu[7]的研究结果提示高脂饮食6周后间充质干细胞数目显著减少。饮食干预如热量限制可增加干细胞数量,促进肠道再生[19]。Mah等[20]的离体研究发现高脂饮食诱导的肥胖小鼠分离出的肠道干细胞形成的肠道样组织(enteroids)明显减少,说明存在干细胞功能损伤。本研究结果显示,高脂饮食大鼠末段回肠Lgr5基因表达显著降低,提示干细胞分化以及再生为肠道黏膜的功能受损,与肠道大体和肠黏膜形态学观察相一致,而考来烯胺可明显升高肠道干细胞Lgr5基因表达。后续研究将采用免疫荧光法检测回肠隐窝中干细胞Lgr5表达,以更直观地观察高脂饮食和考来烯胺对干细胞功能的影响。
为进一步证实在此病理生理过程中胆汁酸发挥的作用。本研究采用对照组大鼠末段回肠组织,与次级胆汁酸的主要成分DCA(10-4mol/L,类似于体内高脂饮食所致胆汁酸浓度)共培养24 h,发现DCA降低了小肠干细胞Lgr5基因表达,而考来烯胺可明显升高其表达。既往DCA对消化道细胞毒性作用机制的研究结果显示DCA可通过诱导线粒体氧化应激[13]、NF-κB途径[15,21],造成细胞DNA损伤,10-4mol/L以上浓度的DCA对DNA损伤显示了一个非线性剂量反应关系[17]。
综上所述,高脂饮食引起的肠道高胆汁酸可下调干细胞功能,降低其向肠上皮细胞的分化能力,破坏肠黏膜及其屏障功能。胆汁酸吸附剂考来烯胺则可改善此病理过程。高脂饮食产生循环高浓度胆汁酸损害回肠干细胞功能的具体细胞、分子层面的机制以及可能的干预靶点则是我们今后进一步的研究方向。
1 Martinez-Medina M, Denizot J, Dreux N, et al. Western diet induces dysbiosis with increasedEcoliin CEABAC10 mice, alters host barrier function favouring AIEC colonisation[J]. Gut, 2014, 63 (1): 116-124.
2 Thomson AB, Keelan M, Clandinin MT, et al. Dietary fat selectively alters transport properties of rat jejunum[J]. J Clin Invest, 1986, 77 (1): 279-288.
3 Teixeira TF, Collado MC, Ferreira CL, et al. Potential mechanisms for the emerging link between obesity and increased intestinal permeability[J]. Nutr Res, 2012, 32 (9): 637-647.
4 Yoshimoto S, Loo TM, Atarashi K, et al. Obesity-induced gut microbial metabolite promotes liver cancer through senescence secretome[J]. Nature, 2013, 499 (7456): 97-101.
5 高春芳, 赵云鹏. 胆红素与胆汁酸的代谢//陆伦根, 曾民徳主编. 胆汁淤积和自身免疫性肝病. 2版. 北京: 人民卫生出版社, 2014: 123-125.
6 Barker N, van Es JH, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5[J]. Nature, 2007, 449 (7165): 1003-1007.
7 Luu YK. Biomechanical promotion of mesenchymal stem cell proliferation as a countermeasure to the development of obesity and osteoporosis [DB/OL]. State University of New York at Stony Brook, 2008, 162: 3338162. http://pqdtopen.proquest.com/doc/304356170.html?FMT=ABS.
8 Peterson LW, Artis D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis[J]. Nat Rev Immunol, 2014, 14 (3): 141-153.
9 Giuffrida P, Biancheri P, MacDonald TT. Proteases and small intestinal barrier function in health and disease[J]. Curr Opin Gastroenterol, 2014, 30 (2): 147-153.
10 Wong MH, Oelkers P, Craddock AL, et al. Expression cloning and characterization of the hamster ileal sodium-dependent bile acid transporter[J]. J Biol Chem, 1994, 269 (2): 1340-1347.
11 Low-Beer TS, Schneider RE, Dobbins WO. Morphological changes of the small-intestinal mucosa of guinea pig and hamster following incubationinvitroand perfusioninvivowith unconjugated bile salts[J]. Gut, 1970, 11 (6): 486-492.
12 Bernstein H, Holubec H, Bernstein C, et al. Unique dietary-related mouse model of colitis[J]. Inflamm Bowel Dis, 2006, 12 (4): 278-293.
13 Ajouz H, Mukherji D, Shamseddine A. Secondary bile acids: an underrecognized cause of colon cancer[J]. World J Surg Oncol, 2014, 12: 164.
14 Suzuki Y, Kaneko R, Nomura M, et al. Simple and rapid quantitation of 21 bile acids in rat serum and liver by UPLC-MS-MS: effect of high fat diet on glycine conjugates of rat bile acids[J]. Nagoya J Med Sci, 2013, 75 (1-2): 57-71.
15 Huo X, Juergens S, Zhang X, et al. Deoxycholic acid causes DNA damage while inducing apoptotic resistance through NF-κB activation in benign Barrett’s epithelial cells[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 301 (2): G278-G286.
16 Mersereau WA, Hinchey EJ. Prevention of bile reflux-induced acute gastric ulceration in the rat by cholestyramine[J]. Ann Surg, 1974, 179 (6): 883-888.
17 Lack L, Suliman HB, Rahman AA, et al. Cholestyramine feeding lowers number of colonic apoptotic cells in rat[J]. J Toxicol Environ Health A, 2005, 68 (22): 1963-1975.
18 Spradling A, Drummond-Barbosa D, Kai T. Stem cells find their niche[J]. Nature, 2001, 414 (6859): 98-104.
20 Mah AT, Van Landeghem L, Gavin HE, et al. Impact of diet-induced obesity on intestinal stem cells: hyperproliferation but impaired intrinsic function that requires insulin/IGF1[J]. Endocrinology, 2014, 155 (9): 3302-3314.
21 Glinghammar B, Inoue H, Rafter JJ. Deoxycholic acid causes DNA damage in colonic cells with subsequent induction of caspases, COX-2 promoter activity and the transcription factors NF-kB and AP-1[J]. Carcinogenesis, 2002, 23 (5): 839-845.
(2016-03-07收稿;2016-04-18修回)
High Bile Acid-induced by High-fat Diet Impairs Intestinal Mucosa by Down-regulating Stem Cell Function
ZHOUHui,LUOShengzheng,QIANYueqin,LULungen.
DepartmentofGastroenterology,ShanghaiFirstPeople’sHospital,ShanghaiJiaoTongUniversity,Shanghai(201620)
LU Lungen, Email: lungenlu1965@163.com
Diet, High-Fat; Bile Acid; Deoxycholic Acid; Stem Cells; Cholestyramine Resin
10.3969/j.issn.1008-7125.2016.10.007
*Email: mdzhouhui@163.com
#本文通信作者,Email: lungenlu1965@163.com
Background: High-fat diet leads to intestinal mucosa barrier dysfunction, but the mechanism is not clear. High-fat diet can induce increase of bile acid. Aims: To investigate whether the high bile acid induced by high-fat diet could act on intestinal stem cell to disrupt stem cell differentiation and imparing the intestinal mucosa. Methods: Twenty-four rats were divided into 3 groups: fed with regular diet, high-fat diet and high-fat diet + cholestyramine, respectively, for 2 weeks. Serum bile acid was detected by ELISA. Ileal diameter was measured and HE staining was performed to observe histology of intestinal mucosa. Expression of Lgr5 gene was determined by RT-qPCR. Ileal tissue fed with regular diet was cultured with deoxycholic acid (DCA) or DCA+cholestyramine for 24 hoursinvitro, expression of Lgr5 gene was determined by RT-qPCR. Results: Compared with control group, serum bile acid was significantly increased (P<0.05), ileal diameter was significantly decreased, height of intestinal crypts and villus was significantly decreased (P<0.05), and expression of Lgr5 gene was significantly decreased in high-fat diet group (P<0.01). All the above-mentioned indices were significantly ameliorated in high-fat diet + cholestyramine group (P<0.05).Invitrostudy showed that expression of Lgr5 gene was significantly decreased in DCA group than in control group (P<0.01), and cholestyramine could significantly increase expression of Lgr5 gene (P<0.05). Conclusions: High-fat diet induced increasing of circulatory bile acid can cause injury of intestinal mucosa by inhibiting stem cell function, which can be ameliorated by cholestyramine.

