DC-CIK细胞联合全身静脉化疗治疗晚期结直肠癌伴弥漫性肝转移的研究
李威威,张海萍,吴 敏
(湖北省天门市第一人民医院,湖北 天门 431700)
DC-CIK细胞联合全身静脉化疗治疗晚期结直肠癌伴弥漫性肝转移的研究
李威威,张海萍,吴 敏
(湖北省天门市第一人民医院,湖北 天门 431700)

目的 观察DC-CIK细胞联合全身静脉化疗治疗晚期结直肠癌伴弥漫性肝转移的疗效。方法 选取晚期结直肠癌伴弥漫性肝转移患者77例,依据治疗方式的不同将患者分为2组,对照组38例行FOLFOX化疗,21 d为1个周期,6个周期为1个疗程;联合组39例行FOLFOX化疗联合DC-CIK细胞治疗,DC-CIK细胞治疗每月1次,至患者死亡或放弃治疗。检测2组治疗前后T细胞亚群(CD3+、CD4+、CD8+)、Th1细胞因子(IFN-γ、TNF-α、IL-2)、血清肿瘤标记物(CEA、CA242、CA199)水平,统计2组近期疗效、不良反应情况,门诊复查及电话随访记录患者生存情况,随访截止时间2015年8月31日。结果 治疗后联合组CD3+、CD8+水平及IFN-γ、TNF-α、IL-2水平均显著高于治疗前(P均<0.05),而CD4+水平无显著变化(P>0.05);对照组CD3+、CD4+、CD8+水平及IFN-γ、TNF-α、IL-2水平均显著低于治疗前(P均<0.05);联合组CD3+、CD8+水平及IFN-γ、TNF-α、IL-2水平均显著高于对照组(P均<0.05),2组CD4+水平比较差异无统计学意义(P>0.05)。治疗后2组CEA水平较治疗前均明显降低(P均<0.05),且联合组明显低于对照组(P<0.05);2组CA199、CA242水平与治疗前比较差异无统计学意义(P均>0.05)。2组有效率比较差异无统计学意义(P>0.05);联合组疾病控制率明显高于对照组(P<0.05),不良反应发生率明显低于对照组(P均<0.05)。联合组生存时间最短116 d,最长者超过16个月,中位生存时间8.5个月;对照组生存时间最短29 d,最长者超过12个月,中位生存时间6个月。 Log-rank检验显示,联合组生存率显著高于对照组(P<0.05)。结论 DC-CIK细胞联合全身静脉化疗是治疗晚期结直肠癌伴弥漫性肝转移较为有效的方案,可明显提高疾病控制率,降低不良反应发生率,延长生存期。
晚期结直肠癌;DC-CIK细胞;全身静脉化疗;弥漫性肝转移
Key words: advanced colorectal cancer; DC-CIK cells; intravenous chemotherapy; diffuse liver metastases
结直肠癌是中老年人群较为常见的消化系统恶性肿瘤,患者早期多无典型临床表现,超过30%的患者确诊时已发展至晚期(临床分期Ⅲ~Ⅳ期)[1],40%以上的患者发病5年即出现转移,丧失最佳手术时机的患者正逐年增多,因此,寻求安全有效的内科疗法成为众多医学同仁的共同责任[2]。笔者观察了DC-CIK细胞联合全身静脉化疗方案治疗晚期结直肠癌伴弥漫性肝转移患者的疗效,现将结果报道如下。
1 临床资料
1.1 一般资料 选取我院2010年1月—2014年1月收治的晚期结直肠癌伴弥漫性肝转移患者77例,均符合《中国结直肠癌诊疗规范(2015版)》相关诊断标准[3],且原发癌灶切除后经活组织病理检查进一步确诊为结直肠癌;术前腹部CT、MRI等影像学资料均显示肝脏存在弥漫性转移灶;患者功能状态评分(PS)[4]≤2分。排除合并有心、肝、脑、肾等严重基础疾病者,合并结直肠癌以外的其他肿瘤者,合并有感染性疾病、内分泌系统或免疫系统异常者,哺乳及妊娠期妇女,近6个月持续服用免疫抑制剂或激素类药物者。其中男44例,女35例;年龄34~73(52.48±13.85)岁。依据治疗方式的不同将患者分为联合组和对照组,2组年龄、性别、肿瘤部位、体质量指数、病理类型、分化程度比较差异均无统计学意义(P均>0.05),具有可比性。见表1。
1.2 治疗方法 对照组给予FOLFOX方案化疗:奥沙利铂(江苏恒瑞医药股份有限公司,国药准字H20000337)85 mg/m2静脉滴注,第1天;亚叶酸钙(江苏恒瑞医药股份有限公司,国药准字H20000584)200 mg/m2静脉滴注,第1天;5-氟尿嘧啶(上海旭东海普药业有限公司,国药准字H31020593)400 mg/m2静脉注射,第1—2天;5-氟尿嘧啶600 mg/m2静脉滴注(22 h滴完),第1—2天。21 d为1个周期,6个周期为1个疗程。联合组在化疗前2 d采集50 mL左右的外周血单核细胞(PBMCs),用于培养DC-CIK细胞(14~16 d)。于采血后的第3天给予FOLFOX方案化疗(具体同对照组)。培养细胞符合免疫功能、细菌、真菌等检测后,用0.9%氯化钠溶液洗涤,然后将其与含2%白蛋白的100 mL 0.9%氯化钠溶液混合,均分成2份回输给患者,1次/月,至患者死亡或放弃治疗。

表1 2组基线资料比较
1.3 观察指标 2组于化疗前后定期行血常规、肝肾功能、T细胞亚群(CD3+、CD4+、CD8+)、Th1细胞因子(IFN-γ、TNF-α、IL-2)、血清肿瘤标记物(CEA、CA242、CA199)、腹部CT等检查,统计2组治疗前及治疗1个疗程后的T细胞亚群、Th1细胞因子、血清肿瘤标记物水平及近期疗效、不良反应情况;门诊复查及电话随访记录患者生存情况,随访截止时间2015年8月31日。
1.4 疗效评定标准[5]完全缓解:癌灶完全消除持续30 d;部分缓解:最长径癌灶之和减少≥30%持续30 d;进展:最长径癌灶之和增加≥20%持续30 d;稳定:介于进展与部分缓解之间。有效=完全缓解+部分缓解;疾病控制=有效+稳定;每2个化疗周期评定1次,如首次评定为完全缓解或部分缓解,30 d后再次评定以确认。
1.5 统计学方法 采用SPSS 20.0软件包对收集的数据进行统计学分析。计数资料用百分率(%)表示,组间比较采用卡方检验;计量资料用均数±标准差表示,组间比较采用独立样本t检验,组内比较采用配对t检验;绘制2组患者的Kaplan-Meier生存曲线,生存率比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组治疗前后T细胞亚群水平比较 治疗前2组T细胞亚群CD3+、CD4+、CD8+水平比较差异均无统计学意义(P均>0.05)。治疗后联合组CD3+、CD8+水平均显著高于治疗前(P均<0.05),而CD4+无显著变化(P>0.05);对照组CD3+、CD4+、CD8+水平均显著低于治疗前(P均<0.05);且联合组CD3+、CD8+水平均显著高于对照组(P均<0.05),而2组CD4+水平比较差异无统计学意义(P>0.05)。见表2。
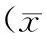
表2 2组治疗前后T细胞亚群水平比较±s,%)
2.2 2组治疗前后Th1细胞因子水平比较 治疗前2组IFN-γ、TNF-α、IL-2水平比较差异均无统计学意义(P均>0.05)。治疗后联合组IFN-γ、TNF-α、IL-2水平均明显高于治疗前(P均<0.05),对照组IFN-γ、TNF-α、IL-2水平均显著低于治疗前(P均<0.05),且联合组各指标水平均显著高于对照组(P均<0.05)。见表3。
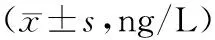
表3 2组治疗前后Th1细胞因子水平比较
2.3 2组治疗前后血清肿瘤标记物水平比较 治疗前2组CEA、CA199、CA242水平比较差异均无统计学意义(P均>0.05)。治疗后2组CEA水平均明显低于治疗前(P均<0.05),且联合组显著低于对照组(P<0.05);2组CA199、CA242水平均无明显变化(P均>0.05)。见表4。
2.4 2组近期疗效比较 2组有效率比较差异无统计学意义(P>0.05),联合组疾病控制率明显高于对照组(P<0.05)。见表5。
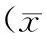
表4 2组治疗前后血清肿瘤标记物水平比较±s)

表5 2组近期疗效比较 例(%)
注:①与对照组比较,2=1.143,P=0.094;②与对照组比较,2=8.547,P=0.012。
2.5 2组不良反应发生情况 联合组不良反应发生率明显低于对照组(P<0.05)。见表6。
2.6 2组生存情况 联合组患者生存时间最短116 d,长者超过16个月,中位生存时间8.5个月;对照组患者生存时间最短29 d,长者超过12个月,中位生存时间6个月。Log-rank检验显示,联合组患者的生存率显著高于对照组(2=5.361,P=0.039),见图1。
3 讨 论
结直肠癌起病隐匿,加之我国较低的健康宣教力度和医疗知识普及程度,半数以上的患者因结直肠癌严重影响其生活质量时才被迫就医,这大大降低了手术治疗的意义。目前,临床应用较多的以规范化疗为中心的保守治疗虽能通过杀伤一定比例的肿瘤细胞来降低肿瘤负荷、缓解临床症状,但难以彻底清除微小病灶,且多数化疗对患者的免疫系统、神经系统、血液系统等有着较多不利的影响[6]。因此,探求科学可靠的非手术疗法有重要临床意义。

表6 2组不良反应发生情况 例(%)
注:①与对照组比较,2=11.028,P=0.007。

图1 2组生存曲线比较
近些年,随着肿瘤分子生物学研究的逐层深入,以DC-CIK细胞过继免疫疗法为代表的生物治疗因适应证广、不良反应轻微而成为肿瘤界研究的热点。树突状细胞(dendritic cell,DC)在抵抗肿瘤细胞免疫逃逸机制的同时发挥抗原提呈功能,成熟的DC多通过Ⅱ型组织相容性抗原途径将肿瘤抗原加工后提呈给T淋巴细胞,从而发挥免疫功能。郭杰等[7]指出,多数结直肠患者存在DC不同程度的功能缺陷或数量减少,回输体外诱导成熟的DC对改善机体免疫功能和肿瘤免疫逃逸、促进肿瘤清除等有重要意义。细胞因子诱导的杀伤细胞(cytokine-induced killers,CIK)是诱导脐带血或外周血中的PBMCs而制得的异质细胞群,它多以CD3+CD8+为效应细胞,不仅能在体外快速分裂增殖,而且具有较高的T淋巴细胞抗瘤活性及自然杀伤细胞广谱杀瘤能力。另外,CIK还可通过分泌大量IFN-γ、TNF-α、IL-2等Th1类细胞因子来改变肿瘤微环境,从而增强免疫效应细胞的杀瘤作用。侯国伟等[8]认为,DC、CIK细胞共同培养具有相互促进作用,不仅能促进二者的增殖及成熟,而且可提高DC的激发免疫应答能力和CIK的细胞毒性作用。黄香等[9]研究显示,化疗一方面通过损伤调节性T细胞来降低其对免疫应答的抑制,另一方面,它对肿瘤细胞的杀伤可诱发机体免疫应答,提高免疫疗法的疗效。本研究结果显示,对照组化疗后T细胞亚群、Th1细胞因子水平均显著降低,这说明化疗对机体的免疫细胞因子及效应细胞具有杀伤作用,与翁海光等[10]的结论一致。而联合组治疗后CD3+、CD8+、Th1细胞因子水平反而升高,这提示DC-CIK细胞具有提高抗肿瘤免疫功能、改善化疗所致免疫抑制等作用,与刘光艺[11]的结论相吻合。
美国ASCO指南指出[12],CEA可作为结直肠癌疗效评估、病情检测的强有力指标,它比大多数单一指标的检测更具有说服力,当影像学资料缺乏典型病灶时,2次及以上(检测间隔时间超过60 d)CEA检测连续升高可判定疾病进展。本研究结果显示,2组治疗后CEA水平均明显低于治疗前,且联合组明显低于对照组,这与杨乔[13]观点一致。本研究还显示,2组治疗后有效率接近,但联合组的疾病控制率、生存率均明显高于对照组,不良反应发生率明显低于对照组,这与芮韬等[14]、尹良伟等[15]的研究并不矛盾,但该2项研究中的CD8+与CD4+百分比的变化、迟发性腹泻的发生情况与本研究有所偏差,考虑与样本大小、检测方法的精度、患者体质等的差异有关,仍需具备大样本、高精度检测手段进一步证实。
综上所述,DC-CIK细胞联合全身静脉化疗在控制病情、减少不良反应、改善预后等方面效果显著,是晚期结直肠癌伴弥漫性肝转移较为有效的治疗方式,可考虑推广运用。
[1] Lee HJ,Flaherty P,Ji HP. Systematic genomic identification of colorectal cancer genes delineating advanced from early clinical stage and metastasis[J]. BMC Med Geno,2013,6(6):1-15
[2] Kim DH. Colorectal cancer epidemic in Korea[J]. Ann Coloproctol,2013,29(1):1-4
[3] 中华人民共和国卫生和计划生育委员会医政医管局. 中国结直肠癌诊疗规范(2015版)[J/CD]. 中华普通外科学文献:电子版,2015,14(10):783-799
[4] Hideki S,Takeshi K,Yoshinori K,et al. Cetuximab improved the poor performance status of a colorectal cancer patient[J]. Gan To Kagaku Ryoho,2014,41(12):1776-1778
[5] Jang HJ,Kim BC,Kim HS,et al. Comparison of RECIST 1.0 and RECIST 1.1 on computed tomography in patients with metastatic colorectal cancer[J]. Oncology,2014,86(2):117-121
[6] 姚宏伟,刘荫华. NCCN结直肠癌临床实践指南2011年更新解读[J]. 中华胃肠外科杂志,2011,14(4):234-238
[7] 郭杰,崔海,朴素宙,等. CIK细胞联合DC细胞过继性免疫治疗结直肠癌化疗患者免疫功能的影响[J]. 中国现代医学杂志,2013,23(10):32-35
[8] 侯国伟,刘晓菲,王环,等. DC-CIK治疗大肠癌的研究进展[J]. 现代生物医学进展,2015,15(13):2574-2576
[9] 黄香,陈龙邦. 化疗药物的免疫调节作用[J]. 医学研究生学报,2010,23(1):76-81
[10] 翁海光,沈冬,茅卫东,等. DC-CIK过继免疫治疗联合化疗治疗晚期结直肠癌的临床研究[J]. 浙江医学,2015,37(8):625-629
[11] 刘光艺. DC-CIK细胞联合全身静脉化疗治疗晚期结直肠癌伴弥漫性转移的临床观察[D]. 重庆:重庆医科大学,2014
[12] Locker GY,Stanley H,Jules H,et al. ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer[J]. J Clin Oncol,2006,24(33):5313-5327
[13] 杨乔. DC-CIK联合化疗治疗晚期结直肠癌的临床研究[D]. 太原:山西医科大学,2013
[14] 芮韬,吴国清,徐继,等. 免疫活化DC联合CIK治疗晚期结直肠癌的临床研究[J]. 浙江医学,2015,37(18):1505-1509
[15] 尹良伟,王苏平,张利,等. DC-CIK过继性免疫疗法联合化疗治疗转移性结直肠癌患者的疗效[J]. 中国肿瘤生物治疗杂志,2013,20(2):217-224
Study on DC-CIK cells combined with intravenous chemotherapy for advanced colorectal cancer with diffuse hepatic metastasis
LI Weiwei, ZHANG Haiping, WU Min
(Tianmen First People’s Hospital, Tianmen 431700, Hubei, China)
Objective It is to observe the curative effect of DC-CIK cells combined with intravenous chemotherapy for advanced colorectal cancer with diffuse hepatic metastasis. Methods 77 cases of advanced colorectal cancer with diffuse liver metastases were divided into two groups according to the treatment of different ways. 38 cases in control group were treated with line FOLFOX chemotherapy, 21 days for a cycle, 6 cycles for a course of treatment. 39 cases in combined group were treated with line FOLFOX chemotherapy combined with DC-CIK cell treatment, DC-CIK cells treatment for once a month until the patient died or gave up treatment. The levels of T cell subsets (CD3+, CD4+, CD8+), intracellular Th1 cytokines (IFN-γ, TNF-α, IL-2), and serum tumor markers (CEA, CA242, CA199) were detected and recorded in two groups before and after treatment. The short-term efficacy and adverse reactions of the two groups were summarized, the patient's survival situation were recorded by outpatient review and telephone follow up. The follow-up deadline was 2015/8/31. Results After treatment, the levels of CD3+, CD8+, IFN-γ, TNF-α and IL-2 in combined group were significantly higher than before treatment (allP<0.05), but the level of CD4+had no obvious change (P>0.05); the levels of CD3+, CD4+, CD8+, IFN-γ, TNF-α, IL-2 were significantly lower than before treatment (allP<0.05); the levels of CD3+, CD8+, IFN-γ, TNF-α and IL-2 in combined group were significantly higher than those in control group (allP<0.05), but there was no significant difference in CD4+between the both groups (P>0.05). The levels of CEA in two groups were significantly lower than before treatment (allP<0.05), and there was significant difference between the both groups (P<0.05); there was no significant difference in CA199 and CA242 of both groups before and after treatment (allP>0.05). There was no significant difference in efficiency between the 2 groups (P>0.05), the control rate of the combined group was significantly higher than that of the control group (P<0.05), the incidence of adverse reactions was significantly lower than that of the control group (P<0.05). The survival time of the combined group was 116 days, the longest in more than 16 months, the median survival time was 8.5 months; the survival time of the control group was 29 days, the longest in more than 12 months, the median survival time was 6 months. The survival rate of the combined group was significantly higher than that of the control group (P<0.05). Conclusion DC-CIK cells combined with intravenous chemotherapy is an effective method for the treatment of advanced colorectal cancer with diffuse liver metastasis, it can significantly improve the disease control rate, reduce the incidence of adverse reactions, and prolong survival time.
李威威,女,主治医师,研究方向为肿瘤的临床治疗。
湖北省自然科学基金项目(2012KFC143)
10.3969/j.issn.1008-8849.2016.18.002
R735.3
A
1008-8849(2016)18-1942-04
2016-01-10

